2021年人教版化学中考总复习专题训练 二氧化碳的研究 导学案
文档属性
| 名称 | 2021年人教版化学中考总复习专题训练 二氧化碳的研究 导学案 |

|
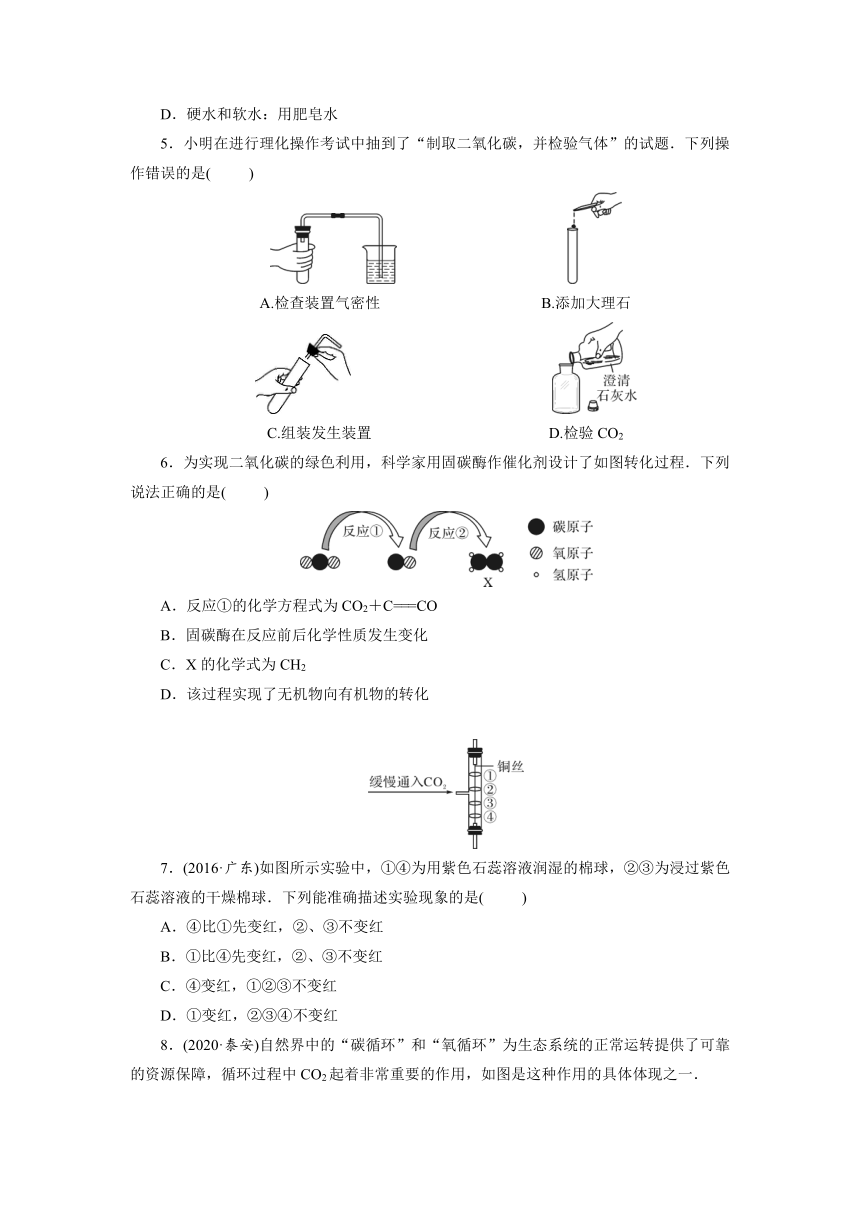
|
| 格式 | docx | ||
| 文件大小 | 302.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-04-05 00:00:00 | ||
图片预览



文档简介
二氧化碳的研究
【化学用语检查站4】
写出下列有关反应的化学方程式及反应的基本类型:
1.工业上制取二氧化碳
,
反应.
2.实验室制取二氧化碳
,
反应.
3.用澄清石灰水检验二氧化碳
,实验现象
.
4.“正常雨水”显微酸性的原因
,
反应
[基础巩固]
1.下列关于碳及其化合物的说法,正确的是(
)
A.金刚石、石墨是碳的单质,而C60则是碳的化合物
B.二氧化碳是导致酸雨的气体之一
C.古代用墨书写或绘画经久不褪色,这是因为常温下碳的化学性质不活泼
D.二氧化碳和一氧化碳都可使动物死亡,所以都具有毒性
2.(2019·宜昌)为探究二氧化碳能否和水反应,用四朵石蕊溶液染成紫色的干燥小花完成下图四个实验.实验Ⅰ、Ⅳ中小花变红,实验Ⅱ、Ⅲ中小花不变色.下列说法不正确的是(
)
A.实验Ⅰ、Ⅱ说明醋酸可以使小花变红
B.实验Ⅲ说明二氧化碳不能使小花变红
C.实验Ⅱ、Ⅲ、Ⅳ说明二氧化碳能与水发生化学反应
D.上述实验说明二氧化碳和醋酸具有相似的化学性质
3.关于CO和CO2的说法正确的是(
)
A.组成:都由碳元素和氧元素组成,分子构成也相同
B.性质:常温下均为无色气体,且都有毒
C.用途:CO可以用来灭火,CO2可以做化工原料
D.转化:在一定条件下可以相互转化
4.区别下列各组物质,所加试剂或操作方法错误的是
(
)
A.空气、氧气和二氧化碳:用燃着的小木条
B.硫粉和高锰酸钾粉末:观察颜色
C.氮气和二氧化碳:闻气味
D.硬水和软水:用肥皂水
5.小明在进行理化操作考试中抽到了“制取二氧化碳,并检验气体”的试题.下列操作错误的是(
)
A.检查装置气密性
B.添加大理石
C.组装发生装置
D.检验CO2
6.为实现二氧化碳的绿色利用,科学家用固碳酶作催化剂设计了如图转化过程.下列说法正确的是(
)
A.反应①的化学方程式为CO2+C===CO
B.固碳酶在反应前后化学性质发生变化
C.X的化学式为CH2
D.该过程实现了无机物向有机物的转化
7.(2016·广东)如图所示实验中,①④为用紫色石蕊溶液润湿的棉球,②③为浸过紫色石蕊溶液的干燥棉球.下列能准确描述实验现象的是(
)
A.④比①先变红,②、③不变红
B.①比④先变红,②、③不变红
C.④变红,①②③不变红
D.①变红,②③④不变红
8.(2020·泰安)自然界中的“碳循环”和“氧循环”为生态系统的正常运转提供了可靠的资源保障,循环过程中CO2起着非常重要的作用,如图是这种作用的具体体现之一.
(1)CO2的水溶液能使紫色石蕊试液变红色,其原因是
(用化学方程式表示).
(2)有机物A完全燃烧的化学方程式:A+6O26CO2+6H2O,则A的化学式是
.
(3)下列关于“碳循环”和“氧循环”的说法错误的是
(填序号,下同).
A.无机物和有机物性质不同,但在一定条件下能相互转化
B.碳循环和氧循环分别是指二氧化碳和氧气的循环
C.绿色植物通过光合作用,将太阳能转化成化学能
D.碳循环和氧循环有利于维持大气中二氧化碳和氧气含量的相对稳定
(4)煤的燃烧会产生大量CO2,通过煤的综合利用可获得多种产品,有很多用途,其中焦炭广泛应用于炼铁.下列说法正确的是
.
A.煤加工成焦炭的变化属于物理变化
B.人类只能通过燃料的燃烧获取能量
C.煤燃烧产生的二氧化碳是污染空气的主要物质
D.煤是复杂的混合物,除了含有碳、氢元素外,还含有少量硫、氮等元素
[能力提升]
9.用CO2和NH3合成尿素CO(NH2)2是固定和利用CO2的成功范例,其反应的化学方程式为:CO2+2NH3===CO(NH2)2+X,下列说法不正确的是(
)
A.NH3中氮的化合价为-3价
B.该反应是充分利用CO2的一种有效途径
C.X的化学式是H2O
D.参加反应的CO2与NH3的质量比是44∶1
10.下列四个坐标图分别示意实验过程中某些量的变化,其中正确的是
(
)
A
B
C
D
向一定量的石灰水中通入二氧化碳
加热一定量高锰酸钾和二氧化锰的混合物
在某一密闭装置内点燃红磷
向一定量石灰石中滴加稀盐酸
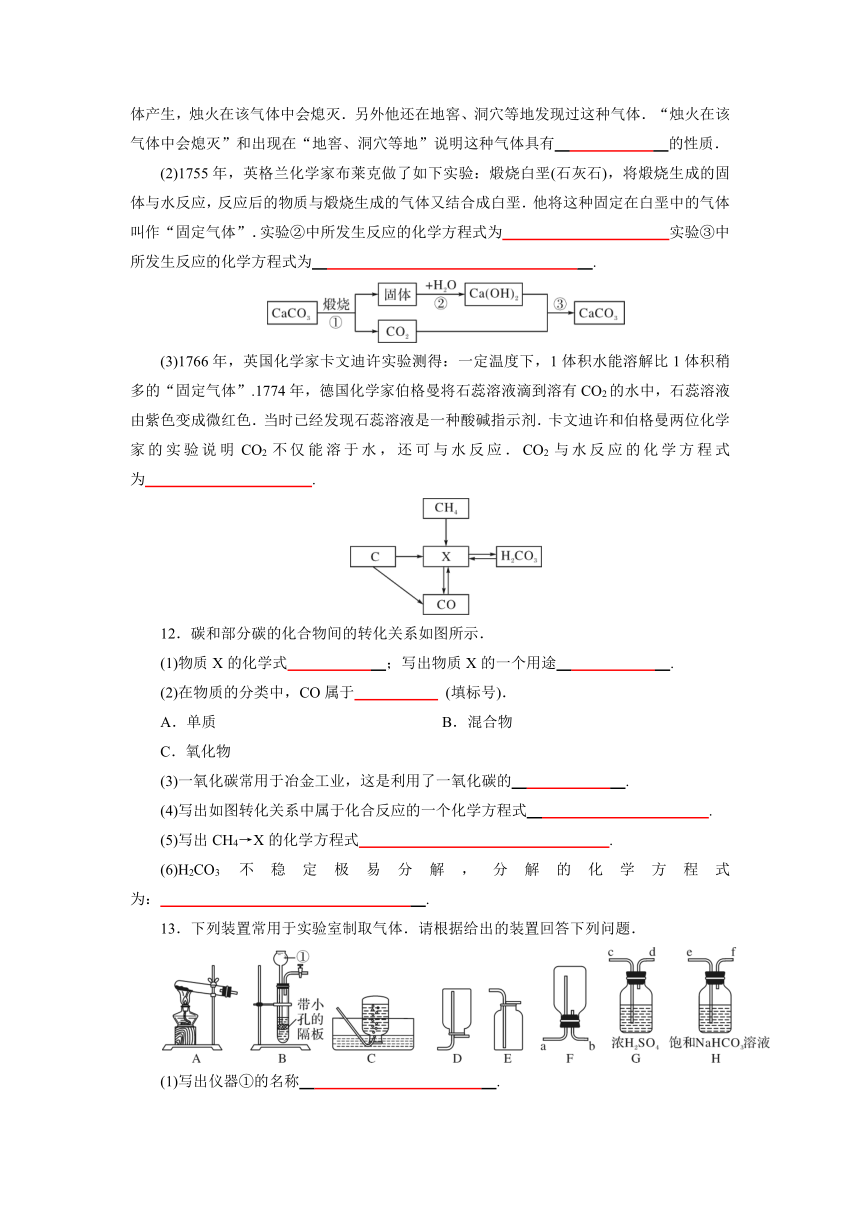
11.(2020·德州)CO2是如何被发现的?化学家又是如何研究它的性质?让我们重温这段历史.
(1)17世纪初,比利时化学家海尔蒙特研究发现,木炭燃烧后,有灰烬还有不可见的气体产生,烛火在该气体中会熄灭.另外他还在地窖、洞穴等地发现过这种气体.“烛火在该气体中会熄灭”和出现在“地窖、洞穴等地”说明这种气体具有
的性质.
(2)1755年,英格兰化学家布莱克做了如下实验:煅烧白垩(石灰石),将煅烧生成的固体与水反应,反应后的物质与煅烧生成的气体又结合成白垩.他将这种固定在白垩中的气体叫作“固定气体”.实验②中所发生反应的化学方程式为
实验③中所发生反应的化学方程式为
.
(3)1766年,英国化学家卡文迪许实验测得:一定温度下,1体积水能溶解比1体积稍多的“固定气体”.1774年,德国化学家伯格曼将石蕊溶液滴到溶有CO2的水中,石蕊溶液由紫色变成微红色.当时已经发现石蕊溶液是一种酸碱指示剂.卡文迪许和伯格曼两位化学家的实验说明CO2不仅能溶于水,还可与水反应.CO2与水反应的化学方程式为
.
12.碳和部分碳的化合物间的转化关系如图所示.
(1)物质X的化学式
;写出物质X的一个用途
.
(2)在物质的分类中,CO属于
(填标号).
A.单质
B.混合物
C.氧化物
(3)一氧化碳常用于冶金工业,这是利用了一氧化碳的
.
(4)写出如图转化关系中属于化合反应的一个化学方程式
.
(5)写出CH4→X的化学方程式
.
(6)H2CO3不稳定极易分解,分解的化学方程式为:
.
13.下列装置常用于实验室制取气体.请根据给出的装置回答下列问题.
(1)写出仪器①的名称
.
(2)实验室用氯酸钾制取氧气,应选用的发生装置是
(填字母标号),化学方程式是
若用C装置收集氧气,当观察到
时,开始收集.
(3)用B和E装置制取并收集CO2,反应的化学方程式为
.选择装置B作为制取CO2气体的发生装置,其突出优点是
,
若改用
F
装置收集二氧化碳,则气体应从
(填“a”或“b”)端进入.制得的二氧化碳中常含有少量的氯化氢气体和水蒸气,欲使用
G、H
装置将以上杂质气体除去,则装置正确的连接顺序是:混合气体→
→
→
→
(用导气管端口字母表示).
(4)已知:一氧化氮(NO)是生命体系信息分子之一,在常温下,它是难溶于水且不与水反应,易与O2反应生成二氧化氮(NO2)的气体.实验室收集少量NO
的装置可用
(填字母标号).
14.有一种石灰石样品的成分是CaCO3和SiO2(已知SiO2既不溶于水也不与盐酸反应).现取8
g石灰石样品与足量的50
g稀盐酸完全反应后,称得容器内的物质总质量为55.36
g.
试回答下列问题:
(1)反应后容器内的物质有
(填化学式).
(2)反应产生二氧化碳的质量为
.
(3)该石灰石样品中碳酸钙的质量分数是多少?
二氧化碳的研究
【化学用语检查站4】
写出下列有关反应的化学方程式及反应的基本类型:
1.工业上制取二氧化碳 CaCO3CaO+CO2↑ , 分解 反应.
2.实验室制取二氧化碳 CaCO3+2HCl===CaCl2+H2O+CO2↑ , 复分解 反应.
3.用澄清石灰水检验二氧化碳 Ca(OH)2+CO2===CaCO3↓+H2O ,实验现象 澄清石灰水变浑浊 .
4.“正常雨水”显微酸性的原因 CO2+H2O===H2CO3 , 化合 反应
[基础巩固]
1.下列关于碳及其化合物的说法,正确的是( C )
A.金刚石、石墨是碳的单质,而C60则是碳的化合物
B.二氧化碳是导致酸雨的气体之一
C.古代用墨书写或绘画经久不褪色,这是因为常温下碳的化学性质不活泼
D.二氧化碳和一氧化碳都可使动物死亡,所以都具有毒性
2.(2019·宜昌)为探究二氧化碳能否和水反应,用四朵石蕊溶液染成紫色的干燥小花完成下图四个实验.实验Ⅰ、Ⅳ中小花变红,实验Ⅱ、Ⅲ中小花不变色.下列说法不正确的是( D )
A.实验Ⅰ、Ⅱ说明醋酸可以使小花变红
B.实验Ⅲ说明二氧化碳不能使小花变红
C.实验Ⅱ、Ⅲ、Ⅳ说明二氧化碳能与水发生化学反应
D.上述实验说明二氧化碳和醋酸具有相似的化学性质
3.关于CO和CO2的说法正确的是( D )
A.组成:都由碳元素和氧元素组成,分子构成也相同
B.性质:常温下均为无色气体,且都有毒
C.用途:CO可以用来灭火,CO2可以做化工原料
D.转化:在一定条件下可以相互转化
4.区别下列各组物质,所加试剂或操作方法错误的是
( C )
A.空气、氧气和二氧化碳:用燃着的小木条
B.硫粉和高锰酸钾粉末:观察颜色
C.氮气和二氧化碳:闻气味
D.硬水和软水:用肥皂水
5.小明在进行理化操作考试中抽到了“制取二氧化碳,并检验气体”的试题.下列操作错误的是( B )
A.检查装置气密性
B.添加大理石
C.组装发生装置
D.检验CO2
6.为实现二氧化碳的绿色利用,科学家用固碳酶作催化剂设计了如图转化过程.下列说法正确的是( D )
A.反应①的化学方程式为CO2+C===CO
B.固碳酶在反应前后化学性质发生变化
C.X的化学式为CH2
D.该过程实现了无机物向有机物的转化
7.(2016·广东)如图所示实验中,①④为用紫色石蕊溶液润湿的棉球,②③为浸过紫色石蕊溶液的干燥棉球.下列能准确描述实验现象的是( A )
A.④比①先变红,②、③不变红
B.①比④先变红,②、③不变红
C.④变红,①②③不变红
D.①变红,②③④不变红
8.(2020·泰安)自然界中的“碳循环”和“氧循环”为生态系统的正常运转提供了可靠的资源保障,循环过程中CO2起着非常重要的作用,如图是这种作用的具体体现之一.
(1)CO2的水溶液能使紫色石蕊试液变红色,其原因是 CO2+H2O===H2CO3 (用化学方程式表示).
(2)有机物A完全燃烧的化学方程式:A+6O26CO2+6H2O,则A的化学式是 C6H12O6 .
(3)下列关于“碳循环”和“氧循环”的说法错误的是 B (填序号,下同).
A.无机物和有机物性质不同,但在一定条件下能相互转化
B.碳循环和氧循环分别是指二氧化碳和氧气的循环
C.绿色植物通过光合作用,将太阳能转化成化学能
D.碳循环和氧循环有利于维持大气中二氧化碳和氧气含量的相对稳定
(4)煤的燃烧会产生大量CO2,通过煤的综合利用可获得多种产品,有很多用途,其中焦炭广泛应用于炼铁.下列说法正确的是 D .
A.煤加工成焦炭的变化属于物理变化
B.人类只能通过燃料的燃烧获取能量
C.煤燃烧产生的二氧化碳是污染空气的主要物质
D.煤是复杂的混合物,除了含有碳、氢元素外,还含有少量硫、氮等元素
[能力提升]
9.用CO2和NH3合成尿素CO(NH2)2是固定和利用CO2的成功范例,其反应的化学方程式为:CO2+2NH3===CO(NH2)2+X,下列说法不正确的是( D )
A.NH3中氮的化合价为-3价
B.该反应是充分利用CO2的一种有效途径
C.X的化学式是H2O
D.参加反应的CO2与NH3的质量比是44∶1
10.下列四个坐标图分别示意实验过程中某些量的变化,其中正确的是
( C )
A
B
C
D
向一定量的石灰水中通入二氧化碳
加热一定量高锰酸钾和二氧化锰的混合物
在某一密闭装置内点燃红磷
向一定量石灰石中滴加稀盐酸
11.(2020·德州)CO2是如何被发现的?化学家又是如何研究它的性质?让我们重温这段历史.
(1)17世纪初,比利时化学家海尔蒙特研究发现,木炭燃烧后,有灰烬还有不可见的气体产生,烛火在该气体中会熄灭.另外他还在地窖、洞穴等地发现过这种气体.“烛火在该气体中会熄灭”和出现在“地窖、洞穴等地”说明这种气体具有 不支持燃烧,密度比空气大 的性质.
(2)1755年,英格兰化学家布莱克做了如下实验:煅烧白垩(石灰石),将煅烧生成的固体与水反应,反应后的物质与煅烧生成的气体又结合成白垩.他将这种固定在白垩中的气体叫作“固定气体”.实验②中所发生反应的化学方程式为 CaO+H2O===Ca(OH)2 .实验③中所发生反应的化学方程式为 CO2+Ca(OH)2===CaCO3↓+H2O .
(3)1766年,英国化学家卡文迪许实验测得:一定温度下,1体积水能溶解比1体积稍多的“固定气体”.1774年,德国化学家伯格曼将石蕊溶液滴到溶有CO2的水中,石蕊溶液由紫色变成微红色.当时已经发现石蕊溶液是一种酸碱指示剂.卡文迪许和伯格曼两位化学家的实验说明CO2不仅能溶于水,还可与水反应.CO2与水反应的化学方程式为 CO2+H2O===H2CO3 .
12.碳和部分碳的化合物间的转化关系如图所示.
(1)物质X的化学式 CO2 ;写出物质X的一个用途 人工降雨 .
(2)在物质的分类中,CO属于 C (填标号).
A.单质
B.混合物
C.氧化物
(3)一氧化碳常用于冶金工业,这是利用了一氧化碳的 还原性 .
(4)写出如图转化关系中属于化合反应的一个化学方程式 CO2+H2O===H2CO3(合理即可) .
(5)写出CH4→X的化学方程式 CH4+2O22H2O+CO2 .
(6)H2CO3不稳定极易分解,分解的化学方程式为: H2CO3===H2O+CO2↑ .
13.下列装置常用于实验室制取气体.请根据给出的装置回答下列问题.
(1)写出仪器①的名称 长颈漏斗 .
(2)实验室用氯酸钾制取氧气,应选用的发生装置是 A (填字母标号),化学方程式是 2KClO32KCl+3O2↑ .若用C装置收集氧气,当观察到 气泡连续均匀冒出 时,开始收集.
(3)用B和E装置制取并收集CO2,反应的化学方程式为 2HCl+CaCO3===CaCl2+CO2↑+H2O .选择装置B作为制取CO2气体的发生装置,其突出优点是 可控制反应的发生和停止 ,
若改用
F
装置收集二氧化碳,则气体应从 b (填“a”或“b”)端进入.制得的二氧化碳中常含有少量的氯化氢气体和水蒸气,欲使用
G、H
装置将以上杂质气体除去,则装置正确的连接顺序是:混合气体→ e → f → c → d (用导气管端口字母表示).
(4)已知:一氧化氮(NO)是生命体系信息分子之一,在常温下,它是难溶于水且不与水反应,易与O2反应生成二氧化氮(NO2)的气体.实验室收集少量NO
的装置可用 C
(填字母标号).
14.有一种石灰石样品的成分是CaCO3和SiO2(已知SiO2既不溶于水也不与盐酸反应).现取8
g石灰石样品与足量的50
g稀盐酸完全反应后,称得容器内的物质总质量为55.36
g.
试回答下列问题:
(1)反应后容器内的物质有 SiO2、CaCl2、HCl、H2O (填化学式).
(2)反应产生二氧化碳的质量为 2.64
g .
(3)该石灰石样品中碳酸钙的质量分数是多少?
解:设石灰石样品中碳酸钙的质量为x.
CaCO3+2HCl===CaCl2+H2O+CO2↑
100
44
x
2.64
g
= 解得x=6
g
石灰石样品中碳酸钙的质量分数为:×100%=75%
答:石灰石样品中碳酸钙的质量分数为75%.
【化学用语检查站4】
写出下列有关反应的化学方程式及反应的基本类型:
1.工业上制取二氧化碳
,
反应.
2.实验室制取二氧化碳
,
反应.
3.用澄清石灰水检验二氧化碳
,实验现象
.
4.“正常雨水”显微酸性的原因
,
反应
[基础巩固]
1.下列关于碳及其化合物的说法,正确的是(
)
A.金刚石、石墨是碳的单质,而C60则是碳的化合物
B.二氧化碳是导致酸雨的气体之一
C.古代用墨书写或绘画经久不褪色,这是因为常温下碳的化学性质不活泼
D.二氧化碳和一氧化碳都可使动物死亡,所以都具有毒性
2.(2019·宜昌)为探究二氧化碳能否和水反应,用四朵石蕊溶液染成紫色的干燥小花完成下图四个实验.实验Ⅰ、Ⅳ中小花变红,实验Ⅱ、Ⅲ中小花不变色.下列说法不正确的是(
)
A.实验Ⅰ、Ⅱ说明醋酸可以使小花变红
B.实验Ⅲ说明二氧化碳不能使小花变红
C.实验Ⅱ、Ⅲ、Ⅳ说明二氧化碳能与水发生化学反应
D.上述实验说明二氧化碳和醋酸具有相似的化学性质
3.关于CO和CO2的说法正确的是(
)
A.组成:都由碳元素和氧元素组成,分子构成也相同
B.性质:常温下均为无色气体,且都有毒
C.用途:CO可以用来灭火,CO2可以做化工原料
D.转化:在一定条件下可以相互转化
4.区别下列各组物质,所加试剂或操作方法错误的是
(
)
A.空气、氧气和二氧化碳:用燃着的小木条
B.硫粉和高锰酸钾粉末:观察颜色
C.氮气和二氧化碳:闻气味
D.硬水和软水:用肥皂水
5.小明在进行理化操作考试中抽到了“制取二氧化碳,并检验气体”的试题.下列操作错误的是(
)
A.检查装置气密性
B.添加大理石
C.组装发生装置
D.检验CO2
6.为实现二氧化碳的绿色利用,科学家用固碳酶作催化剂设计了如图转化过程.下列说法正确的是(
)
A.反应①的化学方程式为CO2+C===CO
B.固碳酶在反应前后化学性质发生变化
C.X的化学式为CH2
D.该过程实现了无机物向有机物的转化
7.(2016·广东)如图所示实验中,①④为用紫色石蕊溶液润湿的棉球,②③为浸过紫色石蕊溶液的干燥棉球.下列能准确描述实验现象的是(
)
A.④比①先变红,②、③不变红
B.①比④先变红,②、③不变红
C.④变红,①②③不变红
D.①变红,②③④不变红
8.(2020·泰安)自然界中的“碳循环”和“氧循环”为生态系统的正常运转提供了可靠的资源保障,循环过程中CO2起着非常重要的作用,如图是这种作用的具体体现之一.
(1)CO2的水溶液能使紫色石蕊试液变红色,其原因是
(用化学方程式表示).
(2)有机物A完全燃烧的化学方程式:A+6O26CO2+6H2O,则A的化学式是
.
(3)下列关于“碳循环”和“氧循环”的说法错误的是
(填序号,下同).
A.无机物和有机物性质不同,但在一定条件下能相互转化
B.碳循环和氧循环分别是指二氧化碳和氧气的循环
C.绿色植物通过光合作用,将太阳能转化成化学能
D.碳循环和氧循环有利于维持大气中二氧化碳和氧气含量的相对稳定
(4)煤的燃烧会产生大量CO2,通过煤的综合利用可获得多种产品,有很多用途,其中焦炭广泛应用于炼铁.下列说法正确的是
.
A.煤加工成焦炭的变化属于物理变化
B.人类只能通过燃料的燃烧获取能量
C.煤燃烧产生的二氧化碳是污染空气的主要物质
D.煤是复杂的混合物,除了含有碳、氢元素外,还含有少量硫、氮等元素
[能力提升]
9.用CO2和NH3合成尿素CO(NH2)2是固定和利用CO2的成功范例,其反应的化学方程式为:CO2+2NH3===CO(NH2)2+X,下列说法不正确的是(
)
A.NH3中氮的化合价为-3价
B.该反应是充分利用CO2的一种有效途径
C.X的化学式是H2O
D.参加反应的CO2与NH3的质量比是44∶1
10.下列四个坐标图分别示意实验过程中某些量的变化,其中正确的是
(
)
A
B
C
D
向一定量的石灰水中通入二氧化碳
加热一定量高锰酸钾和二氧化锰的混合物
在某一密闭装置内点燃红磷
向一定量石灰石中滴加稀盐酸
11.(2020·德州)CO2是如何被发现的?化学家又是如何研究它的性质?让我们重温这段历史.
(1)17世纪初,比利时化学家海尔蒙特研究发现,木炭燃烧后,有灰烬还有不可见的气体产生,烛火在该气体中会熄灭.另外他还在地窖、洞穴等地发现过这种气体.“烛火在该气体中会熄灭”和出现在“地窖、洞穴等地”说明这种气体具有
的性质.
(2)1755年,英格兰化学家布莱克做了如下实验:煅烧白垩(石灰石),将煅烧生成的固体与水反应,反应后的物质与煅烧生成的气体又结合成白垩.他将这种固定在白垩中的气体叫作“固定气体”.实验②中所发生反应的化学方程式为
实验③中所发生反应的化学方程式为
.
(3)1766年,英国化学家卡文迪许实验测得:一定温度下,1体积水能溶解比1体积稍多的“固定气体”.1774年,德国化学家伯格曼将石蕊溶液滴到溶有CO2的水中,石蕊溶液由紫色变成微红色.当时已经发现石蕊溶液是一种酸碱指示剂.卡文迪许和伯格曼两位化学家的实验说明CO2不仅能溶于水,还可与水反应.CO2与水反应的化学方程式为
.
12.碳和部分碳的化合物间的转化关系如图所示.
(1)物质X的化学式
;写出物质X的一个用途
.
(2)在物质的分类中,CO属于
(填标号).
A.单质
B.混合物
C.氧化物
(3)一氧化碳常用于冶金工业,这是利用了一氧化碳的
.
(4)写出如图转化关系中属于化合反应的一个化学方程式
.
(5)写出CH4→X的化学方程式
.
(6)H2CO3不稳定极易分解,分解的化学方程式为:
.
13.下列装置常用于实验室制取气体.请根据给出的装置回答下列问题.
(1)写出仪器①的名称
.
(2)实验室用氯酸钾制取氧气,应选用的发生装置是
(填字母标号),化学方程式是
若用C装置收集氧气,当观察到
时,开始收集.
(3)用B和E装置制取并收集CO2,反应的化学方程式为
.选择装置B作为制取CO2气体的发生装置,其突出优点是
,
若改用
F
装置收集二氧化碳,则气体应从
(填“a”或“b”)端进入.制得的二氧化碳中常含有少量的氯化氢气体和水蒸气,欲使用
G、H
装置将以上杂质气体除去,则装置正确的连接顺序是:混合气体→
→
→
→
(用导气管端口字母表示).
(4)已知:一氧化氮(NO)是生命体系信息分子之一,在常温下,它是难溶于水且不与水反应,易与O2反应生成二氧化氮(NO2)的气体.实验室收集少量NO
的装置可用
(填字母标号).
14.有一种石灰石样品的成分是CaCO3和SiO2(已知SiO2既不溶于水也不与盐酸反应).现取8
g石灰石样品与足量的50
g稀盐酸完全反应后,称得容器内的物质总质量为55.36
g.
试回答下列问题:
(1)反应后容器内的物质有
(填化学式).
(2)反应产生二氧化碳的质量为
.
(3)该石灰石样品中碳酸钙的质量分数是多少?
二氧化碳的研究
【化学用语检查站4】
写出下列有关反应的化学方程式及反应的基本类型:
1.工业上制取二氧化碳 CaCO3CaO+CO2↑ , 分解 反应.
2.实验室制取二氧化碳 CaCO3+2HCl===CaCl2+H2O+CO2↑ , 复分解 反应.
3.用澄清石灰水检验二氧化碳 Ca(OH)2+CO2===CaCO3↓+H2O ,实验现象 澄清石灰水变浑浊 .
4.“正常雨水”显微酸性的原因 CO2+H2O===H2CO3 , 化合 反应
[基础巩固]
1.下列关于碳及其化合物的说法,正确的是( C )
A.金刚石、石墨是碳的单质,而C60则是碳的化合物
B.二氧化碳是导致酸雨的气体之一
C.古代用墨书写或绘画经久不褪色,这是因为常温下碳的化学性质不活泼
D.二氧化碳和一氧化碳都可使动物死亡,所以都具有毒性
2.(2019·宜昌)为探究二氧化碳能否和水反应,用四朵石蕊溶液染成紫色的干燥小花完成下图四个实验.实验Ⅰ、Ⅳ中小花变红,实验Ⅱ、Ⅲ中小花不变色.下列说法不正确的是( D )
A.实验Ⅰ、Ⅱ说明醋酸可以使小花变红
B.实验Ⅲ说明二氧化碳不能使小花变红
C.实验Ⅱ、Ⅲ、Ⅳ说明二氧化碳能与水发生化学反应
D.上述实验说明二氧化碳和醋酸具有相似的化学性质
3.关于CO和CO2的说法正确的是( D )
A.组成:都由碳元素和氧元素组成,分子构成也相同
B.性质:常温下均为无色气体,且都有毒
C.用途:CO可以用来灭火,CO2可以做化工原料
D.转化:在一定条件下可以相互转化
4.区别下列各组物质,所加试剂或操作方法错误的是
( C )
A.空气、氧气和二氧化碳:用燃着的小木条
B.硫粉和高锰酸钾粉末:观察颜色
C.氮气和二氧化碳:闻气味
D.硬水和软水:用肥皂水
5.小明在进行理化操作考试中抽到了“制取二氧化碳,并检验气体”的试题.下列操作错误的是( B )
A.检查装置气密性
B.添加大理石
C.组装发生装置
D.检验CO2
6.为实现二氧化碳的绿色利用,科学家用固碳酶作催化剂设计了如图转化过程.下列说法正确的是( D )
A.反应①的化学方程式为CO2+C===CO
B.固碳酶在反应前后化学性质发生变化
C.X的化学式为CH2
D.该过程实现了无机物向有机物的转化
7.(2016·广东)如图所示实验中,①④为用紫色石蕊溶液润湿的棉球,②③为浸过紫色石蕊溶液的干燥棉球.下列能准确描述实验现象的是( A )
A.④比①先变红,②、③不变红
B.①比④先变红,②、③不变红
C.④变红,①②③不变红
D.①变红,②③④不变红
8.(2020·泰安)自然界中的“碳循环”和“氧循环”为生态系统的正常运转提供了可靠的资源保障,循环过程中CO2起着非常重要的作用,如图是这种作用的具体体现之一.
(1)CO2的水溶液能使紫色石蕊试液变红色,其原因是 CO2+H2O===H2CO3 (用化学方程式表示).
(2)有机物A完全燃烧的化学方程式:A+6O26CO2+6H2O,则A的化学式是 C6H12O6 .
(3)下列关于“碳循环”和“氧循环”的说法错误的是 B (填序号,下同).
A.无机物和有机物性质不同,但在一定条件下能相互转化
B.碳循环和氧循环分别是指二氧化碳和氧气的循环
C.绿色植物通过光合作用,将太阳能转化成化学能
D.碳循环和氧循环有利于维持大气中二氧化碳和氧气含量的相对稳定
(4)煤的燃烧会产生大量CO2,通过煤的综合利用可获得多种产品,有很多用途,其中焦炭广泛应用于炼铁.下列说法正确的是 D .
A.煤加工成焦炭的变化属于物理变化
B.人类只能通过燃料的燃烧获取能量
C.煤燃烧产生的二氧化碳是污染空气的主要物质
D.煤是复杂的混合物,除了含有碳、氢元素外,还含有少量硫、氮等元素
[能力提升]
9.用CO2和NH3合成尿素CO(NH2)2是固定和利用CO2的成功范例,其反应的化学方程式为:CO2+2NH3===CO(NH2)2+X,下列说法不正确的是( D )
A.NH3中氮的化合价为-3价
B.该反应是充分利用CO2的一种有效途径
C.X的化学式是H2O
D.参加反应的CO2与NH3的质量比是44∶1
10.下列四个坐标图分别示意实验过程中某些量的变化,其中正确的是
( C )
A
B
C
D
向一定量的石灰水中通入二氧化碳
加热一定量高锰酸钾和二氧化锰的混合物
在某一密闭装置内点燃红磷
向一定量石灰石中滴加稀盐酸
11.(2020·德州)CO2是如何被发现的?化学家又是如何研究它的性质?让我们重温这段历史.
(1)17世纪初,比利时化学家海尔蒙特研究发现,木炭燃烧后,有灰烬还有不可见的气体产生,烛火在该气体中会熄灭.另外他还在地窖、洞穴等地发现过这种气体.“烛火在该气体中会熄灭”和出现在“地窖、洞穴等地”说明这种气体具有 不支持燃烧,密度比空气大 的性质.
(2)1755年,英格兰化学家布莱克做了如下实验:煅烧白垩(石灰石),将煅烧生成的固体与水反应,反应后的物质与煅烧生成的气体又结合成白垩.他将这种固定在白垩中的气体叫作“固定气体”.实验②中所发生反应的化学方程式为 CaO+H2O===Ca(OH)2 .实验③中所发生反应的化学方程式为 CO2+Ca(OH)2===CaCO3↓+H2O .
(3)1766年,英国化学家卡文迪许实验测得:一定温度下,1体积水能溶解比1体积稍多的“固定气体”.1774年,德国化学家伯格曼将石蕊溶液滴到溶有CO2的水中,石蕊溶液由紫色变成微红色.当时已经发现石蕊溶液是一种酸碱指示剂.卡文迪许和伯格曼两位化学家的实验说明CO2不仅能溶于水,还可与水反应.CO2与水反应的化学方程式为 CO2+H2O===H2CO3 .
12.碳和部分碳的化合物间的转化关系如图所示.
(1)物质X的化学式 CO2 ;写出物质X的一个用途 人工降雨 .
(2)在物质的分类中,CO属于 C (填标号).
A.单质
B.混合物
C.氧化物
(3)一氧化碳常用于冶金工业,这是利用了一氧化碳的 还原性 .
(4)写出如图转化关系中属于化合反应的一个化学方程式 CO2+H2O===H2CO3(合理即可) .
(5)写出CH4→X的化学方程式 CH4+2O22H2O+CO2 .
(6)H2CO3不稳定极易分解,分解的化学方程式为: H2CO3===H2O+CO2↑ .
13.下列装置常用于实验室制取气体.请根据给出的装置回答下列问题.
(1)写出仪器①的名称 长颈漏斗 .
(2)实验室用氯酸钾制取氧气,应选用的发生装置是 A (填字母标号),化学方程式是 2KClO32KCl+3O2↑ .若用C装置收集氧气,当观察到 气泡连续均匀冒出 时,开始收集.
(3)用B和E装置制取并收集CO2,反应的化学方程式为 2HCl+CaCO3===CaCl2+CO2↑+H2O .选择装置B作为制取CO2气体的发生装置,其突出优点是 可控制反应的发生和停止 ,
若改用
F
装置收集二氧化碳,则气体应从 b (填“a”或“b”)端进入.制得的二氧化碳中常含有少量的氯化氢气体和水蒸气,欲使用
G、H
装置将以上杂质气体除去,则装置正确的连接顺序是:混合气体→ e → f → c → d (用导气管端口字母表示).
(4)已知:一氧化氮(NO)是生命体系信息分子之一,在常温下,它是难溶于水且不与水反应,易与O2反应生成二氧化氮(NO2)的气体.实验室收集少量NO
的装置可用 C
(填字母标号).
14.有一种石灰石样品的成分是CaCO3和SiO2(已知SiO2既不溶于水也不与盐酸反应).现取8
g石灰石样品与足量的50
g稀盐酸完全反应后,称得容器内的物质总质量为55.36
g.
试回答下列问题:
(1)反应后容器内的物质有 SiO2、CaCl2、HCl、H2O (填化学式).
(2)反应产生二氧化碳的质量为 2.64
g .
(3)该石灰石样品中碳酸钙的质量分数是多少?
解:设石灰石样品中碳酸钙的质量为x.
CaCO3+2HCl===CaCl2+H2O+CO2↑
100
44
x
2.64
g
= 解得x=6
g
石灰石样品中碳酸钙的质量分数为:×100%=75%
答:石灰石样品中碳酸钙的质量分数为75%.
同课章节目录
