江苏省徐州市郑集高级中学2020-2021学年高一下学期3月月考化学试题 Word版含答案
文档属性
| 名称 | 江苏省徐州市郑集高级中学2020-2021学年高一下学期3月月考化学试题 Word版含答案 |  | |
| 格式 | docx | ||
| 文件大小 | 407.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-04-05 20:37:44 | ||
图片预览



文档简介
郑集高中(南校)2020-2021学年第二学期第一次学情调查
高 一 化 学 试 题(选 修)
考试时间:60分钟 满分:100分
相对原子质量:H-1 He-4 C-12 N-14 O-16 Na-23 Mg-24 Al-27 Si-28 S-32 Cl-35.5
K-39 Ca-40 Mn-55 Fe-56 Cu-64 Zn-65
第Ⅰ卷(选择题 共68分)
一、单项选择题:本题共17小题,每小题4分,共68分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1、下列关于含氮化合物的说法不正确的是( )
A.工业上可使用液氨作制冷剂 B.能导致“光化学烟雾”的形成
C.浓硝酸可用铝槽车运输 D.硫酸铵又称肥田粉,属于硝态氮肥
2、已知NH3,HCl极易溶于水,Cl2能溶于水。下列各装置不能达到实验目的的是( )
A.利用1吸收多余的氨气 B.装置2可用于除去CO2中的HCl
C.装置3可用于干燥氨气 D.装置4可用于排空气法收集H2、CO2、Cl2、HCl等气体
3、下列关于化学反应中物质或能量变化的判断正确的是( )
A. 加热条件下进行的化学反应一定是吸热反应
B. 化学键的断裂和形成是化学反应中能量变化的主要原因
C. 一定条件下进行的化学反应,只能将化学能转化为热能和光能
D. 将固体与固体混合并搅拌,反应放出热量
4、下左图是进行气体性质实验的常用装置,下列对有关实验现象的描述中,不正确的是( )
A. 若水槽中盛有水,试管中盛满SO2,可看到试管中液面上升
B. 若水槽中盛有水(滴有酚酞),试管中是NH3,可看到试管内液面上升并呈红色
C. 若水槽中盛有水,试管中盛满NO2,可看到试管中液面上升并充满试管
D. 若水槽中盛有NaOH溶液,试管中是Cl2,可看到试管内液面上升,黄绿色褪去
5、下列反应属于氧化还原反应,且能量变化如上右图所示的是( )
A.锌粒和稀硫酸反应 B.灼热的木炭与CO2反应
C.甲烷在空气中燃烧的反应 D. 晶体与晶体的反应
6、对于反应,下列不同条件下的反应速率,其中进行得最快的是( )
A. B.
C. D.
7、银锌电池的充电和放电过程可以表示为Ag2O+Zn+H2O 2Ag+Zn(OH)2 。此电池放电时,正极上发生反应的物质是( )
A.Ag B.Zn(OH)2 C.Ag2O D.Zn
8、下列反应中硝酸既表现出酸性又表现出氧化性的是( )
A.使石蕊溶液变红 B.与铜反应放出NO气体并生成
C.与反应放出气体并生成 D.与S单质混合共热时生成和
9、对于300mL 1 mol·L-1盐酸与铁片的反应,采取下列措施中能使反应速率加快的是( )
①升高温度 ②改用100mL 3 mol·L-1盐酸 ③再加300mL 1 mol·L-1盐酸
④用等量铁粉代替铁片 ⑤改用100mL98%的硫酸
A.①②④ B.①③④ C.①②③④ D.①②③⑤
10、把在空气中久置的铝片5.0 g投入盛有50 mL 硫酸溶液的烧杯中,该铝片与硫酸反应产生氢气的速率v与反应时间t可用如图所示的坐标曲线来表示。下列推论错误的是( )
A.O→a段不产生氢气是因为表面的氧化物隔离了铝和硫酸溶液
B.b→c段产生氢气的速率增加较快的主要原因之一是温度升高
C.t=c时反应处于平衡状态
D.时,产生氢气的速率降低主要是因为溶液中降低
11、反应在一定容积的密闭容器中进行,则下列说法或结论正确的是( )
A.其他条件不变,仅将容器的容积缩小一半,反应速率减小
B.反应达平衡状态时
C.保持容积不变,充入少量He气体使体系压强增大,反应速率一定增大
D.其他条件不变,适当增加C(s)的质量会使反应速率增大
12、今有如下三个热化学方程式,关于它们的下列表述正确的是
H2(g)+1/2 O2(g)=H2O(g);ΔH=a KJ·mol-1,
H2(g)+1/2 O2(g)=H2O(l);ΔH== b kJ·mol-1,
2H2(g)+O2(g)=2H2O(l);ΔH== c kJ·mol-1,
A.它们都是吸热反应 B.a、b和c均为正值 C.a== b D.2b== c
13、在一密闭容器中进行反应:,已知反应过程中某一时刻、的浓度分别为0.2mol·L-1、0.1mol·L-1、0.2mol·L-1,当反应达到平衡时,可能存在的数据是( )
A.SO2的浓度为0.4mol·L-1,O2的浓度为0.2mol·L-1
B.SO2的浓度为0.3mol·L-1
C.SO3的浓度为0.4mol·L-1
D.SO2、SO3的浓度均为0.1mol·L-1
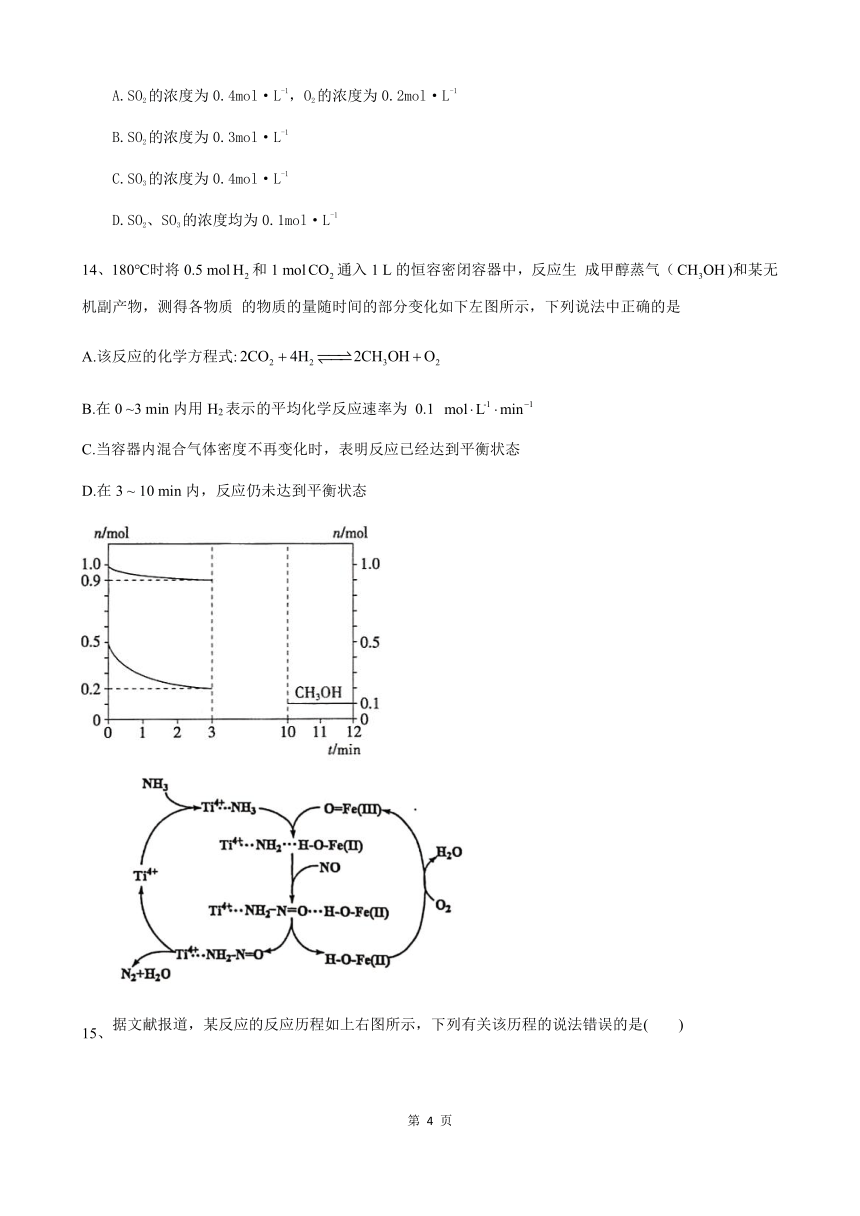
14、180℃时将0.5 mol和1 mol通入1 L的恒容密闭容器中,反应生 成甲醇蒸气()和某无机副产物,测得各物质 的物质的量随时间的部分变化如下左图所示,下列说法中正确的是
A.该反应的化学方程式:
B.在0 ~3 min内用H2表示的平均化学反应速率为 0.1
C.当容器内混合气体密度不再变化时,表明反应已经达到平衡状态
D.在3 ~ 10 min内,反应仍未达到平衡状态
15、据文献报道,某反应的反应历程如上右图所示,下列有关该历程的说法错误的是( )
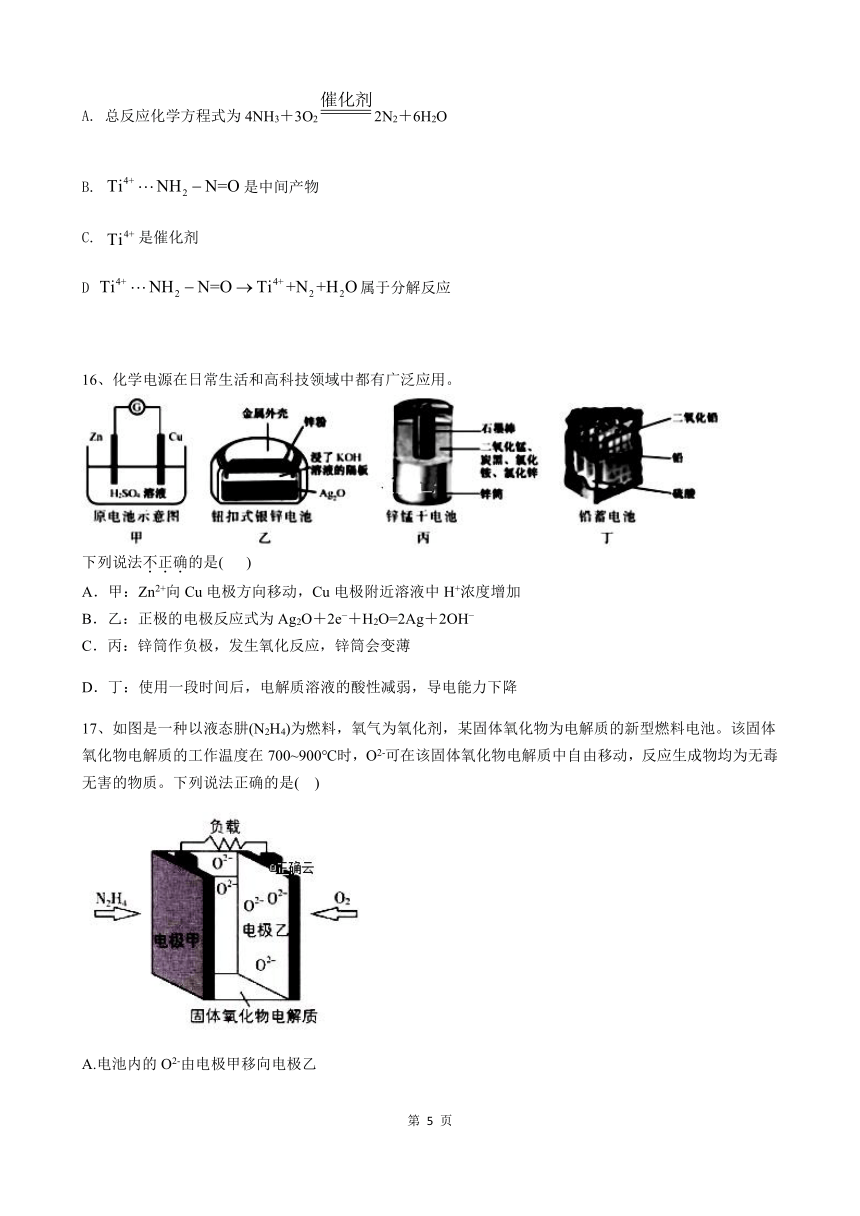
A. 总反应化学方程式为4NH3+3O22N2+6H2O
B. 是中间产物
C. 是催化剂
D 属于分解反应
16、化学电源在日常生活和高科技领域中都有广泛应用。
下列说法不正确的是( )
A.甲:Zn2+向Cu电极方向移动,Cu电极附近溶液中H+浓度增加
B.乙:正极的电极反应式为Ag2O+2e +H2O=2Ag+2OH
C.丙:锌筒作负极,发生氧化反应,锌筒会变薄
D.丁:使用一段时间后,电解质溶液的酸性减弱,导电能力下降
17、如图是一种以液态肼(N2H4)为燃料,氧气为氧化剂,某固体氧化物为电解质的新型燃料电池。该固体氧化物电解质的工作温度在700~900℃时,O2-可在该固体氧化物电解质中自由移动,反应生成物均为无毒无害的物质。下列说法正确的是( )
A.电池内的O2-由电极甲移向电极乙
B.电池总反应为N2H4+2O2=2NO+2H2O
C.当甲电极上消耗1mol N2H4时,乙电极上有1mol O2参与反应
D.电池外电路的电子由电极乙移向电极甲
郑集高中(南校)2020-2021学年第二学期第一次学情调查
高 一 化 学 试 题(选 修)
第II卷(非选择题 共32分)
18、(14分)某化学小组按下图所示实验流程比较浓硝酸和稀硝酸的氧化性强弱,其中B为一种紫红色金属,C为红棕色气体。
请回答下列问题:
(1)A与B反应的化学方程式是_______________________________________;
(2)实验时在装置Ⅰ中加入B后,在加入A之前需向整套装置中通入足量的CO2气体,该操作的目的是__________________________________________________________。
(3)装置Ⅱ中发生反应的化学方程式是______________________________。
(4)通过实验可得出:浓硝酸的氧化性比稀硝酸________(填“强”或“弱”),判断的依据是__________________________________________________________。
(5)小组内有同学指出该流程中装置Ⅴ可有可无,你认为装置Ⅴ是否需要________(填“是”或“否”),理由是 ___________________________________________________。
19、(18分)化学反应中伴随着能量的变化。
(1)下列变化中属于吸热反应的是 (填字母)
①液态水汽化 ②将胆矾加热变为白色粉末 ③苛性钠固体溶于水
④氯酸钾分解制氧气 ⑤生石灰跟水反应生成熟石灰 ⑥干冰升华
A.①② B.②④ C.③ D.①⑥
(2)断开1 mol H-H键、1 mol N-H键、1 mol键分别需要吸收的能量为436 kJ、391 KJ、946 k,则
1 mol 生成理论上能 (填“吸收”或“放出”)能量 kJ。
(3)某学习小组研究影响锌与稀硫酸反应速率的外界条件,设计实验的数据如下:
序号 锌的质量 /g 锌的 状态 c(H2SO4) /mol·L-1 V(H2SO4) /mL 反应前溶液 的温度/℃ 其他试剂
1 0.65 粒状 0.5 50 20 无
2 0.65 粉末 0.5 50 20 无
序号 锌的质量 /g 锌的 状态 c(H2SO4) /mol·L-1 V(H2SO4) /mL 反应前溶液 的温度/℃ 其他试剂
3 0.65 粒状 0.5 50 20 2滴CuSO4溶液
4 0.65 粉末 0.8 50 20 无
5 0.65 粉末 0.8 50 35 2滴CuSO4溶液
在此5组实验中,速率最快的是__________(填实验序号);
实验1和2表明__________对反应速率有影响;
实验1和3表明__________对反应速率有影响。
(4)用和组合形成的质子交换膜燃料电池的结构如图丙:
①则电极d是 (填“正极”或“负极”),电极c的电极反应式为 。
②若线路中转移2 mol电子,则该燃料电池理论上消耗的在标准状况下的体积为 L。
参考答案
一、选择题(共68分)
1-5 DBBCB 6-10 ACBAC 11-15 BDBBA 16-17 AC
二、非选择题(共32分)
18、(共14分,每空2分)
(1)Cu+4HNO3(浓)=Cu(NO3)2+ 2NO2↑+2H2O;
(2)排出系统内的氧气,防止生成的NO被氧化
(3)3NO2+ H2O=2HNO3+NO
(4)强, 浓硝酸能将NO氧化为NO2,而稀硝酸不能
(5)是, 装置Ⅴ可吸收尾气NO、NO2,防止环境污染
19、(共18分,每空2分)
(1)B
(2)①放出 92
(3)5; 固体反应物的表面积; (是否形成)原电池
(4)①正极,
②11.2
高 一 化 学 试 题(选 修)
考试时间:60分钟 满分:100分
相对原子质量:H-1 He-4 C-12 N-14 O-16 Na-23 Mg-24 Al-27 Si-28 S-32 Cl-35.5
K-39 Ca-40 Mn-55 Fe-56 Cu-64 Zn-65
第Ⅰ卷(选择题 共68分)
一、单项选择题:本题共17小题,每小题4分,共68分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1、下列关于含氮化合物的说法不正确的是( )
A.工业上可使用液氨作制冷剂 B.能导致“光化学烟雾”的形成
C.浓硝酸可用铝槽车运输 D.硫酸铵又称肥田粉,属于硝态氮肥
2、已知NH3,HCl极易溶于水,Cl2能溶于水。下列各装置不能达到实验目的的是( )
A.利用1吸收多余的氨气 B.装置2可用于除去CO2中的HCl
C.装置3可用于干燥氨气 D.装置4可用于排空气法收集H2、CO2、Cl2、HCl等气体
3、下列关于化学反应中物质或能量变化的判断正确的是( )
A. 加热条件下进行的化学反应一定是吸热反应
B. 化学键的断裂和形成是化学反应中能量变化的主要原因
C. 一定条件下进行的化学反应,只能将化学能转化为热能和光能
D. 将固体与固体混合并搅拌,反应放出热量
4、下左图是进行气体性质实验的常用装置,下列对有关实验现象的描述中,不正确的是( )
A. 若水槽中盛有水,试管中盛满SO2,可看到试管中液面上升
B. 若水槽中盛有水(滴有酚酞),试管中是NH3,可看到试管内液面上升并呈红色
C. 若水槽中盛有水,试管中盛满NO2,可看到试管中液面上升并充满试管
D. 若水槽中盛有NaOH溶液,试管中是Cl2,可看到试管内液面上升,黄绿色褪去
5、下列反应属于氧化还原反应,且能量变化如上右图所示的是( )
A.锌粒和稀硫酸反应 B.灼热的木炭与CO2反应
C.甲烷在空气中燃烧的反应 D. 晶体与晶体的反应
6、对于反应,下列不同条件下的反应速率,其中进行得最快的是( )
A. B.
C. D.
7、银锌电池的充电和放电过程可以表示为Ag2O+Zn+H2O 2Ag+Zn(OH)2 。此电池放电时,正极上发生反应的物质是( )
A.Ag B.Zn(OH)2 C.Ag2O D.Zn
8、下列反应中硝酸既表现出酸性又表现出氧化性的是( )
A.使石蕊溶液变红 B.与铜反应放出NO气体并生成
C.与反应放出气体并生成 D.与S单质混合共热时生成和
9、对于300mL 1 mol·L-1盐酸与铁片的反应,采取下列措施中能使反应速率加快的是( )
①升高温度 ②改用100mL 3 mol·L-1盐酸 ③再加300mL 1 mol·L-1盐酸
④用等量铁粉代替铁片 ⑤改用100mL98%的硫酸
A.①②④ B.①③④ C.①②③④ D.①②③⑤
10、把在空气中久置的铝片5.0 g投入盛有50 mL 硫酸溶液的烧杯中,该铝片与硫酸反应产生氢气的速率v与反应时间t可用如图所示的坐标曲线来表示。下列推论错误的是( )
A.O→a段不产生氢气是因为表面的氧化物隔离了铝和硫酸溶液
B.b→c段产生氢气的速率增加较快的主要原因之一是温度升高
C.t=c时反应处于平衡状态
D.时,产生氢气的速率降低主要是因为溶液中降低
11、反应在一定容积的密闭容器中进行,则下列说法或结论正确的是( )
A.其他条件不变,仅将容器的容积缩小一半,反应速率减小
B.反应达平衡状态时
C.保持容积不变,充入少量He气体使体系压强增大,反应速率一定增大
D.其他条件不变,适当增加C(s)的质量会使反应速率增大
12、今有如下三个热化学方程式,关于它们的下列表述正确的是
H2(g)+1/2 O2(g)=H2O(g);ΔH=a KJ·mol-1,
H2(g)+1/2 O2(g)=H2O(l);ΔH== b kJ·mol-1,
2H2(g)+O2(g)=2H2O(l);ΔH== c kJ·mol-1,
A.它们都是吸热反应 B.a、b和c均为正值 C.a== b D.2b== c
13、在一密闭容器中进行反应:,已知反应过程中某一时刻、的浓度分别为0.2mol·L-1、0.1mol·L-1、0.2mol·L-1,当反应达到平衡时,可能存在的数据是( )
A.SO2的浓度为0.4mol·L-1,O2的浓度为0.2mol·L-1
B.SO2的浓度为0.3mol·L-1
C.SO3的浓度为0.4mol·L-1
D.SO2、SO3的浓度均为0.1mol·L-1
14、180℃时将0.5 mol和1 mol通入1 L的恒容密闭容器中,反应生 成甲醇蒸气()和某无机副产物,测得各物质 的物质的量随时间的部分变化如下左图所示,下列说法中正确的是
A.该反应的化学方程式:
B.在0 ~3 min内用H2表示的平均化学反应速率为 0.1
C.当容器内混合气体密度不再变化时,表明反应已经达到平衡状态
D.在3 ~ 10 min内,反应仍未达到平衡状态
15、据文献报道,某反应的反应历程如上右图所示,下列有关该历程的说法错误的是( )
A. 总反应化学方程式为4NH3+3O22N2+6H2O
B. 是中间产物
C. 是催化剂
D 属于分解反应
16、化学电源在日常生活和高科技领域中都有广泛应用。
下列说法不正确的是( )
A.甲:Zn2+向Cu电极方向移动,Cu电极附近溶液中H+浓度增加
B.乙:正极的电极反应式为Ag2O+2e +H2O=2Ag+2OH
C.丙:锌筒作负极,发生氧化反应,锌筒会变薄
D.丁:使用一段时间后,电解质溶液的酸性减弱,导电能力下降
17、如图是一种以液态肼(N2H4)为燃料,氧气为氧化剂,某固体氧化物为电解质的新型燃料电池。该固体氧化物电解质的工作温度在700~900℃时,O2-可在该固体氧化物电解质中自由移动,反应生成物均为无毒无害的物质。下列说法正确的是( )
A.电池内的O2-由电极甲移向电极乙
B.电池总反应为N2H4+2O2=2NO+2H2O
C.当甲电极上消耗1mol N2H4时,乙电极上有1mol O2参与反应
D.电池外电路的电子由电极乙移向电极甲
郑集高中(南校)2020-2021学年第二学期第一次学情调查
高 一 化 学 试 题(选 修)
第II卷(非选择题 共32分)
18、(14分)某化学小组按下图所示实验流程比较浓硝酸和稀硝酸的氧化性强弱,其中B为一种紫红色金属,C为红棕色气体。
请回答下列问题:
(1)A与B反应的化学方程式是_______________________________________;
(2)实验时在装置Ⅰ中加入B后,在加入A之前需向整套装置中通入足量的CO2气体,该操作的目的是__________________________________________________________。
(3)装置Ⅱ中发生反应的化学方程式是______________________________。
(4)通过实验可得出:浓硝酸的氧化性比稀硝酸________(填“强”或“弱”),判断的依据是__________________________________________________________。
(5)小组内有同学指出该流程中装置Ⅴ可有可无,你认为装置Ⅴ是否需要________(填“是”或“否”),理由是 ___________________________________________________。
19、(18分)化学反应中伴随着能量的变化。
(1)下列变化中属于吸热反应的是 (填字母)
①液态水汽化 ②将胆矾加热变为白色粉末 ③苛性钠固体溶于水
④氯酸钾分解制氧气 ⑤生石灰跟水反应生成熟石灰 ⑥干冰升华
A.①② B.②④ C.③ D.①⑥
(2)断开1 mol H-H键、1 mol N-H键、1 mol键分别需要吸收的能量为436 kJ、391 KJ、946 k,则
1 mol 生成理论上能 (填“吸收”或“放出”)能量 kJ。
(3)某学习小组研究影响锌与稀硫酸反应速率的外界条件,设计实验的数据如下:
序号 锌的质量 /g 锌的 状态 c(H2SO4) /mol·L-1 V(H2SO4) /mL 反应前溶液 的温度/℃ 其他试剂
1 0.65 粒状 0.5 50 20 无
2 0.65 粉末 0.5 50 20 无
序号 锌的质量 /g 锌的 状态 c(H2SO4) /mol·L-1 V(H2SO4) /mL 反应前溶液 的温度/℃ 其他试剂
3 0.65 粒状 0.5 50 20 2滴CuSO4溶液
4 0.65 粉末 0.8 50 20 无
5 0.65 粉末 0.8 50 35 2滴CuSO4溶液
在此5组实验中,速率最快的是__________(填实验序号);
实验1和2表明__________对反应速率有影响;
实验1和3表明__________对反应速率有影响。
(4)用和组合形成的质子交换膜燃料电池的结构如图丙:
①则电极d是 (填“正极”或“负极”),电极c的电极反应式为 。
②若线路中转移2 mol电子,则该燃料电池理论上消耗的在标准状况下的体积为 L。
参考答案
一、选择题(共68分)
1-5 DBBCB 6-10 ACBAC 11-15 BDBBA 16-17 AC
二、非选择题(共32分)
18、(共14分,每空2分)
(1)Cu+4HNO3(浓)=Cu(NO3)2+ 2NO2↑+2H2O;
(2)排出系统内的氧气,防止生成的NO被氧化
(3)3NO2+ H2O=2HNO3+NO
(4)强, 浓硝酸能将NO氧化为NO2,而稀硝酸不能
(5)是, 装置Ⅴ可吸收尾气NO、NO2,防止环境污染
19、(共18分,每空2分)
(1)B
(2)①放出 92
(3)5; 固体反应物的表面积; (是否形成)原电池
(4)①正极,
②11.2
同课章节目录
