共价键的形成、共价键的类型(两课时)
图片预览








文档简介
(共43张PPT)
§3.31 共价键的形成
选修三 《物质结构与性质》
专题三 第三单元
共价键 原子晶体
2012.2.11
2
1
3
4
本节主要内容
共价键的概念
共价键的表示方法
共价键的形成原理
共价键的特征
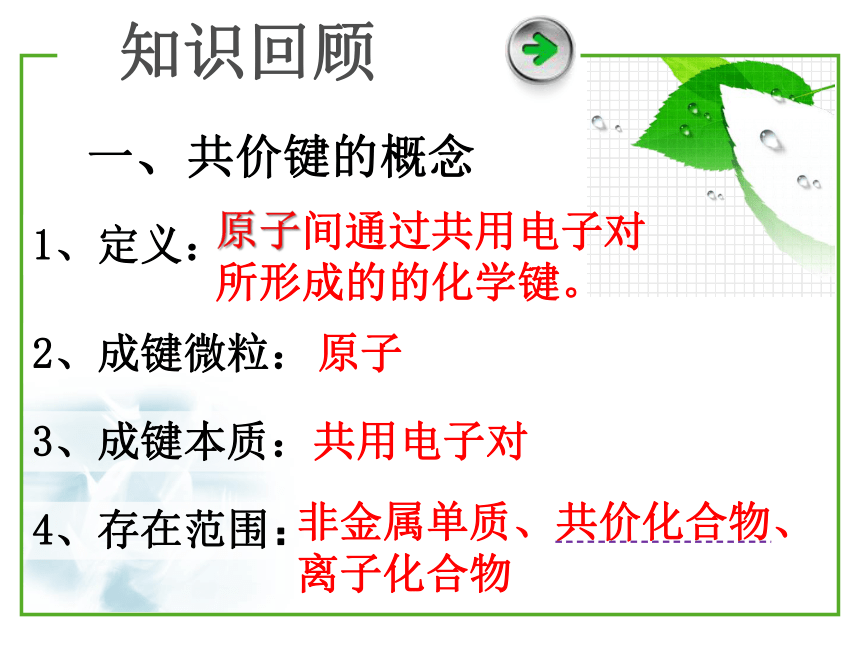
一、共价键的概念
1、定义:
2、成键微粒:
3、成键本质:
原子间通过共用电子对 所形成的的化学键。
原子
共用电子对
知识回顾
4、存在范围:
非金属单质、共价化合物、离子化合物
a、电子式:
b、结构式:
H-H O=O N N
知识回顾
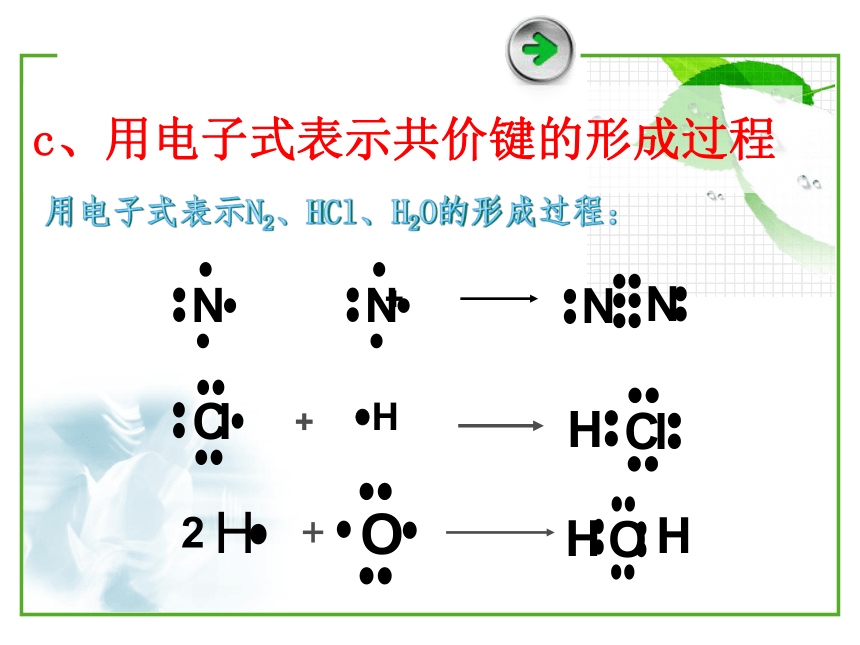
二、共价键的表示方法
c、用电子式表示共价键的形成过程
H
+
2 +
+
1、判断下列电子式书写是否正确
2、以下各分子中,所有原子都满足 最外层为8电子结构的是( )
A.H3O+ B. BF3 C.CCl4 D.PCl5
课堂练习
C
√
元素的电负性差值小于1.7。 一般的,非金属元素原子之间形成 的化学键都是共价键。 某些金属与非金属元素原子之间形成的化学键也是共价键。
通常哪些元素的原子之间能形成共价键
学习新知
问题探究
学习新知
两个成键原子为什么能通过共用电子对相结合呢?又是怎样结合的呢?
问题探究
以氢分子的形成为例
两个氢原子结合成氢分子时电子云的变化
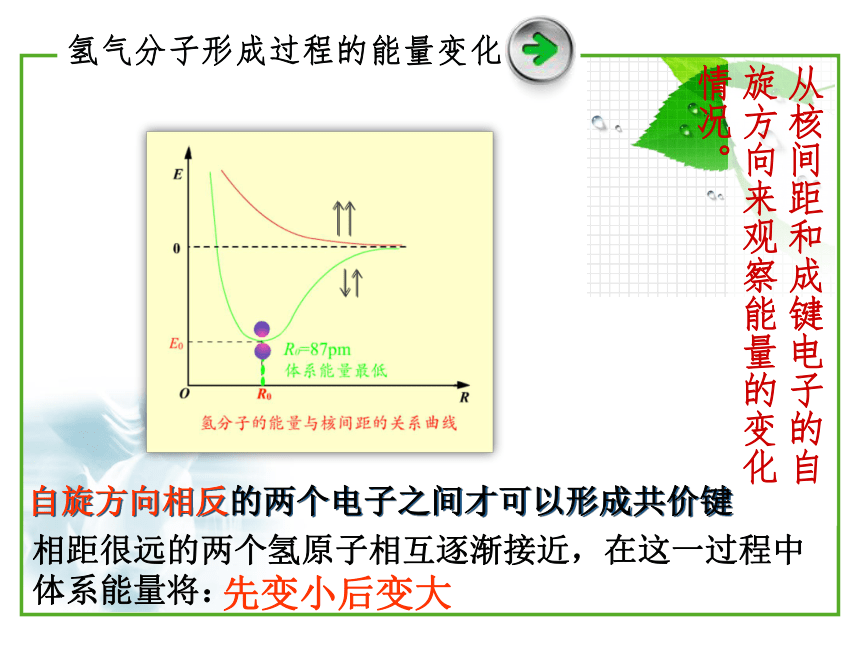
氢气分子形成过程的能量变化
从核间距和成键电子的自旋方向来观察能量的变化情况。
相距很远的两个氢原子相互逐渐接近,在这一过程中体系能量将:
先变小后变大
自旋方向相反的两个电子之间才可以形成共价键
形成共价键的理论要点
电子配对原理
最大重叠原理
两原子各自提供1个自旋方向相反的电子彼此配对。
1、共价键的形成条件
(A)两原子电负性 或 。
(B) 成键原子有 电子 (自旋方向相反)。
(C)成键原子的原子轨道在空间 。
相同
相近
未成对
重叠
三、共价键的形成原理
2、共价键的本质
成键原子相互接近时,原子轨道发生
,自旋方向 的 电子
形成 ,两原子核间的电子
密度 ,体系的能量 。
重叠
相反
未成对
共用电子对
增加
降低
根据H2分子的形成过程,讨论F2分子和HF分子是怎么形成的
问题探究
金属键、离子键不具有饱和性和方向性,共价键是否也没有饱和性和方向性
阅读教材P44,解释N、O、F原子与氢原子形成的简单化合物分别为NH3、H2O和HF。
问题探究
分析:下列形成分子的原子使用 哪些轨道上的电子(即是哪些原子轨道进行重叠)
H2
HF
F2
O2
N2
3、共价键的特点
(1)饱和性:原子有几个未成对电子就形成几个共价键
这是因为只有成键原子中自旋方向相反的未成对
电子才能形成共用电子对。成键过程中,每种元素的
原子有几个未成对电子,通常就只能和几个自旋方向
相反的电子形成共价键。
所以,在共价分子中,每个原子形成共价键的数目
是一定的,这就是共价键的饱和性。
形成的共价键数目 = 未成对电子数目
理论依据:泡利不相容原理、洪特规则
共价键的饱和性决定了各种原子形成分子时相互结合的数量关系
成键原子轨道只有采用最大重叠才能形成稳定的共价键,由于p ,d,f轨道在空间有不同的伸展方向,即有方向性,因此共价键有方向性。
(2)方向性:共价键的方向性决定于p ,d,f轨道 在空间的不同伸展方向。
s轨道和p轨道形成稳定共价键的几种重叠方式
A、有共价键的化合物一定是共价化合物
B、分子中只有共价键的化合物一定是共价化合物
C、由共价键形成的分子一定是共价化合物
D、只有非金属原子间才能形成共价键
B
课堂练习
1、下列说法正确的是 ( )
2、下列不属于共价键的成键因素的是( )
A、共用电子对在两核间高频率出现
B、共用的电子必须配对
C、成键后体系能量降低,趋于稳定
D、两原子核体积大小要适中
D
课堂练习
3、下列微粒中原子最外层电子数均为8的是
A.光气(氧氯化碳) B.六氟化硫 C.二氟化氙 D.三氟化硼
4、写出下列物质的电子式
(1)Br2 (2)CO2 (3)PH3 (4)NaH (5)Na2O2
课堂练习
§3.32 共价键的类型
选修三 《物质结构与性质》
专题三 第三单元
共价键 原子晶体
2012.2.11
成键的两个原子间的连线称为键轴。按成键与键轴之间的关系,共价键的键型主要为两种:
一、σ键:σ键特点: 将成键电子云,沿着键轴旋转任意角度,电子云保持不变。即σ键电子云对键轴呈圆柱型对称。
二、π键:π键特点: 成键电子云围绕键轴旋转180°时,图形重合。
1.σ键:“头碰头”
形成σ键的电子
称为σ电子。
原子轨道沿核间连线重叠(即头碰头方式)形成的共价键,叫σ键.
2.π键:“肩并肩”
+
I
+
I
X
Z
Z
pZ—pZ
形成π键的电子称为π电子。
原子轨道在核间连线两侧进行重叠(即采用肩并肩)方式形成的共价键,叫π键.
σ键的类型
π键的类型
σ键的成键特点:
1).沿键轴(两核的连线)方向 “头碰头”重叠成键
2). σ键可以沿键轴旋转;
3). σ键较稳定,存在于一切共价键中。
因而,只含有σ键的化合物性质是比较稳定的(烷烃)。
2、σ键 与π键
1). “肩并肩”重叠成键;
2). 电子云重叠程度不及σ键,较活泼;
3). π键必须与σ键共存;
4). π键不能自由旋转。
π键的成键特点:
一般说来,共价单键是σ键,
共价双键一般是σ+π键,
共价叁键则是σ+2π键,
所以在分子中,σ键是基础,且任何两个原子之间只能形成一个σ键。
有机物中的共价键
1、C – H 是σ键。
2、C—C 是σ键。
3、C=C 一个σ键,一个π键。
4、 C ≡C 一个σ键,两个π键。
乙烯、乙炔分子中C-C σ键比较稳定不容易断裂,π键比较容易断裂。
请指出乙烷、乙烯、乙炔分子中存在哪些类型的共价键,分别有几个σ键,几个π键?
1个σ键
+ 6个σ键
3个σ键
两个π键
5个σ键,
一个π键
拓展视野 苯分子中的共价键
H2 HCl
特
征 组成
原子吸引共用电子对的能力
共用电子对的位置
成键原子的
电性
结 论
同种元素原子
不同种元素原子
相同
不相同
不偏向任何一个原子
偏向吸引电子能力强的原子
H
H
共用电子对无偏向
共用电子对偏向Cl
不显电性
相对显正电性
相对显负电性
H
Cl
a
b
a
b
H2 HCl
特
征 组成
原子吸引共用电子对的能力
共用电子对的位置
成键原子的
电性
结 论
同种元素原子
不同种元素原子
相同
不相同
不偏向任何一个原子
偏向吸引电子能力强的原子
不显电性
显电性
键无极性
键有极性
4、 非极性键和极性键
非极性键:
共用电子对无偏向(电荷分布均匀)
如:H2(H-H)
Cl2(Cl-Cl)
N2(N N)
极性键
共用电子对有偏向(电荷分布不均匀)
如:HCl(H-Cl) H2O(H-O-H)
二、共价键的类型
1、非极性键:共用电子对不偏向任何原子的共价键,同种非金属元素的原子形成的共价键。
2、极性键:共用电子对发生偏向的共价键,不同种非金属元素的原子形成的共价键。成键原子的电负型相差越大,键的极性越强。
配位键:由一个原子提供一对电子与另一个接受电子的原子形成共价键。例,NH4+ 、H3O+
[归纳、小结]
1、共价键:原子间通过共用电子对所形成的化学键叫共价键。
2、极性键:共用电子对发生偏向的共价键,不同种元素的原子。
非极性键:共用电子对不偏向任何原子的共价键,同种元素的原子
3、共用电子对的目的是达到稳定结构(氢原子达到2个电子,其他原子达到8个电子)
2、共用电子对不偏向或有偏向是由什么因素决定的呢
这是由成键原子对共用电子对的吸引作用大小决定的。
1、键的极性的判断依据是什么?
共用电子对是否有偏向
思 考
[小结]判断方法
同种非金属元素原子间形成的共价键是非极性键
不同种非金属元素原子间形成的共价键是极性键
[练习]指出下列物质中的共价键类型
1、O2
2 、CH4
3 、CO2
4、 H2O2
5 、Na2O2
6 、NaOH
非极性键
极性键
极性键
(H-O-O-H)
极性键 非极性键
非极性键
极性键
课堂练习
分析下列化学式中划有横线的元素,选出符合①②③ 要求的物质编号,填写在横线上。
A. NH3 B. H2O C. HCl D. CH4 E. N2
① 所有的价电子都参与形成共价键的是 ;
② 只有一个价电子参与形成共价键的是 ;
③ 最外层有未参与成键电子对的是 ;
D
C
A、B、C、E
§3.31 共价键的形成
选修三 《物质结构与性质》
专题三 第三单元
共价键 原子晶体
2012.2.11
2
1
3
4
本节主要内容
共价键的概念
共价键的表示方法
共价键的形成原理
共价键的特征
一、共价键的概念
1、定义:
2、成键微粒:
3、成键本质:
原子间通过共用电子对 所形成的的化学键。
原子
共用电子对
知识回顾
4、存在范围:
非金属单质、共价化合物、离子化合物
a、电子式:
b、结构式:
H-H O=O N N
知识回顾
二、共价键的表示方法
c、用电子式表示共价键的形成过程
H
+
2 +
+
1、判断下列电子式书写是否正确
2、以下各分子中,所有原子都满足 最外层为8电子结构的是( )
A.H3O+ B. BF3 C.CCl4 D.PCl5
课堂练习
C
√
元素的电负性差值小于1.7。 一般的,非金属元素原子之间形成 的化学键都是共价键。 某些金属与非金属元素原子之间形成的化学键也是共价键。
通常哪些元素的原子之间能形成共价键
学习新知
问题探究
学习新知
两个成键原子为什么能通过共用电子对相结合呢?又是怎样结合的呢?
问题探究
以氢分子的形成为例
两个氢原子结合成氢分子时电子云的变化
氢气分子形成过程的能量变化
从核间距和成键电子的自旋方向来观察能量的变化情况。
相距很远的两个氢原子相互逐渐接近,在这一过程中体系能量将:
先变小后变大
自旋方向相反的两个电子之间才可以形成共价键
形成共价键的理论要点
电子配对原理
最大重叠原理
两原子各自提供1个自旋方向相反的电子彼此配对。
1、共价键的形成条件
(A)两原子电负性 或 。
(B) 成键原子有 电子 (自旋方向相反)。
(C)成键原子的原子轨道在空间 。
相同
相近
未成对
重叠
三、共价键的形成原理
2、共价键的本质
成键原子相互接近时,原子轨道发生
,自旋方向 的 电子
形成 ,两原子核间的电子
密度 ,体系的能量 。
重叠
相反
未成对
共用电子对
增加
降低
根据H2分子的形成过程,讨论F2分子和HF分子是怎么形成的
问题探究
金属键、离子键不具有饱和性和方向性,共价键是否也没有饱和性和方向性
阅读教材P44,解释N、O、F原子与氢原子形成的简单化合物分别为NH3、H2O和HF。
问题探究
分析:下列形成分子的原子使用 哪些轨道上的电子(即是哪些原子轨道进行重叠)
H2
HF
F2
O2
N2
3、共价键的特点
(1)饱和性:原子有几个未成对电子就形成几个共价键
这是因为只有成键原子中自旋方向相反的未成对
电子才能形成共用电子对。成键过程中,每种元素的
原子有几个未成对电子,通常就只能和几个自旋方向
相反的电子形成共价键。
所以,在共价分子中,每个原子形成共价键的数目
是一定的,这就是共价键的饱和性。
形成的共价键数目 = 未成对电子数目
理论依据:泡利不相容原理、洪特规则
共价键的饱和性决定了各种原子形成分子时相互结合的数量关系
成键原子轨道只有采用最大重叠才能形成稳定的共价键,由于p ,d,f轨道在空间有不同的伸展方向,即有方向性,因此共价键有方向性。
(2)方向性:共价键的方向性决定于p ,d,f轨道 在空间的不同伸展方向。
s轨道和p轨道形成稳定共价键的几种重叠方式
A、有共价键的化合物一定是共价化合物
B、分子中只有共价键的化合物一定是共价化合物
C、由共价键形成的分子一定是共价化合物
D、只有非金属原子间才能形成共价键
B
课堂练习
1、下列说法正确的是 ( )
2、下列不属于共价键的成键因素的是( )
A、共用电子对在两核间高频率出现
B、共用的电子必须配对
C、成键后体系能量降低,趋于稳定
D、两原子核体积大小要适中
D
课堂练习
3、下列微粒中原子最外层电子数均为8的是
A.光气(氧氯化碳) B.六氟化硫 C.二氟化氙 D.三氟化硼
4、写出下列物质的电子式
(1)Br2 (2)CO2 (3)PH3 (4)NaH (5)Na2O2
课堂练习
§3.32 共价键的类型
选修三 《物质结构与性质》
专题三 第三单元
共价键 原子晶体
2012.2.11
成键的两个原子间的连线称为键轴。按成键与键轴之间的关系,共价键的键型主要为两种:
一、σ键:σ键特点: 将成键电子云,沿着键轴旋转任意角度,电子云保持不变。即σ键电子云对键轴呈圆柱型对称。
二、π键:π键特点: 成键电子云围绕键轴旋转180°时,图形重合。
1.σ键:“头碰头”
形成σ键的电子
称为σ电子。
原子轨道沿核间连线重叠(即头碰头方式)形成的共价键,叫σ键.
2.π键:“肩并肩”
+
I
+
I
X
Z
Z
pZ—pZ
形成π键的电子称为π电子。
原子轨道在核间连线两侧进行重叠(即采用肩并肩)方式形成的共价键,叫π键.
σ键的类型
π键的类型
σ键的成键特点:
1).沿键轴(两核的连线)方向 “头碰头”重叠成键
2). σ键可以沿键轴旋转;
3). σ键较稳定,存在于一切共价键中。
因而,只含有σ键的化合物性质是比较稳定的(烷烃)。
2、σ键 与π键
1). “肩并肩”重叠成键;
2). 电子云重叠程度不及σ键,较活泼;
3). π键必须与σ键共存;
4). π键不能自由旋转。
π键的成键特点:
一般说来,共价单键是σ键,
共价双键一般是σ+π键,
共价叁键则是σ+2π键,
所以在分子中,σ键是基础,且任何两个原子之间只能形成一个σ键。
有机物中的共价键
1、C – H 是σ键。
2、C—C 是σ键。
3、C=C 一个σ键,一个π键。
4、 C ≡C 一个σ键,两个π键。
乙烯、乙炔分子中C-C σ键比较稳定不容易断裂,π键比较容易断裂。
请指出乙烷、乙烯、乙炔分子中存在哪些类型的共价键,分别有几个σ键,几个π键?
1个σ键
+ 6个σ键
3个σ键
两个π键
5个σ键,
一个π键
拓展视野 苯分子中的共价键
H2 HCl
特
征 组成
原子吸引共用电子对的能力
共用电子对的位置
成键原子的
电性
结 论
同种元素原子
不同种元素原子
相同
不相同
不偏向任何一个原子
偏向吸引电子能力强的原子
H
H
共用电子对无偏向
共用电子对偏向Cl
不显电性
相对显正电性
相对显负电性
H
Cl
a
b
a
b
H2 HCl
特
征 组成
原子吸引共用电子对的能力
共用电子对的位置
成键原子的
电性
结 论
同种元素原子
不同种元素原子
相同
不相同
不偏向任何一个原子
偏向吸引电子能力强的原子
不显电性
显电性
键无极性
键有极性
4、 非极性键和极性键
非极性键:
共用电子对无偏向(电荷分布均匀)
如:H2(H-H)
Cl2(Cl-Cl)
N2(N N)
极性键
共用电子对有偏向(电荷分布不均匀)
如:HCl(H-Cl) H2O(H-O-H)
二、共价键的类型
1、非极性键:共用电子对不偏向任何原子的共价键,同种非金属元素的原子形成的共价键。
2、极性键:共用电子对发生偏向的共价键,不同种非金属元素的原子形成的共价键。成键原子的电负型相差越大,键的极性越强。
配位键:由一个原子提供一对电子与另一个接受电子的原子形成共价键。例,NH4+ 、H3O+
[归纳、小结]
1、共价键:原子间通过共用电子对所形成的化学键叫共价键。
2、极性键:共用电子对发生偏向的共价键,不同种元素的原子。
非极性键:共用电子对不偏向任何原子的共价键,同种元素的原子
3、共用电子对的目的是达到稳定结构(氢原子达到2个电子,其他原子达到8个电子)
2、共用电子对不偏向或有偏向是由什么因素决定的呢
这是由成键原子对共用电子对的吸引作用大小决定的。
1、键的极性的判断依据是什么?
共用电子对是否有偏向
思 考
[小结]判断方法
同种非金属元素原子间形成的共价键是非极性键
不同种非金属元素原子间形成的共价键是极性键
[练习]指出下列物质中的共价键类型
1、O2
2 、CH4
3 、CO2
4、 H2O2
5 、Na2O2
6 、NaOH
非极性键
极性键
极性键
(H-O-O-H)
极性键 非极性键
非极性键
极性键
课堂练习
分析下列化学式中划有横线的元素,选出符合①②③ 要求的物质编号,填写在横线上。
A. NH3 B. H2O C. HCl D. CH4 E. N2
① 所有的价电子都参与形成共价键的是 ;
② 只有一个价电子参与形成共价键的是 ;
③ 最外层有未参与成键电子对的是 ;
D
C
A、B、C、E
