《电化学基础》精析讲解
图片预览








文档简介
(共44张PPT)
2012年高考一轮复习专题
——电化学
1.了解原电池的工作原理,能写出电极反应和电池反应方程式。
2.了解常见化学电源的种类及其工作原理。 1.原电池的工作原理及电极反应式的书写。
2.了解常用化学电源的构造及新型电源的工作原理,尤其是可充电电池的充放电过程。
3.根据所给自发进行的反应,设计原电池并能绘制装置图。
1.了解电解池的工作原理,能写出电极反应式和总反应方程式。
2.理解金属发生电化学腐蚀的原因,金属腐蚀的危害,防止金属腐蚀的措施。 1.理解电解原理及利用电解原理的创新实验设计。
2.应用电解原理解决工业、生产、生活中的实际问题。
3.结合实际生产、生活考查金属的电化学腐蚀及其危害与防护。
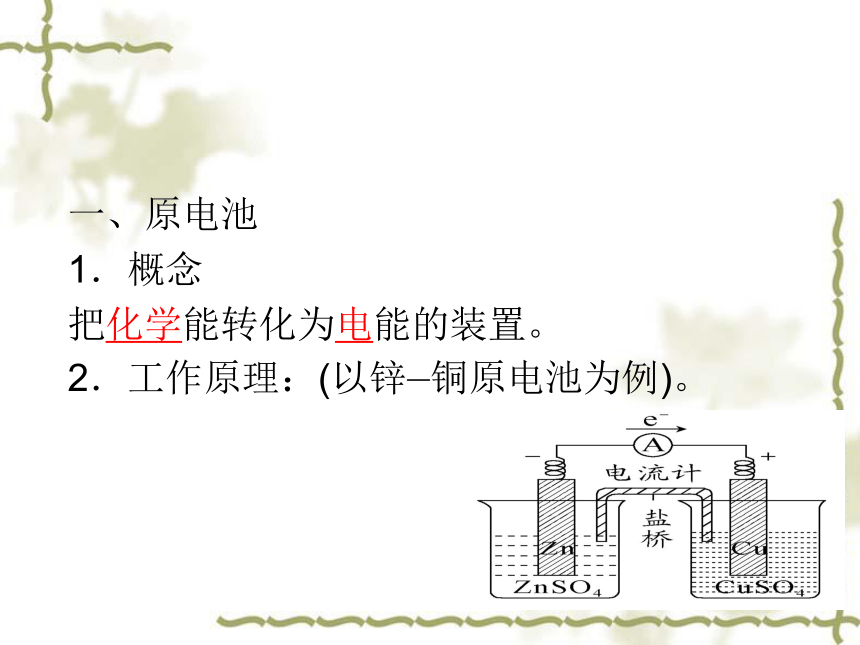
一、原电池
1.概念
把化学能转化为电能的装置。
2.工作原理:(以锌—铜原电池为例)。
电极名称 负极 正极
电极材料 Zn Cu
电极反应 Zn-2e-===Zn2+ Cu2++2e-===2Cu
反应类型 氧化反应 还原反应
电子流向 由负极沿导线流向正极
3.原电池构成条件
(1)两个活泼性不同的电极。
(2)将电极插入电解质溶液中。
(3)用导线连接电极构成闭合回路。
(4)能自发进行氧化还原反应。
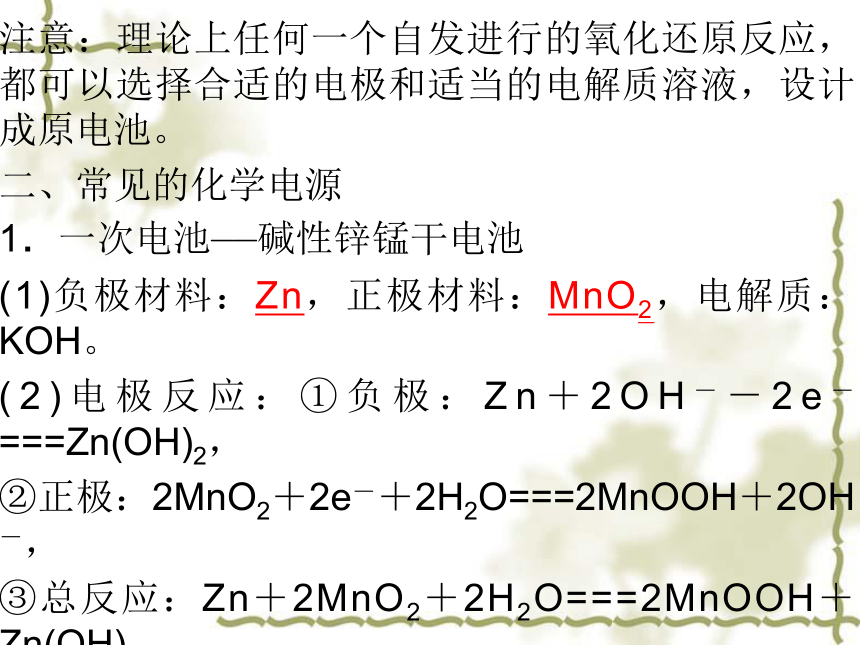
注意:理论上任何一个自发进行的氧化还原反应,都可以选择合适的电极和适当的电解质溶液,设计成原电池。
二、常见的化学电源
1.一次电池——碱性锌锰干电池
(1)负极材料:Zn,正极材料:MnO2,电解质:KOH。
(2)电极反应:①负极:Zn+2OH--2e-===Zn(OH)2,
②正极:2MnO2+2e-+2H2O===2MnOOH+2OH-,
③总反应:Zn+2MnO2+2H2O===2MnOOH+Zn(OH)2。
2.二次电池(可充电电池)——铅蓄电池
负极材料是Pb,正极材料是PbO2。
负极反应:Pb+SO42--2e-===PbSO4
正极反应:PbO2+4H++SO42-+2e-===PbSO4+2H2O
总反应:Pb+PbO2+2H2SO4===2PbSO4+2H2O
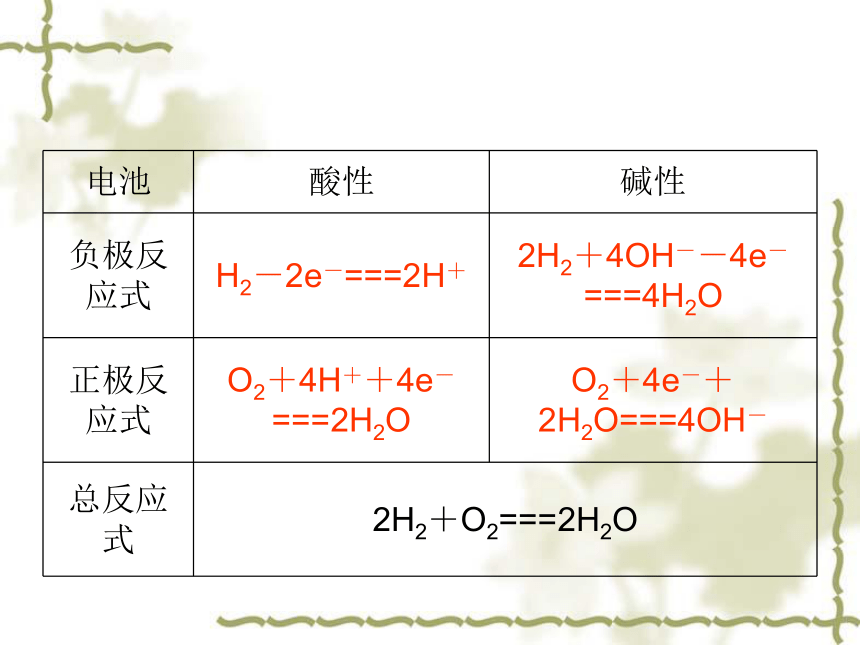
3.燃料电池
氢氧燃料电池是目前最成熟的燃料电池。
电池 酸性 碱性
负极反应式 H2-2e-===2H+ 2H2+4OH--4e-===4H2O
正极反应式 O2+4H++4e-===2H2O O2+4e-+2H2O===4OH-
总反应式 2H2+O2===2H2O
一、电解原理
1.电解:使电流通过电解质溶液(或熔融的电解质)而在阴、阳两极引起氧化还原反应的过程。
2.电解池(也叫电解槽):把电能转变为化学能的装置。
3.电解池的组成和工作原理(电解CuCl2溶液)
电极名称 阴极 阳极
电极材料 铜 石墨
电极反应 Cu2++2e-===Cu 2Cl--2e-===Cl2↑
反应类型 还原反应 氧化反应
电子流向 电子从电源负极沿导线流入电解池的阴极,经过阴、阳离子定向移动形成的内电路,再从电解池的阳极流出,并沿导线流回电源的正极
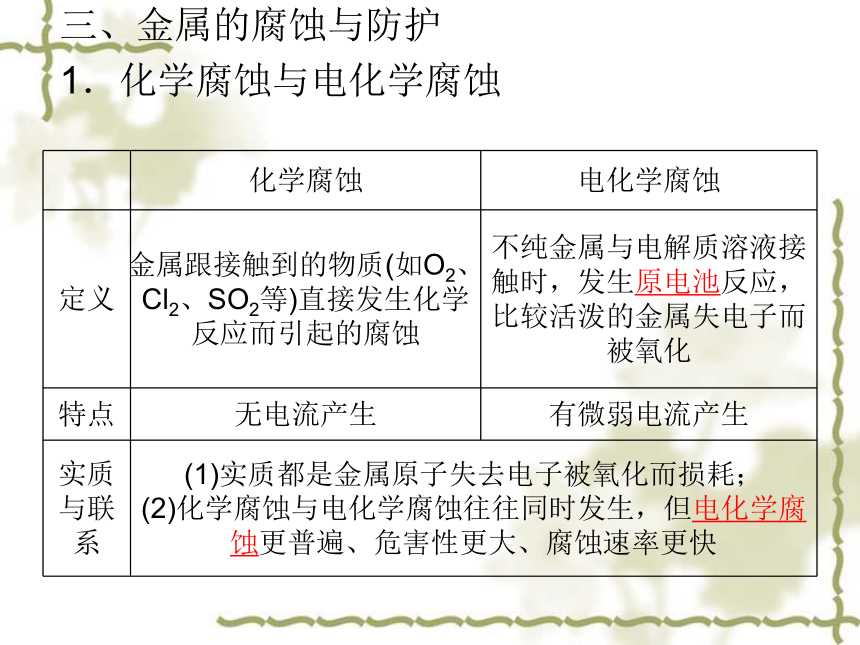
三、金属的腐蚀与防护
1.化学腐蚀与电化学腐蚀
化学腐蚀 电化学腐蚀
定义 金属跟接触到的物质(如O2、Cl2、SO2等)直接发生化学反应而引起的腐蚀 不纯金属与电解质溶液接触时,发生原电池反应,比较活泼的金属失电子而被氧化
特点 无电流产生 有微弱电流产生
实质与联系 (1)实质都是金属原子失去电子被氧化而损耗;
(2)化学腐蚀与电化学腐蚀往往同时发生,但电化学腐蚀更普遍、危害性更大、腐蚀速率更快
类型 析氢腐蚀 吸氧腐蚀
水膜
性质 酸性较强 酸性很弱或呈中性
负极反应 Fe-2e-===Fe2+
正极反应 2H++2e-===H2↑ 2H2O+O2+4e-===4OH-
其他反
应及
产物 Fe2++2OH-===Fe(OH)2 2Fe+O2+2H2O===2Fe(OH)2
4Fe(OH)2+O2+2H2O===4Fe(OH)3
2Fe(OH)3===Fe2O3·xH2O+(3-x)H2O
普遍性 吸氧腐蚀更普遍
3.不同条件下金属腐蚀的快慢
电解原理引起的腐蚀>原电池原理引起的腐蚀>化学腐蚀>有防护腐蚀措施的腐蚀
4.金属的防护
(1)电化学防护
①牺牲阳极的阴极保护法
②外加电流的阴极保护法
(2)其他
①改变金属内部结构,如制成合金;
②使金属与空气、水等物质隔离,如电镀、喷油漆等。
高考原题再现
(2011安徽高考12)研究人员最近发现了一种“水”电池,这种电池能利用淡水与海水之间含盐量差别进行发电,在海水中电池总反应可表示为:5MnO2+2Ag+2NaCl=Na2Mn5O10+2AgCl,下列“水” 电池在海水中放电时的有关说法正确的是:
A.正极反应式:Ag+Cl--e-=AgCl
B.每生成1 mol Na2Mn5O10转移2 mol电子
C.Na+不断向“水”电池的负极移动
D. AgCl是还原产物
解析:由电池总反应可知银失去电子被氧化得氧化产物,即银做负极,产物AgCl是氧化产物,A、D都不正确;在原电池中阳离子在正极得电子发生还原反应,所以阳离子向电池的正极移动,C错误;化合物Na2Mn5O10中Mn元素的化合价是+18/5价,所以每生成1 mol Na2Mn5O10转移电子的物质的量为(4-18/5)×5=2mol,因此选项B正确。
答案:B
(2011北京高考8)结合下图判断,下列叙述正确的是
A.Ⅰ和Ⅱ中正极均被保护
B. Ⅰ和Ⅱ中负极反应均是Fe-2e-=Fe2+
C. Ⅰ和Ⅱ中正极反应均是O2+2H2O+4e-=4OH-
D. Ⅰ和Ⅱ中分别加入少量K3Fe(CN)6溶液,均有蓝色沉淀
(2011福建高考11)研究人员研制出一种锂水电池,可作为鱼雷和潜艇的储备电源。该电池以金属锂和钢板为电极材料,以LiOH为电解质,使用时加入水即可放电。关于该电池的下列说法不正确的是
A.水既是氧化剂又是溶剂
B.放电时正极上有氢气生成
C.放电时OH-向正极移动
D.总反应为:2Li+2H2O=== 2LiOH+H2↑
解析:考生可能迅速选出C项是错误,因为原电池放电时OH-是向负极移动的。这个考点在备考时训练多次。这种电池名称叫锂水电池。可推测其总反应为:2Li+2H2O=== 2LiOH+H2↑。再写出其电极反应如下:
(—)2Li—2e—=2Li+
(+)2H2O+2e—=2OH—+H2↑
结合选项分析A、B、D都是正确的。
此题情景是取材于新的化学电源,知识落脚点是基础,对原电池原理掌握的学生来说是比较容易的。
答案:C
(2011山东高考15)以KCl和ZnCl2混合液为电镀液在铁制品上镀锌,下列说法正确的是
A.未通电前上述镀锌装置可构成原电池,电镀过程是该原电池的充电过程
B.因部分电能转化为热能,电镀时通过的电量与锌的析出量无确定关系
C.电镀时保持电流恒定,升高温度不改变电解反应速率
D.镀锌层破损后对铁制品失去保护作用
解析:电镀时,通常把待镀的金属制品作阴极,把镀层金属作阳极,用含有镀层金属离子的溶液作电镀液。因此在铁制品上镀锌时,铁作阴极,锌作阳极,由于锌比铁活泼,因此未通电前可以构成原电池,但此时锌作负极失去电子,铁作正极,而电镀是锌仍然失电子,所以选项A不正确;在氧化还原反应中必需满足得失电子守恒,因此电镀时通过的电量与锌的析出量有确定关系而与能量变化无关,B不正确;由于电镀时保持电流恒定,因此导线中通过的电子速率是不变的,所以升高温度不能改变电解反应速率,C正确;镀锌层破损后,由于锌比铁活泼,所以即使发生电化学腐蚀也是锌失去电子而保护了铁,即选项D也不正确。
答案:C
(2011新课标全国)铁镍蓄电池又称爱迪生电池,放电时的总反应为:Fe+Ni2O3+3H2O= Fe(OH)2+2Ni(OH)2
下列有关该电池的说法不正确的是
A. 电池的电解液为碱性溶液,正极为Ni2O3、负极为Fe
B. 电池放电时,负极反应为Fe+2OH--2e-=Fe(OH)2
C. 电池充电过程中,阴极附近溶液的pH降低
D. 电池充电时,阳极反应为2Ni(OH)2+2OH--2e-=Ni2O3+3H2O
解析:由放电时的反应可以得出铁做还原剂失去电子,Ni2O3做氧化剂得到电子,因此选项AB均正确;充电可以看作是放电的逆过程,即阴极为原来的负极,所以电池放电时,负极反应为:Fe+2OH--2e-= Fe(OH)2,所以电池充电过程时阴极反应为Fe(OH)2+2e-= Fe+2OH-,因此电池充电过程中,阴极附近溶液的pH会升高,C不正确;同理分析选项D正确。
答案:C
(2010江苏卷).下列说法不正确的是
A.铅蓄电池在放电过程中,负极质量减小,正极质量增加
B.常温下,反应不能自发进行,则该反应的
C.一定条件下,使用催化剂能加快反应速率并提高反应物的平衡转化率
D.相同条件下,溶液中、、的氧化性依次减弱
【答案】AC
【解析】本题主要考查的是相关的反应原理。A项,铅蓄电池在放电过程中,负极反应为其质量在增加;B项,该反应是典型的吸热反应,在常温下不能自发进行;C项,催化剂能改变反应速率,不一定加快,同时它不能改变转化率;D项,可知的氧化性大于,综上分析可知,本题选AC项。
1. (10年广东化学·9)科学家近年来研制出一种新型细菌燃料电池,利用细菌将有机物转化为氢气,氢气进入以磷酸为电解质的燃料电池发电。电池负极反应为:
A.H2+2OH-=2H2O+2e-
B.O2+4H++4e-=2H2O
C.H2=2H++2e-
D.O2+2H2O+4e-=4OH
答案:C
解析:难度:易,电解液为酸性,故A错,负极通入氢气,正极通入氧气,故B、D错。
2..(08年广东化学·12)为了避免青铜器生成铜绿,以下方法正确的是
A.将青铜器放在银质托盘上
B.将青铜器保存在干燥的环境中
C.将青铜器保存在潮湿的空气中
D.在青铜器的表面覆盖一层防渗的高分子膜
答案:BD
解析:铜绿是生活中常见现象,反应原理为2Cu+O2+CO2+H2O==Cu2CO3(OH)2,故青铜器应保存在干燥的环境中或表面覆盖一层防渗的高分子膜防止被腐蚀。A可能发生原电池反应而被腐蚀。
3.(08年广东文基·62)下列说法正确的是
A.需要加热的化学反应都是吸热反应
B.中和反应都是放热反应
C.原电池是将电能转化为化学能的一种装置
D.水力发电是将化学能转化为电能的过程
答案:B
解析:需要加热的化学反应也可能是放热反应,如可燃物的燃烧反应,A选项错误;原电池是将化学能转化为电能的装置,故C选项错误;水力发电是将机械能转化为电能的过程,故D选项错误。正确选项为B
4.(07年广东理基·25)钢铁在潮湿的空气中会被腐蚀,发生的原电池反应为:2Fe+2H2O+O2 2Fe2++4OH-。以下说法正确的是
A.负极发生的反应为:Fe-2e- Fe2+
B.正极发生的反应为:2H2O+O2+2e- 4OH-
C.原电池是将电能转变为化学能的装置
D.钢柱在水下部分比在空气与水交界处更容易腐蚀
答案:A
解析:钢铁在潮湿的环境中发生吸氧腐蚀,负极反应为:Fe-2e- Fe2+,正极反应为:2H2O+O2+4e- 4OH-,在空气与水交界处溶液中的氧气不断溶解,因此在空气与水交界处钢铁更容易腐蚀。
5.(07年广东化学·20)三氧化二镍(Ni2O3)可用于制造高能电池,其电解法制备过程如下:用NaOH调NiCl2溶液pH至7.5,加入适量硫酸钠后进行电解。电解过程中产生的Cl2在弱碱性条件下生成ClO-,把二价镍氧化为三价镍。以下说法正确的是
A.可用铁作阳极材料
B.电解过程中阳极附近溶液的pH升高
C.阳极反应方程式为:2Cl--2e-=Cl2
D.1mol二价镍全部转化为三价镍时,外电路中通过了1mol电子。
答案:CD
解析:电解时阳极产生Cl2,电极反应为2Cl--2e-=Cl2,,故C对,阳极不可能是活泼性电极如铁,故A错。阳极产生Cl2与碱反应,故pH值降低,故B错,二价镍全部转化为三价镍失e-,故D对。
.6.(09年宁夏理综·10)一种燃料电池中发生的化学反应为:在酸性溶液中甲醇与氧作用生成水和二氧化碳。该电池负极发生的反应是
A.CH3OH(g)+O2(g)=H2O(1)+CO2(g)+2H+(aq)+2e-
B.O2(g)+4H+(aq)+4e-=2H2O(1)
C.CH3OH(g)+H2O(1)=CO2(g)+6H+(aq)+6e-
D.O2(g)+2H2O(1)+4e-=4OH-
答案:C
解析:甲醇与氧气反应的化学方程式为:2CH3OH+3O22CO2+4H2O,化合价升高的元素为C,所以在负极上甲醇失去电子而放电,在该极上的电极反应式为:CH3OH(g)+H2O(1)=CO2(g)+6H+(aq)+6e-。
.7.(08年广东化学·16)LiFePO4电池具有稳定性高、安全、对环境友好等优点,可用于电动汽车。电池反应为:FePO4+LiLiFePO4,电池的正极材料是LiFePO4,负极材料是石墨,含Li+导电固体为电解质。下列有关LiFePO4电池说法正确的是
A.可加入硫酸以提高电解质的导电性
B.放电时电池内部Li+向负极移动.
C.充电过程中,电池正极材料的质量减少
D.放电时电池正极反应为:FePO4+Li++e-=LiFePO4
答案:CD
解析:放电时,负极:Li -- e- ==Li+,正极:FePO4 + Li+ + e- == LiFePO4;充电时,阳极:LiFePO4 -- e- == FePO4 + Li+ 阴极:Li+ + e- == Li,所以易知C.D正确。
若加入硫酸,与Li单质(固体)发生反应,所以A错;放电时,Li+应(正电荷)在电池内部(电解质中)向正极移动,故B错。
.(09年江苏化学·16)(8分)以氯化钾和钛白厂的副产品硫酸亚铁为原料生产硫酸钾、过二硫酸钠和氧化铁红颜料,原料的综合利用率较高。其主要流程如下:
(1)反应I前需在FeSO4溶液中加入 (填字母),以除去溶液中的Fe3+。
A.锌粉 B.铁屑 C.KI溶液 D.H2
(2)反应Ⅰ需控制反应温度低于35℃,其目的是 。
(3)工业生产上常在反应Ⅲ的过程中加入一定量的醇类溶剂,其目的是 。
(4)反应Ⅳ常被用于电解生产(NH4)2S2O8(二硫酸铵)。电解时均用惰性电极,阳极发生地电极反应可表示为
答案:(1)B
(2)防止NH4HCO3分解(或减少Fe2+的水解)
(3)降低K2SO4 的溶解度,有利于K2SO4 析出。
(4)2SO42- -2e-2S2O82-
解析:(1)在FeSO4溶液中除去溶液中的Fe3+,最好选用铁屑或铁粉,比较简单。(2)如果温度过高会导致NH4HCO3分解同样也会加快Fe2+的水解(温度越高水解速率越快)这样会使原料利用率降低。(3)由题目看出在III反应中生成的K2SO4 为固体,而K2SO4在无机溶剂中溶解度是比较大的,要想使K2SO4析出只能降低其溶解度所以加入醇类溶剂目的降低K2SO4的溶解度。
(4)根据阴阳极反应原理阳极失电子发生氧化反应,此题实质是电解硫酸铵溶液,在根据反应后的产物得出正确的答案。
【考点分析】此题为化工生产题型,主要考察了化合物性质,电极方程式书写。做此类题要分析清楚每一个环节目的和结果是什么。这样才能判断各反应后的产物分别是什么。
2012年高考一轮复习专题
——电化学
1.了解原电池的工作原理,能写出电极反应和电池反应方程式。
2.了解常见化学电源的种类及其工作原理。 1.原电池的工作原理及电极反应式的书写。
2.了解常用化学电源的构造及新型电源的工作原理,尤其是可充电电池的充放电过程。
3.根据所给自发进行的反应,设计原电池并能绘制装置图。
1.了解电解池的工作原理,能写出电极反应式和总反应方程式。
2.理解金属发生电化学腐蚀的原因,金属腐蚀的危害,防止金属腐蚀的措施。 1.理解电解原理及利用电解原理的创新实验设计。
2.应用电解原理解决工业、生产、生活中的实际问题。
3.结合实际生产、生活考查金属的电化学腐蚀及其危害与防护。
一、原电池
1.概念
把化学能转化为电能的装置。
2.工作原理:(以锌—铜原电池为例)。
电极名称 负极 正极
电极材料 Zn Cu
电极反应 Zn-2e-===Zn2+ Cu2++2e-===2Cu
反应类型 氧化反应 还原反应
电子流向 由负极沿导线流向正极
3.原电池构成条件
(1)两个活泼性不同的电极。
(2)将电极插入电解质溶液中。
(3)用导线连接电极构成闭合回路。
(4)能自发进行氧化还原反应。
注意:理论上任何一个自发进行的氧化还原反应,都可以选择合适的电极和适当的电解质溶液,设计成原电池。
二、常见的化学电源
1.一次电池——碱性锌锰干电池
(1)负极材料:Zn,正极材料:MnO2,电解质:KOH。
(2)电极反应:①负极:Zn+2OH--2e-===Zn(OH)2,
②正极:2MnO2+2e-+2H2O===2MnOOH+2OH-,
③总反应:Zn+2MnO2+2H2O===2MnOOH+Zn(OH)2。
2.二次电池(可充电电池)——铅蓄电池
负极材料是Pb,正极材料是PbO2。
负极反应:Pb+SO42--2e-===PbSO4
正极反应:PbO2+4H++SO42-+2e-===PbSO4+2H2O
总反应:Pb+PbO2+2H2SO4===2PbSO4+2H2O
3.燃料电池
氢氧燃料电池是目前最成熟的燃料电池。
电池 酸性 碱性
负极反应式 H2-2e-===2H+ 2H2+4OH--4e-===4H2O
正极反应式 O2+4H++4e-===2H2O O2+4e-+2H2O===4OH-
总反应式 2H2+O2===2H2O
一、电解原理
1.电解:使电流通过电解质溶液(或熔融的电解质)而在阴、阳两极引起氧化还原反应的过程。
2.电解池(也叫电解槽):把电能转变为化学能的装置。
3.电解池的组成和工作原理(电解CuCl2溶液)
电极名称 阴极 阳极
电极材料 铜 石墨
电极反应 Cu2++2e-===Cu 2Cl--2e-===Cl2↑
反应类型 还原反应 氧化反应
电子流向 电子从电源负极沿导线流入电解池的阴极,经过阴、阳离子定向移动形成的内电路,再从电解池的阳极流出,并沿导线流回电源的正极
三、金属的腐蚀与防护
1.化学腐蚀与电化学腐蚀
化学腐蚀 电化学腐蚀
定义 金属跟接触到的物质(如O2、Cl2、SO2等)直接发生化学反应而引起的腐蚀 不纯金属与电解质溶液接触时,发生原电池反应,比较活泼的金属失电子而被氧化
特点 无电流产生 有微弱电流产生
实质与联系 (1)实质都是金属原子失去电子被氧化而损耗;
(2)化学腐蚀与电化学腐蚀往往同时发生,但电化学腐蚀更普遍、危害性更大、腐蚀速率更快
类型 析氢腐蚀 吸氧腐蚀
水膜
性质 酸性较强 酸性很弱或呈中性
负极反应 Fe-2e-===Fe2+
正极反应 2H++2e-===H2↑ 2H2O+O2+4e-===4OH-
其他反
应及
产物 Fe2++2OH-===Fe(OH)2 2Fe+O2+2H2O===2Fe(OH)2
4Fe(OH)2+O2+2H2O===4Fe(OH)3
2Fe(OH)3===Fe2O3·xH2O+(3-x)H2O
普遍性 吸氧腐蚀更普遍
3.不同条件下金属腐蚀的快慢
电解原理引起的腐蚀>原电池原理引起的腐蚀>化学腐蚀>有防护腐蚀措施的腐蚀
4.金属的防护
(1)电化学防护
①牺牲阳极的阴极保护法
②外加电流的阴极保护法
(2)其他
①改变金属内部结构,如制成合金;
②使金属与空气、水等物质隔离,如电镀、喷油漆等。
高考原题再现
(2011安徽高考12)研究人员最近发现了一种“水”电池,这种电池能利用淡水与海水之间含盐量差别进行发电,在海水中电池总反应可表示为:5MnO2+2Ag+2NaCl=Na2Mn5O10+2AgCl,下列“水” 电池在海水中放电时的有关说法正确的是:
A.正极反应式:Ag+Cl--e-=AgCl
B.每生成1 mol Na2Mn5O10转移2 mol电子
C.Na+不断向“水”电池的负极移动
D. AgCl是还原产物
解析:由电池总反应可知银失去电子被氧化得氧化产物,即银做负极,产物AgCl是氧化产物,A、D都不正确;在原电池中阳离子在正极得电子发生还原反应,所以阳离子向电池的正极移动,C错误;化合物Na2Mn5O10中Mn元素的化合价是+18/5价,所以每生成1 mol Na2Mn5O10转移电子的物质的量为(4-18/5)×5=2mol,因此选项B正确。
答案:B
(2011北京高考8)结合下图判断,下列叙述正确的是
A.Ⅰ和Ⅱ中正极均被保护
B. Ⅰ和Ⅱ中负极反应均是Fe-2e-=Fe2+
C. Ⅰ和Ⅱ中正极反应均是O2+2H2O+4e-=4OH-
D. Ⅰ和Ⅱ中分别加入少量K3Fe(CN)6溶液,均有蓝色沉淀
(2011福建高考11)研究人员研制出一种锂水电池,可作为鱼雷和潜艇的储备电源。该电池以金属锂和钢板为电极材料,以LiOH为电解质,使用时加入水即可放电。关于该电池的下列说法不正确的是
A.水既是氧化剂又是溶剂
B.放电时正极上有氢气生成
C.放电时OH-向正极移动
D.总反应为:2Li+2H2O=== 2LiOH+H2↑
解析:考生可能迅速选出C项是错误,因为原电池放电时OH-是向负极移动的。这个考点在备考时训练多次。这种电池名称叫锂水电池。可推测其总反应为:2Li+2H2O=== 2LiOH+H2↑。再写出其电极反应如下:
(—)2Li—2e—=2Li+
(+)2H2O+2e—=2OH—+H2↑
结合选项分析A、B、D都是正确的。
此题情景是取材于新的化学电源,知识落脚点是基础,对原电池原理掌握的学生来说是比较容易的。
答案:C
(2011山东高考15)以KCl和ZnCl2混合液为电镀液在铁制品上镀锌,下列说法正确的是
A.未通电前上述镀锌装置可构成原电池,电镀过程是该原电池的充电过程
B.因部分电能转化为热能,电镀时通过的电量与锌的析出量无确定关系
C.电镀时保持电流恒定,升高温度不改变电解反应速率
D.镀锌层破损后对铁制品失去保护作用
解析:电镀时,通常把待镀的金属制品作阴极,把镀层金属作阳极,用含有镀层金属离子的溶液作电镀液。因此在铁制品上镀锌时,铁作阴极,锌作阳极,由于锌比铁活泼,因此未通电前可以构成原电池,但此时锌作负极失去电子,铁作正极,而电镀是锌仍然失电子,所以选项A不正确;在氧化还原反应中必需满足得失电子守恒,因此电镀时通过的电量与锌的析出量有确定关系而与能量变化无关,B不正确;由于电镀时保持电流恒定,因此导线中通过的电子速率是不变的,所以升高温度不能改变电解反应速率,C正确;镀锌层破损后,由于锌比铁活泼,所以即使发生电化学腐蚀也是锌失去电子而保护了铁,即选项D也不正确。
答案:C
(2011新课标全国)铁镍蓄电池又称爱迪生电池,放电时的总反应为:Fe+Ni2O3+3H2O= Fe(OH)2+2Ni(OH)2
下列有关该电池的说法不正确的是
A. 电池的电解液为碱性溶液,正极为Ni2O3、负极为Fe
B. 电池放电时,负极反应为Fe+2OH--2e-=Fe(OH)2
C. 电池充电过程中,阴极附近溶液的pH降低
D. 电池充电时,阳极反应为2Ni(OH)2+2OH--2e-=Ni2O3+3H2O
解析:由放电时的反应可以得出铁做还原剂失去电子,Ni2O3做氧化剂得到电子,因此选项AB均正确;充电可以看作是放电的逆过程,即阴极为原来的负极,所以电池放电时,负极反应为:Fe+2OH--2e-= Fe(OH)2,所以电池充电过程时阴极反应为Fe(OH)2+2e-= Fe+2OH-,因此电池充电过程中,阴极附近溶液的pH会升高,C不正确;同理分析选项D正确。
答案:C
(2010江苏卷).下列说法不正确的是
A.铅蓄电池在放电过程中,负极质量减小,正极质量增加
B.常温下,反应不能自发进行,则该反应的
C.一定条件下,使用催化剂能加快反应速率并提高反应物的平衡转化率
D.相同条件下,溶液中、、的氧化性依次减弱
【答案】AC
【解析】本题主要考查的是相关的反应原理。A项,铅蓄电池在放电过程中,负极反应为其质量在增加;B项,该反应是典型的吸热反应,在常温下不能自发进行;C项,催化剂能改变反应速率,不一定加快,同时它不能改变转化率;D项,可知的氧化性大于,综上分析可知,本题选AC项。
1. (10年广东化学·9)科学家近年来研制出一种新型细菌燃料电池,利用细菌将有机物转化为氢气,氢气进入以磷酸为电解质的燃料电池发电。电池负极反应为:
A.H2+2OH-=2H2O+2e-
B.O2+4H++4e-=2H2O
C.H2=2H++2e-
D.O2+2H2O+4e-=4OH
答案:C
解析:难度:易,电解液为酸性,故A错,负极通入氢气,正极通入氧气,故B、D错。
2..(08年广东化学·12)为了避免青铜器生成铜绿,以下方法正确的是
A.将青铜器放在银质托盘上
B.将青铜器保存在干燥的环境中
C.将青铜器保存在潮湿的空气中
D.在青铜器的表面覆盖一层防渗的高分子膜
答案:BD
解析:铜绿是生活中常见现象,反应原理为2Cu+O2+CO2+H2O==Cu2CO3(OH)2,故青铜器应保存在干燥的环境中或表面覆盖一层防渗的高分子膜防止被腐蚀。A可能发生原电池反应而被腐蚀。
3.(08年广东文基·62)下列说法正确的是
A.需要加热的化学反应都是吸热反应
B.中和反应都是放热反应
C.原电池是将电能转化为化学能的一种装置
D.水力发电是将化学能转化为电能的过程
答案:B
解析:需要加热的化学反应也可能是放热反应,如可燃物的燃烧反应,A选项错误;原电池是将化学能转化为电能的装置,故C选项错误;水力发电是将机械能转化为电能的过程,故D选项错误。正确选项为B
4.(07年广东理基·25)钢铁在潮湿的空气中会被腐蚀,发生的原电池反应为:2Fe+2H2O+O2 2Fe2++4OH-。以下说法正确的是
A.负极发生的反应为:Fe-2e- Fe2+
B.正极发生的反应为:2H2O+O2+2e- 4OH-
C.原电池是将电能转变为化学能的装置
D.钢柱在水下部分比在空气与水交界处更容易腐蚀
答案:A
解析:钢铁在潮湿的环境中发生吸氧腐蚀,负极反应为:Fe-2e- Fe2+,正极反应为:2H2O+O2+4e- 4OH-,在空气与水交界处溶液中的氧气不断溶解,因此在空气与水交界处钢铁更容易腐蚀。
5.(07年广东化学·20)三氧化二镍(Ni2O3)可用于制造高能电池,其电解法制备过程如下:用NaOH调NiCl2溶液pH至7.5,加入适量硫酸钠后进行电解。电解过程中产生的Cl2在弱碱性条件下生成ClO-,把二价镍氧化为三价镍。以下说法正确的是
A.可用铁作阳极材料
B.电解过程中阳极附近溶液的pH升高
C.阳极反应方程式为:2Cl--2e-=Cl2
D.1mol二价镍全部转化为三价镍时,外电路中通过了1mol电子。
答案:CD
解析:电解时阳极产生Cl2,电极反应为2Cl--2e-=Cl2,,故C对,阳极不可能是活泼性电极如铁,故A错。阳极产生Cl2与碱反应,故pH值降低,故B错,二价镍全部转化为三价镍失e-,故D对。
.6.(09年宁夏理综·10)一种燃料电池中发生的化学反应为:在酸性溶液中甲醇与氧作用生成水和二氧化碳。该电池负极发生的反应是
A.CH3OH(g)+O2(g)=H2O(1)+CO2(g)+2H+(aq)+2e-
B.O2(g)+4H+(aq)+4e-=2H2O(1)
C.CH3OH(g)+H2O(1)=CO2(g)+6H+(aq)+6e-
D.O2(g)+2H2O(1)+4e-=4OH-
答案:C
解析:甲醇与氧气反应的化学方程式为:2CH3OH+3O22CO2+4H2O,化合价升高的元素为C,所以在负极上甲醇失去电子而放电,在该极上的电极反应式为:CH3OH(g)+H2O(1)=CO2(g)+6H+(aq)+6e-。
.7.(08年广东化学·16)LiFePO4电池具有稳定性高、安全、对环境友好等优点,可用于电动汽车。电池反应为:FePO4+LiLiFePO4,电池的正极材料是LiFePO4,负极材料是石墨,含Li+导电固体为电解质。下列有关LiFePO4电池说法正确的是
A.可加入硫酸以提高电解质的导电性
B.放电时电池内部Li+向负极移动.
C.充电过程中,电池正极材料的质量减少
D.放电时电池正极反应为:FePO4+Li++e-=LiFePO4
答案:CD
解析:放电时,负极:Li -- e- ==Li+,正极:FePO4 + Li+ + e- == LiFePO4;充电时,阳极:LiFePO4 -- e- == FePO4 + Li+ 阴极:Li+ + e- == Li,所以易知C.D正确。
若加入硫酸,与Li单质(固体)发生反应,所以A错;放电时,Li+应(正电荷)在电池内部(电解质中)向正极移动,故B错。
.(09年江苏化学·16)(8分)以氯化钾和钛白厂的副产品硫酸亚铁为原料生产硫酸钾、过二硫酸钠和氧化铁红颜料,原料的综合利用率较高。其主要流程如下:
(1)反应I前需在FeSO4溶液中加入 (填字母),以除去溶液中的Fe3+。
A.锌粉 B.铁屑 C.KI溶液 D.H2
(2)反应Ⅰ需控制反应温度低于35℃,其目的是 。
(3)工业生产上常在反应Ⅲ的过程中加入一定量的醇类溶剂,其目的是 。
(4)反应Ⅳ常被用于电解生产(NH4)2S2O8(二硫酸铵)。电解时均用惰性电极,阳极发生地电极反应可表示为
答案:(1)B
(2)防止NH4HCO3分解(或减少Fe2+的水解)
(3)降低K2SO4 的溶解度,有利于K2SO4 析出。
(4)2SO42- -2e-2S2O82-
解析:(1)在FeSO4溶液中除去溶液中的Fe3+,最好选用铁屑或铁粉,比较简单。(2)如果温度过高会导致NH4HCO3分解同样也会加快Fe2+的水解(温度越高水解速率越快)这样会使原料利用率降低。(3)由题目看出在III反应中生成的K2SO4 为固体,而K2SO4在无机溶剂中溶解度是比较大的,要想使K2SO4析出只能降低其溶解度所以加入醇类溶剂目的降低K2SO4的溶解度。
(4)根据阴阳极反应原理阳极失电子发生氧化反应,此题实质是电解硫酸铵溶液,在根据反应后的产物得出正确的答案。
【考点分析】此题为化工生产题型,主要考察了化合物性质,电极方程式书写。做此类题要分析清楚每一个环节目的和结果是什么。这样才能判断各反应后的产物分别是什么。
