3.2《弱电解质的电离 盐类的水解》(鲁科版选修4)
文档属性
| 名称 | 3.2《弱电解质的电离 盐类的水解》(鲁科版选修4) |

|
|
| 格式 | rar | ||
| 文件大小 | 855.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-02-14 00:00:00 | ||
图片预览





文档简介
(共17张PPT)
盐类水解的影响因素及其应用
【活动与探究Ⅰ】
测定0.1mol / L的下列溶液的pH
盐溶液
(0.1mol/L) 水解的离子方程式 pH
①NaCl
②Na2CO3
③CH3COONa
CO32- + H2O HCO3- + OH-
CH3COO-+H2O CH3COOH+OH-
————
[结论] 有弱才水解
越弱越水解
---内因
1、物质的量浓度相同的NaX、NaY、NaZ三种盐溶液,其pH值分别为8、9、10,则相同物质的量浓度的 HX、HY、HZ的酸性强弱顺序为 。
HX>HY>HZ
【跟踪练习】
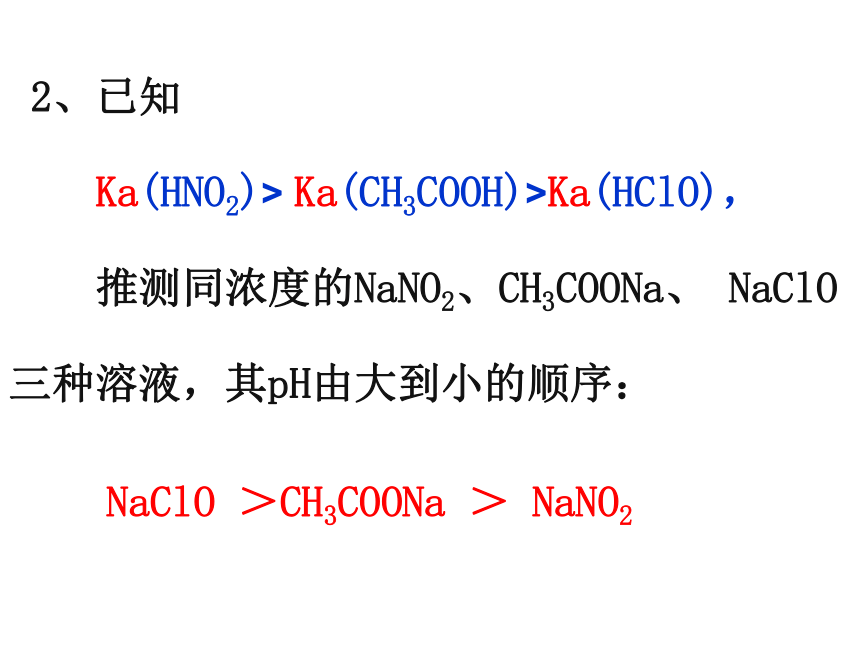
2、已知
Ka(HNO2)> Ka(CH3COOH)>Ka(HClO),
推测同浓度的NaNO2、CH3COONa、 NaClO
三种溶液,其pH由大到小的顺序:
NaClO >CH3COONa > NaNO2
二、盐类水解的影响因素—外因
1、温度:
【活动与探究Ⅱ】
Ⅰ.向0.1mol/L Na2CO3溶液中滴加2-3滴酚酞,观察现象。
Ⅱ.微热后,再观察现象。
加入酚酞,溶液淡红色
加热,溶液变为深红色
升温促进水解
CO32-+H2O HCO3-+OH-
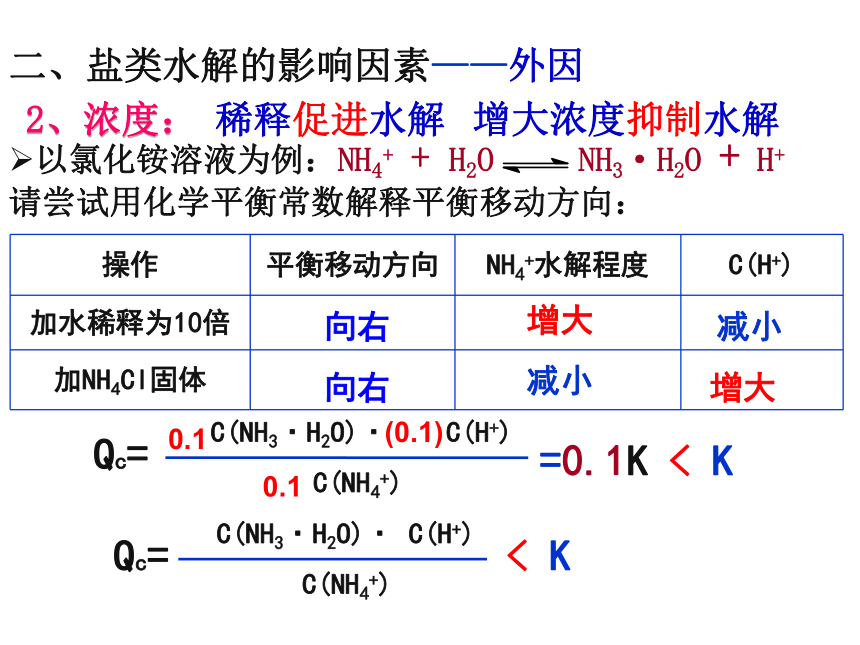
2、浓度:
以氯化铵溶液为例:NH4+ + H2O NH3·H2O + H+
请尝试用化学平衡常数解释平衡移动方向:
C(NH3·H2O)· C(H+)
C(NH4+)
K=
0.1
(0.1)
0.1
=0.1K
稀释促进水解
二、盐类水解的影响因素——外因
Qc=
< K
操作 平衡移动方向 NH4+水解程度 C(H+)
加水稀释为10倍
加NH4Cl固体
向右
向右
增大
减小
减小
增大
C(NH3·H2O)· C(H+)
C(NH4+)
Qc=
< K
增大浓度抑制水解
条件 平衡移动方向 C(H+) pH值 Fe3+的水解
程度
通HCl气体
3、酸碱性:
减小
左移
增大
减小
水解呈酸性的溶液中加入酸抑制水解
现象:溶液黄色加深!
二、盐类水解的影响因素——外因
【活动与探究Ⅲ】
[思考]水解后呈碱性的溶液中加入碱会怎样呢?
水解呈碱性的溶液中加入碱抑制水解
以稀FeCl3溶液为例,存在如下水解平衡:
Fe3++3H2O ? Fe(OH)3+3H+ ,填写下列表格
【活动与探究Ⅳ】
将Al2(SO4)3溶液和NaHCO3溶液混合,观察现象并解释原因,写出有关反应的离子方程式。
②若不生成气体和沉淀离开体系,则水解不彻底,
方程式用“ ” ,不用 “↓ ↑” 箭号。
二、盐类水解的影响因素——外因
互促水解(双水解)
4、与水解有关的其他物质
①若生成的气体和沉淀离开体系,则水解彻底,
方程式用“=”,沉淀和气体标“↓ ↑” 。
[注意事项]:
分析不同条件对CH3COONa水解平衡的影响
CH3COO- + H2O CH3COOH + OH-
条件 移动方向 n(OH-) pH 水解程度
升温
加水
加CH3COONa固体
加NaOH固体
通HCl气体
加NH4Cl固体
【迁移应用】
分析不同条件对CH3COONa水解平衡的影响
CH3COO- + H2O CH3COOH + OH-
条件 移动方向 n(OH-) pH 水解程度
升温 向右 增大 增大 增大
加水 向右 增大 减小 增大
加CH3COONa固体 向右 增大 增大 减小
加NaOH固体 向左 增大 增大 减小
通HCl气体 向右 减小 减小 增大
加NH4Cl固体 向右 减小 减小 增大
【迁移应用】
灭火器原理
外筒放入的是什么药品?
泡沫灭火器里的药品是NaHCO3溶液和Al2(SO4)3溶液。
塑料筒里面放入的是什么药品?
【小结】
《水解秘笈》
有弱才水解
谁强显谁性
越弱越水解
升温稀释促
同酸同碱抑
外因
——条件
——结果
——内因
1、为了使NH4Cl溶液中c(NH4+):c(Cl—)=1 :1,可在NH4Cl溶液中加入( )
①适量的HCl ②适量的NaCl
③适量的氨水 ④适量的NaOH
A.①② B.③
C.③④ D.④
【当堂达标】
B
2、相同条件下,
①Na2CO3 ②CH3COONa ③NaOH三种溶液
的pH值相同,则三者浓度大小关系为
②>①>③
3、FeCl3溶液加热蒸干灼烧后最终产物是什么
写出相关的化学方程式及必要的文字说明。
[小结]
盐水解生成挥发性酸:蒸干后一般先得到难溶弱碱,再灼烧得到氧化物;
盐类水解的影响因素及其应用
【活动与探究Ⅰ】
测定0.1mol / L的下列溶液的pH
盐溶液
(0.1mol/L) 水解的离子方程式 pH
①NaCl
②Na2CO3
③CH3COONa
CO32- + H2O HCO3- + OH-
CH3COO-+H2O CH3COOH+OH-
————
[结论] 有弱才水解
越弱越水解
---内因
1、物质的量浓度相同的NaX、NaY、NaZ三种盐溶液,其pH值分别为8、9、10,则相同物质的量浓度的 HX、HY、HZ的酸性强弱顺序为 。
HX>HY>HZ
【跟踪练习】
2、已知
Ka(HNO2)> Ka(CH3COOH)>Ka(HClO),
推测同浓度的NaNO2、CH3COONa、 NaClO
三种溶液,其pH由大到小的顺序:
NaClO >CH3COONa > NaNO2
二、盐类水解的影响因素—外因
1、温度:
【活动与探究Ⅱ】
Ⅰ.向0.1mol/L Na2CO3溶液中滴加2-3滴酚酞,观察现象。
Ⅱ.微热后,再观察现象。
加入酚酞,溶液淡红色
加热,溶液变为深红色
升温促进水解
CO32-+H2O HCO3-+OH-
2、浓度:
以氯化铵溶液为例:NH4+ + H2O NH3·H2O + H+
请尝试用化学平衡常数解释平衡移动方向:
C(NH3·H2O)· C(H+)
C(NH4+)
K=
0.1
(0.1)
0.1
=0.1K
稀释促进水解
二、盐类水解的影响因素——外因
Qc=
< K
操作 平衡移动方向 NH4+水解程度 C(H+)
加水稀释为10倍
加NH4Cl固体
向右
向右
增大
减小
减小
增大
C(NH3·H2O)· C(H+)
C(NH4+)
Qc=
< K
增大浓度抑制水解
条件 平衡移动方向 C(H+) pH值 Fe3+的水解
程度
通HCl气体
3、酸碱性:
减小
左移
增大
减小
水解呈酸性的溶液中加入酸抑制水解
现象:溶液黄色加深!
二、盐类水解的影响因素——外因
【活动与探究Ⅲ】
[思考]水解后呈碱性的溶液中加入碱会怎样呢?
水解呈碱性的溶液中加入碱抑制水解
以稀FeCl3溶液为例,存在如下水解平衡:
Fe3++3H2O ? Fe(OH)3+3H+ ,填写下列表格
【活动与探究Ⅳ】
将Al2(SO4)3溶液和NaHCO3溶液混合,观察现象并解释原因,写出有关反应的离子方程式。
②若不生成气体和沉淀离开体系,则水解不彻底,
方程式用“ ” ,不用 “↓ ↑” 箭号。
二、盐类水解的影响因素——外因
互促水解(双水解)
4、与水解有关的其他物质
①若生成的气体和沉淀离开体系,则水解彻底,
方程式用“=”,沉淀和气体标“↓ ↑” 。
[注意事项]:
分析不同条件对CH3COONa水解平衡的影响
CH3COO- + H2O CH3COOH + OH-
条件 移动方向 n(OH-) pH 水解程度
升温
加水
加CH3COONa固体
加NaOH固体
通HCl气体
加NH4Cl固体
【迁移应用】
分析不同条件对CH3COONa水解平衡的影响
CH3COO- + H2O CH3COOH + OH-
条件 移动方向 n(OH-) pH 水解程度
升温 向右 增大 增大 增大
加水 向右 增大 减小 增大
加CH3COONa固体 向右 增大 增大 减小
加NaOH固体 向左 增大 增大 减小
通HCl气体 向右 减小 减小 增大
加NH4Cl固体 向右 减小 减小 增大
【迁移应用】
灭火器原理
外筒放入的是什么药品?
泡沫灭火器里的药品是NaHCO3溶液和Al2(SO4)3溶液。
塑料筒里面放入的是什么药品?
【小结】
《水解秘笈》
有弱才水解
谁强显谁性
越弱越水解
升温稀释促
同酸同碱抑
外因
——条件
——结果
——内因
1、为了使NH4Cl溶液中c(NH4+):c(Cl—)=1 :1,可在NH4Cl溶液中加入( )
①适量的HCl ②适量的NaCl
③适量的氨水 ④适量的NaOH
A.①② B.③
C.③④ D.④
【当堂达标】
B
2、相同条件下,
①Na2CO3 ②CH3COONa ③NaOH三种溶液
的pH值相同,则三者浓度大小关系为
②>①>③
3、FeCl3溶液加热蒸干灼烧后最终产物是什么
写出相关的化学方程式及必要的文字说明。
[小结]
盐水解生成挥发性酸:蒸干后一般先得到难溶弱碱,再灼烧得到氧化物;
