3.2《弱电解质的电离 盐类的水解》1(鲁科版选修4)
文档属性
| 名称 | 3.2《弱电解质的电离 盐类的水解》1(鲁科版选修4) |

|
|
| 格式 | rar | ||
| 文件大小 | 923.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-02-14 00:00:00 | ||
图片预览







文档简介
(共25张PPT)
第一环节: 复 习
1、构成条件
有两种活泼性不同的金属(或一种是金属另一种是非金属导体)作电极
电极材料均插入电解质溶液中。
两极相连形成闭合电路。
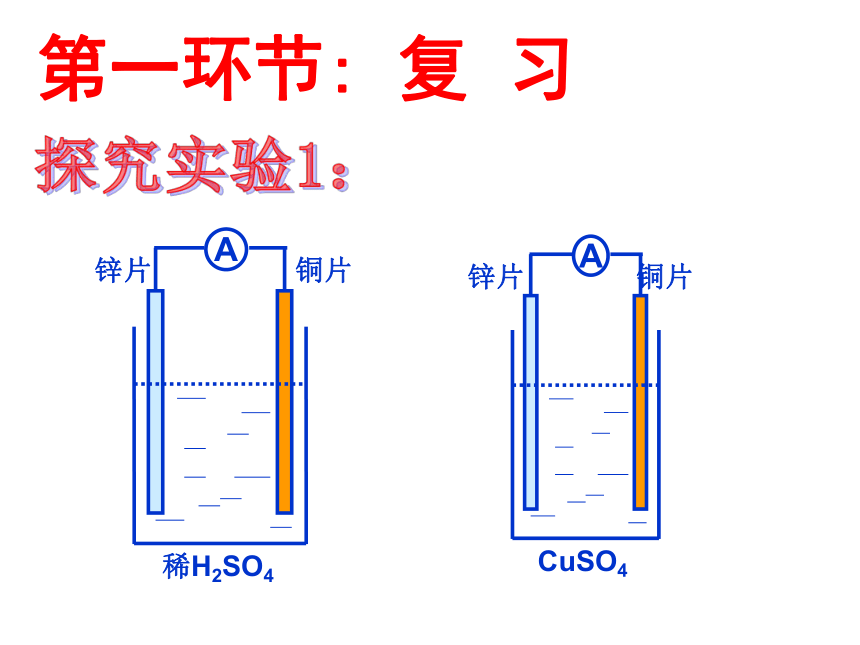
第一环节: 复 习
(1)
(2)
(3)
A
稀H2SO4
锌片 铜片
A
CuSO4
锌片 铜片
第一环节: 复 习
思考:
(1)、如何写出这两套装置的电极反应式和电池总反应方程式?
(2)、以硫酸为电解质分析原电池的工作原理?
(3)、阐述实验现象并分析产生此现象的原因?
第一环节: 复 习
2、电极反应式、总反应式
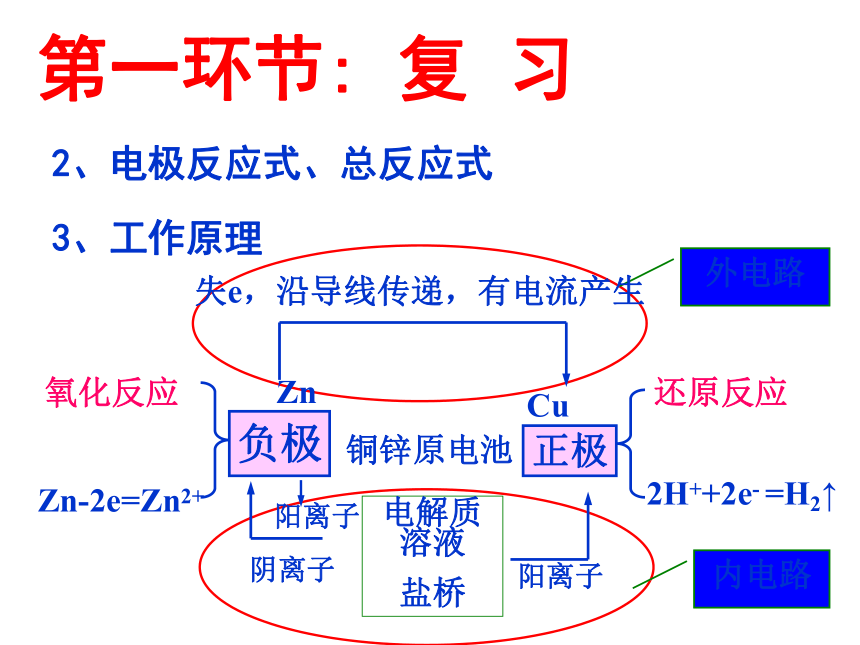
第一环节: 复 习
3、工作原理
氧化反应
Zn-2e=Zn2+
铜锌原电池
还原反应
2H++2e- =H2↑
负极
正极
外电路
内电路
Zn
Cu
失e,沿导线传递,有电流产生
电解质溶液
盐桥
阴离子
阳离子
阳离子
交流研讨:
◆理论上应看到只在铜片上有大量气 泡,实际上锌片上也有大量气泡产生,这是什么原因导致的呢?
◆最终又会造成什么后果?怎样避免和克服呢?
◆用什么办法避免Cu2+在锌片上被还原析出铜,以延长电池放电时间提高供电效率
ZnSO4
Zn Cu
CuSO4
A
上述装置构成了原电池吗?为什么?
问题探究
在原有实验装置的基础上,如何加以改进才能得到持续稳定的电流呢?
第二环节:盐桥原电池
1、盐桥的组成和作用
组成:U型管、由饱和KCl溶液和琼脂制成的胶冻
原电池放电时,一边Zn失去电子成为Zn2+进入溶液,使 ZnSO4溶液因Zn2+增加而带正电,盐桥中的Cl—会 移向ZnSO4溶液;同另一边CuSO4溶液中的Cu2+获得电子成为金属在铜片上析出,使CuSO4溶液因SO42—相对增加而带负电,盐桥中的K+移向CuSO4溶液,从而形成闭合回路。
分析盐桥的作用:
第二环节:盐桥原电池
第二环节:盐桥原电池
2、作用:
(1)联通两个溶液,形成闭合回路。
(2)使两个溶液保持电中性,从而使电极反应持续进行。
第二环节:盐桥原电池
原电池在放电时,负极是还原性较强的物质(如:活泼金属) ,向外电路提供电子;负极上的电子经过导线流向正极,而氧化性较强的物质从正极上得到电子,两极之间再通过盐桥及原电池内部溶液中的阴、阳离子定向运动形成的内电路构成有稳定电流的闭合回路。
分为两个半电池进行
3、工作原理:
Zn——负极
Cu——正极
Zn - 2e- = Zn2+
3、电极反应:
Cu2+ + 2e- = Cu
第二环节:盐桥原电池
总反应方程式:Zn+Cu2+=Zn2++Cu
能产生稳定、持续电流的原电池应具备什么条件?
1.要有导电性不同的两个电极
2.两个半反应在不同的区域进行
3.用导线和盐桥分别将两个半电池连接在一起
讨
论
跟踪练习
1.依实验4-1的原理,按以下反应设计一个能持续产生电流的原电池装置,画出装置图。
Cu+2AgNO3=Cu(NO3)2+2Ag
AgNO3
Ag Cu
Cu(NO3)2
A
2、根据上述原理,为获得较长时间的稳定电流,如何将 “Zn-稀H2SO4-Cu”组成的原电池(如左下图)进行简单改装?
A
稀H2SO4
锌片 铜片
ZnSO4
Zn Cu
H2SO4
A
跟踪练习
总 结
1、复习原电池的形成。
2、进一步了解原电池的反应原理,正确书写电极反应式。
3、利用氧化还原反应原理设计了原电池。
基础闯关
1.锌铜原电池产生电流时,阳离子( )
A、移向Zn 极,阴离子移向Cu 极
B、移向Cu 极,阴离子移向Zn 极
C、和阴离子都移向Zn极
D、和阴离子都移向Cu 极
B
CuSO4
FeSO4
Fe
Cu
2.写出右图的电极反应式及总反应式
3.(07海南化学卷14)依据氧化还原反应:2Ag+(aq)+Cu(s)==Cu2+(aq)+2Ag(s)设计的原电池如图所示。
请回答下列问题:
(1)电极X的材料是 ;
电解质溶液Y是 ;
(2)银电极为电池的 极,
发生的电极反应为 ;
X电极上发生的电极反应为 ;
(3)外电路中的电子是从 电极流向 电极。
CU
铜
银
正
AgNO3溶液
Ag + e = Ag
Cu - 2e = Cu
+
-
-
2+
小试牛刀
4、用铜片、银片、Cu (NO3)2溶液、AgNO3溶液、导线和盐桥(装有琼脂-----KNO3的U型管)构成一个原电池。以下有关该原电池的叙述正确的是( )
①在外电路中,电流由铜电极流向银电极
②正极反应为:Ag++e-=Ag
③实验过程中取出盐桥,原电池仍继续工作
④将铜片浸入AgNO3溶液中发生的化学反应与该原电池反应相同
A. ①② B.②③ C.②④ D.③④
C
利用反应Zn+2FeCl3=2FeCl2+ZnCl2 ,设计出两种原电池,画出原电池的示意图,并写出电极反应方程式。
参考答案
(+)
(-)
G
Zn
Pt
FeCl3溶液
负极(Zn):Zn-2e-=Zn2+(氧化反应)
正极(Pt或C):2Fe3++2e-=2Fe2+(还原反应)
(+)
(-)
ZnCl2溶液
FeCl3溶液
盐桥
G
Zn
C
负极(Zn):Zn-2e-=Zn2+(氧化反应)
正极(Pt或C):2Fe3++2e-=2Fe2+(还原反应)
1、根据氧化还原反应电子转移判断电极反应。
2、根据电极反应确定合适的电极材料和电解质溶液
能力提升
课后作业:
基础巩固型:教材P73 1、2、4
拓展探究型:练习册P82 4、6
第一环节: 复 习
1、构成条件
有两种活泼性不同的金属(或一种是金属另一种是非金属导体)作电极
电极材料均插入电解质溶液中。
两极相连形成闭合电路。
第一环节: 复 习
(1)
(2)
(3)
A
稀H2SO4
锌片 铜片
A
CuSO4
锌片 铜片
第一环节: 复 习
思考:
(1)、如何写出这两套装置的电极反应式和电池总反应方程式?
(2)、以硫酸为电解质分析原电池的工作原理?
(3)、阐述实验现象并分析产生此现象的原因?
第一环节: 复 习
2、电极反应式、总反应式
第一环节: 复 习
3、工作原理
氧化反应
Zn-2e=Zn2+
铜锌原电池
还原反应
2H++2e- =H2↑
负极
正极
外电路
内电路
Zn
Cu
失e,沿导线传递,有电流产生
电解质溶液
盐桥
阴离子
阳离子
阳离子
交流研讨:
◆理论上应看到只在铜片上有大量气 泡,实际上锌片上也有大量气泡产生,这是什么原因导致的呢?
◆最终又会造成什么后果?怎样避免和克服呢?
◆用什么办法避免Cu2+在锌片上被还原析出铜,以延长电池放电时间提高供电效率
ZnSO4
Zn Cu
CuSO4
A
上述装置构成了原电池吗?为什么?
问题探究
在原有实验装置的基础上,如何加以改进才能得到持续稳定的电流呢?
第二环节:盐桥原电池
1、盐桥的组成和作用
组成:U型管、由饱和KCl溶液和琼脂制成的胶冻
原电池放电时,一边Zn失去电子成为Zn2+进入溶液,使 ZnSO4溶液因Zn2+增加而带正电,盐桥中的Cl—会 移向ZnSO4溶液;同另一边CuSO4溶液中的Cu2+获得电子成为金属在铜片上析出,使CuSO4溶液因SO42—相对增加而带负电,盐桥中的K+移向CuSO4溶液,从而形成闭合回路。
分析盐桥的作用:
第二环节:盐桥原电池
第二环节:盐桥原电池
2、作用:
(1)联通两个溶液,形成闭合回路。
(2)使两个溶液保持电中性,从而使电极反应持续进行。
第二环节:盐桥原电池
原电池在放电时,负极是还原性较强的物质(如:活泼金属) ,向外电路提供电子;负极上的电子经过导线流向正极,而氧化性较强的物质从正极上得到电子,两极之间再通过盐桥及原电池内部溶液中的阴、阳离子定向运动形成的内电路构成有稳定电流的闭合回路。
分为两个半电池进行
3、工作原理:
Zn——负极
Cu——正极
Zn - 2e- = Zn2+
3、电极反应:
Cu2+ + 2e- = Cu
第二环节:盐桥原电池
总反应方程式:Zn+Cu2+=Zn2++Cu
能产生稳定、持续电流的原电池应具备什么条件?
1.要有导电性不同的两个电极
2.两个半反应在不同的区域进行
3.用导线和盐桥分别将两个半电池连接在一起
讨
论
跟踪练习
1.依实验4-1的原理,按以下反应设计一个能持续产生电流的原电池装置,画出装置图。
Cu+2AgNO3=Cu(NO3)2+2Ag
AgNO3
Ag Cu
Cu(NO3)2
A
2、根据上述原理,为获得较长时间的稳定电流,如何将 “Zn-稀H2SO4-Cu”组成的原电池(如左下图)进行简单改装?
A
稀H2SO4
锌片 铜片
ZnSO4
Zn Cu
H2SO4
A
跟踪练习
总 结
1、复习原电池的形成。
2、进一步了解原电池的反应原理,正确书写电极反应式。
3、利用氧化还原反应原理设计了原电池。
基础闯关
1.锌铜原电池产生电流时,阳离子( )
A、移向Zn 极,阴离子移向Cu 极
B、移向Cu 极,阴离子移向Zn 极
C、和阴离子都移向Zn极
D、和阴离子都移向Cu 极
B
CuSO4
FeSO4
Fe
Cu
2.写出右图的电极反应式及总反应式
3.(07海南化学卷14)依据氧化还原反应:2Ag+(aq)+Cu(s)==Cu2+(aq)+2Ag(s)设计的原电池如图所示。
请回答下列问题:
(1)电极X的材料是 ;
电解质溶液Y是 ;
(2)银电极为电池的 极,
发生的电极反应为 ;
X电极上发生的电极反应为 ;
(3)外电路中的电子是从 电极流向 电极。
CU
铜
银
正
AgNO3溶液
Ag + e = Ag
Cu - 2e = Cu
+
-
-
2+
小试牛刀
4、用铜片、银片、Cu (NO3)2溶液、AgNO3溶液、导线和盐桥(装有琼脂-----KNO3的U型管)构成一个原电池。以下有关该原电池的叙述正确的是( )
①在外电路中,电流由铜电极流向银电极
②正极反应为:Ag++e-=Ag
③实验过程中取出盐桥,原电池仍继续工作
④将铜片浸入AgNO3溶液中发生的化学反应与该原电池反应相同
A. ①② B.②③ C.②④ D.③④
C
利用反应Zn+2FeCl3=2FeCl2+ZnCl2 ,设计出两种原电池,画出原电池的示意图,并写出电极反应方程式。
参考答案
(+)
(-)
G
Zn
Pt
FeCl3溶液
负极(Zn):Zn-2e-=Zn2+(氧化反应)
正极(Pt或C):2Fe3++2e-=2Fe2+(还原反应)
(+)
(-)
ZnCl2溶液
FeCl3溶液
盐桥
G
Zn
C
负极(Zn):Zn-2e-=Zn2+(氧化反应)
正极(Pt或C):2Fe3++2e-=2Fe2+(还原反应)
1、根据氧化还原反应电子转移判断电极反应。
2、根据电极反应确定合适的电极材料和电解质溶液
能力提升
课后作业:
基础巩固型:教材P73 1、2、4
拓展探究型:练习册P82 4、6
