揭示物质结构的奥秘
图片预览



文档简介
江苏省淮安中学II部高二年级化学教学案 编制:孙义 审核:马士龙
第1讲 专题一 揭示物质结构的奥秘
【课标要求】
1.了解人类探索物质结构的历史与价值,认识在分子等层次研究物质的意义。
2.知道物质是由微粒构成的,了解研究物质结构的基本方法和实验手段。
3.初步认识物质的结构与性质之间的关系,知道物质结构的研究有助于发现具有预期性质的新物质。
【教学重点】了解研究物质结构的基本方法和实验手段
【教学难点】了解研究物质结构的基本方法和实验手段
【课前检测】
1.核磁共振(NMR)技术已广泛应用于复杂分子结构的测定和医学诊断等高科技领域。已知质子数或中子数为奇数的原子核才有NMR现象,而质子数和中子数均为偶数的原子不产生核核磁共振,下列原子组一定能产生NMR现象的是( )
A.18 O、31 P、119 Sn B.27 Al、19 F、12 C
C.6C、16S、9F D.1 H、13 C、35 Cl
2、2007年诺贝尔化学奖得主Gerhard Ertl对金属Pt表面催化CO氧化反应的模型进行了深入研究。下列关于Pt的说法正确的是A
A.Pt和Pt的质子数相同,互称为同位素
B.Pt和Pt的中子数相同,互称为同位素
C.Pt和Pt的核外电子数相同,是同一种核素
D.Pt和Pt的质量数不同,不能互称为同位素
【教学过程】
一、人类探索物质结构的历史
阅读课本P2(你知道吗)
1.人类探索物质结构的历史:原子学说、原子分子论、元素周期律的发现、对有机物认识的进展、波粒二象性、量子化学、实验方法上的改进。
2.俄国化学家________________总结出元素周期律:元素的性质随着______的变化而呈现周期性变的化。他排出的第一张元素周期表包含_____种元素。元素周期律从理论上指导了化学元素的发现和应用。
3. 重要关系式:
核电荷数=核内质子数=核外电子数=原子序数
质量数(A)= +
阳离子的核外电子数= 质子数(Z) 阳离子的电荷数
阴离子的核外电子数=质子数(Z) 阴离子的电荷数
质量数(A)≈该同位素的相对原子质量
二、研究物质结构的意义
阅读P4-5页
第1讲 专题一 揭示物质结构的奥秘作业纸
高考资源网1.据报道,某些建筑材料在使用过程中会产生放射性同位素氡 ,从而对人体产生伤害。该同位素原子的中子数和质子数之差是 ( )
A.136 B.50 C.86 D.222
2.核磁共振(NMR)技术已广泛应用于复杂分子结构的测定和医学诊断等高科技领域。已知质子数或中子数为奇数的原子核才有NMR现象,而质子数和中子数均为偶数的原子不产生核核磁共振,下列原子组一定能产生NMR现象的是( )
A.18 O、31 P、119 Sn B.27 Al、19 F、12 C
C.6C、16S、9F D.1 H、13 C、35 Cl
3.X元素的阳离子和Y元素的阴离子具有相同的电子层结构,下列叙述正确的是
A、原子序数X<Y B、原子半径X< Y
C、离子半径X>Y D、原子最外层电子数X<Y
4.X是核外电子数最少的元素,Y是地壳中含量最丰富的元素,Z在地壳中的含量仅次于Y,W可以形成自然界最硬的原子晶体。下列叙述错误的是 ( )
A.WX4是沼气的主要成分 B.固态X2Y是分子晶体
C.ZW是原子晶体 D.ZY2的水溶液俗称“水玻璃”
5、 道尔顿的原子学说在历史上对物质结构理论的发展曾经起了很大作用。他的学说中,包含有下述三个论点:①物质是由原子组成的;②在化学变化中原子是不能再分割的粒子;③原子是很小的实心球体。从现代物质结构的观点看,你认为这三个论点中,不正确的 A.只有③ B.只有①③ C.只有②③ D.有①②③
6.1999年度诺贝尔化学奖授予了开创“飞秒(10-15s)化学”新领域的科学家,使运用激光光谱技术观测化学反应时分子中原子运动成为可能。你认为该技术不能观察到的是
A.原子中原子核的内部结构 B.化学反应中原子的运动
C.化学反应中生成物分子的形成 D.化学反应中反应物分子的分解
7.美国Lawrece Liermore国家实验室(LINL)成功地在高压下将转化为具有类似结构的原子晶体,下列关于的原子晶体说法,正确的是( )
A.的原子晶体和分子晶体互为同分异构体
B.在一定条件下,原子晶体转化为分子晶体是物理变化
C.的原子晶体和分子晶体具有相同的物理性质和化学性质
D.在的原子晶体中,每一个C原子周围结合4个O原子,每一个O原子跟两个C原子相结合
8.最近医学界通过放射性14C标记C60,发现一种C60的羧酸衍生物在特定条件下通过断裂DNA而杀死细胞,从而抑制艾滋病,则有关14C的叙述正确的是 ( )
A.与12C的化学性质不相同 B.与12C的中子数相同
C.是C60的同素异形体 D.与12C互为同位素
9.NaH是—种离子化合物,它跟水反应的方程式为:NaH+H2O = NaOH+H2↑,它也能跟液态氨、乙醇等发生类似的反应,并都产生氢气。下列有关NaH的叙述错误的是
A、NaH中氢负离子的最外层有两个电子B、NaH中H-半径比Li+半径小
C、NaH跟液氨反应时,有NaNH2生成
D、Na原子与H原子结合组成NaH过程中发生了电子转移.
10.在通信网中必不可少的材料是化合物半导体。现在最为普及的化合物半导体有两种,一种是镓砷半导体,它用作便携电话和无线电通信发射微波的零件;另一种化合物半导体由比镓(Ga)多18个电子的元素A和与砷(As)同族且电子层比砷少一层的元素B组成,它是作为通信电缆中光信号转变为电信号的中继器零件。此化合物的化学式为 ( )
A.GaP B.AlP C.GaAs D.InP
11.有人建议将氢元素排在元素周期表的ⅦA族。下列事实能支持这一观点的是 ( )
①H原子得到一个电子达到最外电子层稳定结构;②氢分子的结构式为H—H;③与碱金属元素等形成离子化合物M+[∶H]-;④分子中原子间的化学键都属于非极性键
A.只有①②③ B.只有①③④
C.只有②③④ D.有①②③④
题号 1 2 3 4 5 6 7 8 9 10 11
答案
班级 姓名 学号 等第
17.固体A的化学式为NH5,它的所有原子的最外层都符合相应的稀有气体原子的最外层电子结构。该物质适当加热就分解成两种气体。溶解于水也有气体放出。试回答下列问题:
(1)固体A属于 晶体,它的电子式为
(2)A溶于水后,溶液呈 性(酸、碱或中性),其与水反应的化学方程式是
6.下列这些粒子: O2—、S2— 、Cl— 、Al3+ 、F— 、Na+、Mg2+ 、Ca2+、K+
(1)与氖原子电子排布相同的粒子有____ _________ _。
(2)与氩原子电子排布相同的粒子有________ ____ _____。
18.A、B、C、D是短周期元素,A元素的最高价氧化物的水化物与它的气态氢化物反应得到离子化合物,B原子的最外层电子数是电子层数的3倍, C、D两原子的最外层电子数分别是内层电子总数的一半。C元素是植物生长的营养元素之一,试写出:
⑴ A、B元素形成的A元素最高价化合物的化学式 ;
⑵ D元素的单质与水反应的化学方程式 ;
⑶ A、C元素气态氢化物的稳定性大小 < .(用化学式表示).
专题二 原子结构与元素的性质
第2讲 原子核外电子的运动(一)
【教学目标】
原子核外电子的运动状态,了解电子云、电子层(能层)、原子轨道(能级)的含义。
【教学重点】电子层 能级的含义
【教学难点】电子层 能级的含义
【课前检测】
写出下列物质的原子结构示意图
Na Cl C Al S2—
2、核外电子排布的规律
1)电子总是从能
2)各层最多能容纳的电子数目为 (n为电子层数)
3)最外层最多能容纳的电子数目为 (K层为最外层,不超过2个电子),次外层电子数目不超过 ,倒数第三层不超过 个电子。
【教学过程】
一、原子核外电子的运动的特征
1、原子结构 阅读课本P8-(你知道吗)
【例题1】:(07年高考广东理基·21)32S与33S互为同位素,下列说法正确的是
A.32S与33S原子的最外层电子数均为2 B.32S与33S具有相同的中子数
C.32S与33S具有不同的电子数 D.32S与33S具有相同的质子数
2.电子层(能层)
(1)在含有多个电子的原子里,由于电子的 各不相同,因此,它们运动的区域也不同,通常能量低的电子在离核 区域运动,而能量高电子在离核较远的区域运动。按原子核外电子能量的差异,将核外电子分为不同的电子层,并用符号 表示。
(2)电子层的表示符号
电子层(n) 一 二 三 四 五 六 七
对应表示符号
3.电子云:电子在核外空间出现机会(概率)多少的形象化描述。
电子运动的特点:①质量极小 ②运动空间极小 ③极高速运动。
电子云的描述:电子在原子核外空间一定范围内出现,可以想象为 笼罩在原子核周围,所以,人们形象地把它叫做“ ”。电子云中的一个小黑点代表 ;电子云密度大的地方,表明 ;
例1.下列关于氢原子电子云图的说法正确的是
A.通常用小黑点来表示电子的多少,黑点密度大,电子数目大
B.黑点密度大,单位体积内电子出现的机会大
C.通常用小黑点来表示电子绕核作高速圆周运动
D.电子云图是对运动无规律性的描述
4.原子轨道:电子出现概率约为90%的空间所形成的电子云轮廓图。
处于同一电子层的原子核外电子,也可以在不同类型的原子轨道上运动,原子轨道用小写的英文字母 、 、 、 表示不同轨道,可容纳的电子数依次是 、 、 、 其中 轨道呈球形;能层序数越大,原子轨道的半径越大。 轨道呈纺锤形,每个p能级有3个原子轨道,他们相互垂直,分别以Px、Py、Pz表示。
5.能层与能级
能级的符号和所能容纳的最多电子数如下:
能 层(n) 一 二 三 四 五 六 七
符 号 K L M N O P Q
能 级(l) 1s 2s 2p 3s 3p 3d 4s 4p 4d 4f 5s … ……
最 多 电 子 数 2 … ……
…… 2n2
例2.下列有关认识正确的是
A.各能级的原子轨道数按s、p、d、f的顺序分别为1、3、5、7
B.各能层含有的电子数为2n2
C.各能层的能级都是从s能级开始至f能级结束 D.各能层含有的能级数为n -1
二、原子轨道能量大小判断
1、各原子轨道能量的高低
阅读课本P12问题解决回答各原子轨道能量的高低
2、原子在轨道上的自旋方向
第2讲 原子核外电子的运动(一)作业纸
一、选择题
1、关于“电子云”的描述中,正确的是
A、一个小黑点表示一个电子 B、一个小黑点代表电子在此出现过一次
C、电子云是带正电的云雾
D、小黑点的疏密表示电子在核外空间单位体积内出现机会的多少
2、下面关于多电子原子核外电子的运动规律的叙述正确的是
A、核外电子是分层运动的 B、所有电子在同一区域里运动
C、能量高的电子在离核近的区域运动 D、能量低的电子在离核低的区域运动
3. 下列有关电子云和原子轨道的说法正确的是
A.原子核外的电子象云雾一样笼罩在原子核周围,故称电子云
B.s能级的原子轨道呈球形,处在该轨道上的电子只能在球壳内运动
C.p能级的原子轨道呈纺锤形,随着能层的增加,p能级原子轨道也在增多
D.与s电子原子轨道相同,p电子原子轨道的平均半径随能层的增大而增大
4.以下对核外电子运动状况的描述正确的是
A.电子的运动与行星相似,围绕原子核在固定的轨道上高速旋转
B.能量低的电子只能在s轨道上运动,能量高的电子总是在f轨道上运动
C.能层序数越大,s原子轨道的半径越大
D.在同一能级上运动的电子,其运动状态肯定不同
5.若n=3,以下能级符号错误的是
A.np B.nf C.nd D. ns
6.图1和图2分别是1s电子的概率概率分布图和原子轨道图。下列有关认识正确的是
A.图1中的每个小黑点表示1个电子
B.图2表示1s电子只能在球体内出现
C.图2表明1s轨道呈圆形,有无数对称轴
D.图1中的小黑点表示某一时刻,电子在核外所处的位置
7.与Ne核外电子排布相同的离子跟与Ar核外电子排布相同的离子形成的化合物是
A. MgBr2 B.Na2S C.KCl D.KF
8、有下列四种轨道:①2s、②2p、③3p、④4d,其中能量最高的是
A. 2s B.2p C.3p D.4d
9.下列有关认识正确的是
A.各能级的原子轨道数按s、p、d、f的顺序分别为1、3、5、7
B.各能层的能级都是从s能级开始至f能级结束
C.各能层含有的能级数为n—1 D.各能层含有的电子数均为2n2
10.按能量由低到高的顺序排列,正确的一组是
A.1s、2p、3d、4s B.1s、2s、3s、2p C.2s、2p、3s、3p D.4p、3d、4s、3p
11. 法国里昂的科学家最近发现一种只由四个中子构成的微粒,这种微粒称为“四中子”,也有人称之为“零号元素”。下列有关“四中子”微粒的说法不正确的是
A.该微粒不显电性 B.该微粒质量数为4
C.与氢元素的质子数相同 D.该微粒质量比氢原子大
12. 最新科技报道,美国夏威夷联合天文中心的科学家发现了新型氢微粒,这种新粒子是由3个氢原子核(只含质子)和2个电子构成,对于这种微粒,下列说法正确的是
A.该微粒为电中性 B.它是氢元素的一种新的同位素
C.它的化学式为H3 D.它比一个普通H2分子多一个氢原子核
13. 在物质结构研究的历史上,根据量子论的观点,首先提出原子核外电子在一系列稳定轨道上运动并较好地解释了氢原子光谱的科学家是w.w.w.g.k.x.x.c.o.m
A.汤姆生 B.卢瑟福 C.道尔顿 D.玻尔
14.下列符号不符合事实的是
A.4s2 B.2p10 C.3d6 D.5f14
15.以s、p、d、f……的排序,各能级可容纳的电子数依次为 ( )
A.1、3、5、7… B.2、6、10、14……C.1、2、3、4…… D.2、4、6、8……
题号 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15
答案
班级 姓名 学号 等第
11.下面是s能级p能级的原子轨道图,试回答问题:
⑴s电子的原子轨道呈 形,每个s能级有 个原子轨道;p电子的原子轨道呈 形,每个p能级有 个原子轨道。
⑵s电子原子轨道、p电子原子轨道的半径与什么因素有关?是什么关系?
12.用“>”“<”或“=”表示下列各组多电子原子的原子轨道能量的高低
⑴3s 3p ⑵2px 2py ⑶3s 3d ⑷4s 3p
13.填表:各电子层包含的原子轨道数目和可容纳的电子数
电子层 原子轨道类型 原子轨道类型数目 可容纳的电子数目
1
2
3 3s,3p,3d 9 18
4
n ——————
第3讲 原子核外电子的运动(二)
【教学目标】多电子原子中核外电子分层排布遵循的原理,能用电子排布式表示常见元素(1~36号)原子核外电子的排布。
【教学重点】原子核外电子排布得规律
【教学难点】原子核外电子排布得规律
【课前检测】
1.下列能级的能量大小比较,正确的是
A.E(4s)>E(3d) B.E(6p)>E(5f) C.E(6s)<E(5p) D.E(4d)<E(5p)
2、写出下列符号中数字的含义:
1s2:1___________ 、2 _____________;3d6:3_______________ 、6 ________________;
3、12.若某基态原子的外围电子排布为4d15s2,则下列说法正确的是
A.该元素基态原子中共有3个电子 B.该元素原子核外有5个电子层
C.该元素原子最外层共有3个电子 D.该元素原子M能层共有8个电子
4、.以下能级符号正确的是
A. 6s B.2d C.3f D.7p
【教学过程】
一.构造原理:基态原子电子排布式
1、电子能级顺序:1s 2s2p 3s3p 4s3d4p 5s4d5p 6s4f5d6p 7s5f6d7p …ns (n-2)f (n-1)d np
构造原理揭示了原子核外电子的能级分布。不同能层的能级有交错现象,
如E(3d)>E(4s)、E(4d)>E(5s)、E(5d)>E(6s)、E(6d)>E(7s)、E(4f)>E(5p)等。
二:基态原子核外电子排布遵循的原则
1.能量最低原理:电子先占据能量低的轨道,再依次进入能量高的轨道.
2.泡利不相容原理:每个轨道最多容纳两个自旋状态不同的电子.
3.洪特规则:在能量相同的轨道上排布时,电子尽可能分占不同的轨道,且自旋状态相同.
洪特规则的特例:在等价轨道的全充满(p6、d10、f14)、半充满(p3、d5、f7)、全空时(p0、d0、f0)的状态,具有较低的能量和较大的稳定性。
【例题1】.电子排布在同一能级时,总是 A.优先单独占据不同轨道,且自旋方向相同B.优先单独占据不同轨道且自旋方向相反
C.自由配对,优先占据同一轨道,且自旋方向相同
D.自由配对,优先占据同一轨道,且自旋方向相反
【例题2】.“各能级最多容纳的电子数,是该能级原子轨道数的二倍”,支撑这一结论的理论是
A.构造原理 B.泡利原理 C.洪特规则 D.能量最低原理
【例题3】.基态碳原子的最外能层的各能级中,电子排布的方式正确的是
A B C D
4、原子核外电子的表示方式
(1)、原子核外电子的排布式
如:Na:1s22s22p63s1,能级符号上面数字是该能级上的电子数。也可以简写:
如11Na [Ne] 3s1 如24Cr [Ar]3d54s1 、 29Cu [Ar]3d104s1.
【例题4】.下列各原子或离子的电子排布式错误的是
A Al 1s22s22p63s23p1 B O2- 1s22s22p6
C Na+ 1s22s22p6 D Si 1s22s22p2
【例题5】:写出下列原子的电子排布式。
19K 24Cr 26Fe3+
35Br 29Cu 25Mn2+-
(2)核外电子的轨道式
【例题6】:写出下列原子的轨道表示式。
6C 13Al
【例题7】.下列关于价电子构型为3s23p4的粒子描述正确的是
A.它的元素符号为O B.它的核外电子排布式为1s22s22p63s23p4
C.它可与H2生成液态化合物 D.其电子排布图为:
1s 2s 2p 3s 3p
三、基态 激发态 光谱
1.基态: 能量状态。如处于最低能量状态的原子称为基态原子。
2.激发态: 能量状态(相对基态而言)。如基态原子的电子吸收能量后,电子跃迁至较高能级成为激发态原子。
3.基态与激发态相互转化的能量转化的关系
基态原子 激发态原子
4.光谱:
【例题8】.下列电子排布中,原子处于激发状态的是
A.1s22s22p5 B. 1s22s22p43s2 C. 1s22s22p63s23p63d44s2 D. 1s22s22p63s23p63d34s2
【例题9】:当碳原子的核外电子排布由 转变为 时,下列说法正确的是
A.碳原子由基态变为激发态 B.碳原子由激发态变为基态
C.碳原子要从外界环境中吸收能量 D.碳原子要向外界环境释放能量
2、现有x、y、z三种元素的原子,电子最后排布在相同的能级组上,而且y的核电荷比x大12个单位,z的质子数比y多4个。1摩尔的x同酸反应能置换出1克氢气,这时x转化为具有氩原子型电子层结构的离子。
(1)判断x、y、z各为何种元素?(2)写出x原子、y的阳离子、z的阴离子的电子排布式。
第3讲 原子核外电子的运动(二)作业纸
1.下列说法中正确的是
A 所有的电子在同一区域里运动
B 能量高的电子在离核远的区域运动,能量低的电子在离核近的区域运动
C 处于最低能量的原子叫基态原子
D 同一原子中,1s、2s、3s所能容纳的电子数越来越多
2.一个电子排布为1s22s22p63s23p1的元素最可能的价态是
A +1 B +2 C +3 D -1
3.下列表达方式错误的是
A 甲烷的电子式 B 氟化钠的电子式
C 硫离子的核外电子排布式 1s22s22p63s23p4 D 碳-12原子 C
4.下图中,能正确表示基态硅原子的是
A B C D
5.具有下列电子排布式的原子中,半径最大的是
A ls22s22p63s23p1 B 1s22s22p3
C 1s22s2sp2 D 1s22s22p63s23p4
6.当镁原子由1s22s22p63s2 →1s22s22p63p2时,以下认识正确的是
A.镁原子由基态转化成激发态,这一过程中吸收能量
B.镁原子由激发态转化成基态,这一过程中释放能量
C.转化后位于p能级上的两个电子处于同一轨道,且自旋方向相同
D.转化后镁原子与硅原子电子层结构相同,化学性质相似
7.以下基态原子的电子排布式不符合构造原理的是
A.1s22s22p63s23p63d74s2 B.1s22s22p63s23p63d54s1
C.1s22s22p63s23p63d104s2 4p1 D.1s22s22p63s23p64s2
8.下列粒子中,电子排布式为1s22s22p63s23p6的有
A.Sc3+ B.Mg2+ C.Cl— D.Br—
9.若某基态原子的外围电子排布为4d15s2,则下列说法正确的是
A.该元素基态原子中共有3个电子 B.该元素原子核外有5个电子层
C.该元素原子最外层共有3个电子 D.该元素原子M能层共有8个电子
题号 1 2 3 4 5 6 7 8 9
答案
班级 姓名 学号 等第
10.(1)砷原子的最外层电子排布式是4s24p3,在元素周期表中,砷元素位于__________
周期 族;最高价氧化物的化学式为 ,砷酸钠的化学式是 .
(2)已知下列元素在周期表中的位置,写出它们最外层电子构型和元素符号:
①第4周期ⅣB族 ;
②第4周期ⅦA族 .
11.按所示格式填写下表:
原子序数 电子排布式 价层电子排布 周期 族
26
1s22s22p6
3d54s1
4 ⅡB
12.某元素的激发态原子的电子排布式为1s2s2p3s3p4s,则该元素基态原子的电子排布式为 ;元素符合为 。
11.R原子的3p轨道上只有一个未成对电子,则R原子可能是 、 ;
X原子在第二能层上只有一个空轨道,则X是 ;
Y原子的核电荷数为33,其外围电子排布是 ,其在元素周期表中的位置是 ,
13.(2007全国卷宁夏考题) 已知A、B、C、D和E 5种分子所含原子数目依次为1、2、3、4和6,且都含有18个电子。又知B、C和D是由两种元素的原子组成。请回答:
(1)组成A分子的原子的核外电子排布式是 ;
(2)B和C的分子式分别是 和 ;
(3)若向D的稀溶液中加入少量二氧化锰,有无色气体生成。则D的分子式是 ,该反应的化学方程式为 ;
(4)若将1mol E在氧气中完全燃烧,只生成1mol CO2和2molH2O,则E的分子式是 。
14.(08年海南)四种元素X、Y、Z、W位于元素周期表的前四周期,已知它们的核电荷数依次增加,且核电荷数之和为51;Y原子的L层p轨道中有2个电子;Z与Y原子的价层电子数相同;W原子的L层电子数与最外层电子数之比为4︰1,其d轨道中的电子数与最外层电子数之比为5︰1。
(1)Y、Z可分别与X形成只含一个中心原子的共价化合物a、b,它们的分子式分别是 、 ;
(2)Y的最高价氧化物和Z的最高价氧化物的晶体类型分别是 晶体、 晶体。
(4)Y与Z,其+2价离子的核外电子排布式是 。
第4讲 元素性质的第变规律(一)
【教学目标】
1、了解同一周期、同一主族中元素第一电离能的变化规律,了解元素电离能和原子核外电子排布的关系。
【教学重点】电离能和原子核外电子排布的关系。
【教学难点】电离能和原子核外电子排布的关系。
【课前检测】
1.下列电子排布式或轨道表示式正确的是
A.C原子的轨道表示式:
B.Ca原子的电子排布式:1s22s22p63s23p63d2
C.N原子的轨道表示式:
D.Br-的电子排布式[Ar] 3d104s24p6
2.写出下列元素的电子排布式:
①Na: ②K: ③Rb:
3.画出下列元素的轨道表示式:
C: Na:
N: Mg:
【教学过程】
一、原子结构与元素周期表
1、在周期表中同一横行的元素原子所含有的 相同。同一纵行 相同。每一个周期总是由 (ns1 )开始到 (ns2np6)结束.如此循环往复,可见元素周期系的形成是由于 的排布发生周期性的重复。
2、随着核电荷数的递增,电子在能级里的填充顺序遵循 原理,不同周期里所含元素种类不一定相同,并且随着周期序号的递增,金属元素的种类也逐渐 ,非金属的种类也逐渐 。
二、元素的分区和族
(1)s 区: , 最后的电子填在 上, 包括 , 属于活泼金属, 为碱金属和碱土金属;
(2)p区:, 最后的电子填在 上, 包括 族元素, 为非金属和少数金属;
(3)d区: , 最后的电子填在 上, 包括 族元素, 为过渡金属;
(4) ds区: , (n-1)d全充满, 最后的电子填在 上, 包括 ,
(5) f区: , 包括 元素
区全是金属元素,非金属元素主要集中 区。主族主要含 区,副族主要含 区,过渡元素主要含 区。
三、元素周期律
1、核外电子排布的周期性变化,
2、元素主要化合价的周期性变化,
3、金属性与非金属性,
4、原子半径的周期性变化
①电子层数:相同条件下,电子层数越多,半径越 。
②核电荷数: 相同条件下,核电荷数越多,半径越 。
③核外电子数:核电荷数相同条件下,核外电子数越多,半径越 。
【例题】:下列化合物中阳离子半径与阴离子半径比值最小的是 ( )
NaF B、MgI2 C、BaI2 D、KBr
四、元素电离能和元素电负性
1、定义:_______________________ ___________单位:
2、分类: 符号
3、元素的第一电离能变化规律
同周期:左→右____________________同主族:上→下___________________
思考:图中哪些元素的第一电离能出现异常?为什么?
4、影响第一电离能的因素
电离能 Na Mg Al
一 496 738 578
二 4562 1451 1817
三 6912 7733 2745
四 9543 10540 11575
5、应用:
1)思考:为什么原子的逐级电离能越来越大?这些数据跟钠、镁、铝的化合价有什么联系?
2)为什么第一电离能同周期左→右会逐渐变大 同主族上→下逐渐变小 与金属性及非金属性变化有何联系
第4讲 元素性质的第变规律(一)作业纸
1、已知1-18号元素的离子aW3+、bX+、cY2-、dZ-都具有相同的电子层结构,下列关系正确的是
A、质子数c>b B、离子的还原性Y2->Z- C、氢化物的稳定性H2Y>HZ D、原子半径X>W
2、下列各组元素性质递变情况错误的是
A 、 Li、Be、B原子最外层电子数依次增多 B 、P、S、Cl元素最高正化合价依次升高
C 、 N、O、F原子半径依次增大 D 、Na、K、Rb的金属性依次增强
3、镭是元素周期表中第七周期的ⅡA族元素。下面关于镭的性质的描述中不正确的是
A、在化合物中呈+2价 B、单质使水分解、放出氢气
C、氢氧化物呈两性 D、碳酸盐难溶于水
4.在下面的电子结构中,第一电离能最小的原子可能是
A. ns2np3 B. ns2np5 C. ns2np4 D. ns2np6
5.下列各组微粒按半径逐渐增大,还原性逐渐增强的顺序排列的是
A 、Na、K、Rb B、F、Cl、Br C、Mg2+、Al2+、Zn2+ D、Cl-、Br-、I-
6.高考资源网1下列叙述正确的是
A.同主族金属的原子半径越大第一电离能越高 B.稀有气体原子序数越大原子半径越大
C.原子的最外层电子数越大越容易得到电子
D.同周期元素的原子半径越小越易失去电子
7.下列关于稀有气体的叙述不正确的是
A.原子的最外电子层都有8个电子
B.其原子与同周期IA、IIA族阳离子具有相同的核外电子排布
C.化学性质非常不活泼D.原子最外层的电子排布为ns2np6
8.下列有关物质性质的比较顺序中,不正确的是
A.热稳定性:HF<HCl<HBr<HI B.微粒半径:K+>Na+>Mg2+>Al3+
C.酸性:HClO4>H2SO4>H3PO4>H2SiO3 D.熔点:Li<Na<K<Rb
9.已知下列元素的原子半径
原子 N S O Si
半径(10-10m) 0.75 1.02 0.74 1.17
根据以上数据,磷原子的半径(10-10m)可能是: A.0.80 B.1.10 C.1.20 D.0.70
10.A、B、C、D、E是同周期的五种主族元素,A和B的最高价氧化物的水化物均呈碱性,且碱性B>A,C和D的气态氢化物的水溶液均显酸性,且酸性C>D,五种元素形成的简单离子中,E离子的半径最小,则它们的原子序数由大到小的顺序为
A. C、D、E、A、B B.E、C、D、A、B
C.A、B、D、C、E D.B、A、E、D、C
11.镭是元素周期表中第ⅡA族元素,下列关于镭的叙述不正确的是
A.镭比钙的金属性更强 B.在化合物中是+2价
C.镭的原子半径比钡的大 D.氢氧化镭呈两性
12.下面各系列中是按电离能增加的顺序排列的
A. C、P、Se B. O、F、Ne C. B、Be、Li D. Li、Na、K
13.以下第二周期各对元素的第一电离能大小次序不正确的是
A. Li<Be B. B<C C.N<O D.F<Ne.
14.下列各组元素原子的第一电离能递增的顺序正确的为
A. Na15.Li、Be、B原子失去一个电子,所需要的能量相差不是很大, 但最难失去第二个电子的原子估计是
A. Li B. Be C.B D. 都相同
题号 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15
答案
班级 姓名 学号 等第
16、概念辨析(填对或错)
1)、每一周期元素中都是以碱金属开始,以稀有气体结束。( )
2)、f区都是副族元素,s区p区都是主族元素 ( )
3)、铝的第一电离能大于K的第一电离能 ( )
4)、20℃时1moLNa失去1moL电子吸收650KJ能量,则Na的第一电离能为650 KJ·moL-1 ( )
17.(07年高考海南化学卷·25) (11分)A、B、C、D、E代表5种元素。请填空:
(1)A元素基态原子的最外层有3个未成对电子,次外层有2个电子,其元素符号为__________;
(2)B元素的负一价离子和C元素的正一价离子的电子层结构都与氩相同,B的元素符号为_______,C的元素符号为______;
(3)D元素的正三价离子的3d亚层为半充满,D的元素符号为_____,其基态原子的电子排布式为____________________。
(4)E元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子,E的元素符号为________,其基态原子的电子排布式为_______________________。
第5讲 元素性质的第变规律(二)
【教学目标】
了解同一周期、同一主族中元素电负性的变化规律,能根据元素电负性说明周期表中元素金属性和非金属性的变化规律。
【教学重点】 电负性的变化规律
【教学难点】电负性的变化规律
【课前检测】
1、(08年海南23).在基态多电子原子中,关于核外电子能量的叙述错误的是:
A.最易失去的电子能量最高 B.电离能最小的电子能量最高
C.p轨道电子能量一定高于s轨道电子能量 D.在离核最近区域内运动的电子能量最低
2.下列元素的第一电离能依次减小的是
A.H、Li、Na、K B.I、Br、Cl、F
C.Na、Mg、Al、Si D.Si、Al、Mg、Na
3.下列说法中正确的是
A.元素周期律的本质是随着核电荷数的增加元素化合价呈周期性的变化
B.核外电子排布的周期性变化是元素性质周期性变化的本质
C.元素周期表中可以把元素分成s、p、d、ds、f五个区
D.最外层电子数≤2的元素一定是金属元素
【教学过程】
一、电负性
1、提出:
2、定义:电负性是用来描述不同元素原子___________________________物理量
3、电负性的变化规律
同一周期,从上到下主族元素的电负性_______________,表明_______________增强
同一主族,从左到右元素的电负性___________________,表明其______________逐渐减弱(非金属性、氧化性)
【思考】:为什么会出现这样的变化
电负性最大的元素是位于周期表______的______,电负性最小的元素是位于周期表______
4.电负性的应用
a.确定元素类型(一般>1.8,非金属元素;<1.8,金属元素).
b.确定化学键类型(两元素电负性差值>1.7,离子键;<1.7,共价键).
c.判断元素价态正负(电负性大的为负价,小的为正价).
d.电负性是判断金属性和非金属性强弱的重要参数(表征原子得电子能力强弱).
【例题1】请查阅下列化合物中元素的电负性值,判断他们哪些是离子化合物,哪些是共价化合物NaF HCl NO MgO KCl CH4
离子化合物: 。
共价化合物: 。
5、对角线法则:位于左上角和右下角性质相似。如:Li与Mg,Be与Al,B与Si
【例题2】:下列各组元素,按原子半径依次减小,元素第一电离能逐渐升高的顺序排列的是
A.K、Na、Li B.N、O、C C.Cl、S、P D.Al、Mg、Na
【例题3】:在下面的电子结构中,第一电离能最小的原子可能是( )
A.ns2np3 B.ns2np5 C.ns2np4 D.ns2np6
【例题4】:已知X、Y元素同周期,且电负性X>Y,下列说法错误的是( )
A.X与Y形成化合物时,X显负价,Y显正价
B.第一电离能可能Y小于X
C.最高价含氧酸的酸性:X对应的酸性弱于Y对应的酸性
D.气态氢化物的稳定性:HmY小于HmX
【例题5】:根据对角线规则,下列物质的性质具有相似性的是 ( )
A、硼和硅 B、铝和铁 C、铍和铝 D、铜和金
【例题6】、已知四种元素的电子排布式为: A.ns2np3 B.ns2np4 C.ns2np5 D.ns2np6
则他们的第一电离能按从大到小的顺序为 ,电负性的大小顺序为 。
【例题7】、在下列空格中,填上适当的元素符号。
(1) 在第3周期中,第一电离能最小的元素是 ,第一电离能最大的元素是 ;
电负性最小的元素是 ,电负性最大的元素是 。 (2)在元素周期表中,第一电离能最小的元素是 ,第一电离能最大的元素是 ;电负性最小的元素是 ,电负性最大的元素是 。(不考虑放射性元素!)
【例题8】、A、B、C、D四种元素,已知A元素是自然界中含量最多的元素;B元素为金属元素,已知它的原子核外K、L层上电子数之和等于M、N层电子数之和;C元素是第3周期第一电离能最小的元素,D元素在第3周期中电负性最大。
(1)试推断A、B、C、D四种元素的名称和符号。
(2)写出上述元素两两化合生成的离子化合物的 化学式。
第5讲 元素性质的第变规律(二)作业纸
1.下列是原子基态的最外层电子排布,其所表示的原子最容易得到电子的是
A.ns2 B.ns2np1 C.ns2np4 D.ns2np5
2.外围电子构型为3d104s1的元素在周期表中应位于
A.第四周期ⅠB族 B.第五周期ⅡB族
C.第四周期ⅦB族 D.第五周期ⅢB族
3、已知X、Y元素同周期,且电负性X>Y,下列说法错误的是
A、X与Y形成化合物是,X可以显负价,Y显正价 B、第一电离能可能Y小于X
C、最高价含氧酸的酸性:X对应的酸性弱于于Y对应的
D、气态氢化物的稳定性:HmY小于HmX
4.对Na、Mg、Al的有关性质的叙述正确的是
A.碱性:NaOHC.电负性:Na>Mg>Al D.还原性:Na>Mg>Al
5、下列不是元素电负性的应用的是 A.判断一种元素是金属还是非金属 B.判断化合物中元素化合价的正负 C.判断化学键的类型 D.判断化合物的溶解度
6、下列各组元素按电负性由大到小顺序排列的是 A. F N O B. O Cl F C. As P H D. Cl S As
题号 1 2 3 4 5 6 7
答案
班级 姓名 学号 答案
7、1932年美国化学家鲍林首先提出了电负性的概念.电负性(用X表示)也是元素的一种重要性质,若 x 越大,其原子吸引电子的能力越强,在所形成的分子中成为带负电荷的一方.下面是某些短周期元素的 x 值:
元素符号 Li Be B C O F Na Al Si P S Cl
x 值 0.98 1.57 2.04 2.55 3.44 3.98 0.93 1.61 1.90 2.19 2.58 3.16
⑴.通过分析 x 值变化规律,确定N、Mg的 x 值范围:
<x (N)< , <x (Mg)< .
⑵.推测x值与原子半径的关系是 ;根据短周期元素的x值变化特点,体现了元素性质的 变化规律.
⑶.某有机化合物结构中含S-N键,其共用电子对偏向 (写原子名称).
⑷.经验规律告诉我们:当成键的两原子相应元素的 x 差值△x>1.7时,一般为离子键,当△ x<1.7时,一般为共价键.试推断AlBr3中化学键类型是 .
⑸.预测周期表中, x 值最小的元素位于 周期 族.(放射性元素除外)
8、下表是元素周期表的一部分。表中所列的字母分别代表某一化学元素。
(1)下列 (填写编号)组元素的单质可能都是电的良导体。
①a、c、h ②b、g、k ③c、h、l ④d、e、f
(2)如果给核外电子足够的能量,这些电子便会摆脱原子核的束缚面离去。核外电子离开该原子或离子所需要的能量主要受两大因素的影响:
1.原子核对核外电子的吸引力 2.形成稳定结构的倾向
下表是一些气态原子失去核外不同电子所需的能量(KJ·mol-):
锂 X Y
失去第一个电子 519 502 580
失去第二个电子 7296 4570 1820
失去第三个电子 11799 6920 2750
失去第四个电子 9550 11600
①通过上述信息和表中的数据分析为什么锂原子失去核外第二个电子时所需的能量要远远大于失去第一个电子所需的能量。
②表中X可能为以上13种元素中的 (填写字母)元素。用元素符号表示X和j形成化合物的化学式 。
③Y是周期表中 族元素。
④以上13种元素中, (填写字母)元素原子失去核外第一个电子需要的能量最多。
9. W、X、Y、Z四种短周期元素的原子序数X>W>Z>Y。W原子的最外层没有p电子,X原子核外s电子与p电子数之比为1∶1,Y原子最外层s电子与p电子数之比为1∶1,Z原子核外电子中p电子数比Y原子多2个。
(1)X元素的单质与Z、Y所形成的化合物反应,其化学方程式:
(2)W、X元素的最高价氧化物对应水化物的碱性强弱为 < (用分子式表示)。
(3)四种元素原子半径的大小为 > > > (填元素符号)
(4)四种元素的电负性由小到大的顺序为 。
(5)这四种元素形成化合物的化学式为离子化合物 ;共价化合物 。
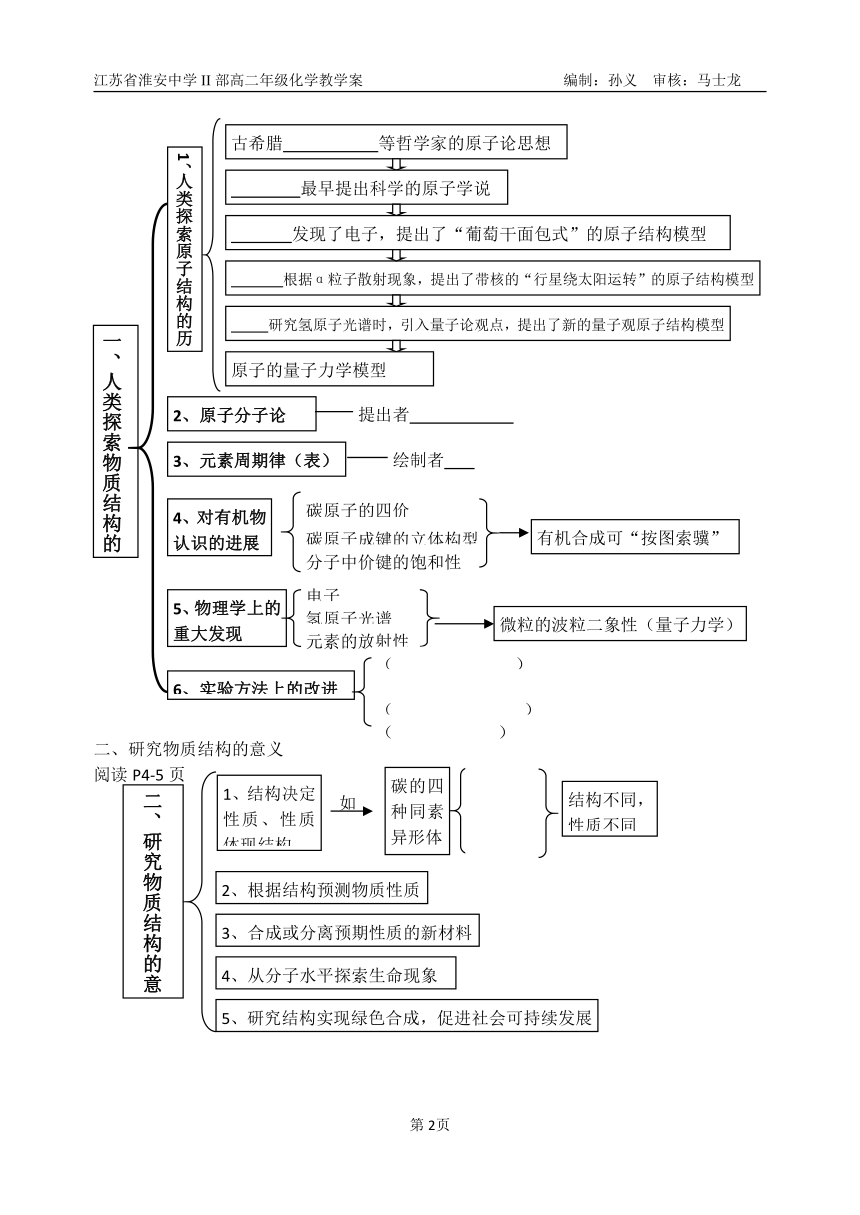
一、人类探索物质结构的历史
2、原子分子论
提出者
3、元素周期律(表)
绘制者
4、对有机物认识的进展
碳原子的四价
碳原子成键的立体构型
分子中价键的饱和性
有机合成可“按图索骥”
5、物理学上的重大发现
电子
氢原子光谱
元素的放射性
微粒的波粒二象性(量子力学)
6、实验方法上的改进
( )
(( )
( )
( )
研究氢原子光谱时,引入量子论观点,提出了新的量子观原子结构模型
根据α粒子散射现象,提出了带核的“行星绕太阳运转”的原子结构模型
古希腊 等哲学家的原子论思想
最早提出科学的原子学说
发现了电子,提出了“葡萄干面包式”的原子结构模型
原子的量子力学模型
1、人类探索原子结构的历史
二、研究物质结构的意义
2、根据结构预测物质性质
3、合成或分离预期性质的新材料
4、从分子水平探索生命现象
5、研究结构实现绿色合成,促进社会可持续发展
如
1、结构决定性质、性质体现结构
结构不同,性质不同
碳的四种同素异形体
PAGE
第20页
第1讲 专题一 揭示物质结构的奥秘
【课标要求】
1.了解人类探索物质结构的历史与价值,认识在分子等层次研究物质的意义。
2.知道物质是由微粒构成的,了解研究物质结构的基本方法和实验手段。
3.初步认识物质的结构与性质之间的关系,知道物质结构的研究有助于发现具有预期性质的新物质。
【教学重点】了解研究物质结构的基本方法和实验手段
【教学难点】了解研究物质结构的基本方法和实验手段
【课前检测】
1.核磁共振(NMR)技术已广泛应用于复杂分子结构的测定和医学诊断等高科技领域。已知质子数或中子数为奇数的原子核才有NMR现象,而质子数和中子数均为偶数的原子不产生核核磁共振,下列原子组一定能产生NMR现象的是( )
A.18 O、31 P、119 Sn B.27 Al、19 F、12 C
C.6C、16S、9F D.1 H、13 C、35 Cl
2、2007年诺贝尔化学奖得主Gerhard Ertl对金属Pt表面催化CO氧化反应的模型进行了深入研究。下列关于Pt的说法正确的是A
A.Pt和Pt的质子数相同,互称为同位素
B.Pt和Pt的中子数相同,互称为同位素
C.Pt和Pt的核外电子数相同,是同一种核素
D.Pt和Pt的质量数不同,不能互称为同位素
【教学过程】
一、人类探索物质结构的历史
阅读课本P2(你知道吗)
1.人类探索物质结构的历史:原子学说、原子分子论、元素周期律的发现、对有机物认识的进展、波粒二象性、量子化学、实验方法上的改进。
2.俄国化学家________________总结出元素周期律:元素的性质随着______的变化而呈现周期性变的化。他排出的第一张元素周期表包含_____种元素。元素周期律从理论上指导了化学元素的发现和应用。
3. 重要关系式:
核电荷数=核内质子数=核外电子数=原子序数
质量数(A)= +
阳离子的核外电子数= 质子数(Z) 阳离子的电荷数
阴离子的核外电子数=质子数(Z) 阴离子的电荷数
质量数(A)≈该同位素的相对原子质量
二、研究物质结构的意义
阅读P4-5页
第1讲 专题一 揭示物质结构的奥秘作业纸
高考资源网1.据报道,某些建筑材料在使用过程中会产生放射性同位素氡 ,从而对人体产生伤害。该同位素原子的中子数和质子数之差是 ( )
A.136 B.50 C.86 D.222
2.核磁共振(NMR)技术已广泛应用于复杂分子结构的测定和医学诊断等高科技领域。已知质子数或中子数为奇数的原子核才有NMR现象,而质子数和中子数均为偶数的原子不产生核核磁共振,下列原子组一定能产生NMR现象的是( )
A.18 O、31 P、119 Sn B.27 Al、19 F、12 C
C.6C、16S、9F D.1 H、13 C、35 Cl
3.X元素的阳离子和Y元素的阴离子具有相同的电子层结构,下列叙述正确的是
A、原子序数X<Y B、原子半径X< Y
C、离子半径X>Y D、原子最外层电子数X<Y
4.X是核外电子数最少的元素,Y是地壳中含量最丰富的元素,Z在地壳中的含量仅次于Y,W可以形成自然界最硬的原子晶体。下列叙述错误的是 ( )
A.WX4是沼气的主要成分 B.固态X2Y是分子晶体
C.ZW是原子晶体 D.ZY2的水溶液俗称“水玻璃”
5、 道尔顿的原子学说在历史上对物质结构理论的发展曾经起了很大作用。他的学说中,包含有下述三个论点:①物质是由原子组成的;②在化学变化中原子是不能再分割的粒子;③原子是很小的实心球体。从现代物质结构的观点看,你认为这三个论点中,不正确的 A.只有③ B.只有①③ C.只有②③ D.有①②③
6.1999年度诺贝尔化学奖授予了开创“飞秒(10-15s)化学”新领域的科学家,使运用激光光谱技术观测化学反应时分子中原子运动成为可能。你认为该技术不能观察到的是
A.原子中原子核的内部结构 B.化学反应中原子的运动
C.化学反应中生成物分子的形成 D.化学反应中反应物分子的分解
7.美国Lawrece Liermore国家实验室(LINL)成功地在高压下将转化为具有类似结构的原子晶体,下列关于的原子晶体说法,正确的是( )
A.的原子晶体和分子晶体互为同分异构体
B.在一定条件下,原子晶体转化为分子晶体是物理变化
C.的原子晶体和分子晶体具有相同的物理性质和化学性质
D.在的原子晶体中,每一个C原子周围结合4个O原子,每一个O原子跟两个C原子相结合
8.最近医学界通过放射性14C标记C60,发现一种C60的羧酸衍生物在特定条件下通过断裂DNA而杀死细胞,从而抑制艾滋病,则有关14C的叙述正确的是 ( )
A.与12C的化学性质不相同 B.与12C的中子数相同
C.是C60的同素异形体 D.与12C互为同位素
9.NaH是—种离子化合物,它跟水反应的方程式为:NaH+H2O = NaOH+H2↑,它也能跟液态氨、乙醇等发生类似的反应,并都产生氢气。下列有关NaH的叙述错误的是
A、NaH中氢负离子的最外层有两个电子B、NaH中H-半径比Li+半径小
C、NaH跟液氨反应时,有NaNH2生成
D、Na原子与H原子结合组成NaH过程中发生了电子转移.
10.在通信网中必不可少的材料是化合物半导体。现在最为普及的化合物半导体有两种,一种是镓砷半导体,它用作便携电话和无线电通信发射微波的零件;另一种化合物半导体由比镓(Ga)多18个电子的元素A和与砷(As)同族且电子层比砷少一层的元素B组成,它是作为通信电缆中光信号转变为电信号的中继器零件。此化合物的化学式为 ( )
A.GaP B.AlP C.GaAs D.InP
11.有人建议将氢元素排在元素周期表的ⅦA族。下列事实能支持这一观点的是 ( )
①H原子得到一个电子达到最外电子层稳定结构;②氢分子的结构式为H—H;③与碱金属元素等形成离子化合物M+[∶H]-;④分子中原子间的化学键都属于非极性键
A.只有①②③ B.只有①③④
C.只有②③④ D.有①②③④
题号 1 2 3 4 5 6 7 8 9 10 11
答案
班级 姓名 学号 等第
17.固体A的化学式为NH5,它的所有原子的最外层都符合相应的稀有气体原子的最外层电子结构。该物质适当加热就分解成两种气体。溶解于水也有气体放出。试回答下列问题:
(1)固体A属于 晶体,它的电子式为
(2)A溶于水后,溶液呈 性(酸、碱或中性),其与水反应的化学方程式是
6.下列这些粒子: O2—、S2— 、Cl— 、Al3+ 、F— 、Na+、Mg2+ 、Ca2+、K+
(1)与氖原子电子排布相同的粒子有____ _________ _。
(2)与氩原子电子排布相同的粒子有________ ____ _____。
18.A、B、C、D是短周期元素,A元素的最高价氧化物的水化物与它的气态氢化物反应得到离子化合物,B原子的最外层电子数是电子层数的3倍, C、D两原子的最外层电子数分别是内层电子总数的一半。C元素是植物生长的营养元素之一,试写出:
⑴ A、B元素形成的A元素最高价化合物的化学式 ;
⑵ D元素的单质与水反应的化学方程式 ;
⑶ A、C元素气态氢化物的稳定性大小 < .(用化学式表示).
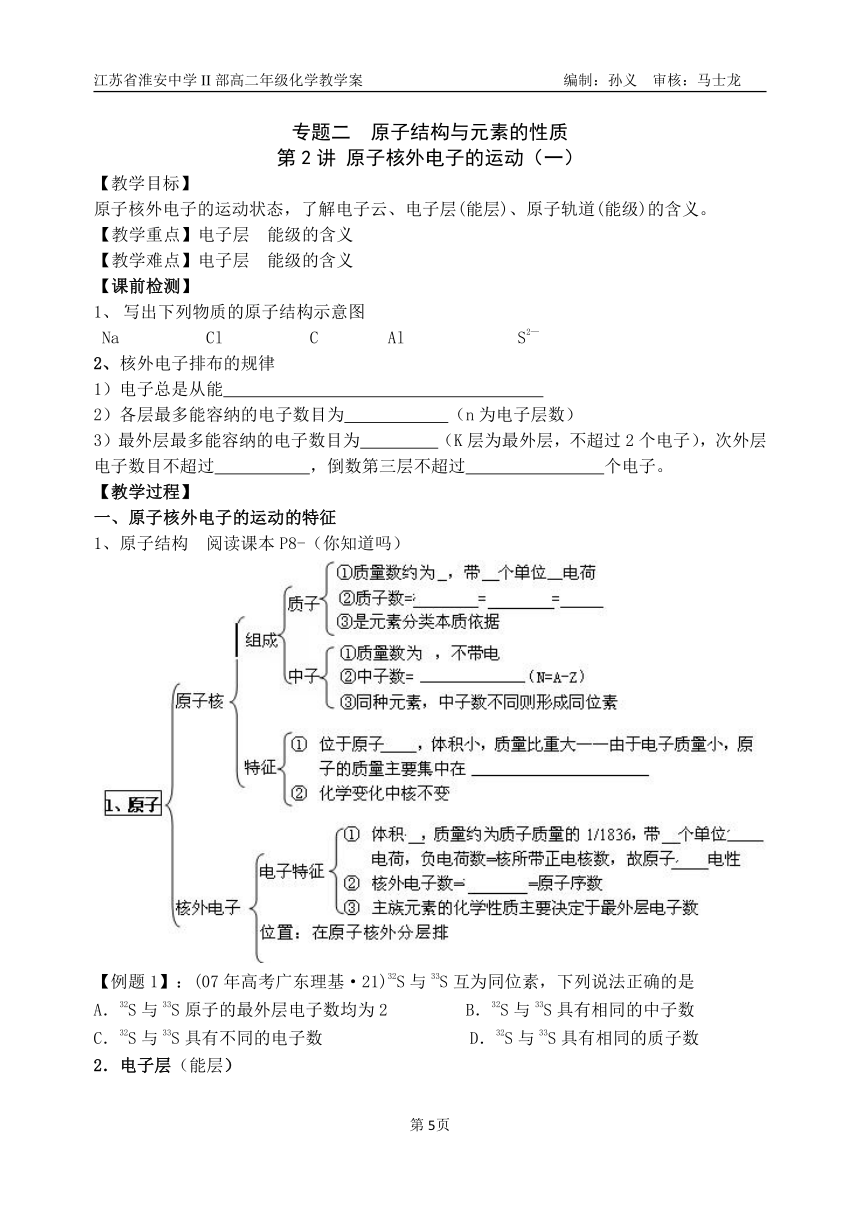
专题二 原子结构与元素的性质
第2讲 原子核外电子的运动(一)
【教学目标】
原子核外电子的运动状态,了解电子云、电子层(能层)、原子轨道(能级)的含义。
【教学重点】电子层 能级的含义
【教学难点】电子层 能级的含义
【课前检测】
写出下列物质的原子结构示意图
Na Cl C Al S2—
2、核外电子排布的规律
1)电子总是从能
2)各层最多能容纳的电子数目为 (n为电子层数)
3)最外层最多能容纳的电子数目为 (K层为最外层,不超过2个电子),次外层电子数目不超过 ,倒数第三层不超过 个电子。
【教学过程】
一、原子核外电子的运动的特征
1、原子结构 阅读课本P8-(你知道吗)
【例题1】:(07年高考广东理基·21)32S与33S互为同位素,下列说法正确的是
A.32S与33S原子的最外层电子数均为2 B.32S与33S具有相同的中子数
C.32S与33S具有不同的电子数 D.32S与33S具有相同的质子数
2.电子层(能层)
(1)在含有多个电子的原子里,由于电子的 各不相同,因此,它们运动的区域也不同,通常能量低的电子在离核 区域运动,而能量高电子在离核较远的区域运动。按原子核外电子能量的差异,将核外电子分为不同的电子层,并用符号 表示。
(2)电子层的表示符号
电子层(n) 一 二 三 四 五 六 七
对应表示符号
3.电子云:电子在核外空间出现机会(概率)多少的形象化描述。
电子运动的特点:①质量极小 ②运动空间极小 ③极高速运动。
电子云的描述:电子在原子核外空间一定范围内出现,可以想象为 笼罩在原子核周围,所以,人们形象地把它叫做“ ”。电子云中的一个小黑点代表 ;电子云密度大的地方,表明 ;
例1.下列关于氢原子电子云图的说法正确的是
A.通常用小黑点来表示电子的多少,黑点密度大,电子数目大
B.黑点密度大,单位体积内电子出现的机会大
C.通常用小黑点来表示电子绕核作高速圆周运动
D.电子云图是对运动无规律性的描述
4.原子轨道:电子出现概率约为90%的空间所形成的电子云轮廓图。
处于同一电子层的原子核外电子,也可以在不同类型的原子轨道上运动,原子轨道用小写的英文字母 、 、 、 表示不同轨道,可容纳的电子数依次是 、 、 、 其中 轨道呈球形;能层序数越大,原子轨道的半径越大。 轨道呈纺锤形,每个p能级有3个原子轨道,他们相互垂直,分别以Px、Py、Pz表示。
5.能层与能级
能级的符号和所能容纳的最多电子数如下:
能 层(n) 一 二 三 四 五 六 七
符 号 K L M N O P Q
能 级(l) 1s 2s 2p 3s 3p 3d 4s 4p 4d 4f 5s … ……
最 多 电 子 数 2 … ……
…… 2n2
例2.下列有关认识正确的是
A.各能级的原子轨道数按s、p、d、f的顺序分别为1、3、5、7
B.各能层含有的电子数为2n2
C.各能层的能级都是从s能级开始至f能级结束 D.各能层含有的能级数为n -1
二、原子轨道能量大小判断
1、各原子轨道能量的高低
阅读课本P12问题解决回答各原子轨道能量的高低
2、原子在轨道上的自旋方向
第2讲 原子核外电子的运动(一)作业纸
一、选择题
1、关于“电子云”的描述中,正确的是
A、一个小黑点表示一个电子 B、一个小黑点代表电子在此出现过一次
C、电子云是带正电的云雾
D、小黑点的疏密表示电子在核外空间单位体积内出现机会的多少
2、下面关于多电子原子核外电子的运动规律的叙述正确的是
A、核外电子是分层运动的 B、所有电子在同一区域里运动
C、能量高的电子在离核近的区域运动 D、能量低的电子在离核低的区域运动
3. 下列有关电子云和原子轨道的说法正确的是
A.原子核外的电子象云雾一样笼罩在原子核周围,故称电子云
B.s能级的原子轨道呈球形,处在该轨道上的电子只能在球壳内运动
C.p能级的原子轨道呈纺锤形,随着能层的增加,p能级原子轨道也在增多
D.与s电子原子轨道相同,p电子原子轨道的平均半径随能层的增大而增大
4.以下对核外电子运动状况的描述正确的是
A.电子的运动与行星相似,围绕原子核在固定的轨道上高速旋转
B.能量低的电子只能在s轨道上运动,能量高的电子总是在f轨道上运动
C.能层序数越大,s原子轨道的半径越大
D.在同一能级上运动的电子,其运动状态肯定不同
5.若n=3,以下能级符号错误的是
A.np B.nf C.nd D. ns
6.图1和图2分别是1s电子的概率概率分布图和原子轨道图。下列有关认识正确的是
A.图1中的每个小黑点表示1个电子
B.图2表示1s电子只能在球体内出现
C.图2表明1s轨道呈圆形,有无数对称轴
D.图1中的小黑点表示某一时刻,电子在核外所处的位置
7.与Ne核外电子排布相同的离子跟与Ar核外电子排布相同的离子形成的化合物是
A. MgBr2 B.Na2S C.KCl D.KF
8、有下列四种轨道:①2s、②2p、③3p、④4d,其中能量最高的是
A. 2s B.2p C.3p D.4d
9.下列有关认识正确的是
A.各能级的原子轨道数按s、p、d、f的顺序分别为1、3、5、7
B.各能层的能级都是从s能级开始至f能级结束
C.各能层含有的能级数为n—1 D.各能层含有的电子数均为2n2
10.按能量由低到高的顺序排列,正确的一组是
A.1s、2p、3d、4s B.1s、2s、3s、2p C.2s、2p、3s、3p D.4p、3d、4s、3p
11. 法国里昂的科学家最近发现一种只由四个中子构成的微粒,这种微粒称为“四中子”,也有人称之为“零号元素”。下列有关“四中子”微粒的说法不正确的是
A.该微粒不显电性 B.该微粒质量数为4
C.与氢元素的质子数相同 D.该微粒质量比氢原子大
12. 最新科技报道,美国夏威夷联合天文中心的科学家发现了新型氢微粒,这种新粒子是由3个氢原子核(只含质子)和2个电子构成,对于这种微粒,下列说法正确的是
A.该微粒为电中性 B.它是氢元素的一种新的同位素
C.它的化学式为H3 D.它比一个普通H2分子多一个氢原子核
13. 在物质结构研究的历史上,根据量子论的观点,首先提出原子核外电子在一系列稳定轨道上运动并较好地解释了氢原子光谱的科学家是w.w.w.g.k.x.x.c.o.m
A.汤姆生 B.卢瑟福 C.道尔顿 D.玻尔
14.下列符号不符合事实的是
A.4s2 B.2p10 C.3d6 D.5f14
15.以s、p、d、f……的排序,各能级可容纳的电子数依次为 ( )
A.1、3、5、7… B.2、6、10、14……C.1、2、3、4…… D.2、4、6、8……
题号 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15
答案
班级 姓名 学号 等第
11.下面是s能级p能级的原子轨道图,试回答问题:
⑴s电子的原子轨道呈 形,每个s能级有 个原子轨道;p电子的原子轨道呈 形,每个p能级有 个原子轨道。
⑵s电子原子轨道、p电子原子轨道的半径与什么因素有关?是什么关系?
12.用“>”“<”或“=”表示下列各组多电子原子的原子轨道能量的高低
⑴3s 3p ⑵2px 2py ⑶3s 3d ⑷4s 3p
13.填表:各电子层包含的原子轨道数目和可容纳的电子数
电子层 原子轨道类型 原子轨道类型数目 可容纳的电子数目
1
2
3 3s,3p,3d 9 18
4
n ——————
第3讲 原子核外电子的运动(二)
【教学目标】多电子原子中核外电子分层排布遵循的原理,能用电子排布式表示常见元素(1~36号)原子核外电子的排布。
【教学重点】原子核外电子排布得规律
【教学难点】原子核外电子排布得规律
【课前检测】
1.下列能级的能量大小比较,正确的是
A.E(4s)>E(3d) B.E(6p)>E(5f) C.E(6s)<E(5p) D.E(4d)<E(5p)
2、写出下列符号中数字的含义:
1s2:1___________ 、2 _____________;3d6:3_______________ 、6 ________________;
3、12.若某基态原子的外围电子排布为4d15s2,则下列说法正确的是
A.该元素基态原子中共有3个电子 B.该元素原子核外有5个电子层
C.该元素原子最外层共有3个电子 D.该元素原子M能层共有8个电子
4、.以下能级符号正确的是
A. 6s B.2d C.3f D.7p
【教学过程】
一.构造原理:基态原子电子排布式
1、电子能级顺序:1s 2s2p 3s3p 4s3d4p 5s4d5p 6s4f5d6p 7s5f6d7p …ns (n-2)f (n-1)d np
构造原理揭示了原子核外电子的能级分布。不同能层的能级有交错现象,
如E(3d)>E(4s)、E(4d)>E(5s)、E(5d)>E(6s)、E(6d)>E(7s)、E(4f)>E(5p)等。
二:基态原子核外电子排布遵循的原则
1.能量最低原理:电子先占据能量低的轨道,再依次进入能量高的轨道.
2.泡利不相容原理:每个轨道最多容纳两个自旋状态不同的电子.
3.洪特规则:在能量相同的轨道上排布时,电子尽可能分占不同的轨道,且自旋状态相同.
洪特规则的特例:在等价轨道的全充满(p6、d10、f14)、半充满(p3、d5、f7)、全空时(p0、d0、f0)的状态,具有较低的能量和较大的稳定性。
【例题1】.电子排布在同一能级时,总是 A.优先单独占据不同轨道,且自旋方向相同B.优先单独占据不同轨道且自旋方向相反
C.自由配对,优先占据同一轨道,且自旋方向相同
D.自由配对,优先占据同一轨道,且自旋方向相反
【例题2】.“各能级最多容纳的电子数,是该能级原子轨道数的二倍”,支撑这一结论的理论是
A.构造原理 B.泡利原理 C.洪特规则 D.能量最低原理
【例题3】.基态碳原子的最外能层的各能级中,电子排布的方式正确的是
A B C D
4、原子核外电子的表示方式
(1)、原子核外电子的排布式
如:Na:1s22s22p63s1,能级符号上面数字是该能级上的电子数。也可以简写:
如11Na [Ne] 3s1 如24Cr [Ar]3d54s1 、 29Cu [Ar]3d104s1.
【例题4】.下列各原子或离子的电子排布式错误的是
A Al 1s22s22p63s23p1 B O2- 1s22s22p6
C Na+ 1s22s22p6 D Si 1s22s22p2
【例题5】:写出下列原子的电子排布式。
19K 24Cr 26Fe3+
35Br 29Cu 25Mn2+-
(2)核外电子的轨道式
【例题6】:写出下列原子的轨道表示式。
6C 13Al
【例题7】.下列关于价电子构型为3s23p4的粒子描述正确的是
A.它的元素符号为O B.它的核外电子排布式为1s22s22p63s23p4
C.它可与H2生成液态化合物 D.其电子排布图为:
1s 2s 2p 3s 3p
三、基态 激发态 光谱
1.基态: 能量状态。如处于最低能量状态的原子称为基态原子。
2.激发态: 能量状态(相对基态而言)。如基态原子的电子吸收能量后,电子跃迁至较高能级成为激发态原子。
3.基态与激发态相互转化的能量转化的关系
基态原子 激发态原子
4.光谱:
【例题8】.下列电子排布中,原子处于激发状态的是
A.1s22s22p5 B. 1s22s22p43s2 C. 1s22s22p63s23p63d44s2 D. 1s22s22p63s23p63d34s2
【例题9】:当碳原子的核外电子排布由 转变为 时,下列说法正确的是
A.碳原子由基态变为激发态 B.碳原子由激发态变为基态
C.碳原子要从外界环境中吸收能量 D.碳原子要向外界环境释放能量
2、现有x、y、z三种元素的原子,电子最后排布在相同的能级组上,而且y的核电荷比x大12个单位,z的质子数比y多4个。1摩尔的x同酸反应能置换出1克氢气,这时x转化为具有氩原子型电子层结构的离子。
(1)判断x、y、z各为何种元素?(2)写出x原子、y的阳离子、z的阴离子的电子排布式。
第3讲 原子核外电子的运动(二)作业纸
1.下列说法中正确的是
A 所有的电子在同一区域里运动
B 能量高的电子在离核远的区域运动,能量低的电子在离核近的区域运动
C 处于最低能量的原子叫基态原子
D 同一原子中,1s、2s、3s所能容纳的电子数越来越多
2.一个电子排布为1s22s22p63s23p1的元素最可能的价态是
A +1 B +2 C +3 D -1
3.下列表达方式错误的是
A 甲烷的电子式 B 氟化钠的电子式
C 硫离子的核外电子排布式 1s22s22p63s23p4 D 碳-12原子 C
4.下图中,能正确表示基态硅原子的是
A B C D
5.具有下列电子排布式的原子中,半径最大的是
A ls22s22p63s23p1 B 1s22s22p3
C 1s22s2sp2 D 1s22s22p63s23p4
6.当镁原子由1s22s22p63s2 →1s22s22p63p2时,以下认识正确的是
A.镁原子由基态转化成激发态,这一过程中吸收能量
B.镁原子由激发态转化成基态,这一过程中释放能量
C.转化后位于p能级上的两个电子处于同一轨道,且自旋方向相同
D.转化后镁原子与硅原子电子层结构相同,化学性质相似
7.以下基态原子的电子排布式不符合构造原理的是
A.1s22s22p63s23p63d74s2 B.1s22s22p63s23p63d54s1
C.1s22s22p63s23p63d104s2 4p1 D.1s22s22p63s23p64s2
8.下列粒子中,电子排布式为1s22s22p63s23p6的有
A.Sc3+ B.Mg2+ C.Cl— D.Br—
9.若某基态原子的外围电子排布为4d15s2,则下列说法正确的是
A.该元素基态原子中共有3个电子 B.该元素原子核外有5个电子层
C.该元素原子最外层共有3个电子 D.该元素原子M能层共有8个电子
题号 1 2 3 4 5 6 7 8 9
答案
班级 姓名 学号 等第
10.(1)砷原子的最外层电子排布式是4s24p3,在元素周期表中,砷元素位于__________
周期 族;最高价氧化物的化学式为 ,砷酸钠的化学式是 .
(2)已知下列元素在周期表中的位置,写出它们最外层电子构型和元素符号:
①第4周期ⅣB族 ;
②第4周期ⅦA族 .
11.按所示格式填写下表:
原子序数 电子排布式 价层电子排布 周期 族
26
1s22s22p6
3d54s1
4 ⅡB
12.某元素的激发态原子的电子排布式为1s2s2p3s3p4s,则该元素基态原子的电子排布式为 ;元素符合为 。
11.R原子的3p轨道上只有一个未成对电子,则R原子可能是 、 ;
X原子在第二能层上只有一个空轨道,则X是 ;
Y原子的核电荷数为33,其外围电子排布是 ,其在元素周期表中的位置是 ,
13.(2007全国卷宁夏考题) 已知A、B、C、D和E 5种分子所含原子数目依次为1、2、3、4和6,且都含有18个电子。又知B、C和D是由两种元素的原子组成。请回答:
(1)组成A分子的原子的核外电子排布式是 ;
(2)B和C的分子式分别是 和 ;
(3)若向D的稀溶液中加入少量二氧化锰,有无色气体生成。则D的分子式是 ,该反应的化学方程式为 ;
(4)若将1mol E在氧气中完全燃烧,只生成1mol CO2和2molH2O,则E的分子式是 。
14.(08年海南)四种元素X、Y、Z、W位于元素周期表的前四周期,已知它们的核电荷数依次增加,且核电荷数之和为51;Y原子的L层p轨道中有2个电子;Z与Y原子的价层电子数相同;W原子的L层电子数与最外层电子数之比为4︰1,其d轨道中的电子数与最外层电子数之比为5︰1。
(1)Y、Z可分别与X形成只含一个中心原子的共价化合物a、b,它们的分子式分别是 、 ;
(2)Y的最高价氧化物和Z的最高价氧化物的晶体类型分别是 晶体、 晶体。
(4)Y与Z,其+2价离子的核外电子排布式是 。
第4讲 元素性质的第变规律(一)
【教学目标】
1、了解同一周期、同一主族中元素第一电离能的变化规律,了解元素电离能和原子核外电子排布的关系。
【教学重点】电离能和原子核外电子排布的关系。
【教学难点】电离能和原子核外电子排布的关系。
【课前检测】
1.下列电子排布式或轨道表示式正确的是
A.C原子的轨道表示式:
B.Ca原子的电子排布式:1s22s22p63s23p63d2
C.N原子的轨道表示式:
D.Br-的电子排布式[Ar] 3d104s24p6
2.写出下列元素的电子排布式:
①Na: ②K: ③Rb:
3.画出下列元素的轨道表示式:
C: Na:
N: Mg:
【教学过程】
一、原子结构与元素周期表
1、在周期表中同一横行的元素原子所含有的 相同。同一纵行 相同。每一个周期总是由 (ns1 )开始到 (ns2np6)结束.如此循环往复,可见元素周期系的形成是由于 的排布发生周期性的重复。
2、随着核电荷数的递增,电子在能级里的填充顺序遵循 原理,不同周期里所含元素种类不一定相同,并且随着周期序号的递增,金属元素的种类也逐渐 ,非金属的种类也逐渐 。
二、元素的分区和族
(1)s 区: , 最后的电子填在 上, 包括 , 属于活泼金属, 为碱金属和碱土金属;
(2)p区:, 最后的电子填在 上, 包括 族元素, 为非金属和少数金属;
(3)d区: , 最后的电子填在 上, 包括 族元素, 为过渡金属;
(4) ds区: , (n-1)d全充满, 最后的电子填在 上, 包括 ,
(5) f区: , 包括 元素
区全是金属元素,非金属元素主要集中 区。主族主要含 区,副族主要含 区,过渡元素主要含 区。
三、元素周期律
1、核外电子排布的周期性变化,
2、元素主要化合价的周期性变化,
3、金属性与非金属性,
4、原子半径的周期性变化
①电子层数:相同条件下,电子层数越多,半径越 。
②核电荷数: 相同条件下,核电荷数越多,半径越 。
③核外电子数:核电荷数相同条件下,核外电子数越多,半径越 。
【例题】:下列化合物中阳离子半径与阴离子半径比值最小的是 ( )
NaF B、MgI2 C、BaI2 D、KBr
四、元素电离能和元素电负性
1、定义:_______________________ ___________单位:
2、分类: 符号
3、元素的第一电离能变化规律
同周期:左→右____________________同主族:上→下___________________
思考:图中哪些元素的第一电离能出现异常?为什么?
4、影响第一电离能的因素
电离能 Na Mg Al
一 496 738 578
二 4562 1451 1817
三 6912 7733 2745
四 9543 10540 11575
5、应用:
1)思考:为什么原子的逐级电离能越来越大?这些数据跟钠、镁、铝的化合价有什么联系?
2)为什么第一电离能同周期左→右会逐渐变大 同主族上→下逐渐变小 与金属性及非金属性变化有何联系
第4讲 元素性质的第变规律(一)作业纸
1、已知1-18号元素的离子aW3+、bX+、cY2-、dZ-都具有相同的电子层结构,下列关系正确的是
A、质子数c>b B、离子的还原性Y2->Z- C、氢化物的稳定性H2Y>HZ D、原子半径X>W
2、下列各组元素性质递变情况错误的是
A 、 Li、Be、B原子最外层电子数依次增多 B 、P、S、Cl元素最高正化合价依次升高
C 、 N、O、F原子半径依次增大 D 、Na、K、Rb的金属性依次增强
3、镭是元素周期表中第七周期的ⅡA族元素。下面关于镭的性质的描述中不正确的是
A、在化合物中呈+2价 B、单质使水分解、放出氢气
C、氢氧化物呈两性 D、碳酸盐难溶于水
4.在下面的电子结构中,第一电离能最小的原子可能是
A. ns2np3 B. ns2np5 C. ns2np4 D. ns2np6
5.下列各组微粒按半径逐渐增大,还原性逐渐增强的顺序排列的是
A 、Na、K、Rb B、F、Cl、Br C、Mg2+、Al2+、Zn2+ D、Cl-、Br-、I-
6.高考资源网1下列叙述正确的是
A.同主族金属的原子半径越大第一电离能越高 B.稀有气体原子序数越大原子半径越大
C.原子的最外层电子数越大越容易得到电子
D.同周期元素的原子半径越小越易失去电子
7.下列关于稀有气体的叙述不正确的是
A.原子的最外电子层都有8个电子
B.其原子与同周期IA、IIA族阳离子具有相同的核外电子排布
C.化学性质非常不活泼D.原子最外层的电子排布为ns2np6
8.下列有关物质性质的比较顺序中,不正确的是
A.热稳定性:HF<HCl<HBr<HI B.微粒半径:K+>Na+>Mg2+>Al3+
C.酸性:HClO4>H2SO4>H3PO4>H2SiO3 D.熔点:Li<Na<K<Rb
9.已知下列元素的原子半径
原子 N S O Si
半径(10-10m) 0.75 1.02 0.74 1.17
根据以上数据,磷原子的半径(10-10m)可能是: A.0.80 B.1.10 C.1.20 D.0.70
10.A、B、C、D、E是同周期的五种主族元素,A和B的最高价氧化物的水化物均呈碱性,且碱性B>A,C和D的气态氢化物的水溶液均显酸性,且酸性C>D,五种元素形成的简单离子中,E离子的半径最小,则它们的原子序数由大到小的顺序为
A. C、D、E、A、B B.E、C、D、A、B
C.A、B、D、C、E D.B、A、E、D、C
11.镭是元素周期表中第ⅡA族元素,下列关于镭的叙述不正确的是
A.镭比钙的金属性更强 B.在化合物中是+2价
C.镭的原子半径比钡的大 D.氢氧化镭呈两性
12.下面各系列中是按电离能增加的顺序排列的
A. C、P、Se B. O、F、Ne C. B、Be、Li D. Li、Na、K
13.以下第二周期各对元素的第一电离能大小次序不正确的是
A. Li<Be B. B<C C.N<O D.F<Ne.
14.下列各组元素原子的第一电离能递增的顺序正确的为
A. Na
A. Li B. Be C.B D. 都相同
题号 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15
答案
班级 姓名 学号 等第
16、概念辨析(填对或错)
1)、每一周期元素中都是以碱金属开始,以稀有气体结束。( )
2)、f区都是副族元素,s区p区都是主族元素 ( )
3)、铝的第一电离能大于K的第一电离能 ( )
4)、20℃时1moLNa失去1moL电子吸收650KJ能量,则Na的第一电离能为650 KJ·moL-1 ( )
17.(07年高考海南化学卷·25) (11分)A、B、C、D、E代表5种元素。请填空:
(1)A元素基态原子的最外层有3个未成对电子,次外层有2个电子,其元素符号为__________;
(2)B元素的负一价离子和C元素的正一价离子的电子层结构都与氩相同,B的元素符号为_______,C的元素符号为______;
(3)D元素的正三价离子的3d亚层为半充满,D的元素符号为_____,其基态原子的电子排布式为____________________。
(4)E元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子,E的元素符号为________,其基态原子的电子排布式为_______________________。
第5讲 元素性质的第变规律(二)
【教学目标】
了解同一周期、同一主族中元素电负性的变化规律,能根据元素电负性说明周期表中元素金属性和非金属性的变化规律。
【教学重点】 电负性的变化规律
【教学难点】电负性的变化规律
【课前检测】
1、(08年海南23).在基态多电子原子中,关于核外电子能量的叙述错误的是:
A.最易失去的电子能量最高 B.电离能最小的电子能量最高
C.p轨道电子能量一定高于s轨道电子能量 D.在离核最近区域内运动的电子能量最低
2.下列元素的第一电离能依次减小的是
A.H、Li、Na、K B.I、Br、Cl、F
C.Na、Mg、Al、Si D.Si、Al、Mg、Na
3.下列说法中正确的是
A.元素周期律的本质是随着核电荷数的增加元素化合价呈周期性的变化
B.核外电子排布的周期性变化是元素性质周期性变化的本质
C.元素周期表中可以把元素分成s、p、d、ds、f五个区
D.最外层电子数≤2的元素一定是金属元素
【教学过程】
一、电负性
1、提出:
2、定义:电负性是用来描述不同元素原子___________________________物理量
3、电负性的变化规律
同一周期,从上到下主族元素的电负性_______________,表明_______________增强
同一主族,从左到右元素的电负性___________________,表明其______________逐渐减弱(非金属性、氧化性)
【思考】:为什么会出现这样的变化
电负性最大的元素是位于周期表______的______,电负性最小的元素是位于周期表______
4.电负性的应用
a.确定元素类型(一般>1.8,非金属元素;<1.8,金属元素).
b.确定化学键类型(两元素电负性差值>1.7,离子键;<1.7,共价键).
c.判断元素价态正负(电负性大的为负价,小的为正价).
d.电负性是判断金属性和非金属性强弱的重要参数(表征原子得电子能力强弱).
【例题1】请查阅下列化合物中元素的电负性值,判断他们哪些是离子化合物,哪些是共价化合物NaF HCl NO MgO KCl CH4
离子化合物: 。
共价化合物: 。
5、对角线法则:位于左上角和右下角性质相似。如:Li与Mg,Be与Al,B与Si
【例题2】:下列各组元素,按原子半径依次减小,元素第一电离能逐渐升高的顺序排列的是
A.K、Na、Li B.N、O、C C.Cl、S、P D.Al、Mg、Na
【例题3】:在下面的电子结构中,第一电离能最小的原子可能是( )
A.ns2np3 B.ns2np5 C.ns2np4 D.ns2np6
【例题4】:已知X、Y元素同周期,且电负性X>Y,下列说法错误的是( )
A.X与Y形成化合物时,X显负价,Y显正价
B.第一电离能可能Y小于X
C.最高价含氧酸的酸性:X对应的酸性弱于Y对应的酸性
D.气态氢化物的稳定性:HmY小于HmX
【例题5】:根据对角线规则,下列物质的性质具有相似性的是 ( )
A、硼和硅 B、铝和铁 C、铍和铝 D、铜和金
【例题6】、已知四种元素的电子排布式为: A.ns2np3 B.ns2np4 C.ns2np5 D.ns2np6
则他们的第一电离能按从大到小的顺序为 ,电负性的大小顺序为 。
【例题7】、在下列空格中,填上适当的元素符号。
(1) 在第3周期中,第一电离能最小的元素是 ,第一电离能最大的元素是 ;
电负性最小的元素是 ,电负性最大的元素是 。 (2)在元素周期表中,第一电离能最小的元素是 ,第一电离能最大的元素是 ;电负性最小的元素是 ,电负性最大的元素是 。(不考虑放射性元素!)
【例题8】、A、B、C、D四种元素,已知A元素是自然界中含量最多的元素;B元素为金属元素,已知它的原子核外K、L层上电子数之和等于M、N层电子数之和;C元素是第3周期第一电离能最小的元素,D元素在第3周期中电负性最大。
(1)试推断A、B、C、D四种元素的名称和符号。
(2)写出上述元素两两化合生成的离子化合物的 化学式。
第5讲 元素性质的第变规律(二)作业纸
1.下列是原子基态的最外层电子排布,其所表示的原子最容易得到电子的是
A.ns2 B.ns2np1 C.ns2np4 D.ns2np5
2.外围电子构型为3d104s1的元素在周期表中应位于
A.第四周期ⅠB族 B.第五周期ⅡB族
C.第四周期ⅦB族 D.第五周期ⅢB族
3、已知X、Y元素同周期,且电负性X>Y,下列说法错误的是
A、X与Y形成化合物是,X可以显负价,Y显正价 B、第一电离能可能Y小于X
C、最高价含氧酸的酸性:X对应的酸性弱于于Y对应的
D、气态氢化物的稳定性:HmY小于HmX
4.对Na、Mg、Al的有关性质的叙述正确的是
A.碱性:NaOH
5、下列不是元素电负性的应用的是 A.判断一种元素是金属还是非金属 B.判断化合物中元素化合价的正负 C.判断化学键的类型 D.判断化合物的溶解度
6、下列各组元素按电负性由大到小顺序排列的是 A. F N O B. O Cl F C. As P H D. Cl S As
题号 1 2 3 4 5 6 7
答案
班级 姓名 学号 答案
7、1932年美国化学家鲍林首先提出了电负性的概念.电负性(用X表示)也是元素的一种重要性质,若 x 越大,其原子吸引电子的能力越强,在所形成的分子中成为带负电荷的一方.下面是某些短周期元素的 x 值:
元素符号 Li Be B C O F Na Al Si P S Cl
x 值 0.98 1.57 2.04 2.55 3.44 3.98 0.93 1.61 1.90 2.19 2.58 3.16
⑴.通过分析 x 值变化规律,确定N、Mg的 x 值范围:
<x (N)< , <x (Mg)< .
⑵.推测x值与原子半径的关系是 ;根据短周期元素的x值变化特点,体现了元素性质的 变化规律.
⑶.某有机化合物结构中含S-N键,其共用电子对偏向 (写原子名称).
⑷.经验规律告诉我们:当成键的两原子相应元素的 x 差值△x>1.7时,一般为离子键,当△ x<1.7时,一般为共价键.试推断AlBr3中化学键类型是 .
⑸.预测周期表中, x 值最小的元素位于 周期 族.(放射性元素除外)
8、下表是元素周期表的一部分。表中所列的字母分别代表某一化学元素。
(1)下列 (填写编号)组元素的单质可能都是电的良导体。
①a、c、h ②b、g、k ③c、h、l ④d、e、f
(2)如果给核外电子足够的能量,这些电子便会摆脱原子核的束缚面离去。核外电子离开该原子或离子所需要的能量主要受两大因素的影响:
1.原子核对核外电子的吸引力 2.形成稳定结构的倾向
下表是一些气态原子失去核外不同电子所需的能量(KJ·mol-):
锂 X Y
失去第一个电子 519 502 580
失去第二个电子 7296 4570 1820
失去第三个电子 11799 6920 2750
失去第四个电子 9550 11600
①通过上述信息和表中的数据分析为什么锂原子失去核外第二个电子时所需的能量要远远大于失去第一个电子所需的能量。
②表中X可能为以上13种元素中的 (填写字母)元素。用元素符号表示X和j形成化合物的化学式 。
③Y是周期表中 族元素。
④以上13种元素中, (填写字母)元素原子失去核外第一个电子需要的能量最多。
9. W、X、Y、Z四种短周期元素的原子序数X>W>Z>Y。W原子的最外层没有p电子,X原子核外s电子与p电子数之比为1∶1,Y原子最外层s电子与p电子数之比为1∶1,Z原子核外电子中p电子数比Y原子多2个。
(1)X元素的单质与Z、Y所形成的化合物反应,其化学方程式:
(2)W、X元素的最高价氧化物对应水化物的碱性强弱为 < (用分子式表示)。
(3)四种元素原子半径的大小为 > > > (填元素符号)
(4)四种元素的电负性由小到大的顺序为 。
(5)这四种元素形成化合物的化学式为离子化合物 ;共价化合物 。
一、人类探索物质结构的历史
2、原子分子论
提出者
3、元素周期律(表)
绘制者
4、对有机物认识的进展
碳原子的四价
碳原子成键的立体构型
分子中价键的饱和性
有机合成可“按图索骥”
5、物理学上的重大发现
电子
氢原子光谱
元素的放射性
微粒的波粒二象性(量子力学)
6、实验方法上的改进
( )
(( )
( )
( )
研究氢原子光谱时,引入量子论观点,提出了新的量子观原子结构模型
根据α粒子散射现象,提出了带核的“行星绕太阳运转”的原子结构模型
古希腊 等哲学家的原子论思想
最早提出科学的原子学说
发现了电子,提出了“葡萄干面包式”的原子结构模型
原子的量子力学模型
1、人类探索原子结构的历史
二、研究物质结构的意义
2、根据结构预测物质性质
3、合成或分离预期性质的新材料
4、从分子水平探索生命现象
5、研究结构实现绿色合成,促进社会可持续发展
如
1、结构决定性质、性质体现结构
结构不同,性质不同
碳的四种同素异形体
PAGE
第20页
