2020-2021学年高一化学人教版必修2 第二章 第二节 化学能与电能 练习
文档属性
| 名称 | 2020-2021学年高一化学人教版必修2 第二章 第二节 化学能与电能 练习 |
|
|
| 格式 | docx | ||
| 文件大小 | 444.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-04-07 00:00:00 | ||
图片预览




文档简介
化学能与电能练习
一、单选题
下列四个常用电化学装置的叙述错误的是(?)
A. 图 I所示电池中,电子从锌片流出
B. 图 II所示干电池中石墨作负极
C. 图 III所示电池为二次电池
D. 图 IV所示电池中正极反应为:O2+?4H++?4e-=?2H2O
不久前,美国一个海军航空站安装了一台250?kW的MCFC型燃料电池,该电池可同时供应电和水蒸气,其工作温度为600~700??C,所用燃料为H2,电解质为熔融的K2CO3,已知该电池的总反应为2H2+O2=2H2O,负极反应为H2+CO32--2e-=H2O+CO2,则下列推断正确的是(??? )
A. 正极反应为4OH-=O2+2H2O+4e-
B. 放电时CO32-向负极移动
C. 电池供应1?mol水蒸气,转移的电子数为4?mol
D. 放电时CO32-向正极移动
圣路易斯大学研制的新型乙醇燃料电池,使用能传递质子(H+)的介质作溶剂,反应原理为?C2H5OH+3O2→2CO2+3H2O,下图是该电池的示意图,下列说法正确的是(????)
A. a极为电池的正极
B. 电池工作时,电流由a极沿导线经灯泡再到b极
C. 电池正极的电极反应为:4H++O2+4e-=2H2O
D. 电池工作时,1mol?乙醇被氧化,则电路中有?6mol?电子转移
用片、片、溶液设计一个原电池。有关该原电池的叙述不正确的是
A. 正极反应式为
B. 由该原电池的工作原理不能比较、的金属活动性强弱
C. 其他条件不变时,将片改为片,电路中通过等量电子时,片溶解的质量大于片
D. 其他条件不变时,将溶液改为溶液,负极电极反应式为
一种新型燃料电池,它以多孔镍板为电极,两电极插入KOH溶液中,向两极分别通入乙烷和氧气,其电极反应式为,。有关此电池的推断正确的是(??? )
A. 电池工作过程中,溶液的pH逐渐减小
B. 正极与负极上参加反应的气体的物质的量之比为2:7
C. 通入乙烷的电极为正极
D. 电解质溶液中的向正极移动
?某科学探究小组为探究电化学原理,设计了如图所示的装置进行探究实验。下列对实验中观察到的现象或相关结论的叙述错误的是(? ? ?)
A. a和b不连接时,该装置不能形成原电池,铁片上有红色的铜析出
B. 无论a和b是否连接,铁片均会被氧化,溶液中均有Fe2+生成
C. a和b用导线连接时,铜片为负极,发生的反应为Cu2++2e-=Cu
D. a和b用导线连接时,溶液中的Cu2+向铜电极移动
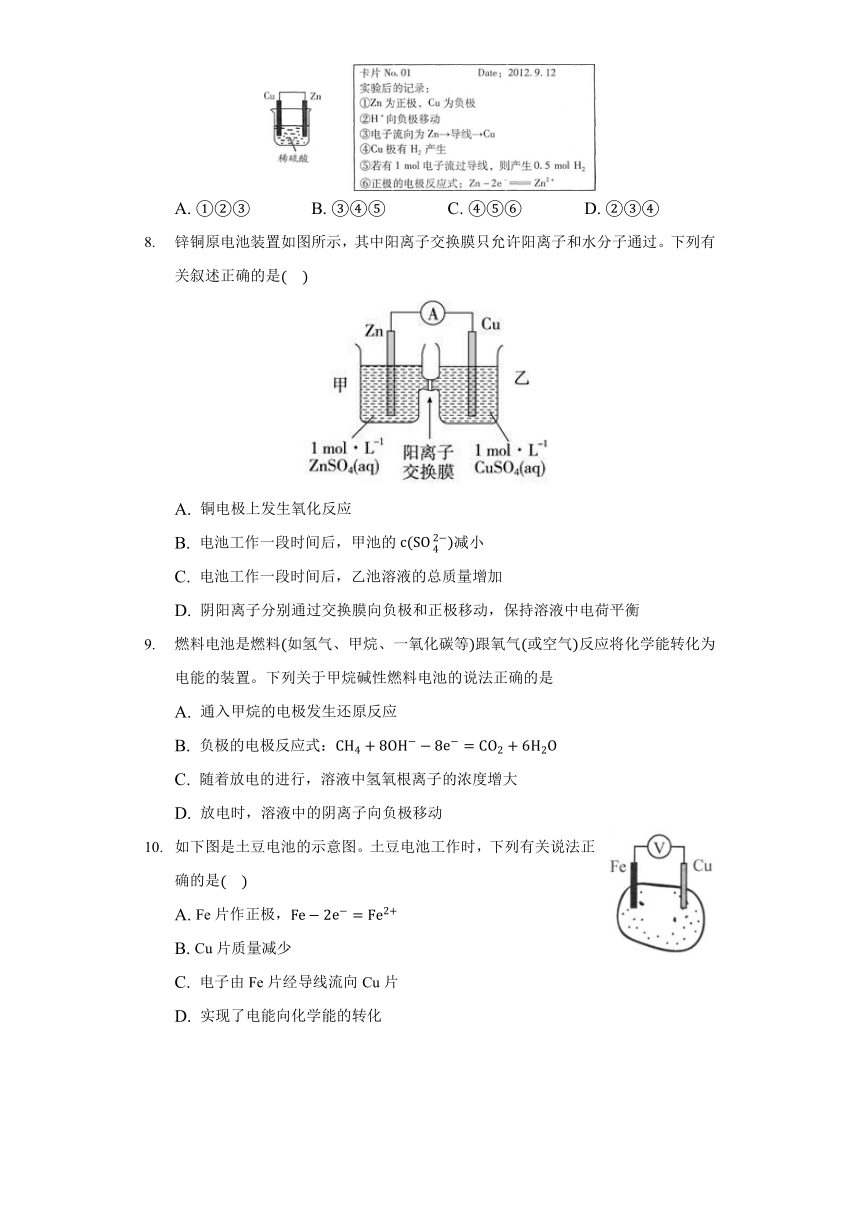
某化学兴趣小组用下图所示装置做完实验后,在卡片上记下了如下6条记录,其中合理的是(????)
A. ①②③ B. ③④⑤ C. ④⑤⑥ D. ②③④
锌铜原电池装置如图所示,其中阳离子交换膜只允许阳离子和水分子通过。下列有关叙述正确的是(????)
A. 铜电极上发生氧化反应
B. 电池工作一段时间后,甲池的c(SO?42-)减小
C. 电池工作一段时间后,乙池溶液的总质量增加
D. 阴阳离子分别通过交换膜向负极和正极移动,保持溶液中电荷平衡
燃料电池是燃料(如氢气、甲烷、一氧化碳等)跟氧气(或空气)反应将化学能转化为电能的装置。下列关于甲烷碱性燃料电池的说法正确的是
A. 通入甲烷的电极发生还原反应
B. 负极的电极反应式:CH4+8OH--8e-=CO2+6H2O
C. 随着放电的进行,溶液中氢氧根离子的浓度增大
D. 放电时,溶液中的阴离子向负极移动
如下图是土豆电池的示意图。土豆电池工作时,下列有关说法正确的是(????)
A. Fe片作正极,Fe-2e-=Fe2+
B. Cu片质量减少
C. 电子由Fe片经导线流向Cu片
D. 实现了电能向化学能的转化
以海水为电解质的Mg-AgCl电池在军事上可用作电动鱼雷的电源,其电池反应离子方程式为:2AgCl+Mg=Mg2++2Ag+2Cl-。该电池工作时,下列说法正确的是(??? )
A. 正、负极的质量均减少 B. AgCl电极发生氧化反应
C. 电子由AgCl经外电路流向Mg D. 实现了电能向化学能的转化
如图甲是一种在微生物作用下将废水中的尿素CO(NH2)2转化为对环境友好的气体物质,实现化学能转化为电能的装置,并利用甲、乙两装置实现在铁上镀铜。下列说法中不正确的是
A. 乙装置中溶液颜色不变
B. 铜电极应与Y相连接
C. M电极反应式:CO(NH2)2+H2O-6e-=CO2↑+N2↑+6H+
D. 当N电极消耗0.25?mol气体时,铜电极质量减少16?g
二、填空题
有一种微型电池,其电极分别为Zn和Ag2O,电解质溶液是KOH溶液,试回答下列问题:
(1)原电池是把________能转化成__________能的装置。
(2)该电池中Zn极为________极。
(3)当金属Zn消耗了16.25?g时,转移电子的物质的量为__________。
市场上出售的“热敷袋”的主要成分为铁屑、炭粉、木屑、少量氯化钠和水等。“热敷袋”启用前用塑料袋使其与空气隔绝,启用后,打开塑料袋轻轻揉搓就会放出热量。使用完后,会发现有大量铁锈。
(1)“热敷袋”是利用________放出热量。
(2)炭粉的主要作用是________________________________________________。
(3)加入氯化钠的主要作用是________________________________。
(4)木屑的作用是________________。
利用下列反应:Fe+2Fe3+=3Fe2+设计一个原电池,请选择适当的材料和试剂.
(1)请写出你选用的正极材料、负极材料、电解质溶液(写化学式):负极为______,正极为______,电解质溶液:______.
(2)负极反应式:______;正极反应式:______.
(3)溶液中Fe3+向______极移动,电子从______极流向______极.
现有如下两个反应:(A)NaOH+HCl=NaCl+H2O?(B)2FeCl3+Cu=2FeCl2+CuCl2
(1)根据两反应本质,判断能否设计成原电池(填“能”或“不能”)
(A)__________________,(B)__________________。
(2)如果(A或B)不能,说明其原因_______________________________。
(3)如果(A或B)可以,指出正、负极的电极材料,并写出电极反应式
负极:材料:________;电极反应式:______________________________;
正极:材料:________;电极反应式:________________________________
三、实验题
现提供纯锌片、纯铜片和500?mL?0.4?mol·L-1H2SO4溶液、导线、1000?mL量筒,试用如图装置测定锌和稀硫酸反应时在某段时间内通过导线的电子的物质的量。
(1)如图所示,装置气密性良好,且1000?mL量筒中已充满了水,刚开始实验时,首先要_______________________。
(2)a电极材料为_________,其电极反应为_________________。b电极材料为_________,其电极反应为__________________。
(3)当量筒中收集到672?mL气体时(已折算为标准状况下),通过导线的电子的物质的量为_________。
某小组拟探究双氧水和铁离子的氧化性强弱,设计如下实验装置。
注明:盐桥为饱和KCl溶液和琼脂,烧杯中溶液均为100?mL。
(1)用30%双氧水配制10%的双氧水需要使用的玻璃仪器有__________________(填名称)。已知:30%双氧水的密度约为1.1?g·cm-3,该双氧水溶液的物质的量浓度约为_________(结果保留1位小数)。
(2)关闭K,电流计显示电子由石墨极流出经外电路流入铂极。盐桥中阳离子向_________极(填“石墨”或“铂”)迁移。负极反应式为____________。若忽略体积变化和盐类水解,电路上转移0.005?mol电子,则c(FeCl3)________(填“净增”或“净减”)________mol·L-1。
(3)一段时间后,向石墨极烧杯中加入适量30%双氧水和硫酸,电流计显示:电子由铂极流入石墨极。此时,铂极是_______________(填“正极”或“负极”)。
(4)结合上述(2)、(3)实验现象,可以得出结论是__________________________________。
答案和解析
1.【答案】B
【解答】
A.图 I所示电池中,Zn为负极,电子从锌片流出,故A正确;
B.图 II所示干电池中铜帽作负极,该电池反应中二氧化锰得到电子被还原,石墨为原电池的正极,故 B错误;
C.图 III所示电池为二次电池,即可充电的电池,故 C正确;
D.图 IV所示电池为氢氧燃料中正极反应为:O2+?4H+?+?4e-?=?2H2O,故 D正确。
2.【答案】B
【解答】
在该燃料电池中,燃料在负极失电子发生氧化反应,氧气在正极得电子发生氧化反应,根据反应中电子的转移与反应物的关系求转移电子的物质的量;在电池内部阴离子向负极移动,阳离子向正极移动,据此进行分析。
A.该燃料电池燃料为H2,电解质为熔融的K2CO3,总反应为2H2+O2=2H2O,负极反应为2H2+2CO32--4e-=2H2O+2CO2,用总反应减负极得正极反应式:O2+2CO2+4e-=2CO32-,故A错误;
B.在电池内部阴离子向负极移动,所以电池工作时,CO32-移向负极,故B正确;
C.根据总反应2H2+O2=2H2O,H2中H由零价变为H2O中H+1价,转移2个电子,每生成2mol?H2O,转移4mol电子,故C错误;
D.放电时CO32-向负极移动,故D错误。
故选B。
3.【答案】C
【解析】解:由质子的移动方向可知a为负极,a极上是乙醇失电子发生氧化反应,电极反应式为C2H5OH+3H2O-12e-=2CO2+12H+,b为正极,发生还原反应,电极反应式为4H++O2+4e-=2H2O,以此解答该题。
A.原电池工作时,阳离子向正极移动,则a为负极,故A错误;
B.电池工作时,电流由正极经外电路流向负极,在该电池中由b极流向a极,故B错误;
C.正极氧气得到电子被还原,电极反应式为4H++O2+4e-=2H2O,故C正确;
D.C2H5OH+3H2O-12e-=2CO2+12H+,则电池工作时,1mol乙醇被氧化时就有12mol电子转移,故D错误。
4.【答案】B
【解答】
A.Cu片、Al片、Cu(NO3)2溶液构成的原电池,金属铝活泼性强于金属铜,所以金属铝是负极,金属铜是正极,铜离子发生得电子的还原反应,正极反应为Cu2++2e-=Cu,故A正确;
B.Cu片、Al片、Cu(NO3)2溶液构成的原电池,金属铝活泼性强于金属铜,所以金属铝是负极,由该原电池工作原理能比较Cu、Al的金属活动性大小,故B错误;
C.Cu片、Al片、Cu(NO3)2溶液构成的原电池,金属铝活泼性强于金属铜,所以金属铝是负极,发生失电子的氧化反应Al-3e-=Al3+,条件不变,将Al片改为Zn片,金属锌是负极,此时负极反应:Zn-2e-=Zn2+,通过等量电子时,如为6mol电子转移,Zn片溶解质量是195g,Al片溶解质量是54g,Zn的大于Al的,故C正确;
D.其他条件不变,将Cu(NO3)2溶液改为FeCl3溶液,金属铝活泼性强于金属铜,所以金属铝是负极,负极电极反应为Al-3e-=Al3+,故D正确。
5.【答案】A
【解答】
A.电池工作过程中,电池总反应为2C2H6+8OH-+7O2=4CO32-+10H2O,反应消耗OH-离子,溶液的pH值逐渐减小,故A正确;
B.由电池总反应为2C2H6+8OH-+7O2=4CO32-+10H2O可知,原电池中两极上转移的电子相等,当有28mol电子转移时,正极上消耗7molO2,负极上消耗2molC2H6,正极与负极上参加反应的气体的物质的量之比为7:2,故B错误;
C.通入氧气的一极为原电池的正极,发生还原反应,通乙烷的电极为负极,发生氧化反应,故C错误;
D.电池工作过程中,阴离子向负极移动,则电解质溶液中OH-向负极移动,故D错误。
故选A。
6.【答案】C
A.?a和b不连接时,没有形成闭合回路,没有构成原电池,发生铁把铜置换出来的化学反应,A项正确;
B.无论a和b是否连接,铁片均会被氧化,溶液中均有Fe2+生成,B项正确;
C.导线连接后,构成原电池,铁比铜活泼,铁作负极,发生的反应为Fe-2e-=Fe2+,C项错误;
D.导线连接后,构成原电池,铁比铜活泼,铁作负极,铜作正极,阳离子向正极移动,D项正确;
7.【答案】B
【解答】
Cu、Zn、稀硫酸构成的原电池中,自发的氧化还原反应是锌和硫酸的反应,金属锌失电子为负极,电极反应式:Zn-2e-=Zn2+,金属铜为正极,电解质中的氢离子移向该电极,在该极得电子,电极反应式为:2H++2e-=H2↑,当有1mol电子流过导线时,则会产生氢气0.5mol,电子由锌电极经导线到达铜电极,和电流的方向相反,所以③④⑤正确。
8.【答案】C
【解答】
A.由图象可知,该原电池反应式为:Zn+Cu2+=Zn2++Cu,Zn为负极,发生氧化反应,Cu为正极,发生还原反应,故A错误;?
B.阳离子交换膜只允许阳离子和水分子通过,故甲池中c(SO42-)不变,故B错误;?
C.甲池中的Zn2+通过阳离子交换膜进入乙池,乙池中发生反应:Cu2++2e-=Cu,保持溶液呈电中性,进入乙池的Zn2+与放电的Cu2+的物质的量相等,而Zn的摩尔质量大于Cu,故乙池溶液总质量增大,故C正确;?
D.甲池中的Zn2+通过阳离子交换膜进入乙池,以保持溶液电荷守恒,阴离子不能通过阳离子交换膜,故D错误。?
故选C。
9.【答案】D
【解答】
甲烷碱性燃料电池中,通入甲烷燃料的电极失电子发生氧化反应,电极反应式为:CH4+10OH--8e-=CO32-+7H2O,所以为负极,通入氧化剂的电极得电子发生还原反应,电极反应式为:2O2+4H2O+8e-=8OH-,所以为正极;电池总反应式为2O2+CH4+2OH-=CO32-+3H2O,根据总反应式判断溶液的pH变化,由电子的流向,判断溶液中离子的移动方向。
A.甲烷碱性燃料电池中,通入燃料甲烷的电极失去电子,发生氧化反应,故A错误;
B.燃料电池中,通入燃料的电极为负极,负极上失电子发生氧化反应,甲烷失电子生成二氧化碳和水,二氧化碳能和碱反应生成碳酸盐和水,所以负极电极反应式为:CH4+10OH--8e-=CO32-+7H2O,故B错误;
C.该电池的反应式为2O2+CH4+2OH-=CO32-+3H2O,消耗了溶液中的氢氧根离子,且有溶剂水生成,导致溶液中氢氧根离子的浓度降低,故C错误;
D.放电时,溶液中的阳离子移向正极,阴离子移向负极,故D正确。
故选D。
10.【答案】C
【解答】
A.该原电池中,Fe的活泼性比Cu强,Fe作负极,故A错误;
B.铜作为正极材料,起导电作用,不参与反应,铜片质量不变,故B错误;
C.原电池中电子从负极出发经导线到正极,Fe作负极,铜作正极,电子从Fe沿导线流向Cu,故C正确;
D.形成原电池反应,原电池是化学能转化为电能的装置,故D错误。
11.【答案】A
12.【答案】D
【解答】
甲装置是将化学能转化为电能的原电池,由甲图可知,M是负极,N是正极,电解质溶液为酸性溶液,负极上失电子发生氧化反应,正极上得电子发生还原反应,在铁上镀铜,则铁为阴极应与负极相连,铜为阳极应与正极相连,
A.在铁上镀铜,则铁为阴极应与负极相连,铜为阳极应与正极相连,电解质的浓度不会发生变化,所以颜色不变,故A正确;
B.原电池中M是负极、N是正极,Y为正极接线柱,铁上镀铜,则铁为阴极、应与负极相连,铜为阳极、应与正极接线柱Y相连,故B正确;
C.CO(NH2)2在负极M上失电子发生氧化反应,生成N2、CO2,结合电荷守恒得到电极反应式为CO(NH2)2+H2O-6e-=CO2↑+N2↑+6H+,故C正确;
D.当N电极消耗0.25mol氧气时,则转移0.25mol×4=1.0mol电子,所以铜电极质量减少64g/mol×1.0mol2=32g,故D错误。
13.【答案】(1)化学;电;
(2)负;
(3)0.5?mol。
【解答】
(1)原电池是把化学能转化成电能的装置,故答案为:化学;电;
(2)该电池中Zn极发生氧化反应,为负极,故答案为:负;
(3)当金属Zn消耗了16.25?g时,Zn变为+2价,所以n(Zn)=16.2565=0.25mol,所以转移电子0.5mol,故转移电子的物质的量为0.5?mol,故答案为:0.5?mol。
14.【答案】(1)铁被氧化
(2)与铁和氯化钠溶液构成原电池,铁作负极,炭粉作正极,加速铁屑的氧化
(3)溶于水形成电解质溶液?
(4)均匀散热
【解答】
(1)由题可知反应后铁变为铁锈,所以热敷袋主要是利用铁被氧化放出热量,
故答案为:铁被氧化;
(2)加入的碳粉与铁屑、NaCl溶液构成原电池,炭粉作电池的正极,加速铁屑的氧化,
故答案为:与铁和氯化钠溶液构成原电池,铁作负极,炭粉作正极,加速铁屑的氧化;
(3)氯化钠溶于水,形成电解质溶液,构成原电池,
故答案为:溶于水形成电解质溶液;
(4)木屑主要是使热敷袋均匀散热,
故答案为:均匀散热。
15.【答案】(1)Fe;碳棒; ??FeCl3??
(2)Fe-2e-=Fe2+;Fe3++e-=Fe2+??
(3)正;负;正
【解答】
(1)负极发生氧化反应,所以负极为Fe;正极发生还原反应,所以正极为碳棒;电解质溶液是:FeCI3;
(2)依据原电池的工作原理可得,负极反应式是:Fe-2e-=Fe2+;
正极反应式是:2Fe3++2e-=2Fe2+;
(3)溶液中Fe3+向正极移动,电子从负极流向正极。
16.【答案】不能;能;A反应不是氧化还原反应,无电子转移;铜,Cu-2e-=Cu2+;碳,2Fe3++2e-=2Fe2+
【解答】
(1)(A)NaOH+HCl=NaCl+H2O中,没有元素的化合价变化,为非氧化还原反应,无电子转移,不能设计成原电池;
(B)2FeCl3+Cu=2FeCl2+CuCl2中,Fe、Cu元素的化合价变化,为氧化还原反应,则B能设计为原电池,
故答案为:不能;能;
(2)A没有元素的化合价变化,为非氧化还原反应,无电子转移;
(3)2FeCl3+Cu=2FeCl2+CuCl2中,Cu失去电子,Fe得到电子,则负极为铜,负极反应为Cu-2e-=Cu2+;正极为碳棒,正极反应为2Fe3++2e-=2Fe2+,
故答案为:铜;Cu-2e-=Cu2+;碳;2Fe3++2e-=2Fe2+。
17.【答案】(1)用导线把a、b两电极连接起来
(2)纯锌片;Zn-2e-=Zn2+;纯铜片;2H++2e-=H2↑
(3)0.06?mol
【解答】
(1)根据图示装置,要想求得电子转移的量,需要设计成锌、铜、硫酸原电池,量取金属锌和硫酸反应产生氢气的体积,根据原电池的构成条件,所以首先要用导线把a、b两电极连接起来。
(2)锌、铜、硫酸原电池中,纯锌片是负极,电极反应:Zn-2e-=Zn2+;铜是正极,该极上电极反应为:2H++2e-=H2↑。
(3)正极上电极反应为:2H++2e-=H2↑,当量筒中收集到672mL气体的物质的量为672mL22400mL=0.03mol氢气时,转移电子是0.06mol。
18.【答案】(1)烧杯、量筒、玻璃棒? ;9.7?mol·L-1
(2)铂;?H2O2-2e-=2H++O2↑;净减; 0.05
(3)负极
(4)较弱酸性条件,Fe3+氧化性比H2O2强;较强酸性条件下,H2O2氧化性比Fe3+强
【解答】
(1)稀释一定质量分数的溶液需要量筒、烧杯和玻璃棒,根据物质的量浓度与质量分数之间的转换关系式,双氧水溶液的物质的量浓度为c=1000ρ?ωM=1000×1.1×0.334mol?L-1=9.7 mol?L-1,
故答案为:烧杯、量筒、玻璃棒? ;9.7?mol·L-1;
(2)在原电池中,电子由负极流向正极,依题意,石墨极为负极,铂极为正极,盐桥中钾离子由负极向正极迁移,以维持电荷守恒。双氧水在负极上发生氧化反应生成O2,溶液酸性增强,其正极反应式为Fe3++e-=Fe2+,电路上转移0.005?mol电子,故净减浓度为0.005 mol0.1 L=0.05 mol?L-1,
一、单选题
下列四个常用电化学装置的叙述错误的是(?)
A. 图 I所示电池中,电子从锌片流出
B. 图 II所示干电池中石墨作负极
C. 图 III所示电池为二次电池
D. 图 IV所示电池中正极反应为:O2+?4H++?4e-=?2H2O
不久前,美国一个海军航空站安装了一台250?kW的MCFC型燃料电池,该电池可同时供应电和水蒸气,其工作温度为600~700??C,所用燃料为H2,电解质为熔融的K2CO3,已知该电池的总反应为2H2+O2=2H2O,负极反应为H2+CO32--2e-=H2O+CO2,则下列推断正确的是(??? )
A. 正极反应为4OH-=O2+2H2O+4e-
B. 放电时CO32-向负极移动
C. 电池供应1?mol水蒸气,转移的电子数为4?mol
D. 放电时CO32-向正极移动
圣路易斯大学研制的新型乙醇燃料电池,使用能传递质子(H+)的介质作溶剂,反应原理为?C2H5OH+3O2→2CO2+3H2O,下图是该电池的示意图,下列说法正确的是(????)
A. a极为电池的正极
B. 电池工作时,电流由a极沿导线经灯泡再到b极
C. 电池正极的电极反应为:4H++O2+4e-=2H2O
D. 电池工作时,1mol?乙醇被氧化,则电路中有?6mol?电子转移
用片、片、溶液设计一个原电池。有关该原电池的叙述不正确的是
A. 正极反应式为
B. 由该原电池的工作原理不能比较、的金属活动性强弱
C. 其他条件不变时,将片改为片,电路中通过等量电子时,片溶解的质量大于片
D. 其他条件不变时,将溶液改为溶液,负极电极反应式为
一种新型燃料电池,它以多孔镍板为电极,两电极插入KOH溶液中,向两极分别通入乙烷和氧气,其电极反应式为,。有关此电池的推断正确的是(??? )
A. 电池工作过程中,溶液的pH逐渐减小
B. 正极与负极上参加反应的气体的物质的量之比为2:7
C. 通入乙烷的电极为正极
D. 电解质溶液中的向正极移动
?某科学探究小组为探究电化学原理,设计了如图所示的装置进行探究实验。下列对实验中观察到的现象或相关结论的叙述错误的是(? ? ?)
A. a和b不连接时,该装置不能形成原电池,铁片上有红色的铜析出
B. 无论a和b是否连接,铁片均会被氧化,溶液中均有Fe2+生成
C. a和b用导线连接时,铜片为负极,发生的反应为Cu2++2e-=Cu
D. a和b用导线连接时,溶液中的Cu2+向铜电极移动
某化学兴趣小组用下图所示装置做完实验后,在卡片上记下了如下6条记录,其中合理的是(????)
A. ①②③ B. ③④⑤ C. ④⑤⑥ D. ②③④
锌铜原电池装置如图所示,其中阳离子交换膜只允许阳离子和水分子通过。下列有关叙述正确的是(????)
A. 铜电极上发生氧化反应
B. 电池工作一段时间后,甲池的c(SO?42-)减小
C. 电池工作一段时间后,乙池溶液的总质量增加
D. 阴阳离子分别通过交换膜向负极和正极移动,保持溶液中电荷平衡
燃料电池是燃料(如氢气、甲烷、一氧化碳等)跟氧气(或空气)反应将化学能转化为电能的装置。下列关于甲烷碱性燃料电池的说法正确的是
A. 通入甲烷的电极发生还原反应
B. 负极的电极反应式:CH4+8OH--8e-=CO2+6H2O
C. 随着放电的进行,溶液中氢氧根离子的浓度增大
D. 放电时,溶液中的阴离子向负极移动
如下图是土豆电池的示意图。土豆电池工作时,下列有关说法正确的是(????)
A. Fe片作正极,Fe-2e-=Fe2+
B. Cu片质量减少
C. 电子由Fe片经导线流向Cu片
D. 实现了电能向化学能的转化
以海水为电解质的Mg-AgCl电池在军事上可用作电动鱼雷的电源,其电池反应离子方程式为:2AgCl+Mg=Mg2++2Ag+2Cl-。该电池工作时,下列说法正确的是(??? )
A. 正、负极的质量均减少 B. AgCl电极发生氧化反应
C. 电子由AgCl经外电路流向Mg D. 实现了电能向化学能的转化
如图甲是一种在微生物作用下将废水中的尿素CO(NH2)2转化为对环境友好的气体物质,实现化学能转化为电能的装置,并利用甲、乙两装置实现在铁上镀铜。下列说法中不正确的是
A. 乙装置中溶液颜色不变
B. 铜电极应与Y相连接
C. M电极反应式:CO(NH2)2+H2O-6e-=CO2↑+N2↑+6H+
D. 当N电极消耗0.25?mol气体时,铜电极质量减少16?g
二、填空题
有一种微型电池,其电极分别为Zn和Ag2O,电解质溶液是KOH溶液,试回答下列问题:
(1)原电池是把________能转化成__________能的装置。
(2)该电池中Zn极为________极。
(3)当金属Zn消耗了16.25?g时,转移电子的物质的量为__________。
市场上出售的“热敷袋”的主要成分为铁屑、炭粉、木屑、少量氯化钠和水等。“热敷袋”启用前用塑料袋使其与空气隔绝,启用后,打开塑料袋轻轻揉搓就会放出热量。使用完后,会发现有大量铁锈。
(1)“热敷袋”是利用________放出热量。
(2)炭粉的主要作用是________________________________________________。
(3)加入氯化钠的主要作用是________________________________。
(4)木屑的作用是________________。
利用下列反应:Fe+2Fe3+=3Fe2+设计一个原电池,请选择适当的材料和试剂.
(1)请写出你选用的正极材料、负极材料、电解质溶液(写化学式):负极为______,正极为______,电解质溶液:______.
(2)负极反应式:______;正极反应式:______.
(3)溶液中Fe3+向______极移动,电子从______极流向______极.
现有如下两个反应:(A)NaOH+HCl=NaCl+H2O?(B)2FeCl3+Cu=2FeCl2+CuCl2
(1)根据两反应本质,判断能否设计成原电池(填“能”或“不能”)
(A)__________________,(B)__________________。
(2)如果(A或B)不能,说明其原因_______________________________。
(3)如果(A或B)可以,指出正、负极的电极材料,并写出电极反应式
负极:材料:________;电极反应式:______________________________;
正极:材料:________;电极反应式:________________________________
三、实验题
现提供纯锌片、纯铜片和500?mL?0.4?mol·L-1H2SO4溶液、导线、1000?mL量筒,试用如图装置测定锌和稀硫酸反应时在某段时间内通过导线的电子的物质的量。
(1)如图所示,装置气密性良好,且1000?mL量筒中已充满了水,刚开始实验时,首先要_______________________。
(2)a电极材料为_________,其电极反应为_________________。b电极材料为_________,其电极反应为__________________。
(3)当量筒中收集到672?mL气体时(已折算为标准状况下),通过导线的电子的物质的量为_________。
某小组拟探究双氧水和铁离子的氧化性强弱,设计如下实验装置。
注明:盐桥为饱和KCl溶液和琼脂,烧杯中溶液均为100?mL。
(1)用30%双氧水配制10%的双氧水需要使用的玻璃仪器有__________________(填名称)。已知:30%双氧水的密度约为1.1?g·cm-3,该双氧水溶液的物质的量浓度约为_________(结果保留1位小数)。
(2)关闭K,电流计显示电子由石墨极流出经外电路流入铂极。盐桥中阳离子向_________极(填“石墨”或“铂”)迁移。负极反应式为____________。若忽略体积变化和盐类水解,电路上转移0.005?mol电子,则c(FeCl3)________(填“净增”或“净减”)________mol·L-1。
(3)一段时间后,向石墨极烧杯中加入适量30%双氧水和硫酸,电流计显示:电子由铂极流入石墨极。此时,铂极是_______________(填“正极”或“负极”)。
(4)结合上述(2)、(3)实验现象,可以得出结论是__________________________________。
答案和解析
1.【答案】B
【解答】
A.图 I所示电池中,Zn为负极,电子从锌片流出,故A正确;
B.图 II所示干电池中铜帽作负极,该电池反应中二氧化锰得到电子被还原,石墨为原电池的正极,故 B错误;
C.图 III所示电池为二次电池,即可充电的电池,故 C正确;
D.图 IV所示电池为氢氧燃料中正极反应为:O2+?4H+?+?4e-?=?2H2O,故 D正确。
2.【答案】B
【解答】
在该燃料电池中,燃料在负极失电子发生氧化反应,氧气在正极得电子发生氧化反应,根据反应中电子的转移与反应物的关系求转移电子的物质的量;在电池内部阴离子向负极移动,阳离子向正极移动,据此进行分析。
A.该燃料电池燃料为H2,电解质为熔融的K2CO3,总反应为2H2+O2=2H2O,负极反应为2H2+2CO32--4e-=2H2O+2CO2,用总反应减负极得正极反应式:O2+2CO2+4e-=2CO32-,故A错误;
B.在电池内部阴离子向负极移动,所以电池工作时,CO32-移向负极,故B正确;
C.根据总反应2H2+O2=2H2O,H2中H由零价变为H2O中H+1价,转移2个电子,每生成2mol?H2O,转移4mol电子,故C错误;
D.放电时CO32-向负极移动,故D错误。
故选B。
3.【答案】C
【解析】解:由质子的移动方向可知a为负极,a极上是乙醇失电子发生氧化反应,电极反应式为C2H5OH+3H2O-12e-=2CO2+12H+,b为正极,发生还原反应,电极反应式为4H++O2+4e-=2H2O,以此解答该题。
A.原电池工作时,阳离子向正极移动,则a为负极,故A错误;
B.电池工作时,电流由正极经外电路流向负极,在该电池中由b极流向a极,故B错误;
C.正极氧气得到电子被还原,电极反应式为4H++O2+4e-=2H2O,故C正确;
D.C2H5OH+3H2O-12e-=2CO2+12H+,则电池工作时,1mol乙醇被氧化时就有12mol电子转移,故D错误。
4.【答案】B
【解答】
A.Cu片、Al片、Cu(NO3)2溶液构成的原电池,金属铝活泼性强于金属铜,所以金属铝是负极,金属铜是正极,铜离子发生得电子的还原反应,正极反应为Cu2++2e-=Cu,故A正确;
B.Cu片、Al片、Cu(NO3)2溶液构成的原电池,金属铝活泼性强于金属铜,所以金属铝是负极,由该原电池工作原理能比较Cu、Al的金属活动性大小,故B错误;
C.Cu片、Al片、Cu(NO3)2溶液构成的原电池,金属铝活泼性强于金属铜,所以金属铝是负极,发生失电子的氧化反应Al-3e-=Al3+,条件不变,将Al片改为Zn片,金属锌是负极,此时负极反应:Zn-2e-=Zn2+,通过等量电子时,如为6mol电子转移,Zn片溶解质量是195g,Al片溶解质量是54g,Zn的大于Al的,故C正确;
D.其他条件不变,将Cu(NO3)2溶液改为FeCl3溶液,金属铝活泼性强于金属铜,所以金属铝是负极,负极电极反应为Al-3e-=Al3+,故D正确。
5.【答案】A
【解答】
A.电池工作过程中,电池总反应为2C2H6+8OH-+7O2=4CO32-+10H2O,反应消耗OH-离子,溶液的pH值逐渐减小,故A正确;
B.由电池总反应为2C2H6+8OH-+7O2=4CO32-+10H2O可知,原电池中两极上转移的电子相等,当有28mol电子转移时,正极上消耗7molO2,负极上消耗2molC2H6,正极与负极上参加反应的气体的物质的量之比为7:2,故B错误;
C.通入氧气的一极为原电池的正极,发生还原反应,通乙烷的电极为负极,发生氧化反应,故C错误;
D.电池工作过程中,阴离子向负极移动,则电解质溶液中OH-向负极移动,故D错误。
故选A。
6.【答案】C
A.?a和b不连接时,没有形成闭合回路,没有构成原电池,发生铁把铜置换出来的化学反应,A项正确;
B.无论a和b是否连接,铁片均会被氧化,溶液中均有Fe2+生成,B项正确;
C.导线连接后,构成原电池,铁比铜活泼,铁作负极,发生的反应为Fe-2e-=Fe2+,C项错误;
D.导线连接后,构成原电池,铁比铜活泼,铁作负极,铜作正极,阳离子向正极移动,D项正确;
7.【答案】B
【解答】
Cu、Zn、稀硫酸构成的原电池中,自发的氧化还原反应是锌和硫酸的反应,金属锌失电子为负极,电极反应式:Zn-2e-=Zn2+,金属铜为正极,电解质中的氢离子移向该电极,在该极得电子,电极反应式为:2H++2e-=H2↑,当有1mol电子流过导线时,则会产生氢气0.5mol,电子由锌电极经导线到达铜电极,和电流的方向相反,所以③④⑤正确。
8.【答案】C
【解答】
A.由图象可知,该原电池反应式为:Zn+Cu2+=Zn2++Cu,Zn为负极,发生氧化反应,Cu为正极,发生还原反应,故A错误;?
B.阳离子交换膜只允许阳离子和水分子通过,故甲池中c(SO42-)不变,故B错误;?
C.甲池中的Zn2+通过阳离子交换膜进入乙池,乙池中发生反应:Cu2++2e-=Cu,保持溶液呈电中性,进入乙池的Zn2+与放电的Cu2+的物质的量相等,而Zn的摩尔质量大于Cu,故乙池溶液总质量增大,故C正确;?
D.甲池中的Zn2+通过阳离子交换膜进入乙池,以保持溶液电荷守恒,阴离子不能通过阳离子交换膜,故D错误。?
故选C。
9.【答案】D
【解答】
甲烷碱性燃料电池中,通入甲烷燃料的电极失电子发生氧化反应,电极反应式为:CH4+10OH--8e-=CO32-+7H2O,所以为负极,通入氧化剂的电极得电子发生还原反应,电极反应式为:2O2+4H2O+8e-=8OH-,所以为正极;电池总反应式为2O2+CH4+2OH-=CO32-+3H2O,根据总反应式判断溶液的pH变化,由电子的流向,判断溶液中离子的移动方向。
A.甲烷碱性燃料电池中,通入燃料甲烷的电极失去电子,发生氧化反应,故A错误;
B.燃料电池中,通入燃料的电极为负极,负极上失电子发生氧化反应,甲烷失电子生成二氧化碳和水,二氧化碳能和碱反应生成碳酸盐和水,所以负极电极反应式为:CH4+10OH--8e-=CO32-+7H2O,故B错误;
C.该电池的反应式为2O2+CH4+2OH-=CO32-+3H2O,消耗了溶液中的氢氧根离子,且有溶剂水生成,导致溶液中氢氧根离子的浓度降低,故C错误;
D.放电时,溶液中的阳离子移向正极,阴离子移向负极,故D正确。
故选D。
10.【答案】C
【解答】
A.该原电池中,Fe的活泼性比Cu强,Fe作负极,故A错误;
B.铜作为正极材料,起导电作用,不参与反应,铜片质量不变,故B错误;
C.原电池中电子从负极出发经导线到正极,Fe作负极,铜作正极,电子从Fe沿导线流向Cu,故C正确;
D.形成原电池反应,原电池是化学能转化为电能的装置,故D错误。
11.【答案】A
12.【答案】D
【解答】
甲装置是将化学能转化为电能的原电池,由甲图可知,M是负极,N是正极,电解质溶液为酸性溶液,负极上失电子发生氧化反应,正极上得电子发生还原反应,在铁上镀铜,则铁为阴极应与负极相连,铜为阳极应与正极相连,
A.在铁上镀铜,则铁为阴极应与负极相连,铜为阳极应与正极相连,电解质的浓度不会发生变化,所以颜色不变,故A正确;
B.原电池中M是负极、N是正极,Y为正极接线柱,铁上镀铜,则铁为阴极、应与负极相连,铜为阳极、应与正极接线柱Y相连,故B正确;
C.CO(NH2)2在负极M上失电子发生氧化反应,生成N2、CO2,结合电荷守恒得到电极反应式为CO(NH2)2+H2O-6e-=CO2↑+N2↑+6H+,故C正确;
D.当N电极消耗0.25mol氧气时,则转移0.25mol×4=1.0mol电子,所以铜电极质量减少64g/mol×1.0mol2=32g,故D错误。
13.【答案】(1)化学;电;
(2)负;
(3)0.5?mol。
【解答】
(1)原电池是把化学能转化成电能的装置,故答案为:化学;电;
(2)该电池中Zn极发生氧化反应,为负极,故答案为:负;
(3)当金属Zn消耗了16.25?g时,Zn变为+2价,所以n(Zn)=16.2565=0.25mol,所以转移电子0.5mol,故转移电子的物质的量为0.5?mol,故答案为:0.5?mol。
14.【答案】(1)铁被氧化
(2)与铁和氯化钠溶液构成原电池,铁作负极,炭粉作正极,加速铁屑的氧化
(3)溶于水形成电解质溶液?
(4)均匀散热
【解答】
(1)由题可知反应后铁变为铁锈,所以热敷袋主要是利用铁被氧化放出热量,
故答案为:铁被氧化;
(2)加入的碳粉与铁屑、NaCl溶液构成原电池,炭粉作电池的正极,加速铁屑的氧化,
故答案为:与铁和氯化钠溶液构成原电池,铁作负极,炭粉作正极,加速铁屑的氧化;
(3)氯化钠溶于水,形成电解质溶液,构成原电池,
故答案为:溶于水形成电解质溶液;
(4)木屑主要是使热敷袋均匀散热,
故答案为:均匀散热。
15.【答案】(1)Fe;碳棒; ??FeCl3??
(2)Fe-2e-=Fe2+;Fe3++e-=Fe2+??
(3)正;负;正
【解答】
(1)负极发生氧化反应,所以负极为Fe;正极发生还原反应,所以正极为碳棒;电解质溶液是:FeCI3;
(2)依据原电池的工作原理可得,负极反应式是:Fe-2e-=Fe2+;
正极反应式是:2Fe3++2e-=2Fe2+;
(3)溶液中Fe3+向正极移动,电子从负极流向正极。
16.【答案】不能;能;A反应不是氧化还原反应,无电子转移;铜,Cu-2e-=Cu2+;碳,2Fe3++2e-=2Fe2+
【解答】
(1)(A)NaOH+HCl=NaCl+H2O中,没有元素的化合价变化,为非氧化还原反应,无电子转移,不能设计成原电池;
(B)2FeCl3+Cu=2FeCl2+CuCl2中,Fe、Cu元素的化合价变化,为氧化还原反应,则B能设计为原电池,
故答案为:不能;能;
(2)A没有元素的化合价变化,为非氧化还原反应,无电子转移;
(3)2FeCl3+Cu=2FeCl2+CuCl2中,Cu失去电子,Fe得到电子,则负极为铜,负极反应为Cu-2e-=Cu2+;正极为碳棒,正极反应为2Fe3++2e-=2Fe2+,
故答案为:铜;Cu-2e-=Cu2+;碳;2Fe3++2e-=2Fe2+。
17.【答案】(1)用导线把a、b两电极连接起来
(2)纯锌片;Zn-2e-=Zn2+;纯铜片;2H++2e-=H2↑
(3)0.06?mol
【解答】
(1)根据图示装置,要想求得电子转移的量,需要设计成锌、铜、硫酸原电池,量取金属锌和硫酸反应产生氢气的体积,根据原电池的构成条件,所以首先要用导线把a、b两电极连接起来。
(2)锌、铜、硫酸原电池中,纯锌片是负极,电极反应:Zn-2e-=Zn2+;铜是正极,该极上电极反应为:2H++2e-=H2↑。
(3)正极上电极反应为:2H++2e-=H2↑,当量筒中收集到672mL气体的物质的量为672mL22400mL=0.03mol氢气时,转移电子是0.06mol。
18.【答案】(1)烧杯、量筒、玻璃棒? ;9.7?mol·L-1
(2)铂;?H2O2-2e-=2H++O2↑;净减; 0.05
(3)负极
(4)较弱酸性条件,Fe3+氧化性比H2O2强;较强酸性条件下,H2O2氧化性比Fe3+强
【解答】
(1)稀释一定质量分数的溶液需要量筒、烧杯和玻璃棒,根据物质的量浓度与质量分数之间的转换关系式,双氧水溶液的物质的量浓度为c=1000ρ?ωM=1000×1.1×0.334mol?L-1=9.7 mol?L-1,
故答案为:烧杯、量筒、玻璃棒? ;9.7?mol·L-1;
(2)在原电池中,电子由负极流向正极,依题意,石墨极为负极,铂极为正极,盐桥中钾离子由负极向正极迁移,以维持电荷守恒。双氧水在负极上发生氧化反应生成O2,溶液酸性增强,其正极反应式为Fe3++e-=Fe2+,电路上转移0.005?mol电子,故净减浓度为0.005 mol0.1 L=0.05 mol?L-1,
