2020-2021学年九年级化学人教版下册第十一单元 盐 化肥 实验活动8 粗盐提纯导学案
文档属性
| 名称 | 2020-2021学年九年级化学人教版下册第十一单元 盐 化肥 实验活动8 粗盐提纯导学案 |

|
|
| 格式 | zip | ||
| 文件大小 | 158.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-04-07 00:00:00 | ||
图片预览

文档简介
实验活动8
粗盐提纯
教学目的:掌握粗盐中难溶性和可溶性杂质去除的思路,掌握除杂的原则。
教学重难点:粗盐中可溶性杂质去除的思路、试剂加入顺序、注意事项。
【知识点一
粗盐中难溶性杂质的去除】
1.
除去不溶性杂质步骤:
①___________
②___________
③___________
④____________
思考:上述过程中玻璃棒的用途分别是什么?
2、易错提示:
(1)过滤时的操作要点:___________、_____________、______________
(2)蒸发操作的注意点:
①蒸发用到的仪器:______________、玻璃棒、铁架台(带铁圈)、酒精灯。
②当蒸发皿中出现____________时,即停止加热
,利用____________________使滤液蒸干。
③停止加热后,不要把蒸发皿立即放在桌上,应用___________夹住放到石棉网上面。
(3)计算产率:
___________________________
(4)误差分析
产率偏低的原因:____________________________、_______________________________、
___________________________、_______________________________
3、问题交流:
(1)能否采用降低溶液温度的方法使食盐溶液浓缩?
(2)有的小组过滤后滤液仍然浑浊,可能的原因有哪些?他们应如何进行下步操作?
(3)此时得到的精盐是不是纯净物?
【练习】(2020?白云区一模)氯化钠是生活中常见的物质。
①如C图所示,实验需要称量5g粗盐,实验过程中指针偏向左边,接下来需要进行的操作是
。
②粗盐的提纯见图,正确的操作顺序是
(填字母)。
③A图中,玻璃棒的作用是
;当蒸发皿中
时,停止加热。
④蒸发中玻璃棒的作用是_________________________________
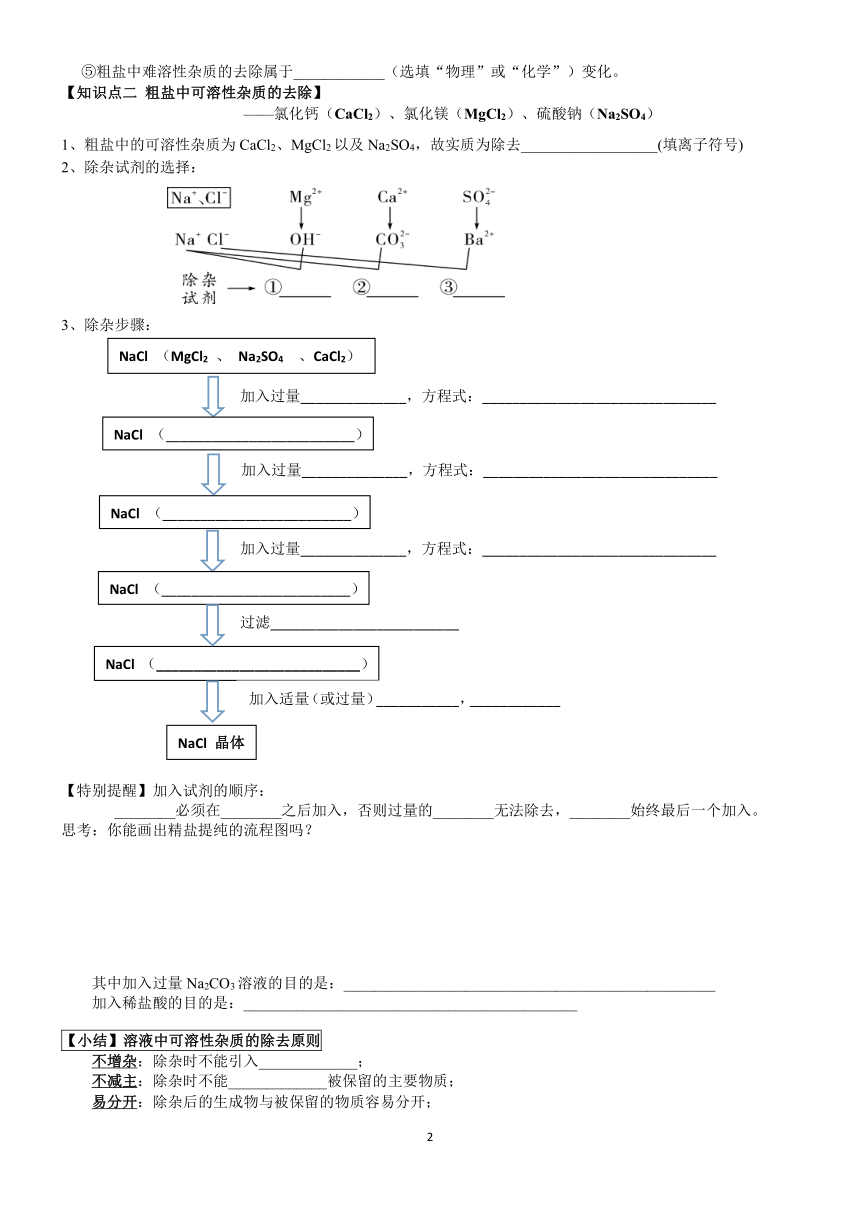
⑤粗盐中难溶性杂质的去除属于____________(选填“物理”或“化学”)变化。
【知识点二
粗盐中可溶性杂质的去除】
——氯化钙(CaCl2)、氯化镁(MgCl2)、硫酸钠(Na2SO4)
1、粗盐中的可溶性杂质为CaCl2、MgCl2以及Na2SO4,故实质为除去__________________(填离子符号)
2、除杂试剂的选择:
3、除杂步骤:
【特别提醒】加入试剂的顺序:
________必须在________之后加入,否则过量的________无法除去,________始终最后一个加入。
思考:你能画出精盐提纯的流程图吗?
其中加入过量Na2CO3溶液的目的是:_________________________________________________
加入稀盐酸的目的是:____________________________________________
【小结】溶液中可溶性杂质的除去原则
不增杂:除杂时不能引入_____________;
不减主:除杂时不能_____________被保留的主要物质;
易分开:除杂后的生成物与被保留的物质容易分开;
复原态:被保留的物质能恢复原状态。
【课堂练习】
1、除去食盐溶液中的Ca2+、Mg2+、SO42-等杂质,需加入NaOH、Na2CO3、BaCl2和盐酸,加入顺序正确的是(
)
A
NaOH——Na2CO3——BaCl2——HCl
B
Na2CO3——BaCl2——HCl——NaOH
C
BaCl2——HCl——NaOH——Na2CO3
D
NaOH——BaCl2——Na2CO3——HCl
2、为了除去粗盐中的Ca2+、Mg2+、SO42—和泥沙,可将粗盐溶于水,然后进行下列五项操作:①过滤;②加过量的NaOH溶液;③加适量的盐酸;④加过量的Na2CO3溶液;⑤加过量的BaCl2溶液。下列操作顺序中最合适的是(
)
A.
②④⑤①③
B.
⑤④②③①
C.
⑤②④③①
D.
②⑤④①③
3、(2017广州)下列除杂所选用试剂与操作方法均正确的是(
)
选项
物质(括号内为杂质)
除杂试剂
实验操作
A
CaO(CaCO3)
水
溶解、过滤
B
H2(CO)
灼热CuO
洗气
C
NaCl(Na2SO4)
过量BaCl2溶液
过滤
D
NaCl(Na2CO3)
足量稀盐酸
蒸发结晶
4、【2018广州】除去下列物质中所含杂质(括号内为杂质)的实验,能达到目的的是(
)
A.
NaOH(Na2CO3):加入适量稀盐酸
B.
CO(CO2):通过装有浓硫酸的洗气瓶
C.
CuO(C):在空气中充分灼烧
D.
MgSO4(Na2SO4):溶解,过滤
5、通过海水晾晒可得粗盐,粗盐除NaCl外,还含有MgCl2、CaCl2、Na2SO4以及泥沙等杂质。以下是制备精盐的实验方案,各步操作流程如下:
(1)在第①步粗盐溶解操作中要用玻璃棒搅拌,作用是__________________________________。
(2)第②步操作加入过量的BaCl2目的是除去粗盐中的___________________________(填化学式),写出这个反应的化学方程式_____________________________、______________________________。
(3)第⑤步“过滤”操作中得到沉淀的成分有:泥沙、BaSO4、CaCO3、__________、__________(填化学式)。
(4)在第③步操作中,选择的除杂的试剂不能用KOH代替NaOH,理由是______________________________。(5)在利用粗盐制备精盐过程的第⑥步操作中,加入适量盐酸的目的是_______________________。
【课后练习】
1、(2020·广东省卷)下列除杂方法正确的是(
)
选项
物质(括号内为杂质)
方法
A
K2CO3溶液(K2SO4)
加BaCl2溶液,过滤
B
N2(O2)
将气体通过灼热的铜网
C
NaOH溶液(Na2CO3)
加入稀硫酸
D
ZnSO4溶液(CuSO4)
加入过量的铁粉,过滤
2、(2019广州)除去下列物质中混有的少量杂质(括号内为杂质),所用方法正确的是(
)
A.
Zn粉(Fe):用ZnCl2溶液浸泡,过滤
B.
碳粉(MnO2):滴入H2O2溶液,过滤
C.
NaCl溶液(Na2SO4):加入适量MgCl2溶液过滤
D.
CO2?(H2O):通过盛有浓硫酸的洗气瓶
3、(2018广州)除去下列物质中所含杂质(括号内为杂质)的实验,能达到目的的
(
)
A.NaOH(Na2CO3):加入适量稀盐酸
B.
CO(CO2):通过装有浓硫酸的洗气瓶
C.
CuO(C):在空气中充分灼烧
D.
MgSO4(Na2SO4):溶解,过滤
4、为了除去粗盐中的泥沙、Ca2+、Mg2+、SO42-等杂质,将粗盐溶于水,然后进行下列五步操作:①过滤
②加过量的氢氧化钠溶液
③加适量盐酸
④加过量的碳酸钠溶液
⑤加过量的氯化钡溶液。正确的操作顺序是(
)
A.①⑤②④③
B.②④⑤①③
C.④⑤②①③
D.②⑤④①③
5、某粗盐固体样品中含有少量CaCl2、MgCl2、Na2SO4、MgSO4和泥沙,进行以下操作可得到纯净的NaCl晶体:①加过量的NaOH溶液;②加H2O溶液;③加过量的BaCl2溶液;④过滤;⑤蒸发;⑥加过量的Na2CO3溶液;⑦加适量的稀盐酸,则正确的操作顺序是(
)
A.②①③⑥④⑦⑤
B.②①⑥③④⑦⑤
C.①⑥⑦②③④⑤
D.⑥②①③④⑤⑦
6、(2019?广州模拟)在除杂质的操作中,为了将杂质完全去除,通常需加入过量的除杂试剂。为了除去NaCl样品中混有少量的Na2SO4和MgCl2,某校化学课外活动小组设计了提纯NaCl的流程图:
(1)加入过量的氢氧化钠可除去的阳离子是
(
写离子符号),写出①的化学方程式:
。
(2)试剂X的化学式为
,溶液M中所含有的全部阴离子有
。
(3)试剂Y的名称是
,它的作用是
。
(4)操作Ⅱ的名称是
,操作Ⅰ、Ⅱ、Ⅲ都要用到的同一种玻璃仪器是
。
7、(2019?番禺区二模)某兴趣小组的同学在实验室用含有少量
CaCl2
的
NaCl
固体配制一定质量分数的
NaCl
溶液。实验步骤如图所示。请回答下列问题:
(1)沉淀
D
的化学式为
。
(2)加入“过量
Na2CO3”所发生反应的化学方程式为
。
(3)在“操作1”用的实验方法是
。
(4)加入“适量
HCl”的目的是
。
(5)“操作2”的目的是测定溶液为中性,测定溶液pH
的方法是
。
(6)经测定“溶液
C”的质量为
50g,质量分数为
6%的氯化钠溶液(密度为
1.04g/cm3)。现要用该溶液配制
50g
质量分数为
3%的氯化钠溶液,所需
6%的氯化钠溶液和水的体积分别为
mL和
mL。(水密度为1.0g/cm3)。
8、(2019?白云区二模)实验一:炎热的夏天,在家中可以自制汽水来消暑解热。制备流程如下:
【制备材料】1.5g小苏打、1.5g柠檬酸、蔗糖、果汁、凉开水、500
mL饮料瓶
(1)步骤②中用凉开水制汽水的原因是
。
(2)参照题中产生气体的化学原理,写出稀硫酸和小苏打反应的化学方程式
。
(3)下列不能与柠檬酸反应的物质有
。(填字母)
A.铜丝
B.烧碱
C.氧化钾
D.鸡蛋壳
实验二:《四川盐法志》记载,“敞锅熬盐”主要步骤为:①将黄卤和黑卤按比例混合;②放入敞口锅中加热浓缩,用木棒不断搅拌,析出粗盐;③用“花水”冲洗粗盐得精品盐。
(1)步骤①中,黄卤所含杂质BaCl2和黑卤所含杂质MgSO4反应生成白色沉淀。
(2)步骤②中,析出粗盐的过程,当
时停止加热。木棒的作用是
。
(3)步骤③用“花水”冲洗粗盐,既可除去表面的MgSO4和MgCl2杂质,又不损失NaCl.则“花水”应当是
(填字母)
A.蒸馏水
B.饱和NaCl溶液
C.饱和NaOH溶液
D.饱和BaCl2溶液
NaCl
(MgCl2
、
Na2SO4
、CaCl2)
加入过量______________,方程式:_______________________________
NaCl
(_________________________)
加入过量______________,方程式:_______________________________
NaCl
(_________________________)
加入过量______________,方程式:_______________________________
NaCl
(_________________________)
过滤_________________________
NaCl
(___________________________)
加入适量(或过量)___________,____________
NaCl
晶体
粗盐提纯
教学目的:掌握粗盐中难溶性和可溶性杂质去除的思路,掌握除杂的原则。
教学重难点:粗盐中可溶性杂质去除的思路、试剂加入顺序、注意事项。
【知识点一
粗盐中难溶性杂质的去除】
1.
除去不溶性杂质步骤:
①___________
②___________
③___________
④____________
思考:上述过程中玻璃棒的用途分别是什么?
2、易错提示:
(1)过滤时的操作要点:___________、_____________、______________
(2)蒸发操作的注意点:
①蒸发用到的仪器:______________、玻璃棒、铁架台(带铁圈)、酒精灯。
②当蒸发皿中出现____________时,即停止加热
,利用____________________使滤液蒸干。
③停止加热后,不要把蒸发皿立即放在桌上,应用___________夹住放到石棉网上面。
(3)计算产率:
___________________________
(4)误差分析
产率偏低的原因:____________________________、_______________________________、
___________________________、_______________________________
3、问题交流:
(1)能否采用降低溶液温度的方法使食盐溶液浓缩?
(2)有的小组过滤后滤液仍然浑浊,可能的原因有哪些?他们应如何进行下步操作?
(3)此时得到的精盐是不是纯净物?
【练习】(2020?白云区一模)氯化钠是生活中常见的物质。
①如C图所示,实验需要称量5g粗盐,实验过程中指针偏向左边,接下来需要进行的操作是
。
②粗盐的提纯见图,正确的操作顺序是
(填字母)。
③A图中,玻璃棒的作用是
;当蒸发皿中
时,停止加热。
④蒸发中玻璃棒的作用是_________________________________
⑤粗盐中难溶性杂质的去除属于____________(选填“物理”或“化学”)变化。
【知识点二
粗盐中可溶性杂质的去除】
——氯化钙(CaCl2)、氯化镁(MgCl2)、硫酸钠(Na2SO4)
1、粗盐中的可溶性杂质为CaCl2、MgCl2以及Na2SO4,故实质为除去__________________(填离子符号)
2、除杂试剂的选择:
3、除杂步骤:
【特别提醒】加入试剂的顺序:
________必须在________之后加入,否则过量的________无法除去,________始终最后一个加入。
思考:你能画出精盐提纯的流程图吗?
其中加入过量Na2CO3溶液的目的是:_________________________________________________
加入稀盐酸的目的是:____________________________________________
【小结】溶液中可溶性杂质的除去原则
不增杂:除杂时不能引入_____________;
不减主:除杂时不能_____________被保留的主要物质;
易分开:除杂后的生成物与被保留的物质容易分开;
复原态:被保留的物质能恢复原状态。
【课堂练习】
1、除去食盐溶液中的Ca2+、Mg2+、SO42-等杂质,需加入NaOH、Na2CO3、BaCl2和盐酸,加入顺序正确的是(
)
A
NaOH——Na2CO3——BaCl2——HCl
B
Na2CO3——BaCl2——HCl——NaOH
C
BaCl2——HCl——NaOH——Na2CO3
D
NaOH——BaCl2——Na2CO3——HCl
2、为了除去粗盐中的Ca2+、Mg2+、SO42—和泥沙,可将粗盐溶于水,然后进行下列五项操作:①过滤;②加过量的NaOH溶液;③加适量的盐酸;④加过量的Na2CO3溶液;⑤加过量的BaCl2溶液。下列操作顺序中最合适的是(
)
A.
②④⑤①③
B.
⑤④②③①
C.
⑤②④③①
D.
②⑤④①③
3、(2017广州)下列除杂所选用试剂与操作方法均正确的是(
)
选项
物质(括号内为杂质)
除杂试剂
实验操作
A
CaO(CaCO3)
水
溶解、过滤
B
H2(CO)
灼热CuO
洗气
C
NaCl(Na2SO4)
过量BaCl2溶液
过滤
D
NaCl(Na2CO3)
足量稀盐酸
蒸发结晶
4、【2018广州】除去下列物质中所含杂质(括号内为杂质)的实验,能达到目的的是(
)
A.
NaOH(Na2CO3):加入适量稀盐酸
B.
CO(CO2):通过装有浓硫酸的洗气瓶
C.
CuO(C):在空气中充分灼烧
D.
MgSO4(Na2SO4):溶解,过滤
5、通过海水晾晒可得粗盐,粗盐除NaCl外,还含有MgCl2、CaCl2、Na2SO4以及泥沙等杂质。以下是制备精盐的实验方案,各步操作流程如下:
(1)在第①步粗盐溶解操作中要用玻璃棒搅拌,作用是__________________________________。
(2)第②步操作加入过量的BaCl2目的是除去粗盐中的___________________________(填化学式),写出这个反应的化学方程式_____________________________、______________________________。
(3)第⑤步“过滤”操作中得到沉淀的成分有:泥沙、BaSO4、CaCO3、__________、__________(填化学式)。
(4)在第③步操作中,选择的除杂的试剂不能用KOH代替NaOH,理由是______________________________。(5)在利用粗盐制备精盐过程的第⑥步操作中,加入适量盐酸的目的是_______________________。
【课后练习】
1、(2020·广东省卷)下列除杂方法正确的是(
)
选项
物质(括号内为杂质)
方法
A
K2CO3溶液(K2SO4)
加BaCl2溶液,过滤
B
N2(O2)
将气体通过灼热的铜网
C
NaOH溶液(Na2CO3)
加入稀硫酸
D
ZnSO4溶液(CuSO4)
加入过量的铁粉,过滤
2、(2019广州)除去下列物质中混有的少量杂质(括号内为杂质),所用方法正确的是(
)
A.
Zn粉(Fe):用ZnCl2溶液浸泡,过滤
B.
碳粉(MnO2):滴入H2O2溶液,过滤
C.
NaCl溶液(Na2SO4):加入适量MgCl2溶液过滤
D.
CO2?(H2O):通过盛有浓硫酸的洗气瓶
3、(2018广州)除去下列物质中所含杂质(括号内为杂质)的实验,能达到目的的
(
)
A.NaOH(Na2CO3):加入适量稀盐酸
B.
CO(CO2):通过装有浓硫酸的洗气瓶
C.
CuO(C):在空气中充分灼烧
D.
MgSO4(Na2SO4):溶解,过滤
4、为了除去粗盐中的泥沙、Ca2+、Mg2+、SO42-等杂质,将粗盐溶于水,然后进行下列五步操作:①过滤
②加过量的氢氧化钠溶液
③加适量盐酸
④加过量的碳酸钠溶液
⑤加过量的氯化钡溶液。正确的操作顺序是(
)
A.①⑤②④③
B.②④⑤①③
C.④⑤②①③
D.②⑤④①③
5、某粗盐固体样品中含有少量CaCl2、MgCl2、Na2SO4、MgSO4和泥沙,进行以下操作可得到纯净的NaCl晶体:①加过量的NaOH溶液;②加H2O溶液;③加过量的BaCl2溶液;④过滤;⑤蒸发;⑥加过量的Na2CO3溶液;⑦加适量的稀盐酸,则正确的操作顺序是(
)
A.②①③⑥④⑦⑤
B.②①⑥③④⑦⑤
C.①⑥⑦②③④⑤
D.⑥②①③④⑤⑦
6、(2019?广州模拟)在除杂质的操作中,为了将杂质完全去除,通常需加入过量的除杂试剂。为了除去NaCl样品中混有少量的Na2SO4和MgCl2,某校化学课外活动小组设计了提纯NaCl的流程图:
(1)加入过量的氢氧化钠可除去的阳离子是
(
写离子符号),写出①的化学方程式:
。
(2)试剂X的化学式为
,溶液M中所含有的全部阴离子有
。
(3)试剂Y的名称是
,它的作用是
。
(4)操作Ⅱ的名称是
,操作Ⅰ、Ⅱ、Ⅲ都要用到的同一种玻璃仪器是
。
7、(2019?番禺区二模)某兴趣小组的同学在实验室用含有少量
CaCl2
的
NaCl
固体配制一定质量分数的
NaCl
溶液。实验步骤如图所示。请回答下列问题:
(1)沉淀
D
的化学式为
。
(2)加入“过量
Na2CO3”所发生反应的化学方程式为
。
(3)在“操作1”用的实验方法是
。
(4)加入“适量
HCl”的目的是
。
(5)“操作2”的目的是测定溶液为中性,测定溶液pH
的方法是
。
(6)经测定“溶液
C”的质量为
50g,质量分数为
6%的氯化钠溶液(密度为
1.04g/cm3)。现要用该溶液配制
50g
质量分数为
3%的氯化钠溶液,所需
6%的氯化钠溶液和水的体积分别为
mL和
mL。(水密度为1.0g/cm3)。
8、(2019?白云区二模)实验一:炎热的夏天,在家中可以自制汽水来消暑解热。制备流程如下:
【制备材料】1.5g小苏打、1.5g柠檬酸、蔗糖、果汁、凉开水、500
mL饮料瓶
(1)步骤②中用凉开水制汽水的原因是
。
(2)参照题中产生气体的化学原理,写出稀硫酸和小苏打反应的化学方程式
。
(3)下列不能与柠檬酸反应的物质有
。(填字母)
A.铜丝
B.烧碱
C.氧化钾
D.鸡蛋壳
实验二:《四川盐法志》记载,“敞锅熬盐”主要步骤为:①将黄卤和黑卤按比例混合;②放入敞口锅中加热浓缩,用木棒不断搅拌,析出粗盐;③用“花水”冲洗粗盐得精品盐。
(1)步骤①中,黄卤所含杂质BaCl2和黑卤所含杂质MgSO4反应生成白色沉淀。
(2)步骤②中,析出粗盐的过程,当
时停止加热。木棒的作用是
。
(3)步骤③用“花水”冲洗粗盐,既可除去表面的MgSO4和MgCl2杂质,又不损失NaCl.则“花水”应当是
(填字母)
A.蒸馏水
B.饱和NaCl溶液
C.饱和NaOH溶液
D.饱和BaCl2溶液
NaCl
(MgCl2
、
Na2SO4
、CaCl2)
加入过量______________,方程式:_______________________________
NaCl
(_________________________)
加入过量______________,方程式:_______________________________
NaCl
(_________________________)
加入过量______________,方程式:_______________________________
NaCl
(_________________________)
过滤_________________________
NaCl
(___________________________)
加入适量(或过量)___________,____________
NaCl
晶体
同课章节目录
