山东省泰安市2020-2021学年高二下学期期中考试模拟训练(答案解析版)
文档属性
| 名称 | 山东省泰安市2020-2021学年高二下学期期中考试模拟训练(答案解析版) |

|
|
| 格式 | docx | ||
| 文件大小 | 401.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-04-07 00:00:00 | ||
图片预览




文档简介
2020~2021年高二下学期期中考试模拟训练(鲁科版)
一、单选题
1.物质的提纯是化学实验中的一项重要操作,也是化工生产及物质制备中的主要环节。下列有关叙述中,正确的是 ( )
A.乙酸乙酯中混有乙酸,可用饱和Na2CO3溶液洗涤,然后分液分离出乙酸乙酯
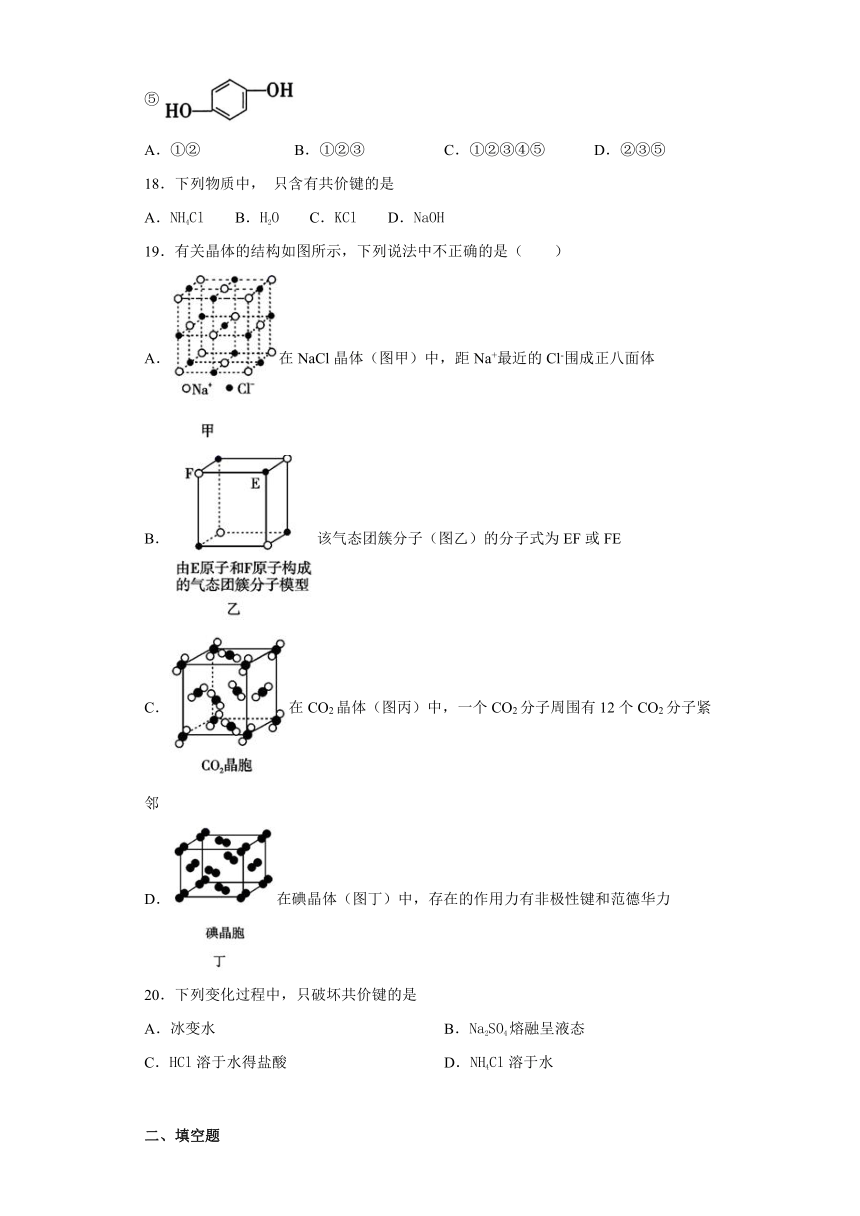
B.在提纯鸡蛋中的蛋白质时,可向鸡蛋清溶液中加入浓硝酸,然后将所得沉淀滤出,即得较纯的蛋白质
C.除去乙烷中少量的乙烯:光照条件下通入Cl2,气液分离
D.乙醇中含乙酸杂质,加入碳酸钠溶液洗涤,分液
2.下列关于丙烯(CH3—CH=CH2)的说法错误的是( )
A.丙烯分子有8个σ键,1个π键 B.丙烯分子中3个碳原子都是sp3杂化
C.丙烯分子存在非极性键 D.丙烯分子中3个碳原子在同一平面上
3.下列各对物质中,互为同系物的是
A.CH3-CH=CH2与 B.与
C.甲苯和二甲苯 D.CH2=CH—CH=CH2和CH3CH2CH2C≡CH
4.下列叙述中正确的是
A.在离子化合物中一定含有金属元素
B.在离子化合物中不可能存在非极性键
C.共价化合物中一定没有金属元素
D.共价化合物中可能既有极性键也有非极性键
5.以下有关杂化轨道的说法中正确的是
A.sp3 杂化轨道中轨道数为 4,且 4 个杂化轨道能量相同
B.杂化轨道既可能形成σ键,也可能形成π键
C.杂化轨道不能容纳孤电子对
D.sp2杂化轨道最多可形成 2 个σ键
6.根据价层电子对互斥理论及原子的杂化理论判断PCl3分子的空间构型和中心原子的杂化方式为(?? )
A.直线形 sp杂化 B.三角形 sp2杂化
C.三角锥形 sp2杂化 D.三角锥形 sp3杂化
7.下列说法都不正确的是
①、CH3—CH=CH2和CH2=CH2的最简式相同
②、CH≡CH和C6H6含碳量相同
③、丁二烯和丁烯为同系物
④、正戊烷、异戊烷、新戊烷的沸点逐渐变低
⑤、标准状况下,11.2L的戊烷所含的分子数为0.5 NA (NA为阿伏加德罗常数)
⑥、能够快速、微量、精确的测定相对分子质量的物理方法是核磁共振氢谱法
A.① ② ⑥ B.② ③ ④ C.② ③ ⑥ D.③ ⑤ ⑥
8.对于A1型最密堆积的描述错误的是( )
A.A1型最密堆积晶体的晶胞也叫面心立方晶胞
B.面心立方晶胞的每个顶点上和每个面的中心上都各有一个微粒
C.平均每个面心立方晶胞中有14个微粒
D.A1型最密堆积可用符号“…ABCABC…”表示
9.分析下表中各项的排布规律,按此规律排布第 27 项应为
1
2
3
4
5
6
7
8
9
10
C2H4
C2H6
C2H6O
C2H4O2
C3H6
C3H8
C3H8O
C3H6O2
C4H8
C4H10
A.C7H16 B.C7H14O2 C.C8H18 D.C8H18O
10.下列化学用语表达正确的是
A.硝基苯的结构简式:
B.NH4Cl的电子式:
C.的名称为3,3-二甲基戊烷
D.具有16个质子、16个中子和18个电子的微粒一定是S2-
11.下列关于乙烯(CH2 =CH2)的说法不正确的是
A.乙烯分子中2个碳原子都是sp2杂化 B.乙烯分子中存在非极性键
C.乙烯分子中4个H原子在同一平面上 D.乙烯分子具有手性异构
12.将1molCH4与氯气发生取代反应,待反应完全后,测定四种有机物的物质的量相等,则产生HCl的物质的量是
A.0.5mol B.2 mol C.2.5 mol D.4mol
13.下面是从实验中测得的不同物质中氧氧键的键长和键能的数据:
O—O键
O22-
O2-
O2
O2+
键长/10-12 m
149
128
121
112
键能/kJ·mol-1
x
y
z=494
w=628
其中x、y的键能数据尚未测定,但可根据规律推导出键能的大小顺序为w>z>y>x。则该规律是( )
A.键长越长,键能越小
B.成键所用的电子数越多,键能越大
C.成键所用的电子数越少,键能越大
D.成键时共用电子越偏移,键能越大
14.下列化学用语的表达不正确的是
A.二氧化碳的比例模型 B.硫原子的结构示意图
C.的原子核内有8个中子 D.NH4Cl的电子式
15.2018年1月26日,中国科技大学的教授们将水置于一个20 ℃、足够强的电场中,水分子瞬间凝固形成“暖冰”。则关于“暖冰”的判断正确的是
A.“暖冰”中存在离子键
B.“暖冰”中水分子的O-H键是非极性键
C.“暖冰”有良好的导电性和导热性
D.水凝固形成20 ℃时的“暖冰”所发生的变化是物理变化
16.下列关于的说法正确的是
A.含有5种不同化学环境的氢
B.所有原子都可能在同一平面上
C.最多有5个碳原子在同一直线上
D.该物质与萘()互为同系物
17.下列物质属于酚类的是( )
① ② ③ ④ ⑤
A.①② B.①②③ C.①②③④⑤ D.②③⑤
18.下列物质中, 只含有共价键的是
A.NH4Cl B.H2O C.KCl D.NaOH
19.有关晶体的结构如图所示,下列说法中不正确的是( )
A.在NaCl晶体(图甲)中,距Na+最近的Cl-围成正八面体
B.该气态团簇分子(图乙)的分子式为EF或FE
C.在CO2晶体(图丙)中,一个CO2分子周围有12个CO2分子紧邻
D.在碘晶体(图丁)中,存在的作用力有非极性键和范德华力
20.下列变化过程中,只破坏共价键的是
A.冰变水 B.Na2SO4熔融呈液态
C.HCl溶于水得盐酸 D.NH4Cl溶于水
二、填空题
21.下列各组物质:①O2和O3 ②H2、D2、T2 ③和 ④CH3CH2CH2CH3和乙烷和丁烷
请用序号回答下列问题:
互为同系物的是______,互为同分异构体的是______,互为同位素的是______,互为同素异形体的是______。
22.乙醇汽油作为汽车的燃料,它是由粮食及各种植物纤维加工成的燃料——乙醇,与汽油按一定比例混配形成的。乙醇汽油作为一种新型清洁燃料,可以有效降低一氧化碳、碳氢化合物等主要污染物的排放,是目前世界上可再生能源的发展重点。
完成下列填空:
①乙醇的结构简式为___________。
②乙烯可以作_____________的催熟剂。
③三氧化铬酒驾原理是遇乙醇转化为绿色的硫酸铬。该过程中乙醇发生_________反应(选填“氧化”或“还原”)。
④写出推广使用乙醇汽油的好处:________________。
三、计算题
23.(1)Ni与Al形成的一种合金可用于铸造飞机发动机叶片,其晶胞结构如图所示,该合金的化学式为________.
(2)的熔点为1238℃,密度为,其晶胞结构如图所示.该晶体的类型为_________,Ga与As以__________键结合.设Ga和As的摩尔质量分别为和,原子半径分别为和,阿伏加德罗常数的值为,则GaAs晶胞中原子的体积占晶胞体积的百分率为_____________(列出含、M2、r1、r2、和的计算式).
(3)自然界中有丰富的钛矿资源,如图表示的是钡钛矿晶体的晶胞结构,经X射线衍射分析,该晶胞为正方体,晶胞参数为apm.
写出钡钛矿晶体的化学式:_____,其密度是_____(设阿伏加德罗常数的值为).
(4)①磷化硼是一种受到高度关注的耐磨涂料,它可用作金属的表面保护层.如图是磷化硼晶体的晶胞,B原子的杂化轨道类型是______.立方相氮化硼晶体的熔点要比磷化硼晶体的高,其原因是_____.
②已知磷化硼的晶胞参数,请列式计算该晶体的密度______(用含的代数式表示即可,不需要计算出结果).晶胞中硼原子和磷原子最近的核间距d为_______pm.
四、有机推断题
24.某物质只含C、H、O三种元素,其分子模型如图所示,分子中共有12个原子(图中球与球之间的连线代表单键、双键等化学键)。
(1)该物质的结构简式为______。
(2)该物质中含有两种官能团,其名称分别为______、_______。
(3)下列物质中,与该物质互为同分异构体的是________(填序号,下同),互为同系物的是_______。
a.CH3CH=CHCOOH b.CH2=CHCOOCH3
c.CH3CH2CH=CHCOOH d.CH3CH(CH3)COOH
参考答案
1.A
【详解】
A.乙酸乙酯不溶于饱和Na2CO3溶液,乙酸的酸性比碳酸强,能与Na2CO3反应生成二氧化碳而被吸收,然后分液可得到纯净的乙酸乙酯,故A正确;
B.浓硝酸可以使蛋白质变性,变性为不可逆过程,最终得不到纯净的蛋白质,故B错误;
C.光照条件下乙烷可以和Cl2反应,最终得不到乙烷,故C错误;
D.乙醇与水互溶,混合液不会分层,该方法无法分离出乙醇,故D错误;
故选A。
【点睛】
注意掌握化学实验基本操作方法,明确常见元素及其化合物性质为解答关键。
2.B
【详解】
A.丙烯中含有6个C-H单键,1个C-C单键和1个碳碳双键,因为双键是由1个σ键和1个π键构成,A选项正确;
B.丙烯中的2个不饱和碳原子是sp2杂化,甲基碳原子才是sp3杂化,B选项错误;
C.丙烯分子中的C原子和C原子之间形成非极性键,C选项正确;
D.由于甲基是和不饱和碳原子直接相连的,而碳碳双键是平面型结构,所以丙烯分子中3个碳原子在同一平面上,D选项正确;
答案选B。
3.C
【详解】
结构相似,组成上相差1个或者若干个CH2的化合物互称为同系物。
A.结构不相似,CH3-CH=CH2为烯烃,含有碳碳双键,为环烷烃,不是同系物,不符合题题意;
B.两种有机物分别为苯酚和苯甲醇,苯酚中,羟基直接与苯环相连,而苯甲醇中,羟基与苯环的侧链相连,不是同系物,不符合题意;
C.甲苯的结构简式为,二甲苯中邻二甲苯的结构简式为,结构相似,分子式分别为C7H8和C8H10,相差1个CH2,为同系物,符合题意;
D.CH2=CH—CH=CH2和CH3CH2CH2C≡CH,结构不同,官能团分别为碳碳双键和碳碳三键,不符合题意;
本题答案选C。
【点睛】
在同系物中,结构相似指的是官能团的种类和数目相同,它们应该属于同类物质。
4.D
【解析】
【详解】
A. 离子化合物中不一定含有金属元素,例如氯化铵等,故A错误;
B.离子化合物一定含离子键,也可能含极性键或非极性键,如NaOH中含有极性键,Na2O2中含有非极性键,故B错误;
B. 共价化合物中也可能含有金属元素,例如氯化铝,故C错误;
D. 共价化合物如过氧化氢,既有极性键也有非极性键,所以D选项是正确的。
故答案选D。
5.A
【详解】
A. 杂化前后轨道数目不变,杂化后轨道能量相同,因此sp3杂化轨道中轨道数为4,且4个杂化轨道能量相同,故A正确;
B. 杂化轨道只能形成σ键,π键是未参与杂化的p轨道形成的,故B错误;
C. 杂化轨道可以容纳孤电子对,比如氨气,故C错误;
D. sp2杂化,轨道数目有3个,因此最多可形成3个σ键,故D错误。
综上所述,答案为A。
6.D
【详解】
PCl3分子中P原子的价层电子对个数=3+×(5-3×1)=4,且含有一个孤电子对,则该分子中中心原子采用sp3杂化,分子构型为三角锥形,故答案为D。
【点睛】
ABm型杂化类型的判断:中心原子电子对计算公式:价电子对数n=(中心原子的价电子数+配位原子的价电子数×m±电荷数);注意:①当上述公式中电荷数为正值时取“-”,电荷数为负值时取“+”;②当配位原子为氧原子或硫原子时,成键电子数为零;根据n值判断杂化类型:一般有如下规律:当n=2,sp杂化;n=3,sp2杂化;n=4,sp3杂化。
7.D
【分析】
【详解】
①CH3-CH=CH2和CH2=CH2的最简式的是CH2,二者的最简式相同,故①正确;
②CH≡CH和C6H6的最简式的是CH,所以二者的含碳量相同,故②正确;
③丁二烯和丁烯中碳碳双键的数目不同,二者不是同系物,故③错误;
④正戊烷、异戊烷、新戊烷分子中含有的碳原子数目,含有的支链逐渐增多,则它们的沸点逐渐变低,故④正确;
⑤标准状况下,戊烷的状态不是气体,题中条件无法计算11.2L的戊烷的物质的量,故⑤错误;
⑥能够快速、微量、精确的测定相对分子质量的物理方法是质谱法,而核磁共振谱法可确定有机物中H的种类,故⑥错误;
根据以上分析,错误的有:③⑤⑥,故选D。
8.C
【详解】
A.A1型最密堆积晶体的晶胞中微粒位于晶胞的每个顶点和面心,所以也叫面心立方晶胞,A正确;
B.面心立方晶胞的每个顶点上和每个面的中心上都各有一个微粒,B正确;
C.根据均摊法,平均每个面心立方晶胞中有=4个微粒,C错误;
D.面心立方晶胞在三维空间里以密置层采取ABCABC…堆积,D正确;
故答案为C。
9.D
【详解】
根据表中的化学式规律采用分组分类法推出:每4个化学式为一组,依次是烯烃、烷烃、饱和一元醇或醚等、饱和一元羧酸或酯等;把表中化学式分为4循环,27=4×6+3,即第27项应在第7组第三位的饱和一元醇,相邻组碳原子数相差1,该组中碳原子数为2+(7-1)×1=8,故第27项则为C8H18O;
答案选D。
10.C
【详解】
A.硝基中的氮原子应直接与苯环上的碳相连接,硝基苯正确的结构简式为:,故A错误;
B.氯化铵为离子化合物,铵根离子和氯离子都需要标出所带电荷及原子的最外层电子,氯化铵正确的电子式为:,故B错误;
C.为烷烃,最长碳链含有5个C,主链为戊烷,在3号C含有两个甲基,有机物的名称为:3,3-二甲基戍烷,故C正确;
D.含有16个质子、16个中子和18个电子的微粒可能为过氧根离子:,不一定为硫离子,故D错误;
故答案为C。
11.D
【详解】
A.乙烯分子中2个碳原子的价层电子对数为3,所以碳碳双键两端的碳原子采用sp2杂化,故A正确;
B.同种非金属元素之间存在非极性共价键,不同非金属元素之间存在极性共价键,所以分子存在非极性键,故B正确;
C.乙烯分子的空间结构为平面形结构,所以4个H原子在同一平面上,故C正确;
D.具有手性异构,分子中至少存在1个连接4个不同原子或基团的碳原子,故乙烯分子不具有手性异构,故D错误。
故选D。
12.C
【解析】
【详解】
四种有机物的物质的量相等,即分别都是0.25mol,则消耗氯气的物质的量分别是0.25mol+0.25mol×2+0.25mol×3+0.25mol×4=2.5mol,答案选C。
13.A
【详解】
A、根据表中数据以及键能大小的顺序是w>z>y>x,可知键长越长,键能越小,故A正确;
B、O2和O2+成键所用电子数均为4个,但键能不同,分别为:494kJ/mol、628kJ/mol,键能与成键所用的电子数无关,故B错误;
C、O2和O2+成键所用电子数均为4个,但键能不同,分别为:494kJ/mol、628kJ/mol,键能与成键所用的电子数无关,故C错误;
D、这些微粒都是由相同的原子组成,电子对无偏移,且电子对偏移程度与键能无关,而是与原子吸引电子能力的相对大小有关,故D错误;
答案选A。
14.A
【详解】
A.二氧化碳分子为直线型结构,三个原子在同一条直线上,A不正确;
B.硫原子的核电荷数为16,核外电子数为16,结构示意图为,B正确;
C.的原子核内含中子的个数为14-6=8,C正确;
D.NH4Cl由NH4+和Cl-构成,电子式为,D正确;
故选A。
【点睛】
简单阳离子的电子式就是它的离子符号,若阳离子由原子团构成,则书写电子式时,必须加 [ ]及带电荷。
15.D
【解析】
A. 水属于共价化合物,所以“暖冰”中只存在共价键,A不正确;B. “暖冰”中水分子的O—H键是不同原子间的共价键,是极性键,B不正确;C. “暖冰”属于分子晶体,晶体中没有自由移动的离子,没有导电性和导热性,C不正确;D. 水凝固形成20℃时的“暖冰”所发生的变化只是水由液态变为固态,没有生成新物质,所以是物理变化,D正确。
16.C
【分析】
该有机物的结构为,据此可以看出,该有机物中最多有5个碳原子在同一条直线上,所有的碳原子(11个)都可能在同一平面上,而-CH3上的氢原子最多只有1个在此平面上。
【详解】
A.根据有机物的结构简式可知,该有机物中有6种不同化学环境的氢原子,故A错误;
B.有机物中含有甲基,甲基为四面体构型,则所有原子不可能在同一平面上,故B错误;
C.根据分析可知,该有机物中最多有5个碳原子在同一直线上,故C正确;
D.该有机物与萘的结构不相似,二者不互为同系物,故D错误。
故选:C。
17.D
【分析】
羟基和苯环直接相连的化合物是酚,据此解答。
【详解】
①是醇类,②是酚类,③是酚类,④是醇类,⑤是酚类,②③⑤符合,答案选D。
18.B
【解析】A、氯化铵是铵盐,含有离子键和共价键,A错误;B、水是共价化合物,含有共价键,B正确;C、氯化钾是离子化合物,含有离子键,C错误;D、氢氧化钠是含有离子键和共价键的离子化合物,D错误,答案选B。
点睛:掌握离子键和共价键的形成条件是解答的关键,一般活泼的金属和活泼的非金属容易形成离子键,非金属元素的原子间容易形成共价键。
19.B
【详解】
A.在NaCl晶体中,距Na+最近的Cl-有6个,分别位于Na+的上、下、左、右、前、后,围成正八面体,A正确;
B.乙是一个分子,不是晶胞,所以分子式为E4F4或F4E4,B错误;
C.没有氢键的分子晶体都是分子密堆积结构,所以1个CO2分子周围有12个CO2分子紧邻,C正确;
D.碘晶体中,有I2分子内部的碘原子间的非极性共价键,还有碘分子间的范德华力,D正确;
故选B。
【点睛】
本题易错选项B,注意题目说法,不要凭经验,把乙当做晶胞。
20.C
【解析】
冰是分子晶体,熔化为水时破坏氢键、分子间作用力,A错误;Na2SO4属于离子化合物,熔融时电离破坏离子键,B错误;HCl中含有共价键,溶于水发生电离,破坏,C正确;NH4Cl溶于水破坏了离子键和共价键,D错误;正确选项:C。
21.⑤ ④ ③ ①
【解析】
【详解】
①O2和O3是O元素的不同性质的单质,二者互为同素异形体;
②H2、D2、T2是H元素的三种同位素原子形成的氢气分子,属于同一物质;
③和是C元素的两种不同原子,二者互为同位素;
④CH3CH2CH2CH3和分子式相同,结构不同,二者互为同分异构体;
⑤乙烷和丁烷分子结构相似,在分子组成上相差2个CH2原子团,互为同系物。
故互为同系物的是⑤,互为同分异构体的是④,互为同位素的是③,互为同素异形体的是①。
22.CH3CH2OH或C2H5OH 水果 氧化 节约石油资源,减少汽车尾气对空气的污染
【分析】
根据乙醇的结构、性质及乙醇汽油的作用解答。
【详解】
①乙醇属于有机物中的醇类,官能团为羟基,乙醇分子可以看成是乙烷分子中的一个氢原子被—OH原子团取代而形成,分子式为C2H6O,结构简式为CH3CH2OH或C2H5OH,答案为:CH3CH2OH或C2H5OH;
②乙烯是植物生长的调节剂,可作水果的催熟剂,答案为:水果;
③三氧化铬的化学式为CrO3,Cr元素的化合价为+6,硫酸铬的化学式为Cr2(SO4)3,Cr元素的化合价为+3,三氧化铬遇乙醇转化为绿色的硫酸铬,Cr元素化合价降低发生还原反应,乙醇发生氧化反应,答案为:氧化;
④根据乙醇汽油的性质可知,使用乙醇汽油能节约石油资源,减少汽车尾气对空气的污染,答案为:节约石油资源,减少汽车尾气对空气的污染。
【点睛】
化合价升高为氧化反应,化合价降低为还原反应,抓住题中提供信息进行分析。
23. 共价晶体 共价 二者均为共价晶体,氮原子的半径小于磷原子,N-B键的键长小于P-B键,N-B键的键能大
【详解】
(1)根据均摊法该晶胞中Al原子的个数为,Ni原子的个数为,所以该合金的化学式为;
(2)根据晶体的熔点和晶胞结构可以判断该晶体为共价晶体,所以原子之间应该以共价键结合.每个晶胞中含有4个Ga和4个As,所以晶胞质量为,进而得到晶胞体积为; 每个晶胞中含有4个Ga原子和4个As原子,所以晶胞中原子占有的总体积为;故GaAs晶胞中原子的体积占晶胞体积的百分率为;
(3)由晶胞结构可知,Ba位于体心,个数为1,Ti位于顶点,个数为,O位于棱心,个数为,故其化学式为;晶胞质量为,故晶体密度;
(4)①根据晶胞结构可知,每个B原子与4个P原子形成4个键,则B原子的杂化轨道类型为;氮化硼与磷化硼都为共价晶体,原子半径越小,共价键越短,共价键的键能越大,晶体熔点越高;
②根据均摊法可知1个晶胞中含有4个B原子和4个P原子,则晶胞的质量为,晶胞体积为,则晶体密度;硼与磷原子的最近核间距为体对角线长的,则。
24. 碳碳双键 羟基 a c
【分析】
根据C、H、O的价键结构,左上方应该是碳碳双键,后上方是碳氧双键,根据同系物和同分异构体的定义来分析。
【详解】
⑴ 根据C、H、O的价键结构,左上方应该是碳碳双键,后上方是碳氧双键,因此物质的结构简式为;故答案为:。
⑵ 该物质中所含官能团的名称为碳碳双键、羧基;故答案为:碳碳双键、羧基。
⑶ a.CH3CH=CHCOOH与分子式相同,但结构不同,互为同分异构体;b.CH3CH2CH=CHCOOH与结构相似,组成相差一个CH2,是同系物,故答案为:a;c。
一、单选题
1.物质的提纯是化学实验中的一项重要操作,也是化工生产及物质制备中的主要环节。下列有关叙述中,正确的是 ( )
A.乙酸乙酯中混有乙酸,可用饱和Na2CO3溶液洗涤,然后分液分离出乙酸乙酯
B.在提纯鸡蛋中的蛋白质时,可向鸡蛋清溶液中加入浓硝酸,然后将所得沉淀滤出,即得较纯的蛋白质
C.除去乙烷中少量的乙烯:光照条件下通入Cl2,气液分离
D.乙醇中含乙酸杂质,加入碳酸钠溶液洗涤,分液
2.下列关于丙烯(CH3—CH=CH2)的说法错误的是( )
A.丙烯分子有8个σ键,1个π键 B.丙烯分子中3个碳原子都是sp3杂化
C.丙烯分子存在非极性键 D.丙烯分子中3个碳原子在同一平面上
3.下列各对物质中,互为同系物的是
A.CH3-CH=CH2与 B.与
C.甲苯和二甲苯 D.CH2=CH—CH=CH2和CH3CH2CH2C≡CH
4.下列叙述中正确的是
A.在离子化合物中一定含有金属元素
B.在离子化合物中不可能存在非极性键
C.共价化合物中一定没有金属元素
D.共价化合物中可能既有极性键也有非极性键
5.以下有关杂化轨道的说法中正确的是
A.sp3 杂化轨道中轨道数为 4,且 4 个杂化轨道能量相同
B.杂化轨道既可能形成σ键,也可能形成π键
C.杂化轨道不能容纳孤电子对
D.sp2杂化轨道最多可形成 2 个σ键
6.根据价层电子对互斥理论及原子的杂化理论判断PCl3分子的空间构型和中心原子的杂化方式为(?? )
A.直线形 sp杂化 B.三角形 sp2杂化
C.三角锥形 sp2杂化 D.三角锥形 sp3杂化
7.下列说法都不正确的是
①、CH3—CH=CH2和CH2=CH2的最简式相同
②、CH≡CH和C6H6含碳量相同
③、丁二烯和丁烯为同系物
④、正戊烷、异戊烷、新戊烷的沸点逐渐变低
⑤、标准状况下,11.2L的戊烷所含的分子数为0.5 NA (NA为阿伏加德罗常数)
⑥、能够快速、微量、精确的测定相对分子质量的物理方法是核磁共振氢谱法
A.① ② ⑥ B.② ③ ④ C.② ③ ⑥ D.③ ⑤ ⑥
8.对于A1型最密堆积的描述错误的是( )
A.A1型最密堆积晶体的晶胞也叫面心立方晶胞
B.面心立方晶胞的每个顶点上和每个面的中心上都各有一个微粒
C.平均每个面心立方晶胞中有14个微粒
D.A1型最密堆积可用符号“…ABCABC…”表示
9.分析下表中各项的排布规律,按此规律排布第 27 项应为
1
2
3
4
5
6
7
8
9
10
C2H4
C2H6
C2H6O
C2H4O2
C3H6
C3H8
C3H8O
C3H6O2
C4H8
C4H10
A.C7H16 B.C7H14O2 C.C8H18 D.C8H18O
10.下列化学用语表达正确的是
A.硝基苯的结构简式:
B.NH4Cl的电子式:
C.的名称为3,3-二甲基戊烷
D.具有16个质子、16个中子和18个电子的微粒一定是S2-
11.下列关于乙烯(CH2 =CH2)的说法不正确的是
A.乙烯分子中2个碳原子都是sp2杂化 B.乙烯分子中存在非极性键
C.乙烯分子中4个H原子在同一平面上 D.乙烯分子具有手性异构
12.将1molCH4与氯气发生取代反应,待反应完全后,测定四种有机物的物质的量相等,则产生HCl的物质的量是
A.0.5mol B.2 mol C.2.5 mol D.4mol
13.下面是从实验中测得的不同物质中氧氧键的键长和键能的数据:
O—O键
O22-
O2-
O2
O2+
键长/10-12 m
149
128
121
112
键能/kJ·mol-1
x
y
z=494
w=628
其中x、y的键能数据尚未测定,但可根据规律推导出键能的大小顺序为w>z>y>x。则该规律是( )
A.键长越长,键能越小
B.成键所用的电子数越多,键能越大
C.成键所用的电子数越少,键能越大
D.成键时共用电子越偏移,键能越大
14.下列化学用语的表达不正确的是
A.二氧化碳的比例模型 B.硫原子的结构示意图
C.的原子核内有8个中子 D.NH4Cl的电子式
15.2018年1月26日,中国科技大学的教授们将水置于一个20 ℃、足够强的电场中,水分子瞬间凝固形成“暖冰”。则关于“暖冰”的判断正确的是
A.“暖冰”中存在离子键
B.“暖冰”中水分子的O-H键是非极性键
C.“暖冰”有良好的导电性和导热性
D.水凝固形成20 ℃时的“暖冰”所发生的变化是物理变化
16.下列关于的说法正确的是
A.含有5种不同化学环境的氢
B.所有原子都可能在同一平面上
C.最多有5个碳原子在同一直线上
D.该物质与萘()互为同系物
17.下列物质属于酚类的是( )
① ② ③ ④ ⑤
A.①② B.①②③ C.①②③④⑤ D.②③⑤
18.下列物质中, 只含有共价键的是
A.NH4Cl B.H2O C.KCl D.NaOH
19.有关晶体的结构如图所示,下列说法中不正确的是( )
A.在NaCl晶体(图甲)中,距Na+最近的Cl-围成正八面体
B.该气态团簇分子(图乙)的分子式为EF或FE
C.在CO2晶体(图丙)中,一个CO2分子周围有12个CO2分子紧邻
D.在碘晶体(图丁)中,存在的作用力有非极性键和范德华力
20.下列变化过程中,只破坏共价键的是
A.冰变水 B.Na2SO4熔融呈液态
C.HCl溶于水得盐酸 D.NH4Cl溶于水
二、填空题
21.下列各组物质:①O2和O3 ②H2、D2、T2 ③和 ④CH3CH2CH2CH3和乙烷和丁烷
请用序号回答下列问题:
互为同系物的是______,互为同分异构体的是______,互为同位素的是______,互为同素异形体的是______。
22.乙醇汽油作为汽车的燃料,它是由粮食及各种植物纤维加工成的燃料——乙醇,与汽油按一定比例混配形成的。乙醇汽油作为一种新型清洁燃料,可以有效降低一氧化碳、碳氢化合物等主要污染物的排放,是目前世界上可再生能源的发展重点。
完成下列填空:
①乙醇的结构简式为___________。
②乙烯可以作_____________的催熟剂。
③三氧化铬酒驾原理是遇乙醇转化为绿色的硫酸铬。该过程中乙醇发生_________反应(选填“氧化”或“还原”)。
④写出推广使用乙醇汽油的好处:________________。
三、计算题
23.(1)Ni与Al形成的一种合金可用于铸造飞机发动机叶片,其晶胞结构如图所示,该合金的化学式为________.
(2)的熔点为1238℃,密度为,其晶胞结构如图所示.该晶体的类型为_________,Ga与As以__________键结合.设Ga和As的摩尔质量分别为和,原子半径分别为和,阿伏加德罗常数的值为,则GaAs晶胞中原子的体积占晶胞体积的百分率为_____________(列出含、M2、r1、r2、和的计算式).
(3)自然界中有丰富的钛矿资源,如图表示的是钡钛矿晶体的晶胞结构,经X射线衍射分析,该晶胞为正方体,晶胞参数为apm.
写出钡钛矿晶体的化学式:_____,其密度是_____(设阿伏加德罗常数的值为).
(4)①磷化硼是一种受到高度关注的耐磨涂料,它可用作金属的表面保护层.如图是磷化硼晶体的晶胞,B原子的杂化轨道类型是______.立方相氮化硼晶体的熔点要比磷化硼晶体的高,其原因是_____.
②已知磷化硼的晶胞参数,请列式计算该晶体的密度______(用含的代数式表示即可,不需要计算出结果).晶胞中硼原子和磷原子最近的核间距d为_______pm.
四、有机推断题
24.某物质只含C、H、O三种元素,其分子模型如图所示,分子中共有12个原子(图中球与球之间的连线代表单键、双键等化学键)。
(1)该物质的结构简式为______。
(2)该物质中含有两种官能团,其名称分别为______、_______。
(3)下列物质中,与该物质互为同分异构体的是________(填序号,下同),互为同系物的是_______。
a.CH3CH=CHCOOH b.CH2=CHCOOCH3
c.CH3CH2CH=CHCOOH d.CH3CH(CH3)COOH
参考答案
1.A
【详解】
A.乙酸乙酯不溶于饱和Na2CO3溶液,乙酸的酸性比碳酸强,能与Na2CO3反应生成二氧化碳而被吸收,然后分液可得到纯净的乙酸乙酯,故A正确;
B.浓硝酸可以使蛋白质变性,变性为不可逆过程,最终得不到纯净的蛋白质,故B错误;
C.光照条件下乙烷可以和Cl2反应,最终得不到乙烷,故C错误;
D.乙醇与水互溶,混合液不会分层,该方法无法分离出乙醇,故D错误;
故选A。
【点睛】
注意掌握化学实验基本操作方法,明确常见元素及其化合物性质为解答关键。
2.B
【详解】
A.丙烯中含有6个C-H单键,1个C-C单键和1个碳碳双键,因为双键是由1个σ键和1个π键构成,A选项正确;
B.丙烯中的2个不饱和碳原子是sp2杂化,甲基碳原子才是sp3杂化,B选项错误;
C.丙烯分子中的C原子和C原子之间形成非极性键,C选项正确;
D.由于甲基是和不饱和碳原子直接相连的,而碳碳双键是平面型结构,所以丙烯分子中3个碳原子在同一平面上,D选项正确;
答案选B。
3.C
【详解】
结构相似,组成上相差1个或者若干个CH2的化合物互称为同系物。
A.结构不相似,CH3-CH=CH2为烯烃,含有碳碳双键,为环烷烃,不是同系物,不符合题题意;
B.两种有机物分别为苯酚和苯甲醇,苯酚中,羟基直接与苯环相连,而苯甲醇中,羟基与苯环的侧链相连,不是同系物,不符合题意;
C.甲苯的结构简式为,二甲苯中邻二甲苯的结构简式为,结构相似,分子式分别为C7H8和C8H10,相差1个CH2,为同系物,符合题意;
D.CH2=CH—CH=CH2和CH3CH2CH2C≡CH,结构不同,官能团分别为碳碳双键和碳碳三键,不符合题意;
本题答案选C。
【点睛】
在同系物中,结构相似指的是官能团的种类和数目相同,它们应该属于同类物质。
4.D
【解析】
【详解】
A. 离子化合物中不一定含有金属元素,例如氯化铵等,故A错误;
B.离子化合物一定含离子键,也可能含极性键或非极性键,如NaOH中含有极性键,Na2O2中含有非极性键,故B错误;
B. 共价化合物中也可能含有金属元素,例如氯化铝,故C错误;
D. 共价化合物如过氧化氢,既有极性键也有非极性键,所以D选项是正确的。
故答案选D。
5.A
【详解】
A. 杂化前后轨道数目不变,杂化后轨道能量相同,因此sp3杂化轨道中轨道数为4,且4个杂化轨道能量相同,故A正确;
B. 杂化轨道只能形成σ键,π键是未参与杂化的p轨道形成的,故B错误;
C. 杂化轨道可以容纳孤电子对,比如氨气,故C错误;
D. sp2杂化,轨道数目有3个,因此最多可形成3个σ键,故D错误。
综上所述,答案为A。
6.D
【详解】
PCl3分子中P原子的价层电子对个数=3+×(5-3×1)=4,且含有一个孤电子对,则该分子中中心原子采用sp3杂化,分子构型为三角锥形,故答案为D。
【点睛】
ABm型杂化类型的判断:中心原子电子对计算公式:价电子对数n=(中心原子的价电子数+配位原子的价电子数×m±电荷数);注意:①当上述公式中电荷数为正值时取“-”,电荷数为负值时取“+”;②当配位原子为氧原子或硫原子时,成键电子数为零;根据n值判断杂化类型:一般有如下规律:当n=2,sp杂化;n=3,sp2杂化;n=4,sp3杂化。
7.D
【分析】
【详解】
①CH3-CH=CH2和CH2=CH2的最简式的是CH2,二者的最简式相同,故①正确;
②CH≡CH和C6H6的最简式的是CH,所以二者的含碳量相同,故②正确;
③丁二烯和丁烯中碳碳双键的数目不同,二者不是同系物,故③错误;
④正戊烷、异戊烷、新戊烷分子中含有的碳原子数目,含有的支链逐渐增多,则它们的沸点逐渐变低,故④正确;
⑤标准状况下,戊烷的状态不是气体,题中条件无法计算11.2L的戊烷的物质的量,故⑤错误;
⑥能够快速、微量、精确的测定相对分子质量的物理方法是质谱法,而核磁共振谱法可确定有机物中H的种类,故⑥错误;
根据以上分析,错误的有:③⑤⑥,故选D。
8.C
【详解】
A.A1型最密堆积晶体的晶胞中微粒位于晶胞的每个顶点和面心,所以也叫面心立方晶胞,A正确;
B.面心立方晶胞的每个顶点上和每个面的中心上都各有一个微粒,B正确;
C.根据均摊法,平均每个面心立方晶胞中有=4个微粒,C错误;
D.面心立方晶胞在三维空间里以密置层采取ABCABC…堆积,D正确;
故答案为C。
9.D
【详解】
根据表中的化学式规律采用分组分类法推出:每4个化学式为一组,依次是烯烃、烷烃、饱和一元醇或醚等、饱和一元羧酸或酯等;把表中化学式分为4循环,27=4×6+3,即第27项应在第7组第三位的饱和一元醇,相邻组碳原子数相差1,该组中碳原子数为2+(7-1)×1=8,故第27项则为C8H18O;
答案选D。
10.C
【详解】
A.硝基中的氮原子应直接与苯环上的碳相连接,硝基苯正确的结构简式为:,故A错误;
B.氯化铵为离子化合物,铵根离子和氯离子都需要标出所带电荷及原子的最外层电子,氯化铵正确的电子式为:,故B错误;
C.为烷烃,最长碳链含有5个C,主链为戊烷,在3号C含有两个甲基,有机物的名称为:3,3-二甲基戍烷,故C正确;
D.含有16个质子、16个中子和18个电子的微粒可能为过氧根离子:,不一定为硫离子,故D错误;
故答案为C。
11.D
【详解】
A.乙烯分子中2个碳原子的价层电子对数为3,所以碳碳双键两端的碳原子采用sp2杂化,故A正确;
B.同种非金属元素之间存在非极性共价键,不同非金属元素之间存在极性共价键,所以分子存在非极性键,故B正确;
C.乙烯分子的空间结构为平面形结构,所以4个H原子在同一平面上,故C正确;
D.具有手性异构,分子中至少存在1个连接4个不同原子或基团的碳原子,故乙烯分子不具有手性异构,故D错误。
故选D。
12.C
【解析】
【详解】
四种有机物的物质的量相等,即分别都是0.25mol,则消耗氯气的物质的量分别是0.25mol+0.25mol×2+0.25mol×3+0.25mol×4=2.5mol,答案选C。
13.A
【详解】
A、根据表中数据以及键能大小的顺序是w>z>y>x,可知键长越长,键能越小,故A正确;
B、O2和O2+成键所用电子数均为4个,但键能不同,分别为:494kJ/mol、628kJ/mol,键能与成键所用的电子数无关,故B错误;
C、O2和O2+成键所用电子数均为4个,但键能不同,分别为:494kJ/mol、628kJ/mol,键能与成键所用的电子数无关,故C错误;
D、这些微粒都是由相同的原子组成,电子对无偏移,且电子对偏移程度与键能无关,而是与原子吸引电子能力的相对大小有关,故D错误;
答案选A。
14.A
【详解】
A.二氧化碳分子为直线型结构,三个原子在同一条直线上,A不正确;
B.硫原子的核电荷数为16,核外电子数为16,结构示意图为,B正确;
C.的原子核内含中子的个数为14-6=8,C正确;
D.NH4Cl由NH4+和Cl-构成,电子式为,D正确;
故选A。
【点睛】
简单阳离子的电子式就是它的离子符号,若阳离子由原子团构成,则书写电子式时,必须加 [ ]及带电荷。
15.D
【解析】
A. 水属于共价化合物,所以“暖冰”中只存在共价键,A不正确;B. “暖冰”中水分子的O—H键是不同原子间的共价键,是极性键,B不正确;C. “暖冰”属于分子晶体,晶体中没有自由移动的离子,没有导电性和导热性,C不正确;D. 水凝固形成20℃时的“暖冰”所发生的变化只是水由液态变为固态,没有生成新物质,所以是物理变化,D正确。
16.C
【分析】
该有机物的结构为,据此可以看出,该有机物中最多有5个碳原子在同一条直线上,所有的碳原子(11个)都可能在同一平面上,而-CH3上的氢原子最多只有1个在此平面上。
【详解】
A.根据有机物的结构简式可知,该有机物中有6种不同化学环境的氢原子,故A错误;
B.有机物中含有甲基,甲基为四面体构型,则所有原子不可能在同一平面上,故B错误;
C.根据分析可知,该有机物中最多有5个碳原子在同一直线上,故C正确;
D.该有机物与萘的结构不相似,二者不互为同系物,故D错误。
故选:C。
17.D
【分析】
羟基和苯环直接相连的化合物是酚,据此解答。
【详解】
①是醇类,②是酚类,③是酚类,④是醇类,⑤是酚类,②③⑤符合,答案选D。
18.B
【解析】A、氯化铵是铵盐,含有离子键和共价键,A错误;B、水是共价化合物,含有共价键,B正确;C、氯化钾是离子化合物,含有离子键,C错误;D、氢氧化钠是含有离子键和共价键的离子化合物,D错误,答案选B。
点睛:掌握离子键和共价键的形成条件是解答的关键,一般活泼的金属和活泼的非金属容易形成离子键,非金属元素的原子间容易形成共价键。
19.B
【详解】
A.在NaCl晶体中,距Na+最近的Cl-有6个,分别位于Na+的上、下、左、右、前、后,围成正八面体,A正确;
B.乙是一个分子,不是晶胞,所以分子式为E4F4或F4E4,B错误;
C.没有氢键的分子晶体都是分子密堆积结构,所以1个CO2分子周围有12个CO2分子紧邻,C正确;
D.碘晶体中,有I2分子内部的碘原子间的非极性共价键,还有碘分子间的范德华力,D正确;
故选B。
【点睛】
本题易错选项B,注意题目说法,不要凭经验,把乙当做晶胞。
20.C
【解析】
冰是分子晶体,熔化为水时破坏氢键、分子间作用力,A错误;Na2SO4属于离子化合物,熔融时电离破坏离子键,B错误;HCl中含有共价键,溶于水发生电离,破坏,C正确;NH4Cl溶于水破坏了离子键和共价键,D错误;正确选项:C。
21.⑤ ④ ③ ①
【解析】
【详解】
①O2和O3是O元素的不同性质的单质,二者互为同素异形体;
②H2、D2、T2是H元素的三种同位素原子形成的氢气分子,属于同一物质;
③和是C元素的两种不同原子,二者互为同位素;
④CH3CH2CH2CH3和分子式相同,结构不同,二者互为同分异构体;
⑤乙烷和丁烷分子结构相似,在分子组成上相差2个CH2原子团,互为同系物。
故互为同系物的是⑤,互为同分异构体的是④,互为同位素的是③,互为同素异形体的是①。
22.CH3CH2OH或C2H5OH 水果 氧化 节约石油资源,减少汽车尾气对空气的污染
【分析】
根据乙醇的结构、性质及乙醇汽油的作用解答。
【详解】
①乙醇属于有机物中的醇类,官能团为羟基,乙醇分子可以看成是乙烷分子中的一个氢原子被—OH原子团取代而形成,分子式为C2H6O,结构简式为CH3CH2OH或C2H5OH,答案为:CH3CH2OH或C2H5OH;
②乙烯是植物生长的调节剂,可作水果的催熟剂,答案为:水果;
③三氧化铬的化学式为CrO3,Cr元素的化合价为+6,硫酸铬的化学式为Cr2(SO4)3,Cr元素的化合价为+3,三氧化铬遇乙醇转化为绿色的硫酸铬,Cr元素化合价降低发生还原反应,乙醇发生氧化反应,答案为:氧化;
④根据乙醇汽油的性质可知,使用乙醇汽油能节约石油资源,减少汽车尾气对空气的污染,答案为:节约石油资源,减少汽车尾气对空气的污染。
【点睛】
化合价升高为氧化反应,化合价降低为还原反应,抓住题中提供信息进行分析。
23. 共价晶体 共价 二者均为共价晶体,氮原子的半径小于磷原子,N-B键的键长小于P-B键,N-B键的键能大
【详解】
(1)根据均摊法该晶胞中Al原子的个数为,Ni原子的个数为,所以该合金的化学式为;
(2)根据晶体的熔点和晶胞结构可以判断该晶体为共价晶体,所以原子之间应该以共价键结合.每个晶胞中含有4个Ga和4个As,所以晶胞质量为,进而得到晶胞体积为; 每个晶胞中含有4个Ga原子和4个As原子,所以晶胞中原子占有的总体积为;故GaAs晶胞中原子的体积占晶胞体积的百分率为;
(3)由晶胞结构可知,Ba位于体心,个数为1,Ti位于顶点,个数为,O位于棱心,个数为,故其化学式为;晶胞质量为,故晶体密度;
(4)①根据晶胞结构可知,每个B原子与4个P原子形成4个键,则B原子的杂化轨道类型为;氮化硼与磷化硼都为共价晶体,原子半径越小,共价键越短,共价键的键能越大,晶体熔点越高;
②根据均摊法可知1个晶胞中含有4个B原子和4个P原子,则晶胞的质量为,晶胞体积为,则晶体密度;硼与磷原子的最近核间距为体对角线长的,则。
24. 碳碳双键 羟基 a c
【分析】
根据C、H、O的价键结构,左上方应该是碳碳双键,后上方是碳氧双键,根据同系物和同分异构体的定义来分析。
【详解】
⑴ 根据C、H、O的价键结构,左上方应该是碳碳双键,后上方是碳氧双键,因此物质的结构简式为;故答案为:。
⑵ 该物质中所含官能团的名称为碳碳双键、羧基;故答案为:碳碳双键、羧基。
⑶ a.CH3CH=CHCOOH与分子式相同,但结构不同,互为同分异构体;b.CH3CH2CH=CHCOOH与结构相似,组成相差一个CH2,是同系物,故答案为:a;c。
同课章节目录
