酸、碱、盐的性质复习 教案
图片预览


文档简介
酸、碱、盐的性质复习
一、教学目标
1.知识与技能:
(1)理解酸碱盐之间发生复分解反应的条件。
(2)会用复分解反应的条件解决一些常见问题:鉴别、除杂等。
(3)能并设计和完成与之有关的实验。
2.过程和方法:
通过一些教师引导,学生总结,进一步提高学生解决实际问题的能力。
3.情感态度与价值观:
(1)根据所学知识来进行归纳,进一步增加学生的好奇心和求知欲。
(2)发展学生善于合作,勤于思考的科学精神
二、重点难点
利用酸碱盐的性质,解决物质共存、转化、除杂、鉴别等一系列问题。
三、教学方法
引导--归纳——运用教学模式教学过程:
四、教学过程
导入新课
我今天带来了六种试剂:稀硫酸、稀盐酸、氢氧化钠溶液、氢氧化钙溶液、碳酸钠溶液、氯化钠溶液,不小心,标签全都掉了,没法实验。同学们,你能帮帮我将这六瓶试剂鉴别出来吗?
师生共同讨论总结:利用酸碱盐的性质设计实验检验。
新课教学
在学生总体回顾酸、碱的通性和盐的性质的基础上,对各性质逐一进行具体提问让学生回答并举例
并让学生上黑板书写有关方程式
1、酸碱指示剂:
酸碱指示剂 酸性 中性 碱性
紫色石蕊溶液 红色 不变色 蓝色
无色酚酞 不变色 不变色 红色
[注意] ①指示剂遇到酸性溶液或碱性溶液时,变色的是指示剂,而不是酸性溶液或碱性溶液。
②根据指示剂颜色的变化,能判断溶液的酸碱性,但不能确定此溶液一定是酸或一定是碱。因为有的盐溶液可能会显酸性或碱性,如Na2CO3溶液显碱性。
2.盐酸、硫酸物理性质
盐酸为氯化氢的水溶液,为无色有刺激性气味液体。浓盐酸具有挥发性,在空气中瓶口能形成白雾, 有腐蚀性。
硫酸为无色无气味液体。浓硫酸易溶于水,具有吸水性、脱水性、腐蚀性。
[注意] ①稀释浓硫酸时,一定要把浓硫酸沿着器壁慢慢倒入水中,并不断搅动。原因是浓硫酸溶于水时会释放出大量的热量,会使液体向四周飞溅,发生危险。
②由于浓硫酸具有吸水性,常在实验室用作干燥剂。
③敞口盛放的浓盐酸和浓硫酸,浓盐酸因挥发性而使其质量减少,浓硫酸因吸水性,而使其质量增加,所以它们都要密封保存。
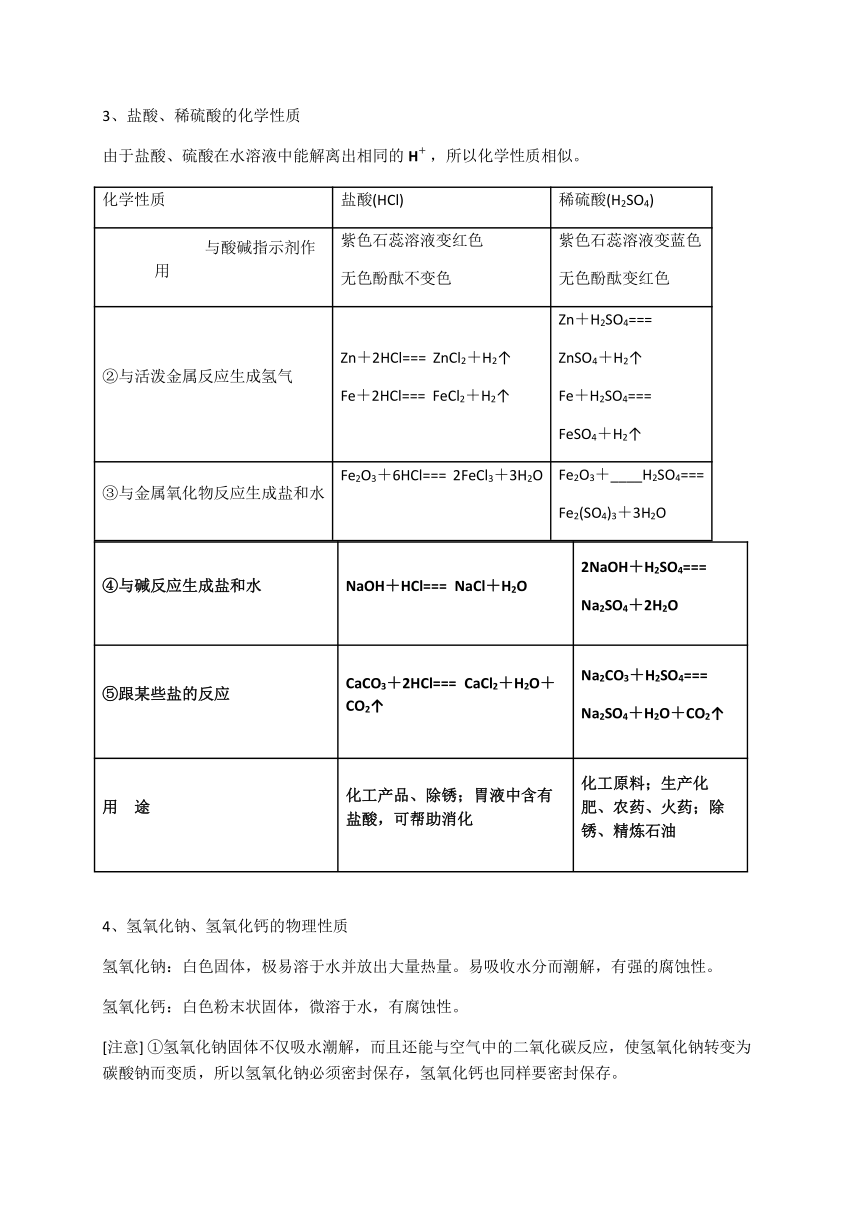
3、盐酸、稀硫酸的化学性质
由于盐酸、硫酸在水溶液中能解离出相同的H+ ,所以化学性质相似。
化学性质 盐酸(HCl) 稀硫酸(H2SO4)
与酸碱指示剂作用 紫色石蕊溶液变红色
无色酚酞不变色 紫色石蕊溶液变蓝色
无色酚酞变红色
②与活泼金属反应生成氢气 Zn+2HCl=== ZnCl2+H2↑
Fe+2HCl=== FeCl2+H2↑ Zn+H2SO4===
ZnSO4+H2↑
Fe+H2SO4===
FeSO4+H2↑
③与金属氧化物反应生成盐和水 Fe2O3+6HCl=== 2FeCl3+3H2O
Fe2O3+____H2SO4===
Fe2(SO4)3+3H2O
④与碱反应生成盐和水 NaOH+HCl=== NaCl+H2O 2NaOH+H2SO4===
Na2SO4+2H2O
⑤跟某些盐的反应 CaCO3+2HCl=== CaCl2+H2O+CO2↑ Na2CO3+H2SO4===
Na2SO4+H2O+CO2↑
用 途 化工产品、除锈;胃液中含有盐酸,可帮助消化 化工原料;生产化肥、农药、火药;除锈、精炼石油
4、氢氧化钠、氢氧化钙的物理性质
氢氧化钠:白色固体,极易溶于水并放出大量热量。易吸收水分而潮解,有强的腐蚀性。
氢氧化钙:白色粉末状固体,微溶于水,有腐蚀性。
[注意] ①氢氧化钠固体不仅吸水潮解,而且还能与空气中的二氧化碳反应,使氢氧化钠转变为碳酸钠而变质,所以氢氧化钠必须密封保存,氢氧化钙也同样要密封保存。
②氢氧化钙可用生石灰与水反应制得,此反应能放出大量的热。反应方程式是:
CaO+H2O=== Ca(OH)2
5、氢氧化钠、氢氧化钙的化学性质和用途
由于氢氧化钠、氢氧化钙在水溶液中能解离出相同的OH- ,所以化学性质相似。
化学性质 氢氧化钠(NaOH) 氢氧化钙[Ca(OH)2]
与酸碱指示剂作用 紫色石蕊溶液变蓝色
无色酚酞变红色 紫色石蕊溶液变蓝色
无色酚酞变红色
②与非金属氧化物反应 2NaOH+CO2=== Na2CO3+H2O
2NaOH+SO2=== Na2SO3+H2O CO2+Ca(OH)2=== CaCO3↓+H2O
SO2+Ca(OH)2=== CaSO3+H2O
③与酸反应生成盐和水 2NaOH+H2SO4=== Na2SO4+2H2O Ca(OH)2+2HCl=== CaCl2+2H2O
④与某些盐反应 2NaOH+CuSO4=== Cu(OH)2↓+Na2SO4 Ca(OH)2+Na2CO3=== CaCO3↓+2NaOH
用 途 制肥皂、造纸、纺织和印染;生活中可除油污 常用于建筑材料
6、盐的化学性质
7、生活中常见的盐
名称 化学式 俗称及主要成分 主要用途
氯化钠 NaCl 食盐的
主要成分 作调味品;配制生理盐水;工业上用来作原料制取碳酸钠、氢氧化钠等
碳酸钠 Na2CO3 纯碱、苏打 用于生产玻璃、造纸、纺织、洗涤剂
碳酸氢钠 NaHCO3 小苏打 发酵粉的主要成分,治疗胃酸过多的药剂
碳酸钙 CaCO3 石灰石、大理石
的主要成分 石灰石、大理石用作建筑材料及实验室制取二氧化碳,碳酸钙也可用于补钙剂
碳酸根离子的检验:取少量样品,加入足量稀盐酸,将生成气泡通入澄清石灰水。如果生成气泡,且澄清石灰水变浑浊,则证明样品中含有碳酸根离子。
粗盐的提纯
1.粗盐的初步提纯(除去不容性杂质)
(1)仪器:药匙、托盘天平、烧杯、玻璃棒、漏斗、铁架台、蒸发皿、酒精灯、坩埚钳。
(2)步骤:
①溶解;
②过滤;
③蒸发;
④计算产率。
(3)玻璃棒的作用:①搅拌,加速溶解 ;
②引流;
③防止液滴飞溅 ;
④转移固体。
8、酸、碱、盐的溶解性
酸:大多数都可溶。
碱:只有氨水、氢氧化钾、氢氧化钠、氢氧化钡可溶于水,氢氧化钙微溶于水,其余均为沉淀。
盐:钾盐、钠盐、铵盐、硝酸盐都可溶;
氯化物除氯化银难溶外,其余多数均可溶;
硫酸盐除硫酸钡难溶,其余多数可溶;
碳酸盐除碳酸钾、碳酸钠、碳酸铵可溶,其余都难溶。
9、酸、碱、盐在溶液中发生复分解反应的条件
酸、碱、盐之间并不是都能发生反应,只有当两种化合物互相交换成分,生成物中有沉淀、水或气体生成时,复分解反应才能发生。
[注意] 当碱与盐、盐与盐反应时,除了生成物中有沉淀、气体或水以外,参加反应的碱和盐、盐和盐都必须可溶。
师生复习后,再相互讨论总结辨别稀硫酸、稀盐酸、氢氧化钠溶液、氢氧化钙溶液、碳酸钠溶液、氯化钠溶液的方法。
小结: 1、酸、碱、盐的组成、分类。
2、酸、碱、盐的化学性质。
作业布置:完成酸碱盐专题复习学案
板书设计:
酸、碱、盐的性质
一、酸的性质
二、碱的性质
三、盐的性质
一、教学目标
1.知识与技能:
(1)理解酸碱盐之间发生复分解反应的条件。
(2)会用复分解反应的条件解决一些常见问题:鉴别、除杂等。
(3)能并设计和完成与之有关的实验。
2.过程和方法:
通过一些教师引导,学生总结,进一步提高学生解决实际问题的能力。
3.情感态度与价值观:
(1)根据所学知识来进行归纳,进一步增加学生的好奇心和求知欲。
(2)发展学生善于合作,勤于思考的科学精神
二、重点难点
利用酸碱盐的性质,解决物质共存、转化、除杂、鉴别等一系列问题。
三、教学方法
引导--归纳——运用教学模式教学过程:
四、教学过程
导入新课
我今天带来了六种试剂:稀硫酸、稀盐酸、氢氧化钠溶液、氢氧化钙溶液、碳酸钠溶液、氯化钠溶液,不小心,标签全都掉了,没法实验。同学们,你能帮帮我将这六瓶试剂鉴别出来吗?
师生共同讨论总结:利用酸碱盐的性质设计实验检验。
新课教学
在学生总体回顾酸、碱的通性和盐的性质的基础上,对各性质逐一进行具体提问让学生回答并举例
并让学生上黑板书写有关方程式
1、酸碱指示剂:
酸碱指示剂 酸性 中性 碱性
紫色石蕊溶液 红色 不变色 蓝色
无色酚酞 不变色 不变色 红色
[注意] ①指示剂遇到酸性溶液或碱性溶液时,变色的是指示剂,而不是酸性溶液或碱性溶液。
②根据指示剂颜色的变化,能判断溶液的酸碱性,但不能确定此溶液一定是酸或一定是碱。因为有的盐溶液可能会显酸性或碱性,如Na2CO3溶液显碱性。
2.盐酸、硫酸物理性质
盐酸为氯化氢的水溶液,为无色有刺激性气味液体。浓盐酸具有挥发性,在空气中瓶口能形成白雾, 有腐蚀性。
硫酸为无色无气味液体。浓硫酸易溶于水,具有吸水性、脱水性、腐蚀性。
[注意] ①稀释浓硫酸时,一定要把浓硫酸沿着器壁慢慢倒入水中,并不断搅动。原因是浓硫酸溶于水时会释放出大量的热量,会使液体向四周飞溅,发生危险。
②由于浓硫酸具有吸水性,常在实验室用作干燥剂。
③敞口盛放的浓盐酸和浓硫酸,浓盐酸因挥发性而使其质量减少,浓硫酸因吸水性,而使其质量增加,所以它们都要密封保存。
3、盐酸、稀硫酸的化学性质
由于盐酸、硫酸在水溶液中能解离出相同的H+ ,所以化学性质相似。
化学性质 盐酸(HCl) 稀硫酸(H2SO4)
与酸碱指示剂作用 紫色石蕊溶液变红色
无色酚酞不变色 紫色石蕊溶液变蓝色
无色酚酞变红色
②与活泼金属反应生成氢气 Zn+2HCl=== ZnCl2+H2↑
Fe+2HCl=== FeCl2+H2↑ Zn+H2SO4===
ZnSO4+H2↑
Fe+H2SO4===
FeSO4+H2↑
③与金属氧化物反应生成盐和水 Fe2O3+6HCl=== 2FeCl3+3H2O
Fe2O3+____H2SO4===
Fe2(SO4)3+3H2O
④与碱反应生成盐和水 NaOH+HCl=== NaCl+H2O 2NaOH+H2SO4===
Na2SO4+2H2O
⑤跟某些盐的反应 CaCO3+2HCl=== CaCl2+H2O+CO2↑ Na2CO3+H2SO4===
Na2SO4+H2O+CO2↑
用 途 化工产品、除锈;胃液中含有盐酸,可帮助消化 化工原料;生产化肥、农药、火药;除锈、精炼石油
4、氢氧化钠、氢氧化钙的物理性质
氢氧化钠:白色固体,极易溶于水并放出大量热量。易吸收水分而潮解,有强的腐蚀性。
氢氧化钙:白色粉末状固体,微溶于水,有腐蚀性。
[注意] ①氢氧化钠固体不仅吸水潮解,而且还能与空气中的二氧化碳反应,使氢氧化钠转变为碳酸钠而变质,所以氢氧化钠必须密封保存,氢氧化钙也同样要密封保存。
②氢氧化钙可用生石灰与水反应制得,此反应能放出大量的热。反应方程式是:
CaO+H2O=== Ca(OH)2
5、氢氧化钠、氢氧化钙的化学性质和用途
由于氢氧化钠、氢氧化钙在水溶液中能解离出相同的OH- ,所以化学性质相似。
化学性质 氢氧化钠(NaOH) 氢氧化钙[Ca(OH)2]
与酸碱指示剂作用 紫色石蕊溶液变蓝色
无色酚酞变红色 紫色石蕊溶液变蓝色
无色酚酞变红色
②与非金属氧化物反应 2NaOH+CO2=== Na2CO3+H2O
2NaOH+SO2=== Na2SO3+H2O CO2+Ca(OH)2=== CaCO3↓+H2O
SO2+Ca(OH)2=== CaSO3+H2O
③与酸反应生成盐和水 2NaOH+H2SO4=== Na2SO4+2H2O Ca(OH)2+2HCl=== CaCl2+2H2O
④与某些盐反应 2NaOH+CuSO4=== Cu(OH)2↓+Na2SO4 Ca(OH)2+Na2CO3=== CaCO3↓+2NaOH
用 途 制肥皂、造纸、纺织和印染;生活中可除油污 常用于建筑材料
6、盐的化学性质
7、生活中常见的盐
名称 化学式 俗称及主要成分 主要用途
氯化钠 NaCl 食盐的
主要成分 作调味品;配制生理盐水;工业上用来作原料制取碳酸钠、氢氧化钠等
碳酸钠 Na2CO3 纯碱、苏打 用于生产玻璃、造纸、纺织、洗涤剂
碳酸氢钠 NaHCO3 小苏打 发酵粉的主要成分,治疗胃酸过多的药剂
碳酸钙 CaCO3 石灰石、大理石
的主要成分 石灰石、大理石用作建筑材料及实验室制取二氧化碳,碳酸钙也可用于补钙剂
碳酸根离子的检验:取少量样品,加入足量稀盐酸,将生成气泡通入澄清石灰水。如果生成气泡,且澄清石灰水变浑浊,则证明样品中含有碳酸根离子。
粗盐的提纯
1.粗盐的初步提纯(除去不容性杂质)
(1)仪器:药匙、托盘天平、烧杯、玻璃棒、漏斗、铁架台、蒸发皿、酒精灯、坩埚钳。
(2)步骤:
①溶解;
②过滤;
③蒸发;
④计算产率。
(3)玻璃棒的作用:①搅拌,加速溶解 ;
②引流;
③防止液滴飞溅 ;
④转移固体。
8、酸、碱、盐的溶解性
酸:大多数都可溶。
碱:只有氨水、氢氧化钾、氢氧化钠、氢氧化钡可溶于水,氢氧化钙微溶于水,其余均为沉淀。
盐:钾盐、钠盐、铵盐、硝酸盐都可溶;
氯化物除氯化银难溶外,其余多数均可溶;
硫酸盐除硫酸钡难溶,其余多数可溶;
碳酸盐除碳酸钾、碳酸钠、碳酸铵可溶,其余都难溶。
9、酸、碱、盐在溶液中发生复分解反应的条件
酸、碱、盐之间并不是都能发生反应,只有当两种化合物互相交换成分,生成物中有沉淀、水或气体生成时,复分解反应才能发生。
[注意] 当碱与盐、盐与盐反应时,除了生成物中有沉淀、气体或水以外,参加反应的碱和盐、盐和盐都必须可溶。
师生复习后,再相互讨论总结辨别稀硫酸、稀盐酸、氢氧化钠溶液、氢氧化钙溶液、碳酸钠溶液、氯化钠溶液的方法。
小结: 1、酸、碱、盐的组成、分类。
2、酸、碱、盐的化学性质。
作业布置:完成酸碱盐专题复习学案
板书设计:
酸、碱、盐的性质
一、酸的性质
二、碱的性质
三、盐的性质
同课章节目录
