2021年化学中考复习系列复分解反应和离子共存
文档属性
| 名称 | 2021年化学中考复习系列复分解反应和离子共存 |  | |
| 格式 | docx | ||
| 文件大小 | 247.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-04-10 09:48:44 | ||
图片预览




文档简介
化学中考复习系列复分解反应和离子共存
进门测试:
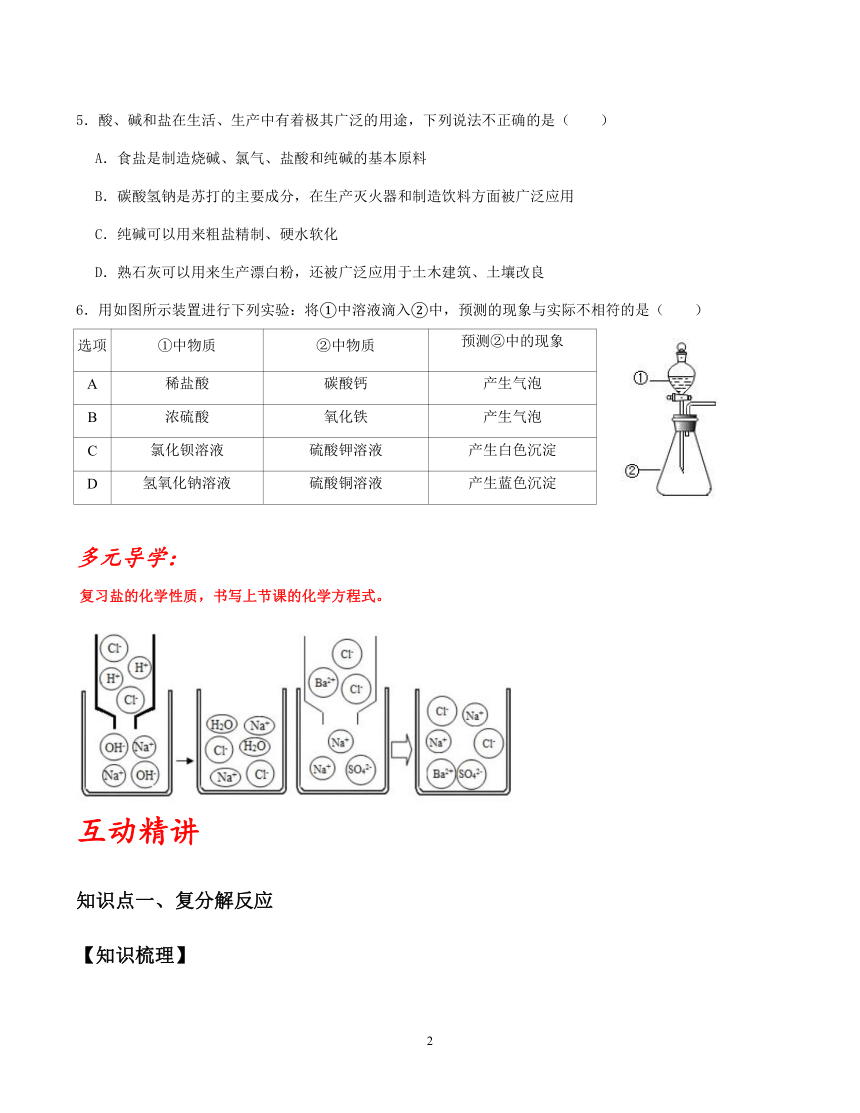
1.将珍珠加入稀盐酸中有气泡生成,生成的气体能使澄清石灰水变浑浊,则珍珠中含有下列离子中的( )
A.氯离子 B.碳酸根离子 C.硫酸根离子 D.氢氧根离子
2.(在粗盐提纯的实验中,下列操作不规范的是( )
A. B.溶解
C.过滤 D.蒸发
3.在盐酸、酒精、纯碱、熟石灰四种物质中,有关用途是:①建筑材料;②金属除锈;③洗涤剂;④燃料。按上述四种物质排列顺序的相应用途是( )
A.②④③① B.③④②① C.①③②④ D.④①③②
4.下列关于酸碱盐的用途不合理的是( )
A.用盐酸除铁锈
B.用氢氧化钠改良酸性土壤
C.用硫酸铜溶液与石灰乳混合配制农药波尔多液
D.用小苏打治疗胃酸过多
5.酸、碱和盐在生活、生产中有着极其广泛的用途,下列说法不正确的是( )
A.食盐是制造烧碱、氯气、盐酸和纯碱的基本原料
B.碳酸氢钠是苏打的主要成分,在生产灭火器和制造饮料方面被广泛应用
C.纯碱可以用来粗盐精制、硬水软化
D.熟石灰可以用来生产漂白粉,还被广泛应用于土木建筑、土壤改良
6.用如图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际不相符的是( )
选项
①中物质
②中物质
172402560960预测②中的现象
A
稀盐酸
碳酸钙
产生气泡
B
浓硫酸
氧化铁
产生气泡
C
氯化钡溶液
硫酸钾溶液
产生白色沉淀
D
氢氧化钠溶液
硫酸铜溶液
产生蓝色沉淀
多元导学:
复习盐的化学性质,书写上节课的化学方程式。
互动精讲
知识点一、复分解反应
【知识梳理】
一、复分解反应的概念
由两种化合物相互交换成分,生成另外两种化合物的反应,叫做复分解反应。
二、要明确复分解反应的要点
①酸+金属性氧化物
盐+水
条件:(1)酸一般为;(2)金属氧化物是否可溶均可。
但须注意,不溶性金属氧化物与反应时较慢,一般需要加热。如:
②酸+碱→盐+水
条件:(1)酸和碱至少有一种可溶;(2)若酸是常见的三种强酸,无论碱是否可溶,反应均可进行。如:
1、盐酸和氢氧化镁反应:
2、?盐酸和氢氧化钾反应:
3、盐酸和氢氧化铜反应:
4、?盐酸和氢氧化钙反应:
5、?盐酸和氢氧化铁反应:
③酸+盐→新酸+新盐
条件:(1)盐除和;(2)生成物中有沉淀、气体或水生成。如:
1.大理石与稀盐酸反应:
2.碳酸钠与稀盐酸反应
3.碳酸镁与稀盐酸反应:?
4. 硫酸和碳酸钠反应:
④碱+盐→新碱+新盐
条件:(1)碱和盐两者均要溶于水;(2)生成物中有沉淀或气体生成。
1.氢氧化钠与硫酸铜:
2.氢氧化钠与氯化铁:
3.氢氧化钠与氯化镁:
4.?氢氧化钙与碳酸钠:
⑤盐+盐→新盐+新盐
条件:(1)参加反应的两种盐都必须可溶;(2)新生成的两种盐中至少有一种是沉淀。
1.氯化钠溶液和硝酸银溶液:
2.硫酸钠和氯化钡: ?
三、熟记部分酸、碱、盐的溶解性表
钾、钠、铵、硝遇水溶;(含有的盐都能溶于水)
氯化物不溶亚汞银;(氯化物中和不溶于水,其它都能溶于水) 硫酸盐不溶硫酸钡;
微溶还有钙和银;(硫酸盐中不溶、微溶,其余均可溶)
其它盐类水下沉;(上面口诀中未包括的盐大多水溶于水) 酸类不溶是硅酸;(在酸类中只有硅酸不溶于水);溶碱只有钾、钠、钡、钙、铵(除KOH、、,外其它碱都不溶于水)
四、复分解反应的实质
在溶液中发生的复分解反应大多是在酸、碱、盐之间进行的,而酸、碱、盐都是在溶液中能电离出离子的化合物。因此复分解反应的实质是酸碱盐在溶液中发生的离子间的交换反应。当溶液中某些离子能相互结合而使其浓度减小时,那么反应就向减小离子浓度的方向进行。如果几种离子混合后,离子的浓度都不发生变化,那么反应也就没有发生。
【例题精讲】
1、判断下列物质能否发生反应,能反应的写出化学方程式,不能反应的说明原因。
①、Na2CO3 +BaCl2 ②、MgSO4 +KOH
③、FeCl3 +Cu (OH)2 ④、NaCl +KNO3
⑤、HCl +CaCO3 ⑥、Cu (OH)2 +HNO3
⑦、AgCl +NaNO3 ⑧、NaCl +Cu(OH)2
⑨、HCl +Mg(OH)2 ⑩、Na2SO4 +K2CO3
2、判断下列物质能否发生反应,能反应的写出化学方程式,不能反应的说明原因。
(1)硫酸铜与氯化钡 (2)氯化铁与硫酸
(3)碳酸钡与盐酸 (4)硝酸钾与氯化银
(5)氢氧化镁与盐酸 (6)氢氧化铜与氯化铁
(7)氢氧化钡与碳酸钠 (8)硫酸钡与盐酸
【巩固练习】
1、从铁、氧气、水、氧化钙、高锰酸钾、硫酸溶液、氢氧化钡溶液、氯化铜溶液、碳酸钠溶液中选择适当的物质,按下列要求各写一个化学方程式。
(1)单质和单质的化合反应
(2)化合物与化合物的化合反应
(3)产生两种单质的分解反应
(4)既有单质又有化合物生成的分解反应
(5)产生气体的置换反应
(6)没有气体产生的置换反应
(7)产生不溶于酸的白色沉淀的复分解反应
(8)产生能溶于酸的白色沉淀的复分解反应
(9)产生气体的复分解反应
(10) 产生蓝色沉淀的复分解反应
2、从Fe、Mg(OH))2、KClO3、干冰、MnO2、稀HNO3、H2O、CuSO4等物质中,选出适当物质(每种物质只能用一次),按下列要求写出化学方程式
化合反应
分解反应
置换反应
复分解反应
3、按箭头指向书写化学方程式
(1)CuSO4→ Cu(OH)2
(2)Cu(OH)2→Cu(NO3)2
(3)Na2CO3 → NaOH
(4)Ca(OH)2→CaCO3
(5)NaCl→ NaNO3
(6)HNO3→ KNO3
(8)Fe(OH)3 →Fe2(SO4)3
(8)MgCO3 → MgCl2
(9)Ca(NO3)2 → NaNO3
(10)Cu(OH)2→CuSO4
知识点二、离子共存
【知识梳理】
判断物质能否在溶液中共存,原因是发生复分解反应而不能共存:
1.共存的条件
(1)组内物质均可溶。
(2)在同一溶液中,物质(即所含离子)之间不发生反应,即不会生成沉淀、气体或水。
2.不能共存的离子
Cl-和Ag+(AgCl↓)
SO42-和Ba2+(BaSO4↓)
OH-
CO32-
HCO3-和H+(H2O+CO2↑)
3.物质共存的隐含条件
(1)pH<7或酸性溶液,则溶液一定存在H+,且该溶液中没有能与H+反应的物质(离子)。
常见的描述有:酸性溶液、pH=2(pH<7)的溶液、能使紫色石蕊溶液呈红色的溶液、加入活泼金属能放出氢气的溶液、加入碳酸盐或碳酸氢盐能放出气体的溶液等。
(2)pH>7或碱性溶液,则溶液一定存在OH-,且该溶液中没有能与OH-反应的物质(离子)。
常见的描述有:碱性溶液、pH=11(pH>7)的溶液、使无色酚酞溶液呈红色的溶液、使紫色石蕊溶液呈蓝色的溶液等。
(3)溶液为无色透明,则溶液一定不存在有色离子,如Cu2+、Fe2+、Fe3+、MnO4-等。溶液也不能形成浑浊或沉淀,即所给混合物中能发生反应生成沉淀的离子不能共存。
【例题精讲】
1.在的无色溶液中,下列离子可以大量共存的是( )
A.、、、 B.、、、
C.、、、 D.、、、
2.下列各组物质在pH=2的溶液中能大量共存且形成无色溶液的是( )
A.NaCl BaCl2 Na2CO3 B.KNO3 HCl CaCl2
C.H2SO4 FeCl3 NaNO3 D.NaOH HNO3 NH4NO3
3.下列各组离子在水中能大量共存的是( )
A.Na+、H+、Cl-、HCO3- B.H+、Na+、OH-、SO42-
C.Na+、K+、NO3- 、Cl- D.Ag+、Ca2+、Cl-、NO3-
【巩固练习】
1.在pH=1的溶液中,下列物质能大量共存,且溶液为无色的是( )
A.NaOH、NaCl、K2SO4 B.MgSO4、Cu(NO)3、KCl
C.KNO3、ZnCl2、Ca(NO3)2 D.CaCl2、(NH4)2SO4、K2CO3
2.下列各组物质在水溶液中能大量共存,且形成无色透明溶液的是( )
A.、、 B.、、
C.、、 D.、、
3.今有一混合物的水溶液,只可能含有以下离子中的若干种:Na+、NH4+、Ba2+、Cl-、CO32-、SO42-。现取两份200mL溶液进行如下实验:①第一份加足量NaOH溶液,加热,收集到气体0.68g;②第二份加足量BaCl2溶液后,得干燥沉淀6.27g,经足量盐酸洗涤、干燥后,沉淀质量为2.33g。根据上述实验,以下推测正确的是( )
A.一定不存在Ba2+,NH4+可能存在 B.CO32-一定存在
C.Na+一定不存在 D.一定不存在Cl-
课堂检测:
1、下列关于复分解反应的说法正确的是( )
A、中和反应不属于复分解反应
B、反应物必须都溶于水
C、反应物一定有酸
D、生成物一定有盐
2、判断复分解反应能否发生,不用考虑的是( )
A、生成物中是否有沉淀
B、生成物中是否有水
C、生成物中是否有气体
D、金属的活动性顺序
3、根据复分解反应发生的条件,判断下列物质间能否发生反应.下列不能发生反应的是( )
A、硝酸银溶液和氯化钠溶液
B、碳酸钠溶液和稀硫酸
C、硫酸铜溶液和氯化钡溶液
D、硫酸钾溶液和氯化钠溶液
4、下列两种溶液混合后,能发生反应,且溶液的总质量不会改变的是( )
A、氯化钠溶液和稀硫酸
B、碳酸钠溶液和稀盐酸
C、碳酸钠溶液和氯化钙溶液
D、氢氧化钠溶液和稀盐酸
5、按下表进行实验,有关说法及分析错误的是( )
向少量NaOH溶液中滴加CuSO4溶液
向少量BaCl2溶液中滴中CuSO4溶液
现象
①
白色沉淀
化学方程式
CuSO4+2NaOH=Cu(OH)2 ↓+CuCl2
②
A、①有蓝色沉淀
B、②反应的化学方程式为:CuSO4+BaCl2=BaSO4↓+CuCl2
C、两个反应都属于复分解反应
D、只要有沉淀生成的反应就属于复分解反应
6、下列物质在溶液中组内两两之间都能互相发生化学反应的是( )
A、硫酸铜 氯化钙 硝酸钠
B、硫酸 碳酸钾 氢氧化钡
C、氯化钙 碳酸钠 氢氧化钾
D、盐酸 硝酸钾 氢氧化锌
7、下列物质间的转化不能一步完成的是( )
A、KNO3 → NaCl B、HCl → NaCI
C、NaCl → AgCI D、H2SO4 → Na2SO4
8、某校化学兴趣小组的同学学习了酸、碱、盐的知识后,对课本中“酸、碱、盐之间并不是都能发生复分解反应”这句话产生了兴趣,展开了探究性学习.
(1)【提出问题】发生复分解反应应具备哪些条件?
(2)【活动探究】该小组同学进行以下四组实验,发现均能反应,请写出④的化学方程式:
①硝酸钡溶液与稀硫酸 ②稀硫酸与碳酸钾溶液 ③稀盐酸与氢氧化钠溶液
④硝酸钡溶液与碳酸钾溶液: .
(3)【理论分析】上述反应为什么能够发生?是因为在这些反应物的溶液中有特殊的阴、阳离子,它们两两结合生成了沉淀或气体或水.如:
①中有Ba2++SO42?→BaSO4↓
②中有H++CO32?→H2O+CO2↑
③中有H++OH?→H2O ④中有 两种离子,所以才发生化学反应.
(4)【得出结论】经过分析,该小组同学得出以下结论:生成物中是否有沉淀或气体或水,是判断酸、碱、盐之间能否发生复分解反应的主要条件.
(5)形成网络】按照一定的顺序排列某些离子,就可以形成一种知识网络.在网络中,用“??”相连接的阴、阳离子间能两两结合生成沉淀或气体或水.
现有Ca2+、HCO3?两种离子,请将它们填入下面合适的“圆圈”内,使其形成一个更为完整的复分解反应的知识网络.
238760241935
进门测试:
1.将珍珠加入稀盐酸中有气泡生成,生成的气体能使澄清石灰水变浑浊,则珍珠中含有下列离子中的( )
A.氯离子 B.碳酸根离子 C.硫酸根离子 D.氢氧根离子
2.(在粗盐提纯的实验中,下列操作不规范的是( )
A. B.溶解
C.过滤 D.蒸发
3.在盐酸、酒精、纯碱、熟石灰四种物质中,有关用途是:①建筑材料;②金属除锈;③洗涤剂;④燃料。按上述四种物质排列顺序的相应用途是( )
A.②④③① B.③④②① C.①③②④ D.④①③②
4.下列关于酸碱盐的用途不合理的是( )
A.用盐酸除铁锈
B.用氢氧化钠改良酸性土壤
C.用硫酸铜溶液与石灰乳混合配制农药波尔多液
D.用小苏打治疗胃酸过多
5.酸、碱和盐在生活、生产中有着极其广泛的用途,下列说法不正确的是( )
A.食盐是制造烧碱、氯气、盐酸和纯碱的基本原料
B.碳酸氢钠是苏打的主要成分,在生产灭火器和制造饮料方面被广泛应用
C.纯碱可以用来粗盐精制、硬水软化
D.熟石灰可以用来生产漂白粉,还被广泛应用于土木建筑、土壤改良
6.用如图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际不相符的是( )
选项
①中物质
②中物质
172402560960预测②中的现象
A
稀盐酸
碳酸钙
产生气泡
B
浓硫酸
氧化铁
产生气泡
C
氯化钡溶液
硫酸钾溶液
产生白色沉淀
D
氢氧化钠溶液
硫酸铜溶液
产生蓝色沉淀
多元导学:
复习盐的化学性质,书写上节课的化学方程式。
互动精讲
知识点一、复分解反应
【知识梳理】
一、复分解反应的概念
由两种化合物相互交换成分,生成另外两种化合物的反应,叫做复分解反应。
二、要明确复分解反应的要点
①酸+金属性氧化物
盐+水
条件:(1)酸一般为;(2)金属氧化物是否可溶均可。
但须注意,不溶性金属氧化物与反应时较慢,一般需要加热。如:
②酸+碱→盐+水
条件:(1)酸和碱至少有一种可溶;(2)若酸是常见的三种强酸,无论碱是否可溶,反应均可进行。如:
1、盐酸和氢氧化镁反应:
2、?盐酸和氢氧化钾反应:
3、盐酸和氢氧化铜反应:
4、?盐酸和氢氧化钙反应:
5、?盐酸和氢氧化铁反应:
③酸+盐→新酸+新盐
条件:(1)盐除和;(2)生成物中有沉淀、气体或水生成。如:
1.大理石与稀盐酸反应:
2.碳酸钠与稀盐酸反应
3.碳酸镁与稀盐酸反应:?
4. 硫酸和碳酸钠反应:
④碱+盐→新碱+新盐
条件:(1)碱和盐两者均要溶于水;(2)生成物中有沉淀或气体生成。
1.氢氧化钠与硫酸铜:
2.氢氧化钠与氯化铁:
3.氢氧化钠与氯化镁:
4.?氢氧化钙与碳酸钠:
⑤盐+盐→新盐+新盐
条件:(1)参加反应的两种盐都必须可溶;(2)新生成的两种盐中至少有一种是沉淀。
1.氯化钠溶液和硝酸银溶液:
2.硫酸钠和氯化钡: ?
三、熟记部分酸、碱、盐的溶解性表
钾、钠、铵、硝遇水溶;(含有的盐都能溶于水)
氯化物不溶亚汞银;(氯化物中和不溶于水,其它都能溶于水) 硫酸盐不溶硫酸钡;
微溶还有钙和银;(硫酸盐中不溶、微溶,其余均可溶)
其它盐类水下沉;(上面口诀中未包括的盐大多水溶于水) 酸类不溶是硅酸;(在酸类中只有硅酸不溶于水);溶碱只有钾、钠、钡、钙、铵(除KOH、、,外其它碱都不溶于水)
四、复分解反应的实质
在溶液中发生的复分解反应大多是在酸、碱、盐之间进行的,而酸、碱、盐都是在溶液中能电离出离子的化合物。因此复分解反应的实质是酸碱盐在溶液中发生的离子间的交换反应。当溶液中某些离子能相互结合而使其浓度减小时,那么反应就向减小离子浓度的方向进行。如果几种离子混合后,离子的浓度都不发生变化,那么反应也就没有发生。
【例题精讲】
1、判断下列物质能否发生反应,能反应的写出化学方程式,不能反应的说明原因。
①、Na2CO3 +BaCl2 ②、MgSO4 +KOH
③、FeCl3 +Cu (OH)2 ④、NaCl +KNO3
⑤、HCl +CaCO3 ⑥、Cu (OH)2 +HNO3
⑦、AgCl +NaNO3 ⑧、NaCl +Cu(OH)2
⑨、HCl +Mg(OH)2 ⑩、Na2SO4 +K2CO3
2、判断下列物质能否发生反应,能反应的写出化学方程式,不能反应的说明原因。
(1)硫酸铜与氯化钡 (2)氯化铁与硫酸
(3)碳酸钡与盐酸 (4)硝酸钾与氯化银
(5)氢氧化镁与盐酸 (6)氢氧化铜与氯化铁
(7)氢氧化钡与碳酸钠 (8)硫酸钡与盐酸
【巩固练习】
1、从铁、氧气、水、氧化钙、高锰酸钾、硫酸溶液、氢氧化钡溶液、氯化铜溶液、碳酸钠溶液中选择适当的物质,按下列要求各写一个化学方程式。
(1)单质和单质的化合反应
(2)化合物与化合物的化合反应
(3)产生两种单质的分解反应
(4)既有单质又有化合物生成的分解反应
(5)产生气体的置换反应
(6)没有气体产生的置换反应
(7)产生不溶于酸的白色沉淀的复分解反应
(8)产生能溶于酸的白色沉淀的复分解反应
(9)产生气体的复分解反应
(10) 产生蓝色沉淀的复分解反应
2、从Fe、Mg(OH))2、KClO3、干冰、MnO2、稀HNO3、H2O、CuSO4等物质中,选出适当物质(每种物质只能用一次),按下列要求写出化学方程式
化合反应
分解反应
置换反应
复分解反应
3、按箭头指向书写化学方程式
(1)CuSO4→ Cu(OH)2
(2)Cu(OH)2→Cu(NO3)2
(3)Na2CO3 → NaOH
(4)Ca(OH)2→CaCO3
(5)NaCl→ NaNO3
(6)HNO3→ KNO3
(8)Fe(OH)3 →Fe2(SO4)3
(8)MgCO3 → MgCl2
(9)Ca(NO3)2 → NaNO3
(10)Cu(OH)2→CuSO4
知识点二、离子共存
【知识梳理】
判断物质能否在溶液中共存,原因是发生复分解反应而不能共存:
1.共存的条件
(1)组内物质均可溶。
(2)在同一溶液中,物质(即所含离子)之间不发生反应,即不会生成沉淀、气体或水。
2.不能共存的离子
Cl-和Ag+(AgCl↓)
SO42-和Ba2+(BaSO4↓)
OH-
CO32-
HCO3-和H+(H2O+CO2↑)
3.物质共存的隐含条件
(1)pH<7或酸性溶液,则溶液一定存在H+,且该溶液中没有能与H+反应的物质(离子)。
常见的描述有:酸性溶液、pH=2(pH<7)的溶液、能使紫色石蕊溶液呈红色的溶液、加入活泼金属能放出氢气的溶液、加入碳酸盐或碳酸氢盐能放出气体的溶液等。
(2)pH>7或碱性溶液,则溶液一定存在OH-,且该溶液中没有能与OH-反应的物质(离子)。
常见的描述有:碱性溶液、pH=11(pH>7)的溶液、使无色酚酞溶液呈红色的溶液、使紫色石蕊溶液呈蓝色的溶液等。
(3)溶液为无色透明,则溶液一定不存在有色离子,如Cu2+、Fe2+、Fe3+、MnO4-等。溶液也不能形成浑浊或沉淀,即所给混合物中能发生反应生成沉淀的离子不能共存。
【例题精讲】
1.在的无色溶液中,下列离子可以大量共存的是( )
A.、、、 B.、、、
C.、、、 D.、、、
2.下列各组物质在pH=2的溶液中能大量共存且形成无色溶液的是( )
A.NaCl BaCl2 Na2CO3 B.KNO3 HCl CaCl2
C.H2SO4 FeCl3 NaNO3 D.NaOH HNO3 NH4NO3
3.下列各组离子在水中能大量共存的是( )
A.Na+、H+、Cl-、HCO3- B.H+、Na+、OH-、SO42-
C.Na+、K+、NO3- 、Cl- D.Ag+、Ca2+、Cl-、NO3-
【巩固练习】
1.在pH=1的溶液中,下列物质能大量共存,且溶液为无色的是( )
A.NaOH、NaCl、K2SO4 B.MgSO4、Cu(NO)3、KCl
C.KNO3、ZnCl2、Ca(NO3)2 D.CaCl2、(NH4)2SO4、K2CO3
2.下列各组物质在水溶液中能大量共存,且形成无色透明溶液的是( )
A.、、 B.、、
C.、、 D.、、
3.今有一混合物的水溶液,只可能含有以下离子中的若干种:Na+、NH4+、Ba2+、Cl-、CO32-、SO42-。现取两份200mL溶液进行如下实验:①第一份加足量NaOH溶液,加热,收集到气体0.68g;②第二份加足量BaCl2溶液后,得干燥沉淀6.27g,经足量盐酸洗涤、干燥后,沉淀质量为2.33g。根据上述实验,以下推测正确的是( )
A.一定不存在Ba2+,NH4+可能存在 B.CO32-一定存在
C.Na+一定不存在 D.一定不存在Cl-
课堂检测:
1、下列关于复分解反应的说法正确的是( )
A、中和反应不属于复分解反应
B、反应物必须都溶于水
C、反应物一定有酸
D、生成物一定有盐
2、判断复分解反应能否发生,不用考虑的是( )
A、生成物中是否有沉淀
B、生成物中是否有水
C、生成物中是否有气体
D、金属的活动性顺序
3、根据复分解反应发生的条件,判断下列物质间能否发生反应.下列不能发生反应的是( )
A、硝酸银溶液和氯化钠溶液
B、碳酸钠溶液和稀硫酸
C、硫酸铜溶液和氯化钡溶液
D、硫酸钾溶液和氯化钠溶液
4、下列两种溶液混合后,能发生反应,且溶液的总质量不会改变的是( )
A、氯化钠溶液和稀硫酸
B、碳酸钠溶液和稀盐酸
C、碳酸钠溶液和氯化钙溶液
D、氢氧化钠溶液和稀盐酸
5、按下表进行实验,有关说法及分析错误的是( )
向少量NaOH溶液中滴加CuSO4溶液
向少量BaCl2溶液中滴中CuSO4溶液
现象
①
白色沉淀
化学方程式
CuSO4+2NaOH=Cu(OH)2 ↓+CuCl2
②
A、①有蓝色沉淀
B、②反应的化学方程式为:CuSO4+BaCl2=BaSO4↓+CuCl2
C、两个反应都属于复分解反应
D、只要有沉淀生成的反应就属于复分解反应
6、下列物质在溶液中组内两两之间都能互相发生化学反应的是( )
A、硫酸铜 氯化钙 硝酸钠
B、硫酸 碳酸钾 氢氧化钡
C、氯化钙 碳酸钠 氢氧化钾
D、盐酸 硝酸钾 氢氧化锌
7、下列物质间的转化不能一步完成的是( )
A、KNO3 → NaCl B、HCl → NaCI
C、NaCl → AgCI D、H2SO4 → Na2SO4
8、某校化学兴趣小组的同学学习了酸、碱、盐的知识后,对课本中“酸、碱、盐之间并不是都能发生复分解反应”这句话产生了兴趣,展开了探究性学习.
(1)【提出问题】发生复分解反应应具备哪些条件?
(2)【活动探究】该小组同学进行以下四组实验,发现均能反应,请写出④的化学方程式:
①硝酸钡溶液与稀硫酸 ②稀硫酸与碳酸钾溶液 ③稀盐酸与氢氧化钠溶液
④硝酸钡溶液与碳酸钾溶液: .
(3)【理论分析】上述反应为什么能够发生?是因为在这些反应物的溶液中有特殊的阴、阳离子,它们两两结合生成了沉淀或气体或水.如:
①中有Ba2++SO42?→BaSO4↓
②中有H++CO32?→H2O+CO2↑
③中有H++OH?→H2O ④中有 两种离子,所以才发生化学反应.
(4)【得出结论】经过分析,该小组同学得出以下结论:生成物中是否有沉淀或气体或水,是判断酸、碱、盐之间能否发生复分解反应的主要条件.
(5)形成网络】按照一定的顺序排列某些离子,就可以形成一种知识网络.在网络中,用“??”相连接的阴、阳离子间能两两结合生成沉淀或气体或水.
现有Ca2+、HCO3?两种离子,请将它们填入下面合适的“圆圈”内,使其形成一个更为完整的复分解反应的知识网络.
238760241935
同课章节目录
