鲁教版化学九下 第七单元 常见的酸和碱 复习题(含答案)
文档属性
| 名称 | 鲁教版化学九下 第七单元 常见的酸和碱 复习题(含答案) |

|
|
| 格式 | docx | ||
| 文件大小 | 300.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-04-09 00:00:00 | ||
图片预览



文档简介
第七单元常见的酸和碱复习题
一、选择题
分类推断是化学学习和研究中常用的方法,以下几种分类推断中正确的是
A.碱溶液的 pH 大于 7,所以 pH 大于 7 的溶液都是碱溶液
B.酸碱中和反应生成盐和水,所以生成盐和水的反应都是中和反应
C.氧化物中都含氧元素,所以含有氧元素的化合物都是氧化物
D.酸性溶液能使紫色石蕊试液变红色,所以能使紫色石蕊试液变红色的一定是酸性溶液
在一定温度下,将少量生石灰放入一定的饱和石灰水中,搅拌并冷却、到原来的温度,下列说法中正确的是
A.溶剂质量不变 B.溶质质量增加 C.溶液浓度不变 D.溶解度增加
将含有等物质的量的烧碱和盐酸的溶液混合,充分反应后,滴加紫色石蕊试液,则溶液的颜色呈
A.红色 B.紫色 C.蓝色 D.无色
在向滴有紫色石蕊试液且含有 a?mol 硫酸的稀硫酸中滴加含 b 克氢氧化钠的氢氧化钠溶液,溶液恰好呈紫色,若将这些氢氧化钠溶液替换成含 b 克氢氧化钾的氢氧化钾溶液,混合后,溶液的颜色是(相对原子质量:H:1,S:32,O:16,K:39,Na:23)
A.红色 B.紫色 C.蓝色 D.无色
【 2014 门头沟一模 25 】下列图象与对应选项关系合理的是
A.在某温度下,向一定量接近饱和的硝酸钾溶液中,不断加入硝酸钾晶体
B.向 NaOH 溶液中滴中稀盐酸至过量
C.用相等质量的双氧水来制取氧气
D.电解水生成氢气和氧气
用稀硫酸除铁锈的原理是
A. FeO+H2SO4=4FeSO4+H2O
B. Fe2O3+3H2SO4=Fe2(SO4)3+3H2↑
C. Fe2O3+2H2SO4=2FeSO4+2H2O
D. Fe2O3+3H2SO4=Fe2(SO4)3+3H2O
某物质能使紫色石蕊溶液变为蓝色,关于该物质的下列说法中正确的是
A.该物质可能是氢氧化铜
B.该物质一定是纯碱的水溶液
C.可以将 pH 试纸放入该物质的稀溶液中测其 pH
D.向该物质的水溶液中滴加稀盐酸,溶液的 pH 一定变小
将等质量的氧化钙和氢氧化钙固体分别加入盛有等质量水的甲、乙两只烧杯中,搅拌后恢复至室温,均全部溶解。对甲、乙烧杯中溶液的分析正确的是
A.溶液的状态:乙一定是不饱和溶液 B.溶质的质量:甲小于乙
C.溶剂的质量:甲大于乙 D.溶质质量分数:甲、乙可能相等
若两种溶液混合后其 pH 值为 7,那么这两种溶液的 pH 值可能是
A. 4 和 5 B. 5 和 10 C. 0 和 7 D. 13 和 7
推理是一种重要的化学思维方法,下列叙述正确的是
A.离子是带电荷的粒子,则带电荷的粒子一定是离子
B.单质是由同种元素组成的,则由同种元素组成的物质一定是单质
C.溶液具有均一性和稳定性,则具有均一性和稳定性的液体一定是溶液
D.碱性溶液能使无色酚酞溶液变红,则能使无色酚酞溶液变红的溶液一定呈碱性
若将一瓶浓硫酸和一瓶浓盐酸都敞口放置在空气中,一段时间后,发生的变化是
A.两个溶液的质量都增大
B.两个溶液中溶质的质量分数都变大
C.两个溶液的 pH 都变大
D.两个溶液的酸性都增强
将 CO 、 CO2 、 H2,HCl,H2O(气)和 N2 的混合气体依次通过足量的下列物质:
① 浓硫酸 ② 饱和氢氧化钠溶液 ③ 灼热的氧化铜粉末,充分反应后的剩余气体是
A. N2 B. N2 、 CO2 、 H2O
C. N2 、 HCl D. N2 、 CO2
在以石灰石、水、碳酸钠为原料制取氢氧化钠的反应中,其反应的基本类型涉及的有
①化合 ②分解 ③置换 ④复分解
A.①② B.①②③ C.①②④ D.①②③④
某溶液的 pH=12,则分别滴入紫色石蕊试液、酚酞试液,溶液呈现
A.红色、无色 B.蓝色、红色 C.蓝色、无色 D.紫色、红色
将溶质质量分数为 10% 的氢氧化钠溶液 40?g,与溶质质量分数为 10% 的盐酸溶液 36.5?g 充分反应,常温下反应后溶液的 pH
A.大于 7 B.小于 7 C.等于 7 D.无法确定
取四朵用石蕊溶液染成的紫色干燥纸花进行以下实验,下列分析错误的是
实验①喷洒稀盐酸②喷洒水③放入干燥CO2中④喷水后放入CO2中花的颜色红色紫色紫色红色
A.①说明酸溶液可以使石蕊变红
B.①④对比说明④中产生了与盐酸性质相似的物质
C.②④对比说明水在石蕊变色过程中不发挥任何作用
D.②③④对比说明二氧化碳能和水反应
逻辑推理是一种重要的化学思维方法,以下推理合理的是
A.因为酸性的溶液能使石蕊变红,所以酸溶液一定能使石蕊变红
B.因为酸和碱中和反应生成盐和水,所以生成盐和水一定是中和反应
C.因为金属能和酸反应产生氢气,所以能和酸产生气体的一定是金属
D.酸性氧化物是非金属氧化物,所以非金属氧化物一定是酸性氧化物
工业用盐中含有的亚硝酸钠 (NaNO2) 是一种有毒物质,利用 NH4Cl 溶液可使 NaNO2 转化为无毒物质.该反应分两步进行:① NaNO2+NH4Cl=NaCl+NH4NO2 ② NH4NO2=N2↑+2H2O
下列叙述不正确的是
A. NH4NO2 由三种元素组成
B.反应①为复分解反应,反应②为分解反应
C.利用 NH4Cl 处理 NaNO2 最终转化为 NaCl 、 N2 和 H2O
D.上述反应所涉及的物质中,氮元素的化合价有四种
黄蜂的毒液呈碱性,若被黄蜂蜇了,涂抹下列物质可缓解疼痛的是
A.食盐水(pH≈7) B.牙膏(pH≈9)
C.米醋(pH≈3) D.肥皂水(pH≈10)
物质露置在空气中一段时间后质量增加且变质的是
A.浓硫酸 B.大理石 C.烧碱 D.浓盐酸
二、填空题
将氢氧化钠溶液滴入 色的氯化铁溶液中,看到的现象是 ,发生反应的化学方程式是 。
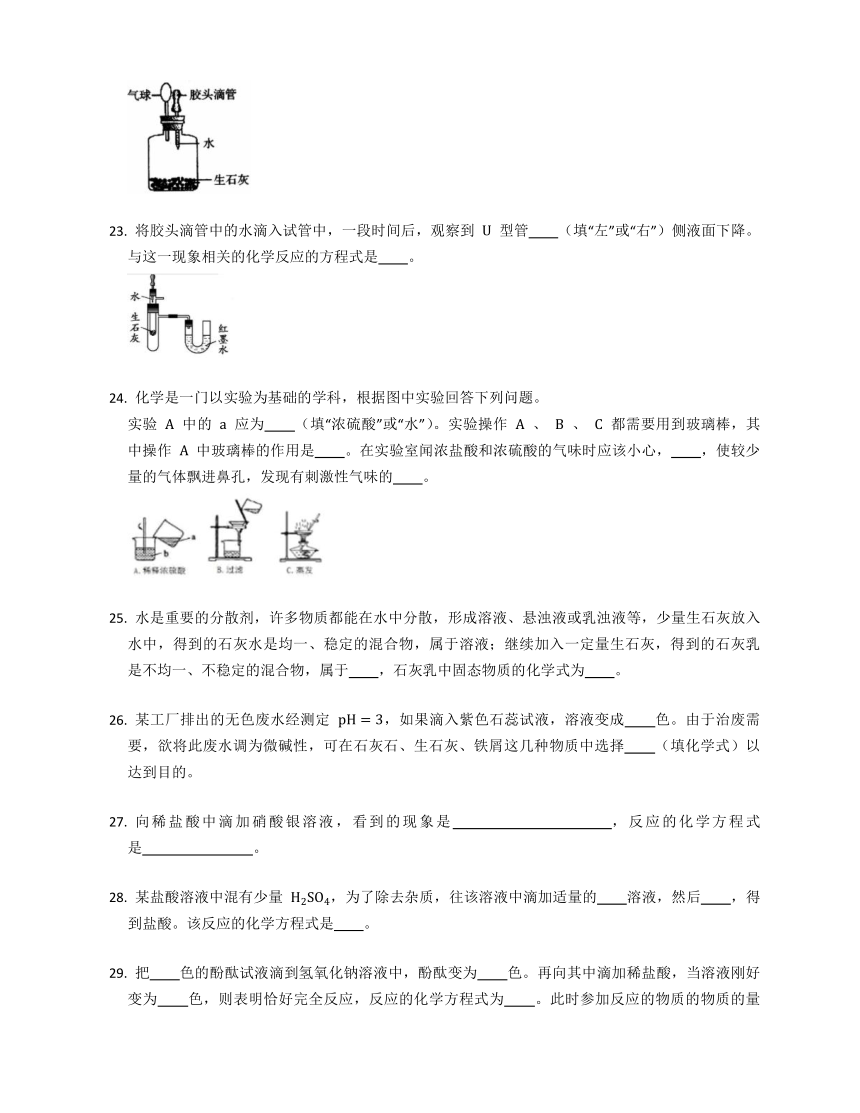
生石灰是氧化钙(CaO)的俗称,是一种常见的干燥剂,某同学按装置(如图)进行实验,看到气球变大(一段时间后又能恢复原状)。请分析气球变大的原因 。
将胶头滴管中的水滴入试管中,一段时间后,观察到 U 型管 (填“左”或“右”)侧液面下降。与这一现象相关的化学反应的方程式是 。
化学是一门以实验为基础的学科,根据图中实验回答下列问题。
实验 A 中的 a 应为 (填“浓硫酸”或“水”)。实验操作 A 、 B 、 C 都需要用到玻璃棒,其中操作 A 中玻璃棒的作用是 。在实验室闻浓盐酸和浓硫酸的气味时应该小心, ,使较少量的气体飘进鼻孔,发现有刺激性气味的 。
水是重要的分散剂,许多物质都能在水中分散,形成溶液、悬浊液或乳浊液等,少量生石灰放入水中,得到的石灰水是均一、稳定的混合物,属于溶液;继续加入一定量生石灰,得到的石灰乳是不均一、不稳定的混合物,属于 ,石灰乳中固态物质的化学式为 。
某工厂排出的无色废水经测定 pH=3,如果滴入紫色石蕊试液,溶液变成 色。由于治废需要,欲将此废水调为微碱性,可在石灰石、生石灰、铁屑这几种物质中选择 (填化学式)以达到目的。
向稀盐酸中滴加硝酸银溶液,看到的现象是 ,反应的化学方程式是 。
某盐酸溶液中混有少量 H2SO4,为了除去杂质,往该溶液中滴加适量的 溶液,然后 ,得到盐酸。该反应的化学方程式是 。
把 色的酚酞试液滴到氢氧化钠溶液中,酚酞变为 色。再向其中滴加稀盐酸,当溶液刚好变为 色,则表明恰好完全反应,反应的化学方程式为 。此时参加反应的物质的物质的量之比为 。40g10% 的氢氧化钠溶液中溶质的物质的量为 ,40g10% 的稀盐酸中,溶质的物质的量为 ,将两者混合后滴加石蕊试液,溶液呈 色,此时溶液中的溶质是 。上述两个实验中酚酞和石蕊的作用是: 。
工业上煅烧石灰石制取二氧化碳和生石灰,其化学方程式是 ;生石灰溶于水,放出大量热量,得到熟石灰,化学方程式是 。
三、计算题
某实验小组为测定铜和氧化铜的混合物中铜元素的含量,取 20?g 该固体混合物,向其中逐滴加入稀 H2SO4,测得剩余固体的质量与加入稀 H2SO4 的质量关系如图所示。
回答下列问题:
(1) 写出滴加稀 H2SO4 时发生反应的化学方程式 。
(2) 该固体混合物中铜元素的质量为 。
(3) 计算稀 H2SO4 中溶质的质量分数(写出计算过程)。
取 20?g 氢氧化钠溶液于烧杯中,将 9.8% 的稀硫酸逐滴加入烧杯,边加边搅拌,随着稀硫酸的不断加入,溶液 pH 的变化如下图所示,回答下列问题:
(1) a 点溶液中的溶质是 Na2SO4 和 (填化学式)。
(2) 计算该氢氧化钠溶液的溶质质量分数(写出计算过程)。
向 32?g 溶质质量分数为 25% 的氢氧化钠溶液中加入一定质量的硫酸铜溶液,恰好完全反应,过滤,所得溶液中溶质的质量分数为 10%。计算:所加硫酸铜溶液中溶质的质量分数。(计算结果精确至 0.1%)
胃舒平是治疗胃酸过多的药品,某批次该药片每片含 0.245?g 氢氧化铝,回答:
(1) 写出氢氧化铝跟盐酸反应的化学方程式。
(2) 计算每片胃舒平药片可以中和盐酸中的 HCl 多少摩尔?(保留到小数点后三位)
取 73?g 稀盐酸加入锥形瓶中,再逐滴滴加溶质质量分数为 10% 的 NaOH 溶液,反应过程中溶液的酸碱度变化如图所示。求该盐酸中溶质的质量分数。
答案
一、选择题
1. 【答案】D
2. 【答案】C
3. 【答案】B
4. 【答案】A
5. 【答案】B
6. 【答案】D
7. 【答案】D
8. 【答案】A
9. 【答案】B
10. 【答案】D
11. 【答案】C
12. 【答案】B
13. 【答案】C
14. 【答案】B
15. 【答案】C
16. 【答案】C
17. 【答案】A
18. 【答案】D
19. 【答案】C
20. 【答案】C
二、填空题
21. 【答案】棕黄色;产生红褐色沉淀;3NaOH+FeCl3→Fe(OH)3↓+3NaCl
22. 【答案】生石灰与水反应放出大量的热,使得瓶内空气体积膨胀
23. 【答案】左;CaO+H2O=Ca(OH)2
24. 【答案】浓硫酸;不断搅拌,使稀释时放出的热量进行扩散;用手在瓶口轻轻扇动;
25. 【答案】悬浊液;Ca(OH)2
26. 【答案】红;CaO
27. 【答案】产生白色沉淀;HCl+AgNO3→AgCl↓+HNO3
28. 【答案】BaCl2;H2SO4+BaCl2→BaSO4↓+2HCl
29. 【答案】无;红;无;NaOH+HCl→NaCl+H2O;1:1;0.1?mol;0.11?mol;红;NaClHCl;
30. 【答案】CaCO3高温CO2↑+CaO;CaO+H2O→Ca(OH)2
三、计算题
31. 【答案】
(1) CuO+H2SO4=CuSO4+H2O
(2) 16.8?g
(3) 设稀 H2SO4 中溶质的质量分数为 x。
CuO+H2SO4=CuSO4+H2O809816?g49?g?x
8098=16?g49?g?x,
x=40%。
答:稀 H2SO4 中溶质的质量分数 40%。
32. 【答案】
(1) NaOH
(2) 设该氢氧化钠溶液的溶质质量分数为 x
2NaOH+H2SO4=Na2SO4+2H2O809820?gx40?g×9.8%
9098=20?gx40?g×9.8%
x=16%
答:该氢氧化钠溶液的溶质质量分数为 16%。
33. 【答案】所加硫酸铜溶液的质量分数为 13.4%。
34. 【答案】
(1) Al(OH)3+3HCl→AlCl3+3H2O
(2) n(HCl)=0.009?mol
35. 【答案】 5%
一、选择题
分类推断是化学学习和研究中常用的方法,以下几种分类推断中正确的是
A.碱溶液的 pH 大于 7,所以 pH 大于 7 的溶液都是碱溶液
B.酸碱中和反应生成盐和水,所以生成盐和水的反应都是中和反应
C.氧化物中都含氧元素,所以含有氧元素的化合物都是氧化物
D.酸性溶液能使紫色石蕊试液变红色,所以能使紫色石蕊试液变红色的一定是酸性溶液
在一定温度下,将少量生石灰放入一定的饱和石灰水中,搅拌并冷却、到原来的温度,下列说法中正确的是
A.溶剂质量不变 B.溶质质量增加 C.溶液浓度不变 D.溶解度增加
将含有等物质的量的烧碱和盐酸的溶液混合,充分反应后,滴加紫色石蕊试液,则溶液的颜色呈
A.红色 B.紫色 C.蓝色 D.无色
在向滴有紫色石蕊试液且含有 a?mol 硫酸的稀硫酸中滴加含 b 克氢氧化钠的氢氧化钠溶液,溶液恰好呈紫色,若将这些氢氧化钠溶液替换成含 b 克氢氧化钾的氢氧化钾溶液,混合后,溶液的颜色是(相对原子质量:H:1,S:32,O:16,K:39,Na:23)
A.红色 B.紫色 C.蓝色 D.无色
【 2014 门头沟一模 25 】下列图象与对应选项关系合理的是
A.在某温度下,向一定量接近饱和的硝酸钾溶液中,不断加入硝酸钾晶体
B.向 NaOH 溶液中滴中稀盐酸至过量
C.用相等质量的双氧水来制取氧气
D.电解水生成氢气和氧气
用稀硫酸除铁锈的原理是
A. FeO+H2SO4=4FeSO4+H2O
B. Fe2O3+3H2SO4=Fe2(SO4)3+3H2↑
C. Fe2O3+2H2SO4=2FeSO4+2H2O
D. Fe2O3+3H2SO4=Fe2(SO4)3+3H2O
某物质能使紫色石蕊溶液变为蓝色,关于该物质的下列说法中正确的是
A.该物质可能是氢氧化铜
B.该物质一定是纯碱的水溶液
C.可以将 pH 试纸放入该物质的稀溶液中测其 pH
D.向该物质的水溶液中滴加稀盐酸,溶液的 pH 一定变小
将等质量的氧化钙和氢氧化钙固体分别加入盛有等质量水的甲、乙两只烧杯中,搅拌后恢复至室温,均全部溶解。对甲、乙烧杯中溶液的分析正确的是
A.溶液的状态:乙一定是不饱和溶液 B.溶质的质量:甲小于乙
C.溶剂的质量:甲大于乙 D.溶质质量分数:甲、乙可能相等
若两种溶液混合后其 pH 值为 7,那么这两种溶液的 pH 值可能是
A. 4 和 5 B. 5 和 10 C. 0 和 7 D. 13 和 7
推理是一种重要的化学思维方法,下列叙述正确的是
A.离子是带电荷的粒子,则带电荷的粒子一定是离子
B.单质是由同种元素组成的,则由同种元素组成的物质一定是单质
C.溶液具有均一性和稳定性,则具有均一性和稳定性的液体一定是溶液
D.碱性溶液能使无色酚酞溶液变红,则能使无色酚酞溶液变红的溶液一定呈碱性
若将一瓶浓硫酸和一瓶浓盐酸都敞口放置在空气中,一段时间后,发生的变化是
A.两个溶液的质量都增大
B.两个溶液中溶质的质量分数都变大
C.两个溶液的 pH 都变大
D.两个溶液的酸性都增强
将 CO 、 CO2 、 H2,HCl,H2O(气)和 N2 的混合气体依次通过足量的下列物质:
① 浓硫酸 ② 饱和氢氧化钠溶液 ③ 灼热的氧化铜粉末,充分反应后的剩余气体是
A. N2 B. N2 、 CO2 、 H2O
C. N2 、 HCl D. N2 、 CO2
在以石灰石、水、碳酸钠为原料制取氢氧化钠的反应中,其反应的基本类型涉及的有
①化合 ②分解 ③置换 ④复分解
A.①② B.①②③ C.①②④ D.①②③④
某溶液的 pH=12,则分别滴入紫色石蕊试液、酚酞试液,溶液呈现
A.红色、无色 B.蓝色、红色 C.蓝色、无色 D.紫色、红色
将溶质质量分数为 10% 的氢氧化钠溶液 40?g,与溶质质量分数为 10% 的盐酸溶液 36.5?g 充分反应,常温下反应后溶液的 pH
A.大于 7 B.小于 7 C.等于 7 D.无法确定
取四朵用石蕊溶液染成的紫色干燥纸花进行以下实验,下列分析错误的是
实验①喷洒稀盐酸②喷洒水③放入干燥CO2中④喷水后放入CO2中花的颜色红色紫色紫色红色
A.①说明酸溶液可以使石蕊变红
B.①④对比说明④中产生了与盐酸性质相似的物质
C.②④对比说明水在石蕊变色过程中不发挥任何作用
D.②③④对比说明二氧化碳能和水反应
逻辑推理是一种重要的化学思维方法,以下推理合理的是
A.因为酸性的溶液能使石蕊变红,所以酸溶液一定能使石蕊变红
B.因为酸和碱中和反应生成盐和水,所以生成盐和水一定是中和反应
C.因为金属能和酸反应产生氢气,所以能和酸产生气体的一定是金属
D.酸性氧化物是非金属氧化物,所以非金属氧化物一定是酸性氧化物
工业用盐中含有的亚硝酸钠 (NaNO2) 是一种有毒物质,利用 NH4Cl 溶液可使 NaNO2 转化为无毒物质.该反应分两步进行:① NaNO2+NH4Cl=NaCl+NH4NO2 ② NH4NO2=N2↑+2H2O
下列叙述不正确的是
A. NH4NO2 由三种元素组成
B.反应①为复分解反应,反应②为分解反应
C.利用 NH4Cl 处理 NaNO2 最终转化为 NaCl 、 N2 和 H2O
D.上述反应所涉及的物质中,氮元素的化合价有四种
黄蜂的毒液呈碱性,若被黄蜂蜇了,涂抹下列物质可缓解疼痛的是
A.食盐水(pH≈7) B.牙膏(pH≈9)
C.米醋(pH≈3) D.肥皂水(pH≈10)
物质露置在空气中一段时间后质量增加且变质的是
A.浓硫酸 B.大理石 C.烧碱 D.浓盐酸
二、填空题
将氢氧化钠溶液滴入 色的氯化铁溶液中,看到的现象是 ,发生反应的化学方程式是 。
生石灰是氧化钙(CaO)的俗称,是一种常见的干燥剂,某同学按装置(如图)进行实验,看到气球变大(一段时间后又能恢复原状)。请分析气球变大的原因 。
将胶头滴管中的水滴入试管中,一段时间后,观察到 U 型管 (填“左”或“右”)侧液面下降。与这一现象相关的化学反应的方程式是 。
化学是一门以实验为基础的学科,根据图中实验回答下列问题。
实验 A 中的 a 应为 (填“浓硫酸”或“水”)。实验操作 A 、 B 、 C 都需要用到玻璃棒,其中操作 A 中玻璃棒的作用是 。在实验室闻浓盐酸和浓硫酸的气味时应该小心, ,使较少量的气体飘进鼻孔,发现有刺激性气味的 。
水是重要的分散剂,许多物质都能在水中分散,形成溶液、悬浊液或乳浊液等,少量生石灰放入水中,得到的石灰水是均一、稳定的混合物,属于溶液;继续加入一定量生石灰,得到的石灰乳是不均一、不稳定的混合物,属于 ,石灰乳中固态物质的化学式为 。
某工厂排出的无色废水经测定 pH=3,如果滴入紫色石蕊试液,溶液变成 色。由于治废需要,欲将此废水调为微碱性,可在石灰石、生石灰、铁屑这几种物质中选择 (填化学式)以达到目的。
向稀盐酸中滴加硝酸银溶液,看到的现象是 ,反应的化学方程式是 。
某盐酸溶液中混有少量 H2SO4,为了除去杂质,往该溶液中滴加适量的 溶液,然后 ,得到盐酸。该反应的化学方程式是 。
把 色的酚酞试液滴到氢氧化钠溶液中,酚酞变为 色。再向其中滴加稀盐酸,当溶液刚好变为 色,则表明恰好完全反应,反应的化学方程式为 。此时参加反应的物质的物质的量之比为 。40g10% 的氢氧化钠溶液中溶质的物质的量为 ,40g10% 的稀盐酸中,溶质的物质的量为 ,将两者混合后滴加石蕊试液,溶液呈 色,此时溶液中的溶质是 。上述两个实验中酚酞和石蕊的作用是: 。
工业上煅烧石灰石制取二氧化碳和生石灰,其化学方程式是 ;生石灰溶于水,放出大量热量,得到熟石灰,化学方程式是 。
三、计算题
某实验小组为测定铜和氧化铜的混合物中铜元素的含量,取 20?g 该固体混合物,向其中逐滴加入稀 H2SO4,测得剩余固体的质量与加入稀 H2SO4 的质量关系如图所示。
回答下列问题:
(1) 写出滴加稀 H2SO4 时发生反应的化学方程式 。
(2) 该固体混合物中铜元素的质量为 。
(3) 计算稀 H2SO4 中溶质的质量分数(写出计算过程)。
取 20?g 氢氧化钠溶液于烧杯中,将 9.8% 的稀硫酸逐滴加入烧杯,边加边搅拌,随着稀硫酸的不断加入,溶液 pH 的变化如下图所示,回答下列问题:
(1) a 点溶液中的溶质是 Na2SO4 和 (填化学式)。
(2) 计算该氢氧化钠溶液的溶质质量分数(写出计算过程)。
向 32?g 溶质质量分数为 25% 的氢氧化钠溶液中加入一定质量的硫酸铜溶液,恰好完全反应,过滤,所得溶液中溶质的质量分数为 10%。计算:所加硫酸铜溶液中溶质的质量分数。(计算结果精确至 0.1%)
胃舒平是治疗胃酸过多的药品,某批次该药片每片含 0.245?g 氢氧化铝,回答:
(1) 写出氢氧化铝跟盐酸反应的化学方程式。
(2) 计算每片胃舒平药片可以中和盐酸中的 HCl 多少摩尔?(保留到小数点后三位)
取 73?g 稀盐酸加入锥形瓶中,再逐滴滴加溶质质量分数为 10% 的 NaOH 溶液,反应过程中溶液的酸碱度变化如图所示。求该盐酸中溶质的质量分数。
答案
一、选择题
1. 【答案】D
2. 【答案】C
3. 【答案】B
4. 【答案】A
5. 【答案】B
6. 【答案】D
7. 【答案】D
8. 【答案】A
9. 【答案】B
10. 【答案】D
11. 【答案】C
12. 【答案】B
13. 【答案】C
14. 【答案】B
15. 【答案】C
16. 【答案】C
17. 【答案】A
18. 【答案】D
19. 【答案】C
20. 【答案】C
二、填空题
21. 【答案】棕黄色;产生红褐色沉淀;3NaOH+FeCl3→Fe(OH)3↓+3NaCl
22. 【答案】生石灰与水反应放出大量的热,使得瓶内空气体积膨胀
23. 【答案】左;CaO+H2O=Ca(OH)2
24. 【答案】浓硫酸;不断搅拌,使稀释时放出的热量进行扩散;用手在瓶口轻轻扇动;
25. 【答案】悬浊液;Ca(OH)2
26. 【答案】红;CaO
27. 【答案】产生白色沉淀;HCl+AgNO3→AgCl↓+HNO3
28. 【答案】BaCl2;H2SO4+BaCl2→BaSO4↓+2HCl
29. 【答案】无;红;无;NaOH+HCl→NaCl+H2O;1:1;0.1?mol;0.11?mol;红;NaClHCl;
30. 【答案】CaCO3高温CO2↑+CaO;CaO+H2O→Ca(OH)2
三、计算题
31. 【答案】
(1) CuO+H2SO4=CuSO4+H2O
(2) 16.8?g
(3) 设稀 H2SO4 中溶质的质量分数为 x。
CuO+H2SO4=CuSO4+H2O809816?g49?g?x
8098=16?g49?g?x,
x=40%。
答:稀 H2SO4 中溶质的质量分数 40%。
32. 【答案】
(1) NaOH
(2) 设该氢氧化钠溶液的溶质质量分数为 x
2NaOH+H2SO4=Na2SO4+2H2O809820?gx40?g×9.8%
9098=20?gx40?g×9.8%
x=16%
答:该氢氧化钠溶液的溶质质量分数为 16%。
33. 【答案】所加硫酸铜溶液的质量分数为 13.4%。
34. 【答案】
(1) Al(OH)3+3HCl→AlCl3+3H2O
(2) n(HCl)=0.009?mol
35. 【答案】 5%
同课章节目录
- 第七单元 常见的酸和碱
- 第一节 酸及其性质
- 第二节 碱及其性质
- 第三节 溶液的酸碱性
- 第四节 酸碱中和反应
- 到实验室去:探究酸和碱的化学性质
- 第八单元 海水中的化学
- 第一节 海洋化学资源
- 第二节 海水“晒盐“
- 第三节 海水“制碱“
- 到实验室去:粗盐中难溶性杂质的去除
- 第九单元 金属
- 第一节 常见的金属材料
- 第二节 金属的化学性质
- 第三节 钢铁的锈蚀与防护
- 到实验室去 探究金属的性质
- 第十单元 化学与健康
- 第一节 食物中的有机物
- 第二节 化学元素与人体健康
- 第三节 远离有毒物质
- 第十一单元 化学与社会发展
- 第一节 化学与能源开发
- 第二节 化学与材料研制
- 第三节 化学与农业生产
- 第四节 化学与环境保护
