初高中化学衔接复习资料: 元素及化合物
文档属性
| 名称 | 初高中化学衔接复习资料: 元素及化合物 |

|
|
| 格式 | zip | ||
| 文件大小 | 98.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 其它版本 | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-02-18 00:00:00 | ||
图片预览




文档简介
初高中化学衔接复习资料
第一部分 元素及化合物
注意:本资料涉及化学方程式请写出产物并配平
一、水 氢
1.水的组成和性质
(1)水的物理性质
纯净的水是没有颜色、没有气味、没有味道的液体,在101Kpa时,水的凝固点是0℃,沸点是100℃,4℃时密度最大,为1g/cm3,水结冰时体积膨胀,所以冰比水轻,能浮在水面上。
(2)水的化学性质
①能与可溶性碱性氧化物(Na2O、CaO等)反应生成对应的碱
Na2O + H2O ===
②能与可溶性酸性氧化物(CO2、SO3等)反应生成对应的酸
CO2 + H2O ===
③能与部分盐反应
CuSO4 + 5H2O ===
2.氢气的性质、用途和制法
(1)氢气的物理性质和用途
在通常情况下,氢气是一种无色、无味的气体,比空气轻,难溶于水,加压降温变成无色液体,再降温变成雪状固体。氢气能合成氨,能用来制盐酸,可作高能燃料;还可以用来制取单晶硅和制备金属材料。
(2)氢气的化学性质
①氢气具有可燃性:纯净的氢气在空气中安静的燃烧,产生淡蓝色的火焰,放出大量的热,用烧杯罩在火焰上方时,在烧杯壁上有水珠生成:
H2+O2
如果氢气不纯,混有空气(或氧气)(且在氢气爆炸极限范围内),点燃时能爆炸。因此,在使用氢气时,要特别注意安全。点燃氢气前,一定要检验氢气的纯度。
②氢气具有还原性:
H2+CuO
二、碳和碳的化合物
1.碳的几种单质
以单质形式存在的碳有金刚石、石墨、足球烯和无定形炭(如:活性炭、木炭、焦炭、炭黑)。碳的几种单质在物理性质上有很大的差异,这是因为碳原子排列的方式不同。
注:(1)金刚石和石墨都是由碳元素组成的,像这种由一种元素组成的不同单质互称为同素异形体。
(2)碳和炭的区别:碳是指碳元素、原子;而炭是含有碳元素的天然产物经过碳化而形成的多种碳的单质,如木炭、活性炭等。
2.碳的化学性质
常温下,碳的化学性质很稳定,但随着温度的升高,其化学活动性大大增强。
(1)可燃性:
充分燃烧:C+O2
不充分燃烧:C+O2
(2)还原性:
碳和氧化铜:C + CuO
碳和二氧化碳:C + CO2
碳和水(水煤气的制取):C + H2O
3.二氧化碳的性质、制法和用途
(1)物理性质及用途
CO2是无色、密度比空气大的气体,在加压和降温的条件下变成雪状的固体干冰,干冰可以直接变成二氧化碳气体。
CO2是一种工业原料,可用在制纯碱、尿素和汽水等工业上,还可以用来灭火;干冰可用作制冷剂和人工降雨,用来保藏很容易腐败的食品;食物进行光合作用,也需要二氧化碳。
(2)化学性质
①不能燃烧,也不能支持燃烧
②能和水反应:CO2 + H2O ===
H2CO3不稳定:H2CO3 ===
③和碱溶液反应:CO2 + NaOH ===
思考:向澄清石灰水中逐渐通入CO2直到过量,有什么现象?对最后所得溶液加热,又有什么现象?写出相关变化的化学方程式。
④其它反应:CO2 + Mg
4.一氧化碳的性质、制法和用途
(1)物理性质
一氧化碳是一种没有颜色,没有气味的气体,比空气稍轻,难溶于水。有剧毒,因为它可以与血液中的血红蛋白结合,使血红蛋白不能很好的与氧气结合,人就会因缺氧而死亡。
(2)化学性质
①可燃性:CO + O2
②还原性:
CO还原氧化铜:CO + CuO
CO还原氧化铁:CO + Fe2O3
(3)用途:燃料,冶金
(4)制法:HCOOH
5.石灰石、生石灰和熟石灰
(1)石灰石、大理石的主要成分都是碳酸钙,它们都是重要的建筑材料。
CaCO3
(2)CaO俗称生石灰,生石灰与水反应,生成氢氧化钙,同时放出大量的热。
CaO + H2O ===
(3)Ca(OH)2俗称熟石灰或消石灰,在工农业生产上应用很广,建筑业上用熟石灰、粘土和沙子混合制成三合土,或用石灰沙浆来砌砖、抹墙,就是利用熟石灰能吸收空气中的二氧化碳变成坚固的碳酸钙这一性质。
CO2 + Ca(OH)2 ===
工业上可用熟石灰作原料来制造氢氧化钠、漂白粉;农业上用它来降低土壤的酸性,改进土壤的结构,还用它来配制农药波尔多液(与硫酸铜溶液混合)和石灰硫黄合剂。
第二部分 基本概念和理论
一、物质的组成和结构
(一)物质的组成
(二)化合价和原子团
1.化合价
(1)定义:一种元素一定数目的原子跟其他元素一定数目的原子化合的性质,叫做这种元
素的化合价。
(2)实质:化合价是元素的化学性质。
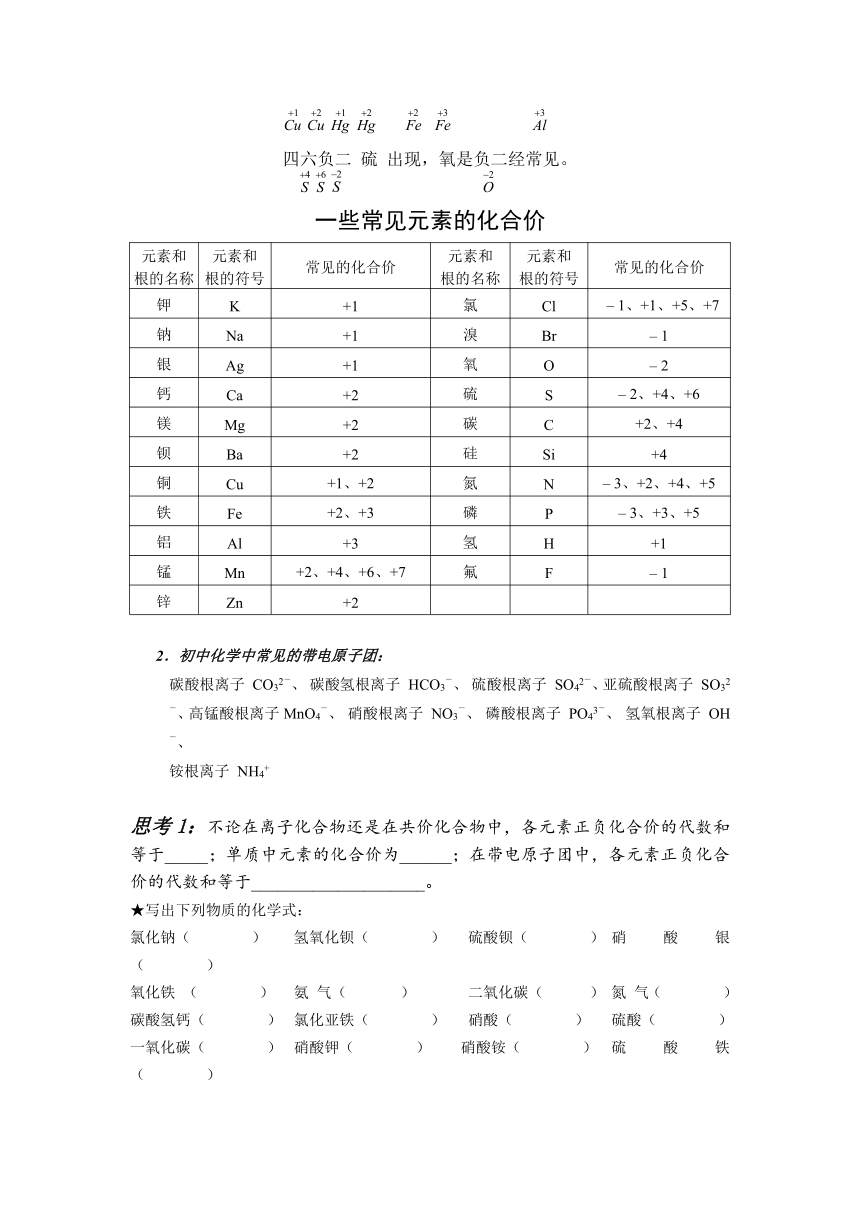
(3)常见元素及原子团的化合价:
化合价有正价和负价,化合物中正、负化合价代数和为零。单质中元素的化合价为零。
在带电原子团中,正、负化合价代数和不为零,代数和为原子团的化合价。
(注意:①同一元素,在不同的原子团中,可显相同的化合价;如:CrO42— Cr2O72—
②同一元素,在结构相同的原子团中,可显不同的化合价;如:KMnO4 K2MnO4
③同一元素,在同一物质中,可显不同的化合价。如:NH4NO3)
化合价口诀
一价 钾 钠 银 铵 氢,二价 钙 镁 钡 铅 锌;
三五价有 磷 和 氮 ,四价 硅 锰 还有 碳 ;
一二 铜 汞 二三 铁,铝 是三价要记得;
四六负二 硫 出现,氧是负二经常见。
一些常见元素的化合价
元素和根的名称 元素和根的符号 常见的化合价 元素和根的名称 元素和根的符号 常见的化合价
钾 K +1 氯 Cl – 1、+1、+5、+7
钠 Na +1 溴 Br – 1
银 Ag +1 氧 O – 2
钙 Ca +2 硫 S – 2、+4、+6
镁 Mg +2 碳 C +2、+4
钡 Ba +2 硅 Si +4
铜 Cu +1、+2 氮 N – 3、+2、+4、+5
铁 Fe +2、+3 磷 P – 3、+3、+5
铝 Al +3 氢 H +1
锰 Mn +2、+4、+6、+7 氟 F – 1
锌 Zn +2
2.初中化学中常见的带电原子团:
碳酸根离子 CO32-、 碳酸氢根离子 HCO3-、 硫酸根离子 SO42-、亚硫酸根离子 SO32-、高锰酸根离子MnO4-、 硝酸根离子 NO3-、 磷酸根离子 PO43-、 氢氧根离子 OH-、
铵根离子 NH4+
思考1:不论在离子化合物还是在共价化合物中,各元素正负化合价的代数和等于_____;单质中元素的化合价为______;在带电原子团中,各元素正负化合价的代数和等于____________________。
★写出下列物质的化学式:
氯化钠( ) 氢氧化钡( ) 硫酸钡( ) 硝酸银( )
氧化铁 ( ) 氨 气( ) 二氧化碳( ) 氮 气( )
碳酸氢钙( ) 氯化亚铁( ) 硝酸( ) 硫酸( )
一氧化碳( ) 硝酸钾( ) 硝酸铵( ) 硫酸铁( )
石灰石( ) 烧碱( ) 纯碱( ) 胆矾( )
(三)物质的分类
Ⅰ 氧化物
1.定义
(1)组成元素的种数:两种
(2)组成物质的类别:化合物
2.氧化物的分类
(1)按组成元素分类
①金属氧化物(如:Na2O、CaO、MgO、ZnO、MnO2、CuO、Fe2O3、Al2O3)
②非金属氧化物(如:CO2、SO2、CO、SO3、P2O5)
(2)按化学性质分类
①不成盐氧化物(如:H2O、CO、NO、MnO2)
②成盐氧化物
Ⅰ、酸性氧化物(大多数非金属氧化物,如:SO2、SO3、CO2、Mn2O7)
Ⅱ、碱性氧化物(大多数金属氧化物,如:CaO、MgO、CuO、Fe2O3)
Ⅲ、两性氧化物(如:Al2O3、ZnO)
(3)按常温下的状态分类
①固态氧化物(如:Fe2O3、CuO)
②液态氧化物(如:H2O)
③气态氧化物(如:CO2)
3.酸性氧化物和碱性氧化物
(1)酸性氧化物
①酸性氧化物都能跟强碱反应,生成盐和水
②大多数酸性氧化物能跟水化合生成酸(SiO2除外)
③大多数酸性氧化物都可由非金属与O2化合生成
①2NaOH + CO2 === Na2CO3 + H2O ②CO2 + H2O === H2CO3 ③C + O2 CO2
(2)碱性氧化物
①碱性氧化物都能跟强酸反应,生成盐和水
②极少数碱性氧化物能跟水化合生成碱(Na2O、BaO、CaO等)
③大多数碱性氧化物都可由金属与O2化合生成
①CaO + 2HCl === CaCl2 + H2O ②Na2O + H2O === 2NaOH ③2Mg + O2 2MgO
思考2:判断正误
①酸性氧化物一定是非金属氧化物( ); ②非金属氧化物一定是酸性氧化物( )
③碱性氧化物一定是金属氧化物( ); ④金属氧化物一定是碱性氧化物( )
Ⅱ 酸(电离时生成阳离子全部是H+ )
1.酸的分类
(1)按组成可分为:含氧酸和无氧酸
(2)按电离出的H+ 个数分为:一元酸、二元酸、三元酸
(3)按酸性的强弱分为:强酸_____________________________、弱酸
(4)按酸的沸点高低可分为:高沸点酸_________、低沸点酸____________________
2.酸的命名
无氧酸一般命名为“氢某酸”____________,含氧酸一般命名为“某酸”_________。
3.酸的通性
(1)酸溶液能与酸碱指示剂作用(石蕊遇酸变红,酚酞遇酸不变色。)
(2)酸 + 活泼金属→盐 + 氢气 H2SO4 + Zn = ZnSO4 + H2↑
(3)酸 + 碱性氧化物→盐 + 水 6HCl + Fe2O3 = 2FeCl3 + 3H2O
(4)酸 + 碱→盐 + 水 H2SO4 + Cu(OH)2 = CuSO4 + H2O
(5)酸 + 盐→新盐 + 新酸 2HCl + CaCO3 = CaCl2 + CO2↑+ H2O
Ⅲ 碱(电离时生成阴离子全部是OH-)
1.碱的分类
(1)按溶解性分为:可溶性碱____________、微溶性碱_________、难溶性碱_________
(2)按碱性强弱分为:强碱_________、弱碱_________
2.碱的命名
氢氧化某
3.碱的通性
(1)碱溶液能与酸碱指示剂作用(石蕊遇碱变蓝,酚酞遇碱变红)
(2)碱 + 酸性氧化物→盐 + 水 2NaOH + CO2 = Na2CO3 + H2O
(3)碱 + 酸→盐 + 水 Ba(OH)2 + H2SO4 = BaSO4↓ + 2H2O
(4)碱(可溶)+ 盐(可溶)→新盐 + 新碱 Ca(OH)2 + Na2CO3 = CaCO3↓ + 2NaOH
另:不溶性的碱受热易分解,生成对应的碱性氧化物和水 Cu(OH)2CuO + H2O
Ⅳ 盐(电离时有金属离子和酸根离子生成)
1.盐的分类和命名
正盐(无氧酸盐叫做“某化某”___________;含氧酸盐叫做“某酸某”_________)
酸式盐(NaHCO3碳酸氢钠、KHSO4硫酸氢钾、Ca(HCO3)2碳酸氢钙)
碱式盐(Cu2(OH)2CO3碱式碳酸铜)
化学上,对于含有相同酸根离或相同金属离子的盐,常给他们一个统称。(如:硫酸盐、钾盐等)
2.盐的性质
(1)盐 + 活泼金属→新盐 + 新金属 CuSO4 + Fe = FeSO4 + Cu
(2)盐 + 酸→新盐 + 新酸 BaCl2 + H2SO4 = BaSO4↓+ 2HCl
(3)盐(可溶)+ 碱(可溶)→新盐 + 新碱 FeCl3 + 3NaOH = Fe(OH)3↓+ 3NaCl
(4)盐(可溶)+ 盐(可溶)→新盐 + 新盐 NaCl + AgNO3 = NaNO3 + AgCl↓
二、物质的性质和变化
(一)物理变化、化学反应和物理性质、化学性质
物理变化与化学反应间最本质的区别是:化学反应有新物质产生。当然物理变化的同时不一定发生化学反应,但化学反应的同时一定伴随物理变化。
(二)质量守恒定律
参加化学反应的各物质质量总和,等于反应后各生成物的质量总和。
质量守恒的原因:
宏观:化学反应前后元素的种类不变
微观(实质):
(三)化学反应的基本类型(四种)
1.化合反应
①概念:A + B → AB
②反应的规律和条件
a、金属单质+非金属单质 b、非金属+非金属
Fe + O2 C + O2
c、酸性氧化物+水 d、碱性氧化物+水
CO2 + H2O CaO + H2O
*e、碱性氧化物+酸性氧化物 f、氨气+酸
CaO + SiO2 ==== CaSiO3 NH3 + HCl
g、结晶水合物的生成
CuSO4 + H2O
思考3:化合反应中反应物不一定为两种,也有三种或四种反应物生成一种产物的反应,请举例说明。
2、分解反应
①概念:AB → A + B
②反应的规律和条件
a、某些盐的分解 b、不溶性碱的分解
KClO3—— Fe(OH)3——
Cu2(OH)2CO32CuO + CO2↑+ H2O
c、电解水 d、含氧酸的分解
H2O—— H2CO3——
e、某些氧化物的分解 HgO——
3、置换反应
①概念:A + BC → B + AC
②反应的规律和条件
a、金属 + 酸 === 盐 + 氢气
选择条件:Ⅰ金属
Ⅱ酸
Zn + H2SO4
Fe + HCl
b、金属 + 盐 === 新盐 + 新金属
条件:盐要可溶 单质金属一定要比盐中的金属活泼
(古代湿法炼铜)Fe + CuSO4
思考4:K、Ca、Na等最活泼的金属是否能将金属从盐溶液中置换出来?
c、氢气还原金属氧化物
H2 + CuO
d、木炭还原金属氧化物
C + CuO
思考5:CO还原Fe2O3的反应是否是置换反应? 为什么?
4、复分解反应
(1)概念:AB + CD → AD + CB
(2)反应条件:生成物中应有沉淀、气体、水等至少一种
(3)反应规律
Ⅰ 酸 + 碱 == 盐 + 水
酸为强酸时,碱为任意碱
HCl + KOH
HCl + Cu(OH)2
HCl + NH3·H2O
碱为强碱时,酸为任意酸
NaOH + H2SO4
NaOH + H2SiO3
弱酸与弱碱一般难发生反应,但NH3·H2O(可溶性弱碱)能够和可溶性弱酸反应
NH3·H2O + CH3COOH
Ⅱ 酸 + 盐 == 新盐 + 新酸
此类情况比较复杂,初中阶段只要求掌握3种类型
CaCO3 + HCl ( 强酸制弱酸)
AgNO3 + HCl
BaCl2 + H2SO4
思考6:将CO2通入CaCl2溶液中,有什么现象?为什么?
Ⅲ 碱 + 盐 == 新盐 + 新碱
反应条件:反应物均能溶于水,产物应有沉淀或气体生成
NaOH + CuSO4
NaOH + NH4Cl
Ⅳ 盐 + 盐 == 新盐 + 新盐
反应条件:反应物均能溶于水,产物至少有一种沉淀
AgNO3 + NaCl
BaCl2 + CuSO4
酸、碱、盐、氧化物、单质之间的转化关系
例:用七种方法制取MgCl2
Ⅰ.Mg + Cl2 ==== MgCl2 ①
Ⅱ.MgO + HCl ==== MgCl2 + H2O ②
Ⅲ.Mg(OH)2 +2HCl ==== MgCl2 +2H2O ④
Ⅳ.MgCO3+2HCl === MgCl2 +H2O +CO2↑⑥
Ⅴ.MgSO4 + BaCl2 === MgCl2 + BaSO4↓ ⑦
Ⅵ.Mg + CuCl2 ==== MgCl2 + Cu ⑧
Ⅶ.Mg + 2HCl ==== MgCl2 + H2↑ ⑨
思考:试用五种方法制备ZnSO4
★ 请从锌、氧气、二氧化碳、水、盐酸、氢氧化钡溶液、硫酸铜溶液、碳酸钙中选出适当的物质,按下列要求写出有关反应的化学方程式:
(1)生成酸的化合反应_________________________________________________
(2)生成两种氧化物的分解反应_________________________________________
(3)生成气体的置换反应_______________________________________________
(4)生成两种沉淀的复分解反应_________________________________________
4.氧化-还原反应 (高中详讲)
5、溶液的导电性
(1)电离与溶液的电性
物质溶解于水(或受热熔化时即熔融状态)产生了能够自由移动的离子的过程,叫做电离。电离过程是不需要通电的,电离生成的阴离子和阳离子所带电量相等,电性相反(即“电荷守恒”),因此溶液不显电性。
(2)电离与导电的关系
溶质先发生电离,溶液才能够导电;溶液若能够导电,说明溶质发生了电离。在能导电的溶液里,溶质是由离子形式存在的,在不能导电的溶液里,溶质是由分子形式存在的。
(3)电离方程式的书写(须同时满足“质量守恒”与“电荷守恒”)
例:HCl = H+ + Cl-
Ca(OH)2 = Ca 2+ + 2OH-
NaCl = Na+ + Cl-
★ 请书写下列物质在水溶液中的电离方程式:
HNO3 NH4NO3
KOH Na2CO3
CaCl2 Fe(NO3)2
Al2(SO4)3
酸碱盐溶解性口诀:
钾钠铵盐硝酸盐,完全溶解不困难;
盐酸盐中氯化银,水中溶解不得行;
硫酸钡铅不溶外,微溶只有银和钙;
碳酸盐溶钾钠铵,余下沉淀记心间。
酸、碱和盐的溶解性表(20℃)
阴离子阳离子 OH- NO3- Cl- SO42- S2- SO32- CO32- SiO32- PO43-
H+ 溶、挥 溶、挥 溶 溶、挥 溶、挥 溶、挥 微 溶
NH4+ 溶、挥 溶 溶 溶 溶 溶 溶 — 溶
K+ 溶 溶 溶 溶 溶 溶 溶 溶 溶
Na+ 溶 溶 溶 溶 溶 溶 溶 溶 溶
Ba2+ 溶 溶 溶 不 — 不 不 不 不
Ca2+ 微 溶 溶 微 — 不 不 不 不
Mg2+ 不 溶 溶 溶 — 微 微 不 不
Al3+ 不 溶 溶 溶 — — — 不 不
Mn2+ 不 溶 溶 溶 不 不 不 不 不
Zn2+ 不 溶 溶 溶 不 不 不 不 不
Cr3+ 不 溶 溶 溶 — — — 不 不
Fe2+ 不 溶 溶 溶 不 不 不 不 不
Fe3+ 不 溶 溶 溶 — — — 不 不
Sn2+ 不 溶 溶 溶 不 — — — 不
Pb2+ 不 溶 微 不 不 不 不 不 不
Cu2+ 不 溶 溶 溶 不 不 不 不 不
Hg2+ — 溶 溶 溶 不 不 — — 不
Ag+ — 溶 不 微 不 不 不 不 不
说明:“溶”表示那种物质可溶于水,“不”表示不溶于水,“微”表示微溶于水,“挥”表示那种物质易挥发或易分解,“—”表示那种物质不存在或遇到水就分解了。
第三部分 实验复习
一、常见气体的制备
(一)气体的制备思路,可从下面几个方面来归纳:
(二)组装仪器:自 下 而 上 ,从 左 到 右 ;气体净化:先净气装置,后干燥装置;
(三)操作顺序:
1.检验装置的气密性;2.装药品进行实验操作;3.记录实验现象、数据;
(四)1.三种常见气体的实验室制法比较
O2 H2 CO2
反应原理
装置类型 固体+ 固体气体 固体 + 液体→气体 固体 + 液体→气体
实验装置图
收集方法
验满方法 验纯方法:用小试管收集一试管氢气,用拇指堵住试管口,移近酒精灯,松开拇指,若听到尖锐的响声,则氢气不纯净;若听到轻微的“噗噗”声,则说明氢气已较纯。
注意事项 1.试管口略低于试管底2.铁夹夹在试管的中上部3.用排水法收集完气体时,应 当均匀产生气泡时才开始收集 1.长颈漏斗
2.固体 + 液体→气体型装置的比较
(1)反应容器: 大试管 、 锥形瓶 、 广口瓶 。
(2)加液仪器:长颈漏斗、分液漏斗
(3)常见装置:
图1 图2 图3
3.启普发生器及简易装置
启普发生器的操作原理是利用气压知识使固、液接触或脱离,控制对气体反应随即产生或停止,使之控制反应的产生。若无启普发生器,可根据启普发生器反应原理设计出多种简易启普发生器。
图5 图6
启普发生器适用条件:块状固体与液体反应,反应不需加热,生成的气体在水中溶解度不大,且注意块状固体不能粉末化,反应放热少。
二、三种物质还原性实验比较
H2 CO C
反应原理
实验装置图
实验现象
主要步骤 1.装药品。2.先通H2,后点燃酒精灯。3.实验完毕,先撤去酒精灯,直到试管冷却,再停止通H2。 1. 2.同左 3.同左 4.整个实验过程都必须进行尾气处理 ,防止污染空气。 1. 。2.装入药品。3.加热4.实验完毕停止加热。
注意事项 1.实验前必须对CO、H2 进行 验纯 。2.先通后点防 爆炸 。3.先撤后停防 氧化 。 为提高温度一般用酒精喷灯。实验结束,应先 ,后 ,目的 。
四、常见气体的检验方法
气体 检验方法 实验现象
O2
H2 1.先经过 ,再 2.点燃时 。
CO2 。
CO 经过灼热的CuO,再通人澄清石灰水。点燃,在火焰上方罩附有澄清石灰水的小烧杯。
H2O
CH4 点燃,在火焰上方罩上干冷的小烧杯,然后换上一个附有澄清石灰水的小烧杯。
点燃
△
点燃
点燃
高温
高温
高温
点燃
点燃
△
高温
浓H2SO4
△
高温
质子
中子
构成
原子核
电 子
构成
原子
(直接)构成
物质
组成
元素
离子
分子
构
成
变
成
构
成
构
成
(纯净物)
单质
化合物
同
种
元
素
成
组
不
同
元
素
组
成
点燃
点燃
△
高温
△
气球
第一部分 元素及化合物
注意:本资料涉及化学方程式请写出产物并配平
一、水 氢
1.水的组成和性质
(1)水的物理性质
纯净的水是没有颜色、没有气味、没有味道的液体,在101Kpa时,水的凝固点是0℃,沸点是100℃,4℃时密度最大,为1g/cm3,水结冰时体积膨胀,所以冰比水轻,能浮在水面上。
(2)水的化学性质
①能与可溶性碱性氧化物(Na2O、CaO等)反应生成对应的碱
Na2O + H2O ===
②能与可溶性酸性氧化物(CO2、SO3等)反应生成对应的酸
CO2 + H2O ===
③能与部分盐反应
CuSO4 + 5H2O ===
2.氢气的性质、用途和制法
(1)氢气的物理性质和用途
在通常情况下,氢气是一种无色、无味的气体,比空气轻,难溶于水,加压降温变成无色液体,再降温变成雪状固体。氢气能合成氨,能用来制盐酸,可作高能燃料;还可以用来制取单晶硅和制备金属材料。
(2)氢气的化学性质
①氢气具有可燃性:纯净的氢气在空气中安静的燃烧,产生淡蓝色的火焰,放出大量的热,用烧杯罩在火焰上方时,在烧杯壁上有水珠生成:
H2+O2
如果氢气不纯,混有空气(或氧气)(且在氢气爆炸极限范围内),点燃时能爆炸。因此,在使用氢气时,要特别注意安全。点燃氢气前,一定要检验氢气的纯度。
②氢气具有还原性:
H2+CuO
二、碳和碳的化合物
1.碳的几种单质
以单质形式存在的碳有金刚石、石墨、足球烯和无定形炭(如:活性炭、木炭、焦炭、炭黑)。碳的几种单质在物理性质上有很大的差异,这是因为碳原子排列的方式不同。
注:(1)金刚石和石墨都是由碳元素组成的,像这种由一种元素组成的不同单质互称为同素异形体。
(2)碳和炭的区别:碳是指碳元素、原子;而炭是含有碳元素的天然产物经过碳化而形成的多种碳的单质,如木炭、活性炭等。
2.碳的化学性质
常温下,碳的化学性质很稳定,但随着温度的升高,其化学活动性大大增强。
(1)可燃性:
充分燃烧:C+O2
不充分燃烧:C+O2
(2)还原性:
碳和氧化铜:C + CuO
碳和二氧化碳:C + CO2
碳和水(水煤气的制取):C + H2O
3.二氧化碳的性质、制法和用途
(1)物理性质及用途
CO2是无色、密度比空气大的气体,在加压和降温的条件下变成雪状的固体干冰,干冰可以直接变成二氧化碳气体。
CO2是一种工业原料,可用在制纯碱、尿素和汽水等工业上,还可以用来灭火;干冰可用作制冷剂和人工降雨,用来保藏很容易腐败的食品;食物进行光合作用,也需要二氧化碳。
(2)化学性质
①不能燃烧,也不能支持燃烧
②能和水反应:CO2 + H2O ===
H2CO3不稳定:H2CO3 ===
③和碱溶液反应:CO2 + NaOH ===
思考:向澄清石灰水中逐渐通入CO2直到过量,有什么现象?对最后所得溶液加热,又有什么现象?写出相关变化的化学方程式。
④其它反应:CO2 + Mg
4.一氧化碳的性质、制法和用途
(1)物理性质
一氧化碳是一种没有颜色,没有气味的气体,比空气稍轻,难溶于水。有剧毒,因为它可以与血液中的血红蛋白结合,使血红蛋白不能很好的与氧气结合,人就会因缺氧而死亡。
(2)化学性质
①可燃性:CO + O2
②还原性:
CO还原氧化铜:CO + CuO
CO还原氧化铁:CO + Fe2O3
(3)用途:燃料,冶金
(4)制法:HCOOH
5.石灰石、生石灰和熟石灰
(1)石灰石、大理石的主要成分都是碳酸钙,它们都是重要的建筑材料。
CaCO3
(2)CaO俗称生石灰,生石灰与水反应,生成氢氧化钙,同时放出大量的热。
CaO + H2O ===
(3)Ca(OH)2俗称熟石灰或消石灰,在工农业生产上应用很广,建筑业上用熟石灰、粘土和沙子混合制成三合土,或用石灰沙浆来砌砖、抹墙,就是利用熟石灰能吸收空气中的二氧化碳变成坚固的碳酸钙这一性质。
CO2 + Ca(OH)2 ===
工业上可用熟石灰作原料来制造氢氧化钠、漂白粉;农业上用它来降低土壤的酸性,改进土壤的结构,还用它来配制农药波尔多液(与硫酸铜溶液混合)和石灰硫黄合剂。
第二部分 基本概念和理论
一、物质的组成和结构
(一)物质的组成
(二)化合价和原子团
1.化合价
(1)定义:一种元素一定数目的原子跟其他元素一定数目的原子化合的性质,叫做这种元
素的化合价。
(2)实质:化合价是元素的化学性质。
(3)常见元素及原子团的化合价:
化合价有正价和负价,化合物中正、负化合价代数和为零。单质中元素的化合价为零。
在带电原子团中,正、负化合价代数和不为零,代数和为原子团的化合价。
(注意:①同一元素,在不同的原子团中,可显相同的化合价;如:CrO42— Cr2O72—
②同一元素,在结构相同的原子团中,可显不同的化合价;如:KMnO4 K2MnO4
③同一元素,在同一物质中,可显不同的化合价。如:NH4NO3)
化合价口诀
一价 钾 钠 银 铵 氢,二价 钙 镁 钡 铅 锌;
三五价有 磷 和 氮 ,四价 硅 锰 还有 碳 ;
一二 铜 汞 二三 铁,铝 是三价要记得;
四六负二 硫 出现,氧是负二经常见。
一些常见元素的化合价
元素和根的名称 元素和根的符号 常见的化合价 元素和根的名称 元素和根的符号 常见的化合价
钾 K +1 氯 Cl – 1、+1、+5、+7
钠 Na +1 溴 Br – 1
银 Ag +1 氧 O – 2
钙 Ca +2 硫 S – 2、+4、+6
镁 Mg +2 碳 C +2、+4
钡 Ba +2 硅 Si +4
铜 Cu +1、+2 氮 N – 3、+2、+4、+5
铁 Fe +2、+3 磷 P – 3、+3、+5
铝 Al +3 氢 H +1
锰 Mn +2、+4、+6、+7 氟 F – 1
锌 Zn +2
2.初中化学中常见的带电原子团:
碳酸根离子 CO32-、 碳酸氢根离子 HCO3-、 硫酸根离子 SO42-、亚硫酸根离子 SO32-、高锰酸根离子MnO4-、 硝酸根离子 NO3-、 磷酸根离子 PO43-、 氢氧根离子 OH-、
铵根离子 NH4+
思考1:不论在离子化合物还是在共价化合物中,各元素正负化合价的代数和等于_____;单质中元素的化合价为______;在带电原子团中,各元素正负化合价的代数和等于____________________。
★写出下列物质的化学式:
氯化钠( ) 氢氧化钡( ) 硫酸钡( ) 硝酸银( )
氧化铁 ( ) 氨 气( ) 二氧化碳( ) 氮 气( )
碳酸氢钙( ) 氯化亚铁( ) 硝酸( ) 硫酸( )
一氧化碳( ) 硝酸钾( ) 硝酸铵( ) 硫酸铁( )
石灰石( ) 烧碱( ) 纯碱( ) 胆矾( )
(三)物质的分类
Ⅰ 氧化物
1.定义
(1)组成元素的种数:两种
(2)组成物质的类别:化合物
2.氧化物的分类
(1)按组成元素分类
①金属氧化物(如:Na2O、CaO、MgO、ZnO、MnO2、CuO、Fe2O3、Al2O3)
②非金属氧化物(如:CO2、SO2、CO、SO3、P2O5)
(2)按化学性质分类
①不成盐氧化物(如:H2O、CO、NO、MnO2)
②成盐氧化物
Ⅰ、酸性氧化物(大多数非金属氧化物,如:SO2、SO3、CO2、Mn2O7)
Ⅱ、碱性氧化物(大多数金属氧化物,如:CaO、MgO、CuO、Fe2O3)
Ⅲ、两性氧化物(如:Al2O3、ZnO)
(3)按常温下的状态分类
①固态氧化物(如:Fe2O3、CuO)
②液态氧化物(如:H2O)
③气态氧化物(如:CO2)
3.酸性氧化物和碱性氧化物
(1)酸性氧化物
①酸性氧化物都能跟强碱反应,生成盐和水
②大多数酸性氧化物能跟水化合生成酸(SiO2除外)
③大多数酸性氧化物都可由非金属与O2化合生成
①2NaOH + CO2 === Na2CO3 + H2O ②CO2 + H2O === H2CO3 ③C + O2 CO2
(2)碱性氧化物
①碱性氧化物都能跟强酸反应,生成盐和水
②极少数碱性氧化物能跟水化合生成碱(Na2O、BaO、CaO等)
③大多数碱性氧化物都可由金属与O2化合生成
①CaO + 2HCl === CaCl2 + H2O ②Na2O + H2O === 2NaOH ③2Mg + O2 2MgO
思考2:判断正误
①酸性氧化物一定是非金属氧化物( ); ②非金属氧化物一定是酸性氧化物( )
③碱性氧化物一定是金属氧化物( ); ④金属氧化物一定是碱性氧化物( )
Ⅱ 酸(电离时生成阳离子全部是H+ )
1.酸的分类
(1)按组成可分为:含氧酸和无氧酸
(2)按电离出的H+ 个数分为:一元酸、二元酸、三元酸
(3)按酸性的强弱分为:强酸_____________________________、弱酸
(4)按酸的沸点高低可分为:高沸点酸_________、低沸点酸____________________
2.酸的命名
无氧酸一般命名为“氢某酸”____________,含氧酸一般命名为“某酸”_________。
3.酸的通性
(1)酸溶液能与酸碱指示剂作用(石蕊遇酸变红,酚酞遇酸不变色。)
(2)酸 + 活泼金属→盐 + 氢气 H2SO4 + Zn = ZnSO4 + H2↑
(3)酸 + 碱性氧化物→盐 + 水 6HCl + Fe2O3 = 2FeCl3 + 3H2O
(4)酸 + 碱→盐 + 水 H2SO4 + Cu(OH)2 = CuSO4 + H2O
(5)酸 + 盐→新盐 + 新酸 2HCl + CaCO3 = CaCl2 + CO2↑+ H2O
Ⅲ 碱(电离时生成阴离子全部是OH-)
1.碱的分类
(1)按溶解性分为:可溶性碱____________、微溶性碱_________、难溶性碱_________
(2)按碱性强弱分为:强碱_________、弱碱_________
2.碱的命名
氢氧化某
3.碱的通性
(1)碱溶液能与酸碱指示剂作用(石蕊遇碱变蓝,酚酞遇碱变红)
(2)碱 + 酸性氧化物→盐 + 水 2NaOH + CO2 = Na2CO3 + H2O
(3)碱 + 酸→盐 + 水 Ba(OH)2 + H2SO4 = BaSO4↓ + 2H2O
(4)碱(可溶)+ 盐(可溶)→新盐 + 新碱 Ca(OH)2 + Na2CO3 = CaCO3↓ + 2NaOH
另:不溶性的碱受热易分解,生成对应的碱性氧化物和水 Cu(OH)2CuO + H2O
Ⅳ 盐(电离时有金属离子和酸根离子生成)
1.盐的分类和命名
正盐(无氧酸盐叫做“某化某”___________;含氧酸盐叫做“某酸某”_________)
酸式盐(NaHCO3碳酸氢钠、KHSO4硫酸氢钾、Ca(HCO3)2碳酸氢钙)
碱式盐(Cu2(OH)2CO3碱式碳酸铜)
化学上,对于含有相同酸根离或相同金属离子的盐,常给他们一个统称。(如:硫酸盐、钾盐等)
2.盐的性质
(1)盐 + 活泼金属→新盐 + 新金属 CuSO4 + Fe = FeSO4 + Cu
(2)盐 + 酸→新盐 + 新酸 BaCl2 + H2SO4 = BaSO4↓+ 2HCl
(3)盐(可溶)+ 碱(可溶)→新盐 + 新碱 FeCl3 + 3NaOH = Fe(OH)3↓+ 3NaCl
(4)盐(可溶)+ 盐(可溶)→新盐 + 新盐 NaCl + AgNO3 = NaNO3 + AgCl↓
二、物质的性质和变化
(一)物理变化、化学反应和物理性质、化学性质
物理变化与化学反应间最本质的区别是:化学反应有新物质产生。当然物理变化的同时不一定发生化学反应,但化学反应的同时一定伴随物理变化。
(二)质量守恒定律
参加化学反应的各物质质量总和,等于反应后各生成物的质量总和。
质量守恒的原因:
宏观:化学反应前后元素的种类不变
微观(实质):
(三)化学反应的基本类型(四种)
1.化合反应
①概念:A + B → AB
②反应的规律和条件
a、金属单质+非金属单质 b、非金属+非金属
Fe + O2 C + O2
c、酸性氧化物+水 d、碱性氧化物+水
CO2 + H2O CaO + H2O
*e、碱性氧化物+酸性氧化物 f、氨气+酸
CaO + SiO2 ==== CaSiO3 NH3 + HCl
g、结晶水合物的生成
CuSO4 + H2O
思考3:化合反应中反应物不一定为两种,也有三种或四种反应物生成一种产物的反应,请举例说明。
2、分解反应
①概念:AB → A + B
②反应的规律和条件
a、某些盐的分解 b、不溶性碱的分解
KClO3—— Fe(OH)3——
Cu2(OH)2CO32CuO + CO2↑+ H2O
c、电解水 d、含氧酸的分解
H2O—— H2CO3——
e、某些氧化物的分解 HgO——
3、置换反应
①概念:A + BC → B + AC
②反应的规律和条件
a、金属 + 酸 === 盐 + 氢气
选择条件:Ⅰ金属
Ⅱ酸
Zn + H2SO4
Fe + HCl
b、金属 + 盐 === 新盐 + 新金属
条件:盐要可溶 单质金属一定要比盐中的金属活泼
(古代湿法炼铜)Fe + CuSO4
思考4:K、Ca、Na等最活泼的金属是否能将金属从盐溶液中置换出来?
c、氢气还原金属氧化物
H2 + CuO
d、木炭还原金属氧化物
C + CuO
思考5:CO还原Fe2O3的反应是否是置换反应? 为什么?
4、复分解反应
(1)概念:AB + CD → AD + CB
(2)反应条件:生成物中应有沉淀、气体、水等至少一种
(3)反应规律
Ⅰ 酸 + 碱 == 盐 + 水
酸为强酸时,碱为任意碱
HCl + KOH
HCl + Cu(OH)2
HCl + NH3·H2O
碱为强碱时,酸为任意酸
NaOH + H2SO4
NaOH + H2SiO3
弱酸与弱碱一般难发生反应,但NH3·H2O(可溶性弱碱)能够和可溶性弱酸反应
NH3·H2O + CH3COOH
Ⅱ 酸 + 盐 == 新盐 + 新酸
此类情况比较复杂,初中阶段只要求掌握3种类型
CaCO3 + HCl ( 强酸制弱酸)
AgNO3 + HCl
BaCl2 + H2SO4
思考6:将CO2通入CaCl2溶液中,有什么现象?为什么?
Ⅲ 碱 + 盐 == 新盐 + 新碱
反应条件:反应物均能溶于水,产物应有沉淀或气体生成
NaOH + CuSO4
NaOH + NH4Cl
Ⅳ 盐 + 盐 == 新盐 + 新盐
反应条件:反应物均能溶于水,产物至少有一种沉淀
AgNO3 + NaCl
BaCl2 + CuSO4
酸、碱、盐、氧化物、单质之间的转化关系
例:用七种方法制取MgCl2
Ⅰ.Mg + Cl2 ==== MgCl2 ①
Ⅱ.MgO + HCl ==== MgCl2 + H2O ②
Ⅲ.Mg(OH)2 +2HCl ==== MgCl2 +2H2O ④
Ⅳ.MgCO3+2HCl === MgCl2 +H2O +CO2↑⑥
Ⅴ.MgSO4 + BaCl2 === MgCl2 + BaSO4↓ ⑦
Ⅵ.Mg + CuCl2 ==== MgCl2 + Cu ⑧
Ⅶ.Mg + 2HCl ==== MgCl2 + H2↑ ⑨
思考:试用五种方法制备ZnSO4
★ 请从锌、氧气、二氧化碳、水、盐酸、氢氧化钡溶液、硫酸铜溶液、碳酸钙中选出适当的物质,按下列要求写出有关反应的化学方程式:
(1)生成酸的化合反应_________________________________________________
(2)生成两种氧化物的分解反应_________________________________________
(3)生成气体的置换反应_______________________________________________
(4)生成两种沉淀的复分解反应_________________________________________
4.氧化-还原反应 (高中详讲)
5、溶液的导电性
(1)电离与溶液的电性
物质溶解于水(或受热熔化时即熔融状态)产生了能够自由移动的离子的过程,叫做电离。电离过程是不需要通电的,电离生成的阴离子和阳离子所带电量相等,电性相反(即“电荷守恒”),因此溶液不显电性。
(2)电离与导电的关系
溶质先发生电离,溶液才能够导电;溶液若能够导电,说明溶质发生了电离。在能导电的溶液里,溶质是由离子形式存在的,在不能导电的溶液里,溶质是由分子形式存在的。
(3)电离方程式的书写(须同时满足“质量守恒”与“电荷守恒”)
例:HCl = H+ + Cl-
Ca(OH)2 = Ca 2+ + 2OH-
NaCl = Na+ + Cl-
★ 请书写下列物质在水溶液中的电离方程式:
HNO3 NH4NO3
KOH Na2CO3
CaCl2 Fe(NO3)2
Al2(SO4)3
酸碱盐溶解性口诀:
钾钠铵盐硝酸盐,完全溶解不困难;
盐酸盐中氯化银,水中溶解不得行;
硫酸钡铅不溶外,微溶只有银和钙;
碳酸盐溶钾钠铵,余下沉淀记心间。
酸、碱和盐的溶解性表(20℃)
阴离子阳离子 OH- NO3- Cl- SO42- S2- SO32- CO32- SiO32- PO43-
H+ 溶、挥 溶、挥 溶 溶、挥 溶、挥 溶、挥 微 溶
NH4+ 溶、挥 溶 溶 溶 溶 溶 溶 — 溶
K+ 溶 溶 溶 溶 溶 溶 溶 溶 溶
Na+ 溶 溶 溶 溶 溶 溶 溶 溶 溶
Ba2+ 溶 溶 溶 不 — 不 不 不 不
Ca2+ 微 溶 溶 微 — 不 不 不 不
Mg2+ 不 溶 溶 溶 — 微 微 不 不
Al3+ 不 溶 溶 溶 — — — 不 不
Mn2+ 不 溶 溶 溶 不 不 不 不 不
Zn2+ 不 溶 溶 溶 不 不 不 不 不
Cr3+ 不 溶 溶 溶 — — — 不 不
Fe2+ 不 溶 溶 溶 不 不 不 不 不
Fe3+ 不 溶 溶 溶 — — — 不 不
Sn2+ 不 溶 溶 溶 不 — — — 不
Pb2+ 不 溶 微 不 不 不 不 不 不
Cu2+ 不 溶 溶 溶 不 不 不 不 不
Hg2+ — 溶 溶 溶 不 不 — — 不
Ag+ — 溶 不 微 不 不 不 不 不
说明:“溶”表示那种物质可溶于水,“不”表示不溶于水,“微”表示微溶于水,“挥”表示那种物质易挥发或易分解,“—”表示那种物质不存在或遇到水就分解了。
第三部分 实验复习
一、常见气体的制备
(一)气体的制备思路,可从下面几个方面来归纳:
(二)组装仪器:自 下 而 上 ,从 左 到 右 ;气体净化:先净气装置,后干燥装置;
(三)操作顺序:
1.检验装置的气密性;2.装药品进行实验操作;3.记录实验现象、数据;
(四)1.三种常见气体的实验室制法比较
O2 H2 CO2
反应原理
装置类型 固体+ 固体气体 固体 + 液体→气体 固体 + 液体→气体
实验装置图
收集方法
验满方法 验纯方法:用小试管收集一试管氢气,用拇指堵住试管口,移近酒精灯,松开拇指,若听到尖锐的响声,则氢气不纯净;若听到轻微的“噗噗”声,则说明氢气已较纯。
注意事项 1.试管口略低于试管底2.铁夹夹在试管的中上部3.用排水法收集完气体时,应 当均匀产生气泡时才开始收集 1.长颈漏斗
2.固体 + 液体→气体型装置的比较
(1)反应容器: 大试管 、 锥形瓶 、 广口瓶 。
(2)加液仪器:长颈漏斗、分液漏斗
(3)常见装置:
图1 图2 图3
3.启普发生器及简易装置
启普发生器的操作原理是利用气压知识使固、液接触或脱离,控制对气体反应随即产生或停止,使之控制反应的产生。若无启普发生器,可根据启普发生器反应原理设计出多种简易启普发生器。
图5 图6
启普发生器适用条件:块状固体与液体反应,反应不需加热,生成的气体在水中溶解度不大,且注意块状固体不能粉末化,反应放热少。
二、三种物质还原性实验比较
H2 CO C
反应原理
实验装置图
实验现象
主要步骤 1.装药品。2.先通H2,后点燃酒精灯。3.实验完毕,先撤去酒精灯,直到试管冷却,再停止通H2。 1. 2.同左 3.同左 4.整个实验过程都必须进行尾气处理 ,防止污染空气。 1. 。2.装入药品。3.加热4.实验完毕停止加热。
注意事项 1.实验前必须对CO、H2 进行 验纯 。2.先通后点防 爆炸 。3.先撤后停防 氧化 。 为提高温度一般用酒精喷灯。实验结束,应先 ,后 ,目的 。
四、常见气体的检验方法
气体 检验方法 实验现象
O2
H2 1.先经过 ,再 2.点燃时 。
CO2 。
CO 经过灼热的CuO,再通人澄清石灰水。点燃,在火焰上方罩附有澄清石灰水的小烧杯。
H2O
CH4 点燃,在火焰上方罩上干冷的小烧杯,然后换上一个附有澄清石灰水的小烧杯。
点燃
△
点燃
点燃
高温
高温
高温
点燃
点燃
△
高温
浓H2SO4
△
高温
质子
中子
构成
原子核
电 子
构成
原子
(直接)构成
物质
组成
元素
离子
分子
构
成
变
成
构
成
构
成
(纯净物)
单质
化合物
同
种
元
素
成
组
不
同
元
素
组
成
点燃
点燃
△
高温
△
气球
同课章节目录
