离子反应
图片预览









文档简介
(共37张PPT)
化学反应
1、根据反应物和生成物的类别
及反应前后物质种类的多少
化合反应
分解反应
置换反应
复分解反应
2、根据反应中是否有电
子转移(得失或偏移)
氧化还原反应
非氧化还原反应
3、根据反应中是否离子参加:
离子反应
非离子反应
大厂高级实验中学 化学教师 左辉
下列物质中哪些能导电?为什么?
盐酸,NaOH溶液,NaCl固体,石墨,
蔗糖溶液,K2SO4溶液,酒精溶液,Cu.
1、石墨、Cu导电是由于有自由移动的电子
2、盐酸、NaOH溶液、K2SO4溶液导电是由于有自由移动的离子
你能写出HCl、NaOH、 K2SO4的电离方程式吗?
HCl = H+ + Cl-
NaOH = Na+ + OH-
K2SO4 =2K+ + SO42-
NaOH、K2SO4除了在水溶液里能导电还能在其他条件下导电吗
熔融
电解质: 在水溶液或熔融状态下能导电的化合物
一、电解质和非电解质
非电解质:在水溶液和熔融状态下 不能导电的化合物
判断下列物质哪些是电解质,那些是非电解质:
①H2SO4, ②Ca(OH)2, ③ 盐酸,④AgCl, ⑤ Na2O,
⑥CH3COOH, ⑦ 酒精,⑧CH4、⑨Fe、⑩SO2、
电解质:
非电解质:
①②④⑤⑥
⑦⑧⑩
小结:
1、电解质和非电解质都是化合物
2、电解质导电要有外界条件:水溶液或熔融状态
3、电解质应是本身电离而导电的化合物
4、某些难溶于水的盐也是电解质: AgCl 、
BaSO4 、
CaCO3等
5 、酸、碱、盐、水、部分金属氧化物等一般都是电解质
非金属氧化物、多数有机物、NH3等一般都是非电解质
单质,既不是电解质也不是是非电解质。|非质非非质|
电解质溶液的导电性
溶液导电示意图:
定向运动
自由移动的离子
电解质溶液
一定要搞清本质!
电离
外电场
导电
电解质溶液的导电性实验
实验现象
原因分析
盐 酸
NaOH溶液
NaCl溶液
醋酸溶液
氨 水
灯 泡 亮 了
溶液中存在自由移动的离子
灯很亮
灯稍暗
全部电离
部分电离
灯泡亮暗 →
溶液的导电性不同 →
电解质电离程度不同→
电解质有强弱之分→
单位体积溶液里自由移动离子的数目不同→
为什么HCl、NaOH、NaCl溶液的导电性比CH3COOH溶液、氨水强呢?
强电解质:在水溶液里能全部电离
成离子的电解质.
弱电解质: 在水溶液里部分电离
成离子的电解质
如: 弱酸、弱碱、水
如:强酸、强碱、大部分盐
二、强电解质和弱电解质
例1. 下表中物质的分类组合正确的是( )
编组 A B C D
强电解质 NaCl H2SO4 CaCO3 HNO3
弱电解质 H2O BaSO4 醋酸 碳酸
非电解质 Cl2 SO3 CH4 蔗糖
CD
弱酸、弱碱、水
强酸、强碱、
大多数盐
某些共价化合物
离子化合物、某些共价化合物
弱
强
分子、水合离子
水合离子
部分
全部
物质类别
化合物类型
同条件下导电性
溶液里溶质粒子
电离程度
弱电解质
强电解质
强弱电解质的比较:
练习. 判断下列说法是否正确,并说明理由
铜能导电,Cl2溶于水也能导电,
所以铜和Cl2都是电解质。
B. 氯化钠溶液能导电,所以氯化钠
溶液是电解质。
C. 固态氯化钠不导电,但氯化钠是电解质。
D. SO3,SO2,CO2,NH3溶于水都
能导电,所以它们都是电解质。
E. 氯化氢的水溶液能导电,所以氯化
氢是电解质。
F. CaCO3,BaSO4,AgCl的水溶液几
乎不能导电,所以它们都不是电解质
物质
纯净物
混合物
单质
化合物
电解质
非电解质
强电解质
弱电解质
强酸:例: HCl、HNO3、
H2SO4等
强碱:例: KOH、NaOH、
Ca(OH)2、Ba(OH)2等
多数盐:例: NaNO3、
NaCl、BaSO4等
弱酸:例: CH3COOH 、
H2CO3等
弱碱:例: NH3 H2O 、
Cu(OH)2等
水
例:蔗糖、酒精、 CH4 、
NH3 、 CO2 、 SO2 、 SO3 等
部分金属氧化物:
例:Na 2O 、CaO等
判断正误并分析原因:
1、铜和石墨都能导电,它们都是电解质;Cl2不能导电,故Cl2是非电解质
2、把SO3溶于水所得的溶液能导电,所以SO3是电解质
3、BaSO4难溶于水,所以BaSO4是强电解质
4 、电解质溶液都能够导电,能导电的物质都是电解质
X
X
√
X
1、下列各项中的物质能导电且属于强电解质的是( )
A、固态氯化镁 B、氯化镁溶液
C、氨水 D、碳酸
2、NaHSO4溶于水的电离方程式_________,
3 、下列物质属于弱电解质的是( ) A、醋酸 B、BaSO4 C、Cu D、SO2
NaHSO4 Na+ + H++ SO42-
B
A
二、离子反应
1、离子反应:有离子参加的反应。
编号 (1) (2) (3)
实验
现象
解释
与
结论
无明显变化
溶液仍为蓝色
有白色沉淀生成
滤液为蓝色
有白色沉淀生成,滴
加稀硝酸沉淀不溶
解,滤液仍为蓝色
没有发生化学
反应,溶液中
仍是自由移动
的Cu2+、SO42-、
Na+、Cl-
Ba2+和SO42-发生反应
生成了BaSO4白色沉
淀,而Cu2+ Cl- 没
参加反应,留在滤液
中,因此滤液为蓝色
Ag+和Cl-反应生成了
不溶于稀硝酸的AgCl
白色沉淀。Cu2+、
NO3-还留在滤液中,
故滤液仍为蓝色
NaCl溶液
CuSO4溶液
过量BaCl2溶液
CuSO4溶液
AgNO3溶液、稀硝酸
(2)中的滤液
2、离子方程式
(1)概念
离子方程式:用实际参加反应的离子符号表示离子反应的式子。
(2)离子方程式的书写步骤
(写、改、删、查)
① 写:依反应事实写出反应的化学方程式
② 改:仅把强酸、强碱、可溶盐改写成离子符号;其它的(单质、
氧化物、难溶物、难电离物以及气态物等)仍用化学式表示。
③ 删:删去方程式两边不参加反应的离子,并使方程式中系数为
最简整数比。
④ 查:根据质量守恒和电量守恒,检查离子方程式两边各元素的
原子个数和电荷总数是否相等。
(基础)
(关键)
(保证)
(途径)
讨论1:以 NaOH 溶液与盐酸的反应和 KOH 溶液与硫酸的反应为例,分析中和反应的实质。
H+ + OH- == H2O
思考:下列各反应中,能用离子方程式 H++OH-=H2O 表示的是( )
A、硫酸氢钠溶液和氢氧化钾溶液反应
B、盐酸和氨水反应
C、稀硫酸和氢氧化钡溶液反应
D、碳酸溶液和石灰水反应
A
(3)离子方程式的意义
① 揭示了离子反应的实质
② 表示同一类型的反应
(例:Ba2+ + SO42- = BaSO4↓)
(例:H+ + OH- = H2O)
练习:写出下列反应的离子方程式
1、MnO2+4HCl(浓)== MnCl2+Cl2↑+2H2O
2、澄清石灰水中通入CO2
△
1、 MnO2+4H++2Cl-==Mn2++Cl2 ↑+2H2O
2、Ca2++2OH— + CO2 = CaCO3 ↓+ H2O
△
练习1、下列离子方程式中正确的是( )
A、向碳酸钠溶液中加入盐酸
CO32-+ 2H+ = CO2 ↑+H2O
B、单质铁和三氯化铁溶液反应生成氯化亚铁
Fe + Fe3+=2Fe2+
C、金属钠与水反应生成氢氧化钠和氢气
Na + H2O=Na++OH-+H2↑
D、氯化铵晶体和石灰粉共热产生氨气
NH4+ +OH-=NH3 ↑+H2O
△
A
(注意:不是在溶液中进行的反应,不能用离子方程式表示。)
2、下列离子方程式中,错误的是( )
A、氢氧化钡溶液和稀硫酸反应
Ba2++OH-+ H++SO42-=BaSO4↓+H2O
B、纯碱水和硝酸反应
CO32- +2H+ =H2O + CO2↑
C、硫酸铵稀溶液和氢氧化钠溶液反应
NH4++OH-=NH3·H2O
D、醋酸溶液与氨水反应
CH3COOH + NH3·H2O = NH4+ + CH3COO_ + H2O
A
4、下列四个图示中,能表示向石灰水中通CO2气体至过量的是
( )
B
写出变化过程中发生的有关反应的离子方程式:
Ca2+ + 2OH- + CO2 = CaCO3 ↓+ H2O
CaCO3 + H2O + CO2 = Ca2+ + 2HCO3-
思考:下列物质中哪些是电解质:
铜、硫酸、氯化钠固体、氢氧化钠固体、碳酸钙、
二氧化碳、氧化钠、甲烷。
电解质:硫酸、氯化钠固体、氢氧化钠固体、碳酸钙、
氧化钠
思考:“Na2O溶于水能导电,说明Na2O是电解质.”对吗?
化学反应
1、根据反应物和生成物的类别
及反应前后物质种类的多少
化合反应
分解反应
置换反应
复分解反应
2、根据反应中是否有电
子转移(得失或偏移)
氧化还原反应
非氧化还原反应
3、根据反应中是否离子参加:
离子反应
非离子反应
大厂高级实验中学 化学教师 左辉
下列物质中哪些能导电?为什么?
盐酸,NaOH溶液,NaCl固体,石墨,
蔗糖溶液,K2SO4溶液,酒精溶液,Cu.
1、石墨、Cu导电是由于有自由移动的电子
2、盐酸、NaOH溶液、K2SO4溶液导电是由于有自由移动的离子
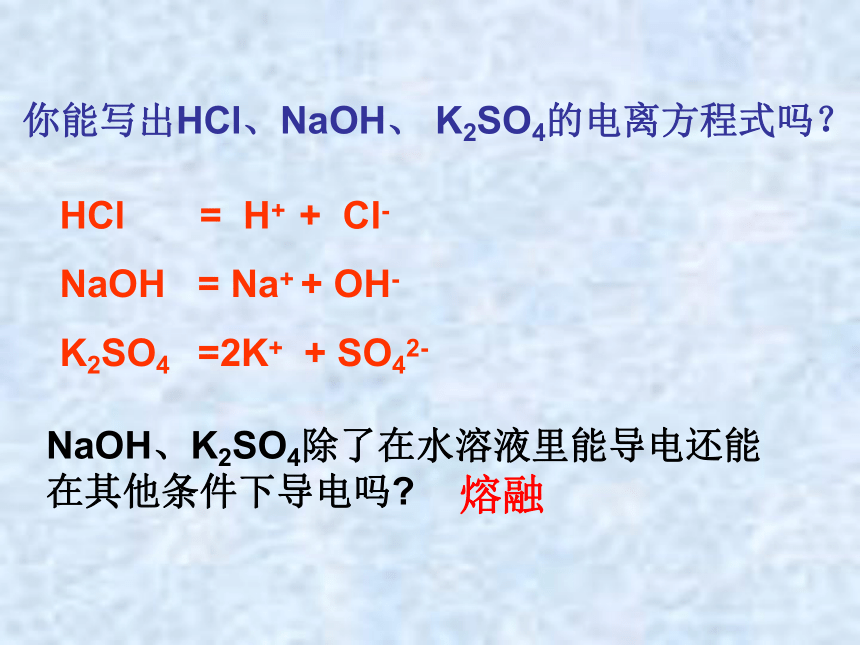
你能写出HCl、NaOH、 K2SO4的电离方程式吗?
HCl = H+ + Cl-
NaOH = Na+ + OH-
K2SO4 =2K+ + SO42-
NaOH、K2SO4除了在水溶液里能导电还能在其他条件下导电吗
熔融
电解质: 在水溶液或熔融状态下能导电的化合物
一、电解质和非电解质
非电解质:在水溶液和熔融状态下 不能导电的化合物
判断下列物质哪些是电解质,那些是非电解质:
①H2SO4, ②Ca(OH)2, ③ 盐酸,④AgCl, ⑤ Na2O,
⑥CH3COOH, ⑦ 酒精,⑧CH4、⑨Fe、⑩SO2、
电解质:
非电解质:
①②④⑤⑥
⑦⑧⑩
小结:
1、电解质和非电解质都是化合物
2、电解质导电要有外界条件:水溶液或熔融状态
3、电解质应是本身电离而导电的化合物
4、某些难溶于水的盐也是电解质: AgCl 、
BaSO4 、
CaCO3等
5 、酸、碱、盐、水、部分金属氧化物等一般都是电解质
非金属氧化物、多数有机物、NH3等一般都是非电解质
单质,既不是电解质也不是是非电解质。|非质非非质|
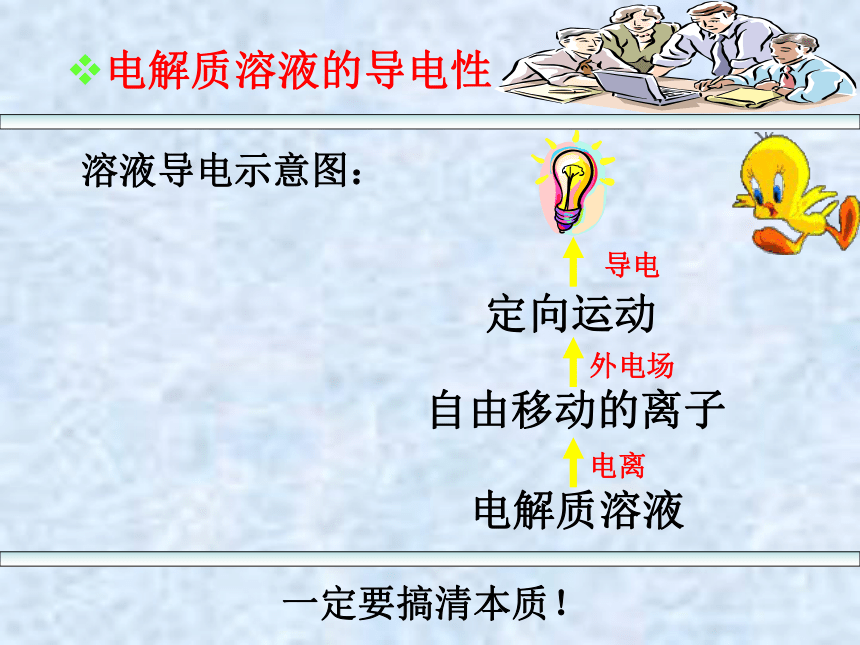
电解质溶液的导电性
溶液导电示意图:
定向运动
自由移动的离子
电解质溶液
一定要搞清本质!
电离
外电场
导电
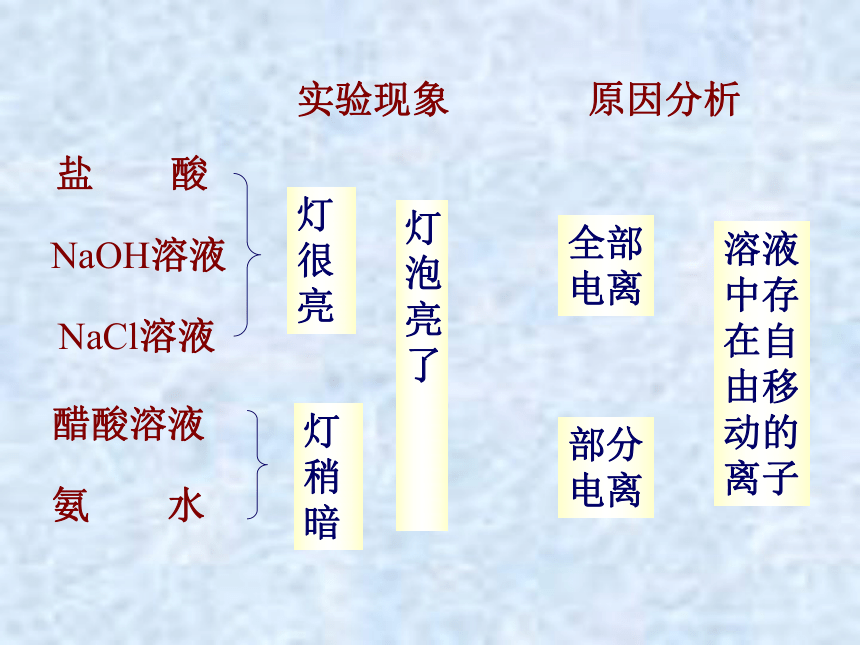
电解质溶液的导电性实验
实验现象
原因分析
盐 酸
NaOH溶液
NaCl溶液
醋酸溶液
氨 水
灯 泡 亮 了
溶液中存在自由移动的离子
灯很亮
灯稍暗
全部电离
部分电离
灯泡亮暗 →
溶液的导电性不同 →
电解质电离程度不同→
电解质有强弱之分→
单位体积溶液里自由移动离子的数目不同→
为什么HCl、NaOH、NaCl溶液的导电性比CH3COOH溶液、氨水强呢?
强电解质:在水溶液里能全部电离
成离子的电解质.
弱电解质: 在水溶液里部分电离
成离子的电解质
如: 弱酸、弱碱、水
如:强酸、强碱、大部分盐
二、强电解质和弱电解质
例1. 下表中物质的分类组合正确的是( )
编组 A B C D
强电解质 NaCl H2SO4 CaCO3 HNO3
弱电解质 H2O BaSO4 醋酸 碳酸
非电解质 Cl2 SO3 CH4 蔗糖
CD
弱酸、弱碱、水
强酸、强碱、
大多数盐
某些共价化合物
离子化合物、某些共价化合物
弱
强
分子、水合离子
水合离子
部分
全部
物质类别
化合物类型
同条件下导电性
溶液里溶质粒子
电离程度
弱电解质
强电解质
强弱电解质的比较:
练习. 判断下列说法是否正确,并说明理由
铜能导电,Cl2溶于水也能导电,
所以铜和Cl2都是电解质。
B. 氯化钠溶液能导电,所以氯化钠
溶液是电解质。
C. 固态氯化钠不导电,但氯化钠是电解质。
D. SO3,SO2,CO2,NH3溶于水都
能导电,所以它们都是电解质。
E. 氯化氢的水溶液能导电,所以氯化
氢是电解质。
F. CaCO3,BaSO4,AgCl的水溶液几
乎不能导电,所以它们都不是电解质
物质
纯净物
混合物
单质
化合物
电解质
非电解质
强电解质
弱电解质
强酸:例: HCl、HNO3、
H2SO4等
强碱:例: KOH、NaOH、
Ca(OH)2、Ba(OH)2等
多数盐:例: NaNO3、
NaCl、BaSO4等
弱酸:例: CH3COOH 、
H2CO3等
弱碱:例: NH3 H2O 、
Cu(OH)2等
水
例:蔗糖、酒精、 CH4 、
NH3 、 CO2 、 SO2 、 SO3 等
部分金属氧化物:
例:Na 2O 、CaO等
判断正误并分析原因:
1、铜和石墨都能导电,它们都是电解质;Cl2不能导电,故Cl2是非电解质
2、把SO3溶于水所得的溶液能导电,所以SO3是电解质
3、BaSO4难溶于水,所以BaSO4是强电解质
4 、电解质溶液都能够导电,能导电的物质都是电解质
X
X
√
X
1、下列各项中的物质能导电且属于强电解质的是( )
A、固态氯化镁 B、氯化镁溶液
C、氨水 D、碳酸
2、NaHSO4溶于水的电离方程式_________,
3 、下列物质属于弱电解质的是( ) A、醋酸 B、BaSO4 C、Cu D、SO2
NaHSO4 Na+ + H++ SO42-
B
A
二、离子反应
1、离子反应:有离子参加的反应。
编号 (1) (2) (3)
实验
现象
解释
与
结论
无明显变化
溶液仍为蓝色
有白色沉淀生成
滤液为蓝色
有白色沉淀生成,滴
加稀硝酸沉淀不溶
解,滤液仍为蓝色
没有发生化学
反应,溶液中
仍是自由移动
的Cu2+、SO42-、
Na+、Cl-
Ba2+和SO42-发生反应
生成了BaSO4白色沉
淀,而Cu2+ Cl- 没
参加反应,留在滤液
中,因此滤液为蓝色
Ag+和Cl-反应生成了
不溶于稀硝酸的AgCl
白色沉淀。Cu2+、
NO3-还留在滤液中,
故滤液仍为蓝色
NaCl溶液
CuSO4溶液
过量BaCl2溶液
CuSO4溶液
AgNO3溶液、稀硝酸
(2)中的滤液
2、离子方程式
(1)概念
离子方程式:用实际参加反应的离子符号表示离子反应的式子。
(2)离子方程式的书写步骤
(写、改、删、查)
① 写:依反应事实写出反应的化学方程式
② 改:仅把强酸、强碱、可溶盐改写成离子符号;其它的(单质、
氧化物、难溶物、难电离物以及气态物等)仍用化学式表示。
③ 删:删去方程式两边不参加反应的离子,并使方程式中系数为
最简整数比。
④ 查:根据质量守恒和电量守恒,检查离子方程式两边各元素的
原子个数和电荷总数是否相等。
(基础)
(关键)
(保证)
(途径)
讨论1:以 NaOH 溶液与盐酸的反应和 KOH 溶液与硫酸的反应为例,分析中和反应的实质。
H+ + OH- == H2O
思考:下列各反应中,能用离子方程式 H++OH-=H2O 表示的是( )
A、硫酸氢钠溶液和氢氧化钾溶液反应
B、盐酸和氨水反应
C、稀硫酸和氢氧化钡溶液反应
D、碳酸溶液和石灰水反应
A
(3)离子方程式的意义
① 揭示了离子反应的实质
② 表示同一类型的反应
(例:Ba2+ + SO42- = BaSO4↓)
(例:H+ + OH- = H2O)
练习:写出下列反应的离子方程式
1、MnO2+4HCl(浓)== MnCl2+Cl2↑+2H2O
2、澄清石灰水中通入CO2
△
1、 MnO2+4H++2Cl-==Mn2++Cl2 ↑+2H2O
2、Ca2++2OH— + CO2 = CaCO3 ↓+ H2O
△
练习1、下列离子方程式中正确的是( )
A、向碳酸钠溶液中加入盐酸
CO32-+ 2H+ = CO2 ↑+H2O
B、单质铁和三氯化铁溶液反应生成氯化亚铁
Fe + Fe3+=2Fe2+
C、金属钠与水反应生成氢氧化钠和氢气
Na + H2O=Na++OH-+H2↑
D、氯化铵晶体和石灰粉共热产生氨气
NH4+ +OH-=NH3 ↑+H2O
△
A
(注意:不是在溶液中进行的反应,不能用离子方程式表示。)
2、下列离子方程式中,错误的是( )
A、氢氧化钡溶液和稀硫酸反应
Ba2++OH-+ H++SO42-=BaSO4↓+H2O
B、纯碱水和硝酸反应
CO32- +2H+ =H2O + CO2↑
C、硫酸铵稀溶液和氢氧化钠溶液反应
NH4++OH-=NH3·H2O
D、醋酸溶液与氨水反应
CH3COOH + NH3·H2O = NH4+ + CH3COO_ + H2O
A
4、下列四个图示中,能表示向石灰水中通CO2气体至过量的是
( )
B
写出变化过程中发生的有关反应的离子方程式:
Ca2+ + 2OH- + CO2 = CaCO3 ↓+ H2O
CaCO3 + H2O + CO2 = Ca2+ + 2HCO3-
思考:下列物质中哪些是电解质:
铜、硫酸、氯化钠固体、氢氧化钠固体、碳酸钙、
二氧化碳、氧化钠、甲烷。
电解质:硫酸、氯化钠固体、氢氧化钠固体、碳酸钙、
氧化钠
思考:“Na2O溶于水能导电,说明Na2O是电解质.”对吗?
