江西省抚州市南城一中2020-2021学年高一下学期4月月考化学试题 Word版含答案
文档属性
| 名称 | 江西省抚州市南城一中2020-2021学年高一下学期4月月考化学试题 Word版含答案 |  | |
| 格式 | doc | ||
| 文件大小 | 419.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-04-10 23:07:30 | ||
图片预览

文档简介
江西省南城一中2023届高一下学期4月月考
化 学 试 卷
一、选择题(每小题只有一个正确答案,每小题3分,共计48分)
1. 化学与生活、社会密切相关。下列说法正确的是:( )
A.光纤通信使用的光缆的主要成分是晶体Si,太阳能电池使用的材料主要是SiO2
B.氨很容易液化,液氨气化吸收大量的热,所以液氨常用作致冷剂
C.高锰酸钾溶液、酒精、双氧水都能杀菌消毒,消毒原理相同,都利用了强氧化性
D.SO2可以用来漂白纸浆、毛、丝、草帽辫、增白食品等
2. 下列有关化学用语的表示正确的是( )
A.NH4Cl的电子式: B.S2-的结构示意图:
C.氨的电子式: D.碳元素位于第2周期,VIA族
3.下列有关性质的比较,不能用元素周期律解释的是
A. 原子半径:C > O B. 酸性:HCl > H2SiO3
C. 热稳定性:H2O > H2S D. 金属性:Na > Al
4.下列大小比较正确的是( )
A.离子半径:Na+>Mg2+>Al3+>Cl-;原子半径:Na>Mg>Al>Cl
B.稳定性:HF>H2O>NH3>CH4;还原性:HFC.碱性:CsOH>KOH>Mg(OH)2>NaOH;金属性:Cs>K>Mg>Na
D.酸性:HClO>H2SO4>H2CO3;非金属性Cl>S>C
5. 设NA表示阿伏加德罗常数的值,下列判断正确的是
A. 标准状况下,22.4LSO3中含有的原子数目为4NA
B. 在常温常压下,48g氧气和臭氧的混合气体含氧原子数是3NA
C. 1molCl2参加反应转移电子数一定为2NA
D. lmolNa2O2与水充分反应转移的电子数为2NA
6.C和Si 是同主族元素,最外层电子数相同,性质相似。下列关于CO2与SiO2说法中正确的是( )
A.CO2能与水反应生成对应的酸;SiO2也能与水反应生成对应的酸
B.CO2的结构式是O=C=O;SiO2的结构式是O=Si=O
C.CO2分子由1个C原子和2个O原子构成;SiO2分子由1个Si原子和2个O原子构成
D.CO2具有氧化性,可作氧化剂;SiO2也具有氧化性,可作氧化剂
7.近年来,我国在超导研究方面居世界领先地位,铊(Tl)是超导体的组成成分之一,铊位于第六周期第ⅢA族,下列对铊的性质推导可能正确的是( )
①铊是易导电的银白色金属 ②Tl(OH)3是两性氢氧化物
③Tl3+的氧化能力比Al3+的强 ④单质能跟稀HNO3反应生成硝酸盐
A.①④ B.②③ C.只有① D.只有④
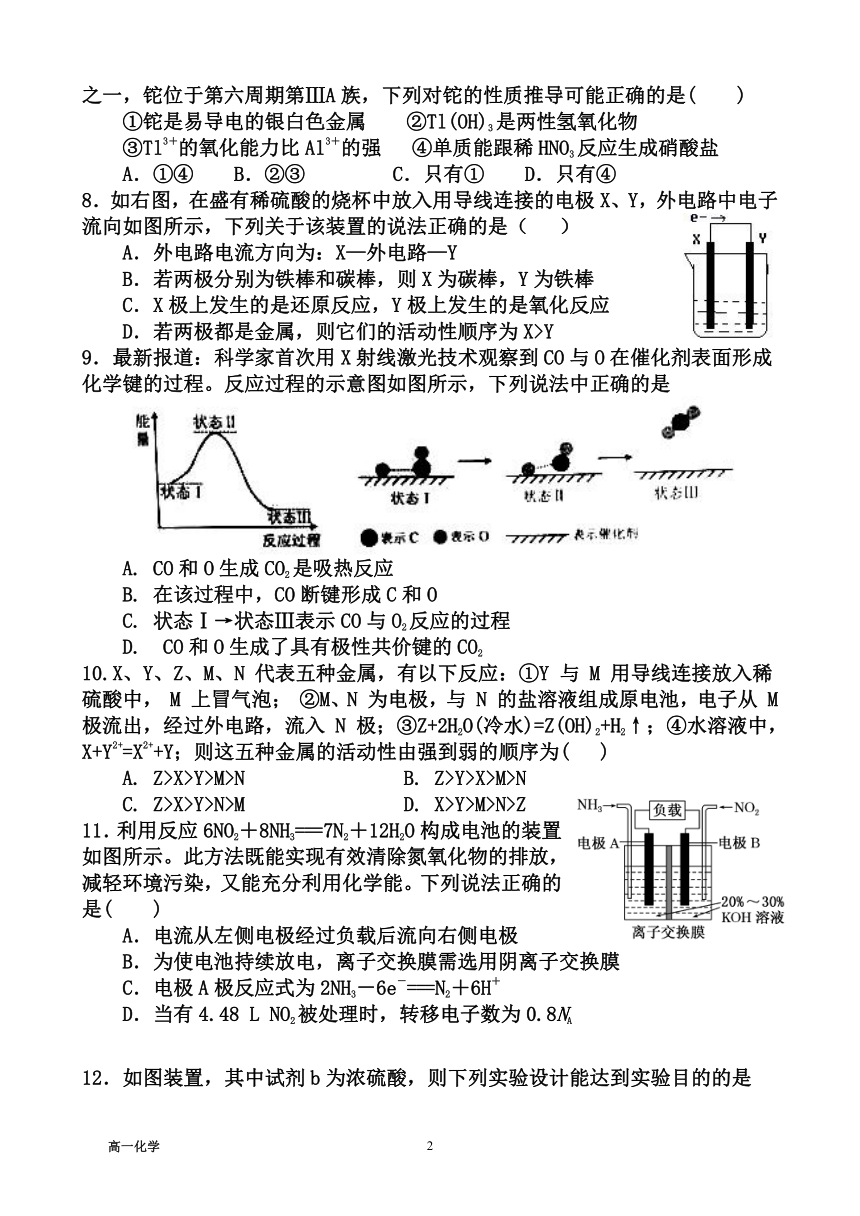
8.如右图,在盛有稀硫酸的烧杯中放入用导线连接的电极X、Y,外电路中电子流向如图所示,下列关于该装置的说法正确的是( )
A.外电路电流方向为:X—外电路—Y
B.若两极分别为铁棒和碳棒,则X为碳棒,Y为铁棒
C.X极上发生的是还原反应,Y极上发生的是氧化反应
D.若两极都是金属,则它们的活动性顺序为X>Y
9.最新报道:科学家首次用X射线激光技术观察到CO与O在催化剂表面形成化学键的过程。反应过程的示意图如图所示,下列说法中正确的是
CO和O生成CO2是吸热反应
在该过程中,CO断键形成C和O
状态Ⅰ→状态Ⅲ表示CO与O2反应的过程
CO和O生成了具有极性共价键的CO2
10.X、Y、Z、M、N 代表五种金属,有以下反应:①Y 与 M 用导线连接放入稀硫酸中, M 上冒气泡; ②M、N 为电极,与 N 的盐溶液组成原电池,电子从 M 极流出,经过外电路,流入 N 极;③Z+2H2O(冷水)=Z(OH)2+H2↑;④水溶液中,X+Y2+=X2++Y;则这五种金属的活动性由强到弱的顺序为( )
A. Z>X>Y>M>N B. Z>Y>X>M>N
C. Z>X>Y>N>M D. X>Y>M>N>Z
11.利用反应6NO2+8NH3===7N2+12H2O构成电池的装置如图所示。此方法既能实现有效清除氮氧化物的排放,减轻环境污染,又能充分利用化学能。下列说法正确的是( )
A.电流从左侧电极经过负载后流向右侧电极
B.为使电池持续放电,离子交换膜需选用阴离子交换膜
C.电极A极反应式为2NH3-6e-===N2+6H+
D.当有4.48 L NO2被处理时,转移电子数为0.8NA
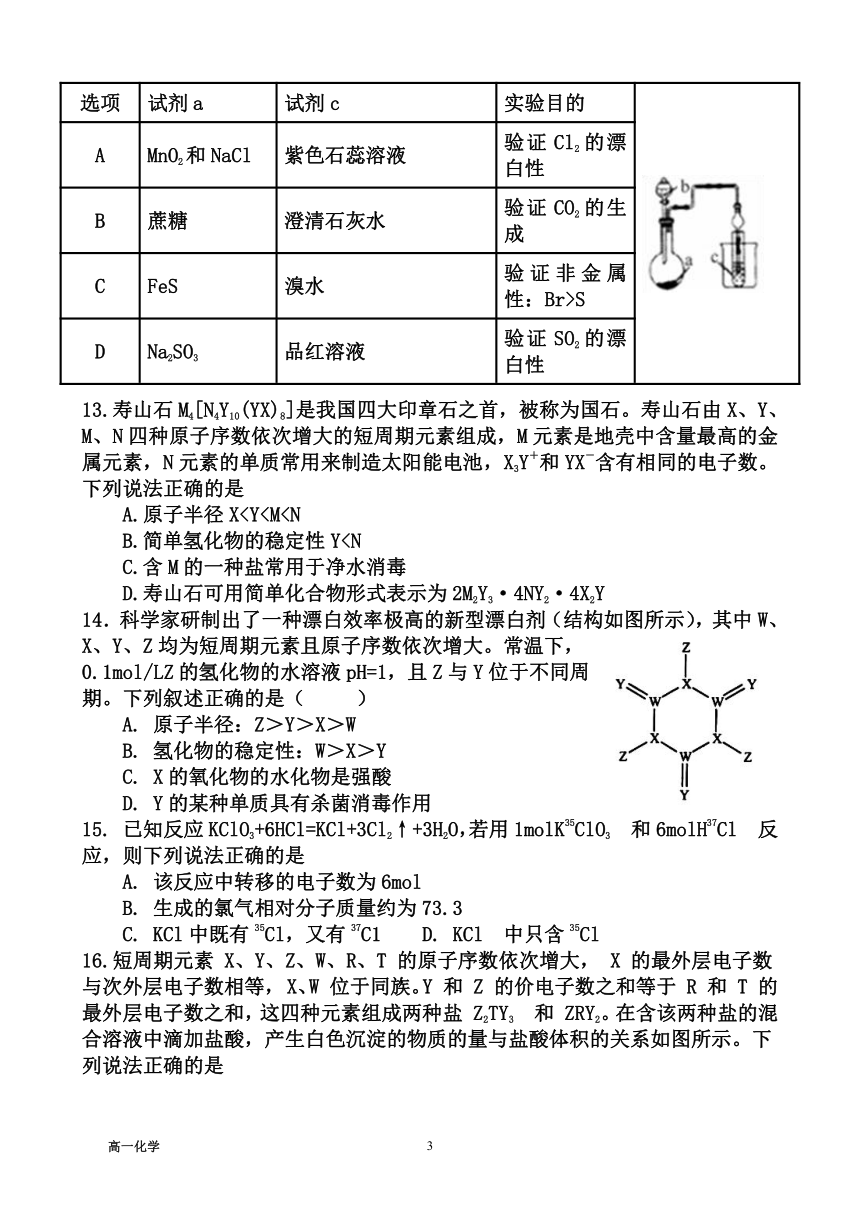
12.如图装置,其中试剂b为浓硫酸,则下列实验设计能达到实验目的的是
选项 试剂a 试剂c 实验目的
A MnO2和NaCl 紫色石蕊溶液 验证Cl2的漂白性
B 蔗糖 澄清石灰水 验证CO2的生成
C FeS 溴水 验证非金属性:Br>S
D Na2SO3 品红溶液 验证SO2的漂白性
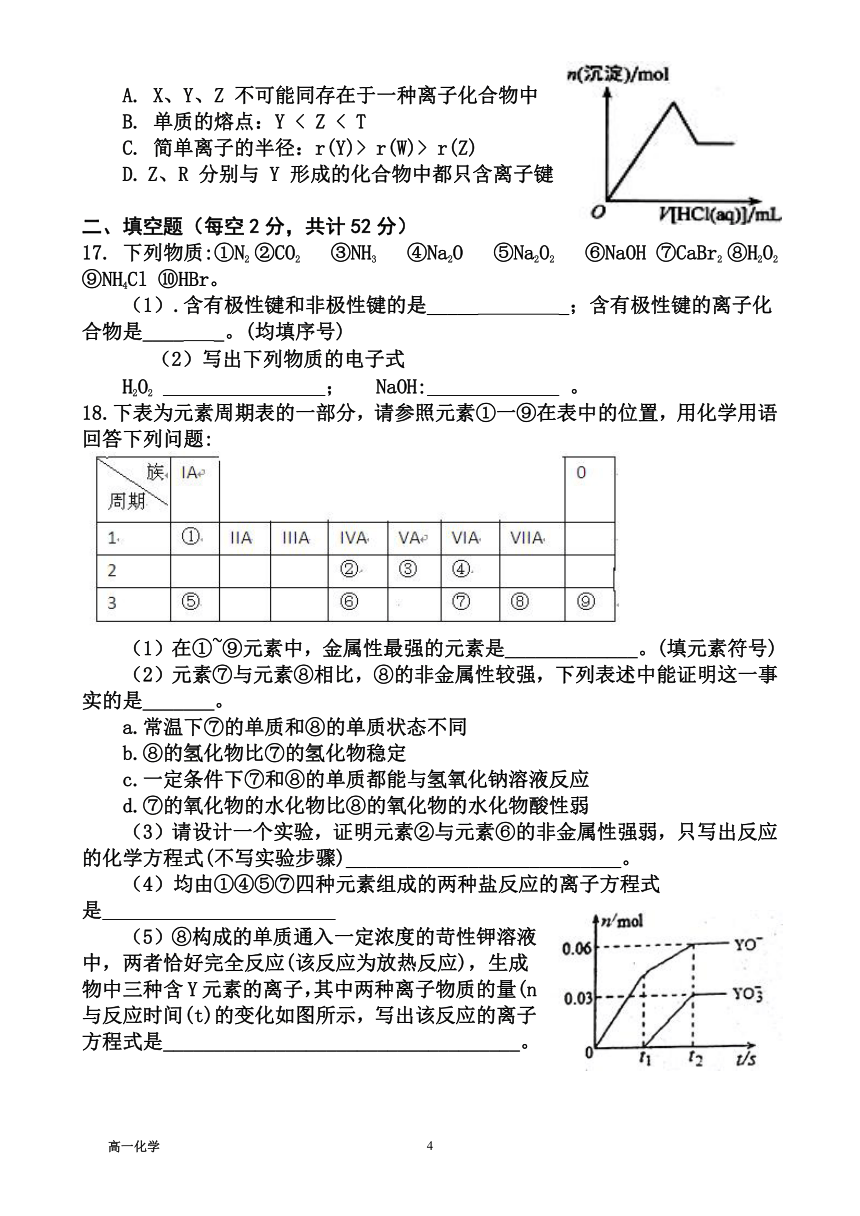
13.寿山石M4[N4Y10(YX)8]是我国四大印章石之首,被称为国石。寿山石由X、Y、M、N四种原子序数依次增大的短周期元素组成,M元素是地壳中含量最高的金属元素,N元素的单质常用来制造太阳能电池,X3Y+和YX-含有相同的电子数。下列说法正确的是
A.原子半径XB.简单氢化物的稳定性YC.含M的一种盐常用于净水消毒
D.寿山石可用简单化合物形式表示为2M2Y3·4NY2·4X2Y
14.科学家研制出了一种漂白效率极高的新型漂白剂(结构如图所示),其中W、X、Y、Z均为短周期元素且原子序数依次增大。常温下,0.1mol/LZ的氢化物的水溶液pH=1,且Z与Y位于不同周期。下列叙述正确的是( )
A. 原子半径:Z>Y>X>W
B. 氢化物的稳定性:W>X>Y
C. X的氧化物的水化物是强酸
D. Y的某种单质具有杀菌消毒作用
15. 已知反应KClO3+6HCl=KCl+3Cl2↑+3H2O,若用1molK35ClO3?和6molH37Cl?反应,则下列说法正确的是
A. 该反应中转移的电子数为6mol
B. 生成的氯气相对分子质量约为73.3
C. KCl中既有35Cl,又有37C1 D. KCl?中只含35Cl
16.短周期元素 X、Y、Z、W、R、T 的原子序数依次增大, X 的最外层电子数与次外层电子数相等, X、W 位于同族。Y 和 Z 的价电子数之和等于 R 和 T 的最外层电子数之和,这四种元素组成两种盐 Z2TY3 和 ZRY2。在含该两种盐的混合溶液中滴加盐酸,产生白色沉淀的物质的量与盐酸体积的关系如图所示。下列说法正确的是
A. X、Y、Z 不可能同存在于一种离子化合物中
B. 单质的熔点:Y < Z < T
C. 简单离子的半径:r(Y)> r(W)> r(Z)
D. Z、R 分别与 Y 形成的化合物中都只含离子键
二、填空题(每空2分,共计52分)
17. 下列物质:①N2 ②CO2? ③NH3? ④Na2O? ⑤Na2O2? ⑥NaOH ⑦CaBr2 ⑧H2O2 ⑨NH4Cl ⑩HBr。
(1).含有极性键和非极性键的是_____ _;含有极性键的离子化合物是____ _。(均填序号)
(2)写出下列物质的电子式
H2O2 ; NaOH: 。
18.下表为元素周期表的一部分,请参照元素①一⑨在表中的位置,用化学用语回答下列问题:
(1)在①~⑨元素中,金属性最强的元素是_____________。(填元素符号)
(2)元素⑦与元素⑧相比,⑧的非金属性较强,下列表述中能证明这一事实的是_______。
a.常温下⑦的单质和⑧的单质状态不同
b.⑧的氢化物比⑦的氢化物稳定
c.一定条件下⑦和⑧的单质都能与氢氧化钠溶液反应
d.⑦的氧化物的水化物比⑧的氧化物的水化物酸性弱
(3)请设计一个实验,证明元素②与元素⑥的非金属性强弱,只写出反应的化学方程式(不写实验步骤)___________________________。
(4)均由①④⑤⑦四种元素组成的两种盐反应的离子方程式
是
(5)⑧构成的单质通入一定浓度的苛性钾溶液中,两者恰好完全反应(该反应为放热反应),生成物中三种含Y元素的离子,其中两种离子物质的量(n)与反应时间(t)的变化如图所示,写出该反应的离子方程式是___________________________________。
19. I. 人们运用原电池原理制作了多种电池,以满足不同的需要。以下各种电池广泛运用于日常生活、生产和科学技术等方面,请根据题中提供的信息填空:
图1 图2
(1)燃料电池是一种高效、环境友好的供电装置,图1是甲烷燃烧电池工作原理示意图,该电池的负极反应式为 _________________________________;标准状况下,22.4L甲烷全部反应后,转移电子__________mol。
(2)图2是瑞典ASES公司设计的曾用于驱动潜艇的液氨—液氧燃料电池的示意图,该燃料电池工作时,电池的总反应方程式______________________;
负极的电极反应式为_______________________________________。
II.现有短周期元素X形成的单质A与NaOH溶液反应,有如下转化关系:
,(若产物中有水生成则省略未表示出来)。
(3)常温常压下,若A为非金属固态单质,且其在电子工业中有着重要的用途,则工业制取A化学方程式为___________________________________;
(4)若A?为金属单质,C为气体,则A与NaOH溶液反应的离子方程式为_____________________________。
20.阅读下面的信息,推断元素及有关物质。信息①:X、Y、Z、W是常见的短周期元素,其原子序数依次增大,且原子核外最外层电子数均不少于2。
(1)根据信息①,X一定不是________(填字母)。
A.氢 B.碳 C.氧 D.硫
信息②:上述四种元素的单质均能在足量的氧气中燃烧,生成的四种氧化物中,有两种能溶于稀硫酸,三种能溶于浓氢氧化钠溶液,其相对分子质量都大于26。
(2)这四种元素中是否可能有一种是铝元素?________。(填“是”或“否”)
信息③:向上述四种元素的单质组成的混合物中加入足量盐酸,固体部分溶解,过滤,向滤液中加入过量的烧碱溶液,最终溶液中析出白色沉淀。
(3)白色沉淀物的化学式的为________________。
信息④:向上述四种元素的单质组成的混合物中加入足量烧碱溶液,固体部分溶解,过滤,向滤液中加入过量的盐酸,最终溶液中析出白色沉淀。
(4)生成白色沉淀物的离子方程式为____________________________。
信息⑤:X与W同主族。
(5)X与浓硫酸加热时反应的化学方程式为__________________________。
21.某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验.
Ⅰ.利用图装置可验证同主族元素非金属性的变化规律
(1)干燥管D的作用为_______________;
(2)若要证明非金属性:C>Si,则在A中加盐酸、B中加CaCO3、C中加Na2SiO3溶液,观察到C中溶液________________________的现象,即可证明.但有的同学认为盐酸具有挥发性,可进入C中干扰实验,应在两装置间添加装有________溶液的洗气瓶。
Ⅱ 高锰酸钾是一种典型的强氧化剂,无论在实验室还是在化工生产中都有重要的应用。下图是实验室制备氯气并进行一系列相关实验的装置(夹持设备已略)。
(3)制备氯气选用的药品为:?高锰酸钾和浓盐酸,相应的离子方程式为:_____________。
(4)装置B的作用是_________________________________________。
(5)设计装置D、E的目的是比较氯、溴、碘的非金属性。当向D中缓缓通入足量氯气时,可以看到无色溶液逐渐变为红棕色,说明氧的非金属性大于溴。打开活塞,将D?中的少量溶液加入E?中,振荡E,观察到的现象是__________________________________________。该现象不能说明溴的非金属性强于碘,原因是______________________________________。
高一化学4月月考答案
一、选择题(每小题只有一个正确答案,每小题3分,共计48分)
题号 1 2 3 4 5 6 7 8
答案 B C B B B D A D
题号 9 10 11 12 13 14 15 16
答案 D A B D D D B B
二、填空题(每空2分,共计52分)
17 (1). ⑧ ⑥⑨ (2).略
18. (1).Na (2). b
(3)Na2SiO3+CO2+H2O=Na2CO3+H2SiO3或Na2SiO3+2CO2+2H2O=2NaHCO3+H2SiO3↓
(4)H++HSO3_=SO2↑+H2O
(5). 5Cl2+?10OH-=2C1O-+?C1O3-+?7Cl-+5H2O
19. (1).CH4+10OH—-8e-==CO32-+7H2O 0.8 (2).4NH3+3O2==2N2+6H2O;2NH3-6e-+6OH-=N2+6H2O
(3). 2C+SiO22CO↑+Si (4). 2Al+2OH-+2H2O=2AlO2-+3H2↑
20.(1)AD (2)是 (3)Mg(OH)2
(4)SiO+2H+===H2SiO3↓
(5)C+2H2SO4(浓)CO2↑+2SO2↑+2H2O
21.Ⅰ.(1) 防止倒吸 (2) 有白色沉淀生成 饱和NaHCO3
Ⅱ . (3). 2MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8H2O (4). 除HCl和防堵塞(或作安全瓶) (5). E中溶液分为两层,上层为紫红色,下层为无色 过量的Cl2也可将I-氧化为I2
高一化学
化 学 试 卷
一、选择题(每小题只有一个正确答案,每小题3分,共计48分)
1. 化学与生活、社会密切相关。下列说法正确的是:( )
A.光纤通信使用的光缆的主要成分是晶体Si,太阳能电池使用的材料主要是SiO2
B.氨很容易液化,液氨气化吸收大量的热,所以液氨常用作致冷剂
C.高锰酸钾溶液、酒精、双氧水都能杀菌消毒,消毒原理相同,都利用了强氧化性
D.SO2可以用来漂白纸浆、毛、丝、草帽辫、增白食品等
2. 下列有关化学用语的表示正确的是( )
A.NH4Cl的电子式: B.S2-的结构示意图:
C.氨的电子式: D.碳元素位于第2周期,VIA族
3.下列有关性质的比较,不能用元素周期律解释的是
A. 原子半径:C > O B. 酸性:HCl > H2SiO3
C. 热稳定性:H2O > H2S D. 金属性:Na > Al
4.下列大小比较正确的是( )
A.离子半径:Na+>Mg2+>Al3+>Cl-;原子半径:Na>Mg>Al>Cl
B.稳定性:HF>H2O>NH3>CH4;还原性:HF
D.酸性:HClO>H2SO4>H2CO3;非金属性Cl>S>C
5. 设NA表示阿伏加德罗常数的值,下列判断正确的是
A. 标准状况下,22.4LSO3中含有的原子数目为4NA
B. 在常温常压下,48g氧气和臭氧的混合气体含氧原子数是3NA
C. 1molCl2参加反应转移电子数一定为2NA
D. lmolNa2O2与水充分反应转移的电子数为2NA
6.C和Si 是同主族元素,最外层电子数相同,性质相似。下列关于CO2与SiO2说法中正确的是( )
A.CO2能与水反应生成对应的酸;SiO2也能与水反应生成对应的酸
B.CO2的结构式是O=C=O;SiO2的结构式是O=Si=O
C.CO2分子由1个C原子和2个O原子构成;SiO2分子由1个Si原子和2个O原子构成
D.CO2具有氧化性,可作氧化剂;SiO2也具有氧化性,可作氧化剂
7.近年来,我国在超导研究方面居世界领先地位,铊(Tl)是超导体的组成成分之一,铊位于第六周期第ⅢA族,下列对铊的性质推导可能正确的是( )
①铊是易导电的银白色金属 ②Tl(OH)3是两性氢氧化物
③Tl3+的氧化能力比Al3+的强 ④单质能跟稀HNO3反应生成硝酸盐
A.①④ B.②③ C.只有① D.只有④
8.如右图,在盛有稀硫酸的烧杯中放入用导线连接的电极X、Y,外电路中电子流向如图所示,下列关于该装置的说法正确的是( )
A.外电路电流方向为:X—外电路—Y
B.若两极分别为铁棒和碳棒,则X为碳棒,Y为铁棒
C.X极上发生的是还原反应,Y极上发生的是氧化反应
D.若两极都是金属,则它们的活动性顺序为X>Y
9.最新报道:科学家首次用X射线激光技术观察到CO与O在催化剂表面形成化学键的过程。反应过程的示意图如图所示,下列说法中正确的是
CO和O生成CO2是吸热反应
在该过程中,CO断键形成C和O
状态Ⅰ→状态Ⅲ表示CO与O2反应的过程
CO和O生成了具有极性共价键的CO2
10.X、Y、Z、M、N 代表五种金属,有以下反应:①Y 与 M 用导线连接放入稀硫酸中, M 上冒气泡; ②M、N 为电极,与 N 的盐溶液组成原电池,电子从 M 极流出,经过外电路,流入 N 极;③Z+2H2O(冷水)=Z(OH)2+H2↑;④水溶液中,X+Y2+=X2++Y;则这五种金属的活动性由强到弱的顺序为( )
A. Z>X>Y>M>N B. Z>Y>X>M>N
C. Z>X>Y>N>M D. X>Y>M>N>Z
11.利用反应6NO2+8NH3===7N2+12H2O构成电池的装置如图所示。此方法既能实现有效清除氮氧化物的排放,减轻环境污染,又能充分利用化学能。下列说法正确的是( )
A.电流从左侧电极经过负载后流向右侧电极
B.为使电池持续放电,离子交换膜需选用阴离子交换膜
C.电极A极反应式为2NH3-6e-===N2+6H+
D.当有4.48 L NO2被处理时,转移电子数为0.8NA
12.如图装置,其中试剂b为浓硫酸,则下列实验设计能达到实验目的的是
选项 试剂a 试剂c 实验目的
A MnO2和NaCl 紫色石蕊溶液 验证Cl2的漂白性
B 蔗糖 澄清石灰水 验证CO2的生成
C FeS 溴水 验证非金属性:Br>S
D Na2SO3 品红溶液 验证SO2的漂白性
13.寿山石M4[N4Y10(YX)8]是我国四大印章石之首,被称为国石。寿山石由X、Y、M、N四种原子序数依次增大的短周期元素组成,M元素是地壳中含量最高的金属元素,N元素的单质常用来制造太阳能电池,X3Y+和YX-含有相同的电子数。下列说法正确的是
A.原子半径X
D.寿山石可用简单化合物形式表示为2M2Y3·4NY2·4X2Y
14.科学家研制出了一种漂白效率极高的新型漂白剂(结构如图所示),其中W、X、Y、Z均为短周期元素且原子序数依次增大。常温下,0.1mol/LZ的氢化物的水溶液pH=1,且Z与Y位于不同周期。下列叙述正确的是( )
A. 原子半径:Z>Y>X>W
B. 氢化物的稳定性:W>X>Y
C. X的氧化物的水化物是强酸
D. Y的某种单质具有杀菌消毒作用
15. 已知反应KClO3+6HCl=KCl+3Cl2↑+3H2O,若用1molK35ClO3?和6molH37Cl?反应,则下列说法正确的是
A. 该反应中转移的电子数为6mol
B. 生成的氯气相对分子质量约为73.3
C. KCl中既有35Cl,又有37C1 D. KCl?中只含35Cl
16.短周期元素 X、Y、Z、W、R、T 的原子序数依次增大, X 的最外层电子数与次外层电子数相等, X、W 位于同族。Y 和 Z 的价电子数之和等于 R 和 T 的最外层电子数之和,这四种元素组成两种盐 Z2TY3 和 ZRY2。在含该两种盐的混合溶液中滴加盐酸,产生白色沉淀的物质的量与盐酸体积的关系如图所示。下列说法正确的是
A. X、Y、Z 不可能同存在于一种离子化合物中
B. 单质的熔点:Y < Z < T
C. 简单离子的半径:r(Y)> r(W)> r(Z)
D. Z、R 分别与 Y 形成的化合物中都只含离子键
二、填空题(每空2分,共计52分)
17. 下列物质:①N2 ②CO2? ③NH3? ④Na2O? ⑤Na2O2? ⑥NaOH ⑦CaBr2 ⑧H2O2 ⑨NH4Cl ⑩HBr。
(1).含有极性键和非极性键的是_____ _;含有极性键的离子化合物是____ _。(均填序号)
(2)写出下列物质的电子式
H2O2 ; NaOH: 。
18.下表为元素周期表的一部分,请参照元素①一⑨在表中的位置,用化学用语回答下列问题:
(1)在①~⑨元素中,金属性最强的元素是_____________。(填元素符号)
(2)元素⑦与元素⑧相比,⑧的非金属性较强,下列表述中能证明这一事实的是_______。
a.常温下⑦的单质和⑧的单质状态不同
b.⑧的氢化物比⑦的氢化物稳定
c.一定条件下⑦和⑧的单质都能与氢氧化钠溶液反应
d.⑦的氧化物的水化物比⑧的氧化物的水化物酸性弱
(3)请设计一个实验,证明元素②与元素⑥的非金属性强弱,只写出反应的化学方程式(不写实验步骤)___________________________。
(4)均由①④⑤⑦四种元素组成的两种盐反应的离子方程式
是
(5)⑧构成的单质通入一定浓度的苛性钾溶液中,两者恰好完全反应(该反应为放热反应),生成物中三种含Y元素的离子,其中两种离子物质的量(n)与反应时间(t)的变化如图所示,写出该反应的离子方程式是___________________________________。
19. I. 人们运用原电池原理制作了多种电池,以满足不同的需要。以下各种电池广泛运用于日常生活、生产和科学技术等方面,请根据题中提供的信息填空:
图1 图2
(1)燃料电池是一种高效、环境友好的供电装置,图1是甲烷燃烧电池工作原理示意图,该电池的负极反应式为 _________________________________;标准状况下,22.4L甲烷全部反应后,转移电子__________mol。
(2)图2是瑞典ASES公司设计的曾用于驱动潜艇的液氨—液氧燃料电池的示意图,该燃料电池工作时,电池的总反应方程式______________________;
负极的电极反应式为_______________________________________。
II.现有短周期元素X形成的单质A与NaOH溶液反应,有如下转化关系:
,(若产物中有水生成则省略未表示出来)。
(3)常温常压下,若A为非金属固态单质,且其在电子工业中有着重要的用途,则工业制取A化学方程式为___________________________________;
(4)若A?为金属单质,C为气体,则A与NaOH溶液反应的离子方程式为_____________________________。
20.阅读下面的信息,推断元素及有关物质。信息①:X、Y、Z、W是常见的短周期元素,其原子序数依次增大,且原子核外最外层电子数均不少于2。
(1)根据信息①,X一定不是________(填字母)。
A.氢 B.碳 C.氧 D.硫
信息②:上述四种元素的单质均能在足量的氧气中燃烧,生成的四种氧化物中,有两种能溶于稀硫酸,三种能溶于浓氢氧化钠溶液,其相对分子质量都大于26。
(2)这四种元素中是否可能有一种是铝元素?________。(填“是”或“否”)
信息③:向上述四种元素的单质组成的混合物中加入足量盐酸,固体部分溶解,过滤,向滤液中加入过量的烧碱溶液,最终溶液中析出白色沉淀。
(3)白色沉淀物的化学式的为________________。
信息④:向上述四种元素的单质组成的混合物中加入足量烧碱溶液,固体部分溶解,过滤,向滤液中加入过量的盐酸,最终溶液中析出白色沉淀。
(4)生成白色沉淀物的离子方程式为____________________________。
信息⑤:X与W同主族。
(5)X与浓硫酸加热时反应的化学方程式为__________________________。
21.某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验.
Ⅰ.利用图装置可验证同主族元素非金属性的变化规律
(1)干燥管D的作用为_______________;
(2)若要证明非金属性:C>Si,则在A中加盐酸、B中加CaCO3、C中加Na2SiO3溶液,观察到C中溶液________________________的现象,即可证明.但有的同学认为盐酸具有挥发性,可进入C中干扰实验,应在两装置间添加装有________溶液的洗气瓶。
Ⅱ 高锰酸钾是一种典型的强氧化剂,无论在实验室还是在化工生产中都有重要的应用。下图是实验室制备氯气并进行一系列相关实验的装置(夹持设备已略)。
(3)制备氯气选用的药品为:?高锰酸钾和浓盐酸,相应的离子方程式为:_____________。
(4)装置B的作用是_________________________________________。
(5)设计装置D、E的目的是比较氯、溴、碘的非金属性。当向D中缓缓通入足量氯气时,可以看到无色溶液逐渐变为红棕色,说明氧的非金属性大于溴。打开活塞,将D?中的少量溶液加入E?中,振荡E,观察到的现象是__________________________________________。该现象不能说明溴的非金属性强于碘,原因是______________________________________。
高一化学4月月考答案
一、选择题(每小题只有一个正确答案,每小题3分,共计48分)
题号 1 2 3 4 5 6 7 8
答案 B C B B B D A D
题号 9 10 11 12 13 14 15 16
答案 D A B D D D B B
二、填空题(每空2分,共计52分)
17 (1). ⑧ ⑥⑨ (2).略
18. (1).Na (2). b
(3)Na2SiO3+CO2+H2O=Na2CO3+H2SiO3或Na2SiO3+2CO2+2H2O=2NaHCO3+H2SiO3↓
(4)H++HSO3_=SO2↑+H2O
(5). 5Cl2+?10OH-=2C1O-+?C1O3-+?7Cl-+5H2O
19. (1).CH4+10OH—-8e-==CO32-+7H2O 0.8 (2).4NH3+3O2==2N2+6H2O;2NH3-6e-+6OH-=N2+6H2O
(3). 2C+SiO22CO↑+Si (4). 2Al+2OH-+2H2O=2AlO2-+3H2↑
20.(1)AD (2)是 (3)Mg(OH)2
(4)SiO+2H+===H2SiO3↓
(5)C+2H2SO4(浓)CO2↑+2SO2↑+2H2O
21.Ⅰ.(1) 防止倒吸 (2) 有白色沉淀生成 饱和NaHCO3
Ⅱ . (3). 2MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8H2O (4). 除HCl和防堵塞(或作安全瓶) (5). E中溶液分为两层,上层为紫红色,下层为无色 过量的Cl2也可将I-氧化为I2
高一化学
同课章节目录
