山东省临朐县实验中学2020-2021学年高一下学期4月月考化学试题 Word版含答案
文档属性
| 名称 | 山东省临朐县实验中学2020-2021学年高一下学期4月月考化学试题 Word版含答案 |  | |
| 格式 | docx | ||
| 文件大小 | 601.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-04-11 20:58:45 | ||
图片预览



文档简介
临朐县实验中学2020-2021学年高一下学期4月月考
化学
1.答题前,考生先将自己的姓名、考号、座号填写在相应位置。
2.选择题答案必须使用 2B 铅笔(按填涂样例)正确填涂;非选择题答案必须使用 0.5
毫米黑色签字笔书写,字体工整、笔迹清楚。
3.请按照题号在各题目的答题区域内作答,超出答题区域书写的答案无效;在草稿纸、 试题卷上答题无效。
可能用到的相对原子质量: H 1 C 12 N 14 O 16 Na 23 Al27 Cl35.5 Cu 64
一、选择题:本题共 10 小题,每小题 2 分,共 20 分。每小题只有一个选项符合题意。
1.化学与生产、生活密切相关,下列叙述错误的是
A.氢氧化铝是一种两性氢氧化物,可用于中和过多胃酸
B.海水提溴化工生产中,常用氧气作氧化剂
C.推广使用燃料电池汽车,可减少颗粒物、CO 等有害物质的排放
D. Na2SiO3 是最简单的硅酸盐,其水溶液可用作木材防火剂
2.下列叙述正确的是
A.同周期元素中,ⅠA 族元素的原子半径最小
B.仅由非金属元素不可能形成离子化合物
C.目前使用的元素周期表中,最长的周期含有 32 种元素
D.凡是有化学键断裂的过程一定发生了化学反应
3.下列每种物质既有离子键又有共价键的一组是
A.NaOH H2SO4 (NH4)2SO4 B.MgO Na2SO4 HNO3 C.Na2O2 KOH Na3PO4 D.HCl Al2O3 MgCl2
4.利用焰色反应的原理既可制作五彩缤纷的节日烟花,亦可定性鉴别某些金属盐。灼烧食盐样品时,钠的焰色为
A. 黄色 B.红色 C.紫色 D.绿色
5.下列叙述中错误的是
A.13C 和 14C 属于同一种元素,它们互为同位素
B.1H 和 2H 是不同的核素,它们的质子数相等
C.14C 和 14N 的质量数相等,它们的中子数不等
D.6Li 和 7Li 的电子数相等,中子数也相等
6.a、b、c、d 四块金属片浸入稀硫酸中,用导线两两相连组成原电池。若 a、b 相连时,电流由 a 经导线流向 b;c、d 相连时,电子由 d 流向 c;a、c 相连时,a 极上产生大量气泡;b、
d 相连时,H+移向 d 极。则四种金属的活动性由强到弱的顺序为
A.a>b>c>d B.a>c>d>b C.c>a>b>d D.b>d>c>a
7.N2H4 是一种高效清洁的火箭燃料。已知在 25℃、101 kPa 下,8gN2H4(g)完全燃烧生成氮气和液态水时,放出 133.5 kJ 热量。则下列热化学方程中正确的是
A.N2H4(g)+O2(g)=N2(g)+2H2O(g) △H=-534kJ·mol-1 B.N2H4(g)+O2(g)=N2(g)+2H2O(l) △H=-133.5kJ·mol-1 C.N2H4(g)+O2(g)=N2(g)+2H2O(l) △H=534kJ·mol-1 D.N2H4(g)+O2(g)=N2(g)+2H2O(l) △H=-534kJ·mol-1
8.从海带中提取碘的实验中,包括灼烧、浸取和过滤、氧化、萃取、反萃取等步骤。下列说法正确的是
A.灼烧中用到的仪器有蒸发皿、三脚架、酒精灯、玻璃棒
B.过滤中用到的仪器只有烧杯、漏斗(带滤纸)、铁架台
C.萃取得到碘的四氯化碳溶液,分液时从分液漏斗上口倒出
D.反萃取是在碘的四氯化碳溶液中加入浓氢氧化钠溶液,振荡、静置、分液,再向水溶液中滴加 45%硫酸溶液,过滤得固态碘
9.短周期元素的离子 aW2+、bX+、cY2-、dZ- 具有相同的电子层结构,下列推断正确的是
A.原子半径:W>X>Z>Y B.碱性:XOH>W(OH)2
C.离子半径:W2+>Y2- D.热稳定性: H2Y>HZ
10.在 25℃、101kPa 时,已知:
2H2O(g)=2H2(g)+O2(g) △H1;
H2(g)+Cl2(g)=2HCl(g) △H2;
2Cl2(g)+2H2O(g)=4HCl(g) + O2(g) △H3 。
则△H3 与△H1 和△H2 间的关系正确的是
A. △H3=△H1+2△H2 B.△H3=△H1+△H2
C.△H3=△H1-2△H2 D.△H3=△H1-△H2
二、本题共 5 小题,每小题 4 分,共 20 分。每小题有 1 个或 2 个选项符合题意,全都选对得
4 分,选对但不全的得 1 分,有选错的得 0 分。
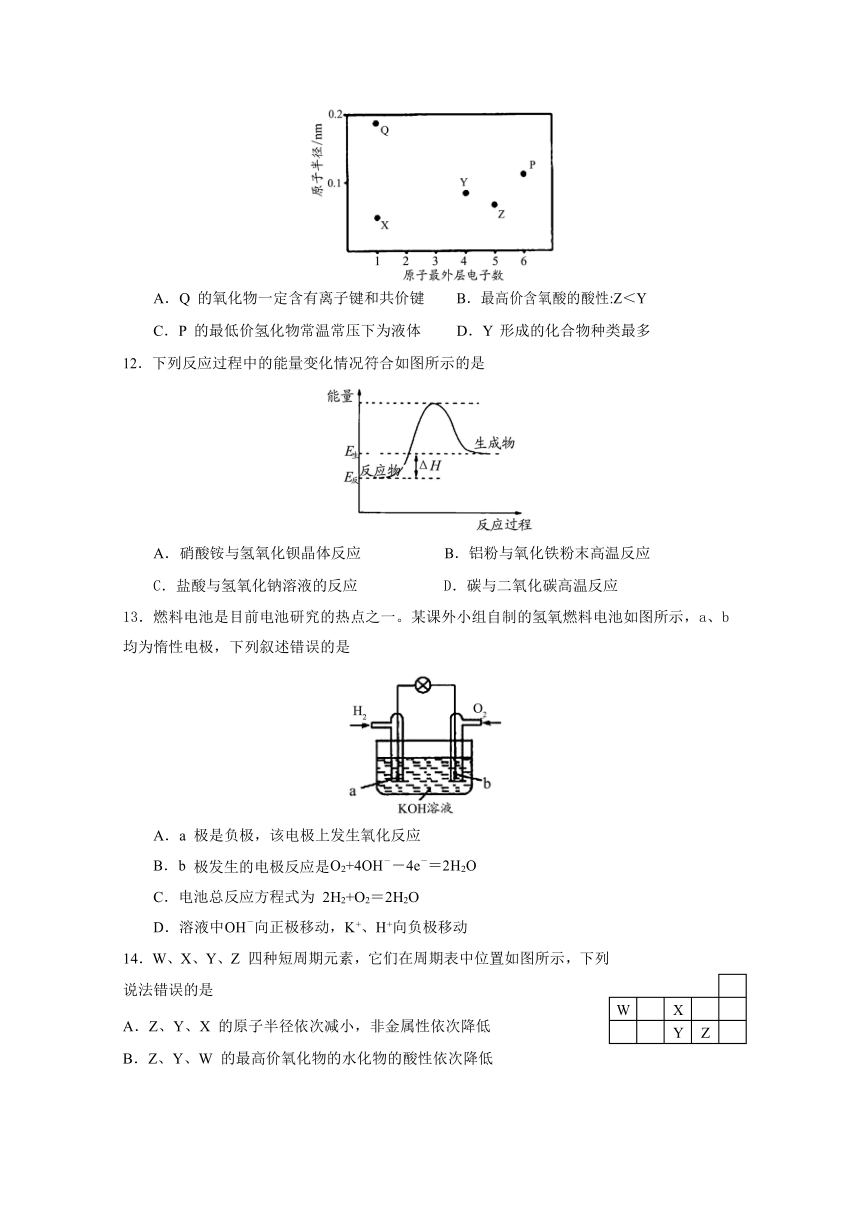
11.X、Y、Z、P、Q 为五种短周期元素,其原子半径和最外层电子数之间的关系如下图所示。下列说法正确的是
A.Q 的氧化物一定含有离子键和共价键 B.最高价含氧酸的酸性:Z<Y
C.P 的最低价氢化物常温常压下为液体 D.Y 形成的化合物种类最多
12.下列反应过程中的能量变化情况符合如图所示的是
284226090170
A.硝酸铵与氢氧化钡晶体反应 B.铝粉与氧化铁粉末高温反应
C.盐酸与氢氧化钠溶液的反应 D.碳与二氧化碳高温反应
13.燃料电池是目前电池研究的热点之一。某课外小组自制的氢氧燃料电池如图所示,a、b
均为惰性电极,下列叙述错误的是
3001645112395
A.a 极是负极,该电极上发生氧化反应
B.b 极发生的电极反应是 O2+4OH――4e-=2H2O
C.电池总反应方程式为 2H2+O2=2H2O
D.溶液中 OH-向正极移动,K+、H+向负极移动
5354320327025W
X
Y Z
W
X
Y Z
14.W、X、Y、Z 四种短周期元素,它们在周期表中位置如图所示,下列说法错误的是
A.Z、Y、X 的原子半径依次减小,非金属性依次降低
B.Z、Y、W 的最高价氧化物的水化物的酸性依次降低
C.W 与 Y 两种元素都存在多种同素异形体
D.Y 的气态氢化物与 Z 的单质在一定条件下可发生氧化还原反应
194564095885015.化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的,如下图为 N2(g)和 O2(g)反应生成 NO(g)过程中的能量变化。则下列说法正确的是
A.通常情况下,NO 比 N2 稳定
B.通常情况下,N2(g)和 O2(g)混合能直接生成 NO
C.1molN2(g)和 1molO2(g)反应吸收的能量为 180kJ
D.1molN2(g)和 1molO2(g)具有的总能量大于 2mol NO(g)具有的总能量
三、非选择题:本题共 5 小题,共 60 分。
16.(10 分)《自然》杂志曾报道我国科学家通过测量 SiO2 中 26Al 和 10Be 两种元素的比例确定
“北京人”年龄的研究结果,这种测量方法叫“铝铍测年法”。完成下列填空:
(1)l0Be 和 9Be (填序号)。
a.是同一种原子 b.具有相同的中子数
c.具有相同的化学性质 d.互为同位素
(2)写出 A1(OH)3 与 NaOH 溶液反应的化学方程式: 。
(3)研究表明 28A1 可以衰变为 26Mg,可以比较这两种元素金属性强弱的方法是 (填序 号)。
a.比较 Mg (OH) 2 与 A1 (OH) 3 的碱性强弱
b.比较这两种元素的最高正化合价
c.将打磨过表面积相同的镁条和铝片分别和 100℃热水作用,并滴入酚酞溶液
d.比较这两种金属的硬度和熔点
(4)目前还有一种测量方法叫“钾氩测年法”。
两种常见简单阴离子的核外电子排布与 Ar 相同,两者的半径大小关系为: (用化学符号表示);其中一种离子与钾同周期相邻元素的离子所形成的化合物可用作干燥剂,用电子式表示该物质的形成过程: 。
17.(12 分)A、B、C、D 四种元素,原子序数依次增大,A 原子的最外层上有 4 个电子;B的阴离子和 C 的阳离子具有相同的电子层结构,两元素的单质反应,生成一种淡黄色的固体
E,D 的 L 层电子数等于 K、M 两个电子层上的电子数之和。完成下列填空:
(1)C 离子的结构示意图为 ,D 在周期表中位置是 。
(2)写出 E 的电子式: 。
(3)A、D 两元素形成的化合物属 (填“离子”或“共价”)化合物,1mol 该化合物含 mol e-。
(4)写出 D 的最高价氧化物的水化物和 A 单质反应的化学方程式: 。
(5) 元素硒(Se)被誉为“生命的奇效元素”,与 D 元素同主族,则下列关于硒的叙述错误的是 (填序号)。
a.Se 元素的最高化合价为+6
b.硒的最高价氧化物对应水化物的化学式 H2SeO3
c.硒的非金属性比氧元素弱
d.气态氢化物的热稳定性:H2Se>H2D
108013570294518. 海带中含有丰富的碘元素,某学习小组设计如下实验流程提取海带中的碘,请回答下列问题:
(1)仪器 A 的名称为 ,实验室取用仪器 A 必须使用 。
(2)煮沸的作用是 。
(3)步骤 X 中,使用了分液漏斗。分液漏斗使用前,须进行的操作是 ;萃取后, 分液漏斗内观察到的现象是 ;分液时,为了保证液体顺利留下,应首先 。
(4)向海带浸取原液中通入适量 O2,并控制溶液 pH 为 4.5,此时发生反应的离子反应方程式为: 。
(5)某同学欲采用蒸馏含 I2 的 CCl4 溶液得到纯碘,此方案不合理,理由是 。
19.(14 分)某同学为验证同主族元素非金属性的变化规律,设计了如下实验(实验装置如图所示)。
2881630231140
(1)仪器 A 的名称为 ,干燥管 D 的作用是 。
(2)向 Na2S 溶液中通入氯气出现淡黄色浑浊,可证明 Cl 的非金属性比 S 强,反应的离子方程式为 。
(3)若要证明非金属性:Cl>I,则 A 中加浓盐酸,B 中加 KMnO4 固体, C 中加淀粉碘化钾混合溶液,观察到 ,即可证明。从环境保护的观点考虑,此装置缺少尾气处理装 置,可用 溶液吸收尾气。
(4)课外活动小组在 A 中加盐酸、B 中加 CaCO3 固体,C 中加 Na2SiO3 溶液,观察到 C 中产生白色沉淀(H2SiO3),请你利用原子结构知识解释这一现象: ;有的同学认为 盐酸具有挥发性,可进入 C 中干扰实验,应在两装置间添加盛有 的洗气瓶。
20637563182520.(12 分)Ⅰ 以氧化铝为原料,通过碳热还原法可合成氮化铝(AlN);通过电解法可制取铝。回答下列问题:
碳热还原 Al2O3 合成 AlN 的总热化学方程式是 。
" 已知化学反应:①AgNO3+NaCl===AgCl↓+NaNO3 ②2FeCl3+Cu===2FeCl2+CuCl2
(1)上述两个化学反应中有一个不可用于设计原电池,它是 (填序号),理由是 。
(2)另一个可用于设计原电池,若利用该反应设计如下图所示的原电池,请在如图方框中标明电极材料和电解质溶液的名称(图中“I”表示电流)。
4670425-255270
该电池电极 a 上发生的电极反应式是
, 电极 b 上发生
反应(填“氧化”或“还原”)。
参考答案
368300127000
-3175130175
-22225-9525
化学
1.答题前,考生先将自己的姓名、考号、座号填写在相应位置。
2.选择题答案必须使用 2B 铅笔(按填涂样例)正确填涂;非选择题答案必须使用 0.5
毫米黑色签字笔书写,字体工整、笔迹清楚。
3.请按照题号在各题目的答题区域内作答,超出答题区域书写的答案无效;在草稿纸、 试题卷上答题无效。
可能用到的相对原子质量: H 1 C 12 N 14 O 16 Na 23 Al27 Cl35.5 Cu 64
一、选择题:本题共 10 小题,每小题 2 分,共 20 分。每小题只有一个选项符合题意。
1.化学与生产、生活密切相关,下列叙述错误的是
A.氢氧化铝是一种两性氢氧化物,可用于中和过多胃酸
B.海水提溴化工生产中,常用氧气作氧化剂
C.推广使用燃料电池汽车,可减少颗粒物、CO 等有害物质的排放
D. Na2SiO3 是最简单的硅酸盐,其水溶液可用作木材防火剂
2.下列叙述正确的是
A.同周期元素中,ⅠA 族元素的原子半径最小
B.仅由非金属元素不可能形成离子化合物
C.目前使用的元素周期表中,最长的周期含有 32 种元素
D.凡是有化学键断裂的过程一定发生了化学反应
3.下列每种物质既有离子键又有共价键的一组是
A.NaOH H2SO4 (NH4)2SO4 B.MgO Na2SO4 HNO3 C.Na2O2 KOH Na3PO4 D.HCl Al2O3 MgCl2
4.利用焰色反应的原理既可制作五彩缤纷的节日烟花,亦可定性鉴别某些金属盐。灼烧食盐样品时,钠的焰色为
A. 黄色 B.红色 C.紫色 D.绿色
5.下列叙述中错误的是
A.13C 和 14C 属于同一种元素,它们互为同位素
B.1H 和 2H 是不同的核素,它们的质子数相等
C.14C 和 14N 的质量数相等,它们的中子数不等
D.6Li 和 7Li 的电子数相等,中子数也相等
6.a、b、c、d 四块金属片浸入稀硫酸中,用导线两两相连组成原电池。若 a、b 相连时,电流由 a 经导线流向 b;c、d 相连时,电子由 d 流向 c;a、c 相连时,a 极上产生大量气泡;b、
d 相连时,H+移向 d 极。则四种金属的活动性由强到弱的顺序为
A.a>b>c>d B.a>c>d>b C.c>a>b>d D.b>d>c>a
7.N2H4 是一种高效清洁的火箭燃料。已知在 25℃、101 kPa 下,8gN2H4(g)完全燃烧生成氮气和液态水时,放出 133.5 kJ 热量。则下列热化学方程中正确的是
A.N2H4(g)+O2(g)=N2(g)+2H2O(g) △H=-534kJ·mol-1 B.N2H4(g)+O2(g)=N2(g)+2H2O(l) △H=-133.5kJ·mol-1 C.N2H4(g)+O2(g)=N2(g)+2H2O(l) △H=534kJ·mol-1 D.N2H4(g)+O2(g)=N2(g)+2H2O(l) △H=-534kJ·mol-1
8.从海带中提取碘的实验中,包括灼烧、浸取和过滤、氧化、萃取、反萃取等步骤。下列说法正确的是
A.灼烧中用到的仪器有蒸发皿、三脚架、酒精灯、玻璃棒
B.过滤中用到的仪器只有烧杯、漏斗(带滤纸)、铁架台
C.萃取得到碘的四氯化碳溶液,分液时从分液漏斗上口倒出
D.反萃取是在碘的四氯化碳溶液中加入浓氢氧化钠溶液,振荡、静置、分液,再向水溶液中滴加 45%硫酸溶液,过滤得固态碘
9.短周期元素的离子 aW2+、bX+、cY2-、dZ- 具有相同的电子层结构,下列推断正确的是
A.原子半径:W>X>Z>Y B.碱性:XOH>W(OH)2
C.离子半径:W2+>Y2- D.热稳定性: H2Y>HZ
10.在 25℃、101kPa 时,已知:
2H2O(g)=2H2(g)+O2(g) △H1;
H2(g)+Cl2(g)=2HCl(g) △H2;
2Cl2(g)+2H2O(g)=4HCl(g) + O2(g) △H3 。
则△H3 与△H1 和△H2 间的关系正确的是
A. △H3=△H1+2△H2 B.△H3=△H1+△H2
C.△H3=△H1-2△H2 D.△H3=△H1-△H2
二、本题共 5 小题,每小题 4 分,共 20 分。每小题有 1 个或 2 个选项符合题意,全都选对得
4 分,选对但不全的得 1 分,有选错的得 0 分。
11.X、Y、Z、P、Q 为五种短周期元素,其原子半径和最外层电子数之间的关系如下图所示。下列说法正确的是
A.Q 的氧化物一定含有离子键和共价键 B.最高价含氧酸的酸性:Z<Y
C.P 的最低价氢化物常温常压下为液体 D.Y 形成的化合物种类最多
12.下列反应过程中的能量变化情况符合如图所示的是
284226090170
A.硝酸铵与氢氧化钡晶体反应 B.铝粉与氧化铁粉末高温反应
C.盐酸与氢氧化钠溶液的反应 D.碳与二氧化碳高温反应
13.燃料电池是目前电池研究的热点之一。某课外小组自制的氢氧燃料电池如图所示,a、b
均为惰性电极,下列叙述错误的是
3001645112395
A.a 极是负极,该电极上发生氧化反应
B.b 极发生的电极反应是 O2+4OH――4e-=2H2O
C.电池总反应方程式为 2H2+O2=2H2O
D.溶液中 OH-向正极移动,K+、H+向负极移动
5354320327025W
X
Y Z
W
X
Y Z
14.W、X、Y、Z 四种短周期元素,它们在周期表中位置如图所示,下列说法错误的是
A.Z、Y、X 的原子半径依次减小,非金属性依次降低
B.Z、Y、W 的最高价氧化物的水化物的酸性依次降低
C.W 与 Y 两种元素都存在多种同素异形体
D.Y 的气态氢化物与 Z 的单质在一定条件下可发生氧化还原反应
194564095885015.化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的,如下图为 N2(g)和 O2(g)反应生成 NO(g)过程中的能量变化。则下列说法正确的是
A.通常情况下,NO 比 N2 稳定
B.通常情况下,N2(g)和 O2(g)混合能直接生成 NO
C.1molN2(g)和 1molO2(g)反应吸收的能量为 180kJ
D.1molN2(g)和 1molO2(g)具有的总能量大于 2mol NO(g)具有的总能量
三、非选择题:本题共 5 小题,共 60 分。
16.(10 分)《自然》杂志曾报道我国科学家通过测量 SiO2 中 26Al 和 10Be 两种元素的比例确定
“北京人”年龄的研究结果,这种测量方法叫“铝铍测年法”。完成下列填空:
(1)l0Be 和 9Be (填序号)。
a.是同一种原子 b.具有相同的中子数
c.具有相同的化学性质 d.互为同位素
(2)写出 A1(OH)3 与 NaOH 溶液反应的化学方程式: 。
(3)研究表明 28A1 可以衰变为 26Mg,可以比较这两种元素金属性强弱的方法是 (填序 号)。
a.比较 Mg (OH) 2 与 A1 (OH) 3 的碱性强弱
b.比较这两种元素的最高正化合价
c.将打磨过表面积相同的镁条和铝片分别和 100℃热水作用,并滴入酚酞溶液
d.比较这两种金属的硬度和熔点
(4)目前还有一种测量方法叫“钾氩测年法”。
两种常见简单阴离子的核外电子排布与 Ar 相同,两者的半径大小关系为: (用化学符号表示);其中一种离子与钾同周期相邻元素的离子所形成的化合物可用作干燥剂,用电子式表示该物质的形成过程: 。
17.(12 分)A、B、C、D 四种元素,原子序数依次增大,A 原子的最外层上有 4 个电子;B的阴离子和 C 的阳离子具有相同的电子层结构,两元素的单质反应,生成一种淡黄色的固体
E,D 的 L 层电子数等于 K、M 两个电子层上的电子数之和。完成下列填空:
(1)C 离子的结构示意图为 ,D 在周期表中位置是 。
(2)写出 E 的电子式: 。
(3)A、D 两元素形成的化合物属 (填“离子”或“共价”)化合物,1mol 该化合物含 mol e-。
(4)写出 D 的最高价氧化物的水化物和 A 单质反应的化学方程式: 。
(5) 元素硒(Se)被誉为“生命的奇效元素”,与 D 元素同主族,则下列关于硒的叙述错误的是 (填序号)。
a.Se 元素的最高化合价为+6
b.硒的最高价氧化物对应水化物的化学式 H2SeO3
c.硒的非金属性比氧元素弱
d.气态氢化物的热稳定性:H2Se>H2D
108013570294518. 海带中含有丰富的碘元素,某学习小组设计如下实验流程提取海带中的碘,请回答下列问题:
(1)仪器 A 的名称为 ,实验室取用仪器 A 必须使用 。
(2)煮沸的作用是 。
(3)步骤 X 中,使用了分液漏斗。分液漏斗使用前,须进行的操作是 ;萃取后, 分液漏斗内观察到的现象是 ;分液时,为了保证液体顺利留下,应首先 。
(4)向海带浸取原液中通入适量 O2,并控制溶液 pH 为 4.5,此时发生反应的离子反应方程式为: 。
(5)某同学欲采用蒸馏含 I2 的 CCl4 溶液得到纯碘,此方案不合理,理由是 。
19.(14 分)某同学为验证同主族元素非金属性的变化规律,设计了如下实验(实验装置如图所示)。
2881630231140
(1)仪器 A 的名称为 ,干燥管 D 的作用是 。
(2)向 Na2S 溶液中通入氯气出现淡黄色浑浊,可证明 Cl 的非金属性比 S 强,反应的离子方程式为 。
(3)若要证明非金属性:Cl>I,则 A 中加浓盐酸,B 中加 KMnO4 固体, C 中加淀粉碘化钾混合溶液,观察到 ,即可证明。从环境保护的观点考虑,此装置缺少尾气处理装 置,可用 溶液吸收尾气。
(4)课外活动小组在 A 中加盐酸、B 中加 CaCO3 固体,C 中加 Na2SiO3 溶液,观察到 C 中产生白色沉淀(H2SiO3),请你利用原子结构知识解释这一现象: ;有的同学认为 盐酸具有挥发性,可进入 C 中干扰实验,应在两装置间添加盛有 的洗气瓶。
20637563182520.(12 分)Ⅰ 以氧化铝为原料,通过碳热还原法可合成氮化铝(AlN);通过电解法可制取铝。回答下列问题:
碳热还原 Al2O3 合成 AlN 的总热化学方程式是 。
" 已知化学反应:①AgNO3+NaCl===AgCl↓+NaNO3 ②2FeCl3+Cu===2FeCl2+CuCl2
(1)上述两个化学反应中有一个不可用于设计原电池,它是 (填序号),理由是 。
(2)另一个可用于设计原电池,若利用该反应设计如下图所示的原电池,请在如图方框中标明电极材料和电解质溶液的名称(图中“I”表示电流)。
4670425-255270
该电池电极 a 上发生的电极反应式是
, 电极 b 上发生
反应(填“氧化”或“还原”)。
参考答案
368300127000
-3175130175
-22225-9525
同课章节目录
