6.1.2 化学反应与电能 课件(29张ppt)【新教材】2020-2021学年人教版(2019)高一化学必修二
文档属性
| 名称 | 6.1.2 化学反应与电能 课件(29张ppt)【新教材】2020-2021学年人教版(2019)高一化学必修二 |

|
|
| 格式 | pptx | ||
| 文件大小 | 774.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-04-11 00:00:00 | ||
图片预览







文档简介
人教版必修第二册第六章第一节
化学反应与能量变化
第2课时
化学反应与电能
化学反应与电能
电池
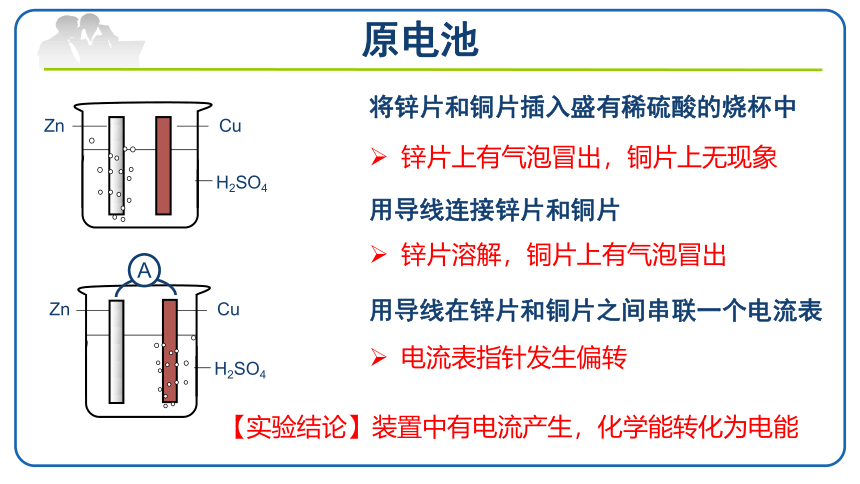
原电池
将锌片和铜片插入盛有稀硫酸的烧杯中
锌片上有气泡冒出,铜片上无现象
用导线连接锌片和铜片
锌片溶解,铜片上有气泡冒出
用导线在锌片和铜片之间串联一个电流表
电流表指针发生偏转
【实验结论】装置中有电流产生,化学能转化为电能
Zn
Cu
H2SO4
Zn
Cu
H2SO4
A
负极
Zn
= Zn2+
-2e-
2H+
= H2↑
+2e-
锌片
铜片
氧化反应
还原反应
正极
得电子
电子流入
失电子
电子流出
活泼性较强
活泼性较弱
总反应式:
Zn
2H+
Zn2+
H2↑
+
=
+
e-
I
原电池
1.概念:原电池是将 转化为 的装置。
2.本质:
3.电极:(1)负极:______电子,发生_____反应,较 ;
(2)正极:______电子,发生_____反应,较不活泼。
4.构成原电池的条件:
化学能
电能
失去
氧化
得到
还原
(4)闭合回路。
氧化还原反应——电子得失
(1)自发进行的氧化还原反应;
(2)两个活动性不同的电极;
(3)电解质(溶液或熔融电解质);
活泼
7.电流方向:
外电路:
内电路:
与电子移动方向相反(正极→负极)
与阳离子移动方向相同(负极→正极)
5.电子方向:
负极→正极
6.离子方向:阳离子向 极移动,阴离子向 极移动。
原电池
正 负
课堂巩固
1、理论上不能设计为原电池的化学反应是( )
A.CH4 + 2O2 === CO2 + 2H2O
B.2FeCl3 + Fe === 3FeCl2
C.2Al + 2NaOH + 2H2O === 2NaAlO2 + 3H2↑
D.HNO3 + NaOH === NaNO3 + H2O
D
本质:氧化还原反应
2、下列关于原电池的叙述,正确的是( )
A.构成原电池的正极和负极材料必须是两种活动性不同的金属
B.原电池是将化学能转变为电能的装置
C.在原电池中,电子流出的一极是负极,该电极被还原
D.原电池放电时,电流的方向是从负极到正极
课堂巩固
B
课堂巩固
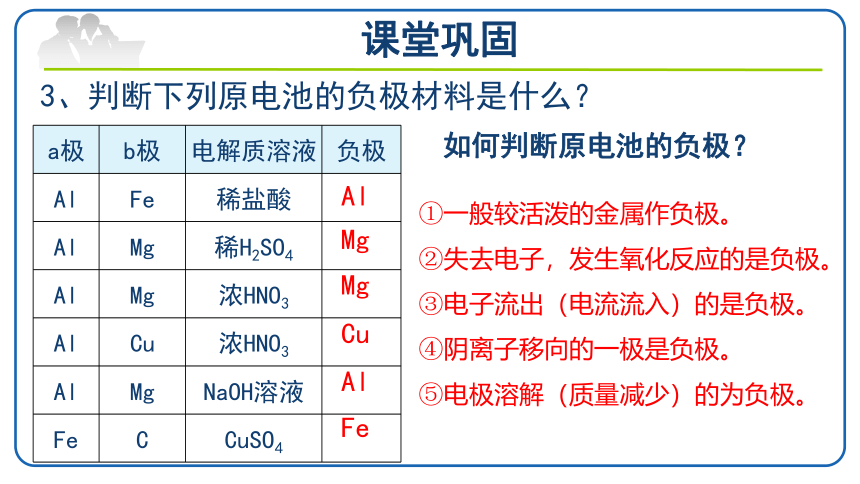
3、判断下列原电池的负极材料是什么?
a极
b极
电解质溶液
负极
Al
Fe
稀盐酸
?
Al
Mg
稀H2SO4
?
Al
Mg
浓HNO3
?
Al
Cu
浓HNO3
?
Al
Mg
NaOH溶液
?
Fe
C
CuSO4
?
Al
Mg
Mg
Cu
Al
Fe
①一般较活泼的金属作负极。
②失去电子,发生氧化反应的是负极。
③电子流出(电流流入)的是负极。
④阴离子移向的一极是负极。
⑤电极溶解(质量减少)的为负极。
如何判断原电池的负极?
4、下列装置能构成原电池的是 ,
能构成原电池的,写出其电极反应式和总反应式。
课堂巩固
CDE
ZnSO4
H
5.某小组为研究原电池原理,设计如图装置。下列叙述正确的是( )
A.a和b不连接时,铁片上会有H2产生 B.a和b用导线连接时,铁片上发生的反应为Cu2++2e-===Cu C.a和b用导线连接时,电子由a流向b D.无论a和b是否连接,铁片均会溶解,
溶液从蓝色逐渐变成浅绿色
D
课堂巩固
6、如图所示,在铁圈和银圈的焊接处,用一根棉线将其悬在盛水的烧杯中,使之平衡;小心的向烧杯中央滴入CuSO4溶液,片刻后可观察到的现象是( )
A. 铁圈和银圈左右摇摆不定;
B. 保持平衡状态;
C. 铁圈向下倾斜;
D. 银圈向下倾斜;
课堂巩固
D
(6)一般来说,负极质量减小,正极质量不变或增加。
(1)相对活泼性强的为负极,另一个为正极
(3)电子由负极→正极。
(2)发生氧化反应的为负极,发生还原反应的为正极。
(4)电流由正极→负极。
(5)阴离子→负极,阳离子→正极。
如何判断原电池的负极?
7、如图装置,电流表G发生偏转,同时A极逐渐变粗,B极逐渐
变细,C为电解质溶液,则A、B、C应是下列各组中的( )
A、A是锌,B是铜,C为稀H2SO4
B、A是铜,B是锌,C为稀硫酸
C、A是铁,B是银,C为AgNO3溶液
D、A是Ag,B是铁,C为AgNO3溶液
A
C
A
B
D
课堂巩固
1.比较金属活动性
两种金属分别作原电池的两极时,一般作负极的金属比正极的金属活泼。
2.加快氧化还原反应的速率
一个自发进行的氧化还原反应,设计成原电池时反应速率增大。
3.设计原电池
利用原电池原理设计和制造原电池,将化学能直接转化为电能。
原电池的应用
课堂巩固
1、请设计原电池实现下列反应,画出原电池的装置,标出正负极,并写出电极反应式:
⑴Zn + CuSO4 =ZnSO4 +Cu
⑵Cu + 2Ag+ =Cu2+ +2Ag
⑶2Fe3+ + Fe = 3Fe2+
⑷2Fe3+ + Cu = 2Fe2++ Cu2+
课堂巩固
2、有a、b、c、d四个金属电极,有关的实验装置及部分实验现象如下:
{5940675A-B579-460E-94D1-54222C63F5DA}实验装置
部分实验现象
a极质量减小,b极质量增大
b极有气泡产生,c极无变化
d极溶解,c极有气泡产生
电流从a极流向d极
由此可判断这四种金属的活动性顺序是 。
d > a> b> c
课堂巩固
3.锌与H2SO4反应制H2时向溶液中加少量CuSO4后为什么反应速率加快?
锌置换出铜构成原电池。
4.欲提高Cu粉与硝酸的反应速度,可加入下列什么试剂( )
A.蒸馏水 B.碳酸钠固体 C.食盐水 D.AgNO3溶液(少量)
D
5. 铁在下列情况下腐蚀最快的是( )
A.铁放入海水中 B.将铁和锌连接后放入到海水中
C.将铁和锌连接后放入到淡水中 D.将铁和锡连接后放入到海水中
D
一、锌锰干电池(一次电池)
常见的锌锰干电池的构造如图所示。其中,石墨棒作正极,氯化铵糊作电解质溶液,锌筒作负极。在使用过程中,电子由锌筒(负极)流向石墨棒(正极),锌逐渐消耗,二氧化锰不断被还原,电池电压逐渐降低,最后失效。这种电池放电之后不能充电(内部的氧化还原反应无法逆向进行),属于一次电池。
常见的化学电池——干电池(一次)
?
负极:Zn﹣2e- = Zn2+
?
碱性锌锰干电池
——将电解质NH4Cl换成KOH
负极:Zn﹣2e- + 2OH- = Zn(OH)2
正极:2MnO2 +2e- + 2H2O = 2MnO(OH) + 2OH-
总:Zn + 2MnO2 + 2H2O = 2MnO(OH) + Zn(OH)2
常见的化学电池——干电池(一次)
二、充电电池(二次电池)
有些电池放电时所进行的氧化还原反应,在充电时可以逆向进行,使电池恢复到放电前的状态,从而实现放电(化学能转化为电能)与充电(电能转化为化学能)的循环。这种充电电池属于二次电池。常见的充电电池有铅酸蓄电池、镍氢电池、锂离子电池等,目前汽车上使用的大多是铅酸蓄电池。
常见的化学电池——充电电池(二次)
铅酸蓄电池
(-)Pb l H2SO4 I PbO2 (+)
负极:Pb﹣2e- + SO42- = PbSO4
正极:PbO2 + 2e- + 4H+ + SO42- = PbSO4 + 2H2O
总:Pb + PbO2 + 2H2SO4 = 2PbSO4 + 2H2O
常见的化学电池——充电电池(二次)
常见的化学电池——燃料电池
燃料电池是一种将燃料(如氢气、甲烷、乙醇)和氧化剂(如氧气)的化学能直接转化为电能的电化学反应装置,具有清洁、安全、高效等特点。燃料电池的能量转化率可以达到80%以上。当以氢气为燃料时,产物为水;以甲烷为燃料时,产物为水和二氧化碳。
①反应物不储存在电池内部,而由外界提供的。电池只是一个反应器。
②电极一般不参与反应,常采用惰性电极:活性炭棒、金属铂等
③燃料在负极发生氧化反应,O2在正极发生还原反应,两者不直接燃烧;电解质不同,电极反应可能不同,产物也不一定相同。
氢氧燃料电池(H2 、O2)
氢氧燃料电池
电解质
负极(H2)
正极(O2)
酸性H2SO4(aq)
?
?
碱性KOH(aq)
?
?
中性Na2SO4(aq)
总反应:2H2 + O2 = 2H2O
2H2 - 4e- = 4H+
2H2 + 4OH- - 4e- = 4H2O
O2 + 4H+ + 4e- = 2H2O
O2 + 2H2O + 4e- = 4OH-
2H2 - 4e- = 4H+
O2 + 2H2O + 4e- = 4OH-
甲烷燃料电池(CH4、O2)
甲烷电池
H2SO4作电解质
KOH作电解质
负极
?
?
正极
?
?
总反应式
?
?
CH4+ 2H2O -8e- = CO2+ 8H+
2O2 + 8H+ + 8e- = 4H2O
2O2 + 8e- + 4H2O = 8OH-
CH4 + 2O2 = CO2 + 2H2O
CH4 + 10OH- -8e- = CO32-+ 7H2O
CH4 + 2O2 +2OH- = CO32- + 3H2O
甲烷燃料电池
1、被称之为“软电池”的纸质电池,采用一个薄层纸片(在其一边镀锌,而在其另一边镀二氧化锰)作为传导体。在纸内的离子“流过”水和氧化锌组成的电解液。电池总反应为:
Zn + 2MnO2 + H2O === ZnO + 2MnO(OH),下列说法正确的是( )
A.电池工作时,锌失去电子,做正极
B.该电池反应中二氧化锰起催化剂作用
C.当生成0.1 mol ZnO时,转移电子个数为1.204×1024
D.外电路中每通过0.2 mol电子,锌的质量理论上减少6.5 g
D
课堂巩固
2、高铁电池是一种新型可充电电池,与普通电池相比,该电池能较长时间保持稳定的放电电压。高铁电池的总反应为3Zn+2K2FeO4+8H2O
3Zn(OH)2+2Fe(OH)3+4KOH。请回答下列问题:(1)放电时,正极发生________(填“氧化”或“还原”)反应,则负极反应式为_____________________________________________,正极反应式为_________________________________________。(2)放电时,________(填“正”或“负”)极附近溶液的碱性增强。
放电
充电
正
还原
3Zn-6e-+6OH- = 3Zn(OH)2
2FeO42-+6e-+8H2O = 2Fe(OH)3+10OH-
课堂巩固
3、锂—空气电池的工作原理如图,总反应式为4Li+O2+2H2O = 4LiOH。
回答下列问题:(1)A、B分别为原电池的什么极?发生什么反应?写出电极反应式。(2)电解液a可以是水溶液吗?为什么?(3)电解液中的Li+向什么极迁移?(4)电解液b的pH如何变化?
(1)A极为负极,发生氧化反应,4Li-4e- = 4Li+。 B极为正极,发生还原反应,O2+4e-+2H2O = 4OH- (2)不可以,因为Li与H2O反应。 (3)Li+向B极迁移。 (4)pH增大。
课堂巩固
化学反应与能量变化
第2课时
化学反应与电能
化学反应与电能
电池
原电池
将锌片和铜片插入盛有稀硫酸的烧杯中
锌片上有气泡冒出,铜片上无现象
用导线连接锌片和铜片
锌片溶解,铜片上有气泡冒出
用导线在锌片和铜片之间串联一个电流表
电流表指针发生偏转
【实验结论】装置中有电流产生,化学能转化为电能
Zn
Cu
H2SO4
Zn
Cu
H2SO4
A
负极
Zn
= Zn2+
-2e-
2H+
= H2↑
+2e-
锌片
铜片
氧化反应
还原反应
正极
得电子
电子流入
失电子
电子流出
活泼性较强
活泼性较弱
总反应式:
Zn
2H+
Zn2+
H2↑
+
=
+
e-
I
原电池
1.概念:原电池是将 转化为 的装置。
2.本质:
3.电极:(1)负极:______电子,发生_____反应,较 ;
(2)正极:______电子,发生_____反应,较不活泼。
4.构成原电池的条件:
化学能
电能
失去
氧化
得到
还原
(4)闭合回路。
氧化还原反应——电子得失
(1)自发进行的氧化还原反应;
(2)两个活动性不同的电极;
(3)电解质(溶液或熔融电解质);
活泼
7.电流方向:
外电路:
内电路:
与电子移动方向相反(正极→负极)
与阳离子移动方向相同(负极→正极)
5.电子方向:
负极→正极
6.离子方向:阳离子向 极移动,阴离子向 极移动。
原电池
正 负
课堂巩固
1、理论上不能设计为原电池的化学反应是( )
A.CH4 + 2O2 === CO2 + 2H2O
B.2FeCl3 + Fe === 3FeCl2
C.2Al + 2NaOH + 2H2O === 2NaAlO2 + 3H2↑
D.HNO3 + NaOH === NaNO3 + H2O
D
本质:氧化还原反应
2、下列关于原电池的叙述,正确的是( )
A.构成原电池的正极和负极材料必须是两种活动性不同的金属
B.原电池是将化学能转变为电能的装置
C.在原电池中,电子流出的一极是负极,该电极被还原
D.原电池放电时,电流的方向是从负极到正极
课堂巩固
B
课堂巩固
3、判断下列原电池的负极材料是什么?
a极
b极
电解质溶液
负极
Al
Fe
稀盐酸
?
Al
Mg
稀H2SO4
?
Al
Mg
浓HNO3
?
Al
Cu
浓HNO3
?
Al
Mg
NaOH溶液
?
Fe
C
CuSO4
?
Al
Mg
Mg
Cu
Al
Fe
①一般较活泼的金属作负极。
②失去电子,发生氧化反应的是负极。
③电子流出(电流流入)的是负极。
④阴离子移向的一极是负极。
⑤电极溶解(质量减少)的为负极。
如何判断原电池的负极?
4、下列装置能构成原电池的是 ,
能构成原电池的,写出其电极反应式和总反应式。
课堂巩固
CDE
ZnSO4
H
5.某小组为研究原电池原理,设计如图装置。下列叙述正确的是( )
A.a和b不连接时,铁片上会有H2产生 B.a和b用导线连接时,铁片上发生的反应为Cu2++2e-===Cu C.a和b用导线连接时,电子由a流向b D.无论a和b是否连接,铁片均会溶解,
溶液从蓝色逐渐变成浅绿色
D
课堂巩固
6、如图所示,在铁圈和银圈的焊接处,用一根棉线将其悬在盛水的烧杯中,使之平衡;小心的向烧杯中央滴入CuSO4溶液,片刻后可观察到的现象是( )
A. 铁圈和银圈左右摇摆不定;
B. 保持平衡状态;
C. 铁圈向下倾斜;
D. 银圈向下倾斜;
课堂巩固
D
(6)一般来说,负极质量减小,正极质量不变或增加。
(1)相对活泼性强的为负极,另一个为正极
(3)电子由负极→正极。
(2)发生氧化反应的为负极,发生还原反应的为正极。
(4)电流由正极→负极。
(5)阴离子→负极,阳离子→正极。
如何判断原电池的负极?
7、如图装置,电流表G发生偏转,同时A极逐渐变粗,B极逐渐
变细,C为电解质溶液,则A、B、C应是下列各组中的( )
A、A是锌,B是铜,C为稀H2SO4
B、A是铜,B是锌,C为稀硫酸
C、A是铁,B是银,C为AgNO3溶液
D、A是Ag,B是铁,C为AgNO3溶液
A
C
A
B
D
课堂巩固
1.比较金属活动性
两种金属分别作原电池的两极时,一般作负极的金属比正极的金属活泼。
2.加快氧化还原反应的速率
一个自发进行的氧化还原反应,设计成原电池时反应速率增大。
3.设计原电池
利用原电池原理设计和制造原电池,将化学能直接转化为电能。
原电池的应用
课堂巩固
1、请设计原电池实现下列反应,画出原电池的装置,标出正负极,并写出电极反应式:
⑴Zn + CuSO4 =ZnSO4 +Cu
⑵Cu + 2Ag+ =Cu2+ +2Ag
⑶2Fe3+ + Fe = 3Fe2+
⑷2Fe3+ + Cu = 2Fe2++ Cu2+
课堂巩固
2、有a、b、c、d四个金属电极,有关的实验装置及部分实验现象如下:
{5940675A-B579-460E-94D1-54222C63F5DA}实验装置
部分实验现象
a极质量减小,b极质量增大
b极有气泡产生,c极无变化
d极溶解,c极有气泡产生
电流从a极流向d极
由此可判断这四种金属的活动性顺序是 。
d > a> b> c
课堂巩固
3.锌与H2SO4反应制H2时向溶液中加少量CuSO4后为什么反应速率加快?
锌置换出铜构成原电池。
4.欲提高Cu粉与硝酸的反应速度,可加入下列什么试剂( )
A.蒸馏水 B.碳酸钠固体 C.食盐水 D.AgNO3溶液(少量)
D
5. 铁在下列情况下腐蚀最快的是( )
A.铁放入海水中 B.将铁和锌连接后放入到海水中
C.将铁和锌连接后放入到淡水中 D.将铁和锡连接后放入到海水中
D
一、锌锰干电池(一次电池)
常见的锌锰干电池的构造如图所示。其中,石墨棒作正极,氯化铵糊作电解质溶液,锌筒作负极。在使用过程中,电子由锌筒(负极)流向石墨棒(正极),锌逐渐消耗,二氧化锰不断被还原,电池电压逐渐降低,最后失效。这种电池放电之后不能充电(内部的氧化还原反应无法逆向进行),属于一次电池。
常见的化学电池——干电池(一次)
?
负极:Zn﹣2e- = Zn2+
?
碱性锌锰干电池
——将电解质NH4Cl换成KOH
负极:Zn﹣2e- + 2OH- = Zn(OH)2
正极:2MnO2 +2e- + 2H2O = 2MnO(OH) + 2OH-
总:Zn + 2MnO2 + 2H2O = 2MnO(OH) + Zn(OH)2
常见的化学电池——干电池(一次)
二、充电电池(二次电池)
有些电池放电时所进行的氧化还原反应,在充电时可以逆向进行,使电池恢复到放电前的状态,从而实现放电(化学能转化为电能)与充电(电能转化为化学能)的循环。这种充电电池属于二次电池。常见的充电电池有铅酸蓄电池、镍氢电池、锂离子电池等,目前汽车上使用的大多是铅酸蓄电池。
常见的化学电池——充电电池(二次)
铅酸蓄电池
(-)Pb l H2SO4 I PbO2 (+)
负极:Pb﹣2e- + SO42- = PbSO4
正极:PbO2 + 2e- + 4H+ + SO42- = PbSO4 + 2H2O
总:Pb + PbO2 + 2H2SO4 = 2PbSO4 + 2H2O
常见的化学电池——充电电池(二次)
常见的化学电池——燃料电池
燃料电池是一种将燃料(如氢气、甲烷、乙醇)和氧化剂(如氧气)的化学能直接转化为电能的电化学反应装置,具有清洁、安全、高效等特点。燃料电池的能量转化率可以达到80%以上。当以氢气为燃料时,产物为水;以甲烷为燃料时,产物为水和二氧化碳。
①反应物不储存在电池内部,而由外界提供的。电池只是一个反应器。
②电极一般不参与反应,常采用惰性电极:活性炭棒、金属铂等
③燃料在负极发生氧化反应,O2在正极发生还原反应,两者不直接燃烧;电解质不同,电极反应可能不同,产物也不一定相同。
氢氧燃料电池(H2 、O2)
氢氧燃料电池
电解质
负极(H2)
正极(O2)
酸性H2SO4(aq)
?
?
碱性KOH(aq)
?
?
中性Na2SO4(aq)
总反应:2H2 + O2 = 2H2O
2H2 - 4e- = 4H+
2H2 + 4OH- - 4e- = 4H2O
O2 + 4H+ + 4e- = 2H2O
O2 + 2H2O + 4e- = 4OH-
2H2 - 4e- = 4H+
O2 + 2H2O + 4e- = 4OH-
甲烷燃料电池(CH4、O2)
甲烷电池
H2SO4作电解质
KOH作电解质
负极
?
?
正极
?
?
总反应式
?
?
CH4+ 2H2O -8e- = CO2+ 8H+
2O2 + 8H+ + 8e- = 4H2O
2O2 + 8e- + 4H2O = 8OH-
CH4 + 2O2 = CO2 + 2H2O
CH4 + 10OH- -8e- = CO32-+ 7H2O
CH4 + 2O2 +2OH- = CO32- + 3H2O
甲烷燃料电池
1、被称之为“软电池”的纸质电池,采用一个薄层纸片(在其一边镀锌,而在其另一边镀二氧化锰)作为传导体。在纸内的离子“流过”水和氧化锌组成的电解液。电池总反应为:
Zn + 2MnO2 + H2O === ZnO + 2MnO(OH),下列说法正确的是( )
A.电池工作时,锌失去电子,做正极
B.该电池反应中二氧化锰起催化剂作用
C.当生成0.1 mol ZnO时,转移电子个数为1.204×1024
D.外电路中每通过0.2 mol电子,锌的质量理论上减少6.5 g
D
课堂巩固
2、高铁电池是一种新型可充电电池,与普通电池相比,该电池能较长时间保持稳定的放电电压。高铁电池的总反应为3Zn+2K2FeO4+8H2O
3Zn(OH)2+2Fe(OH)3+4KOH。请回答下列问题:(1)放电时,正极发生________(填“氧化”或“还原”)反应,则负极反应式为_____________________________________________,正极反应式为_________________________________________。(2)放电时,________(填“正”或“负”)极附近溶液的碱性增强。
放电
充电
正
还原
3Zn-6e-+6OH- = 3Zn(OH)2
2FeO42-+6e-+8H2O = 2Fe(OH)3+10OH-
课堂巩固
3、锂—空气电池的工作原理如图,总反应式为4Li+O2+2H2O = 4LiOH。
回答下列问题:(1)A、B分别为原电池的什么极?发生什么反应?写出电极反应式。(2)电解液a可以是水溶液吗?为什么?(3)电解液中的Li+向什么极迁移?(4)电解液b的pH如何变化?
(1)A极为负极,发生氧化反应,4Li-4e- = 4Li+。 B极为正极,发生还原反应,O2+4e-+2H2O = 4OH- (2)不可以,因为Li与H2O反应。 (3)Li+向B极迁移。 (4)pH增大。
课堂巩固
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
