6.2 化学反应速率与限度 第二课时 课件(16张ppt)【新教材】2020-2021学年人教版(2019)高一化学必修二
文档属性
| 名称 | 6.2 化学反应速率与限度 第二课时 课件(16张ppt)【新教材】2020-2021学年人教版(2019)高一化学必修二 |  | |
| 格式 | pptx | ||
| 文件大小 | 549.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-04-11 21:38:59 | ||
图片预览



文档简介
化学反应速率与限度
课时2 影响化学反应速率的因素
思考:
1.在通常情况下,Na与水的反应和Mg与水的反应哪个剧烈(反应速率快)?为什么?
2.为什么F2与H2黑暗即爆炸,而Cl2与H2光照或点燃才反应。
影响化学反应速率的因素
参加反应的物质自身的性质是决定化学反应速率的主要原因
——内因
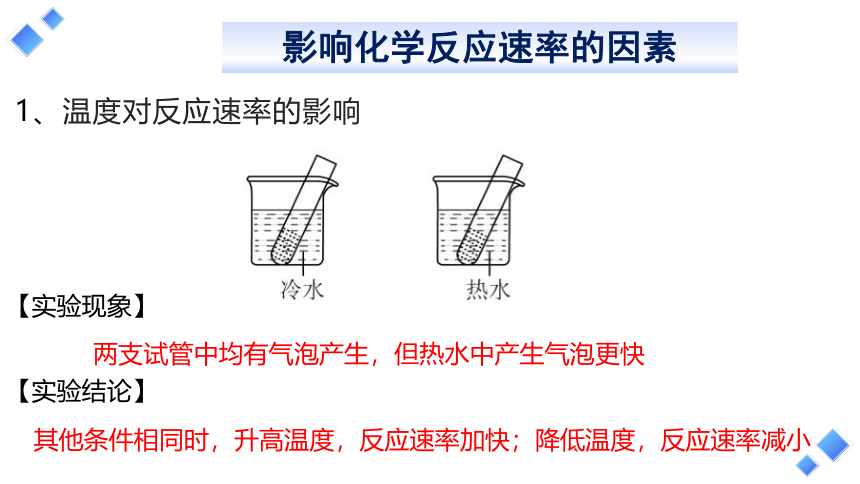
1、温度对反应速率的影响
两支试管中均有气泡产生,但热水中产生气泡更快
其他条件相同时,升高温度,反应速率加快;降低温度,反应速率减小
影响化学反应速率的因素
【实验现象】
【实验结论】
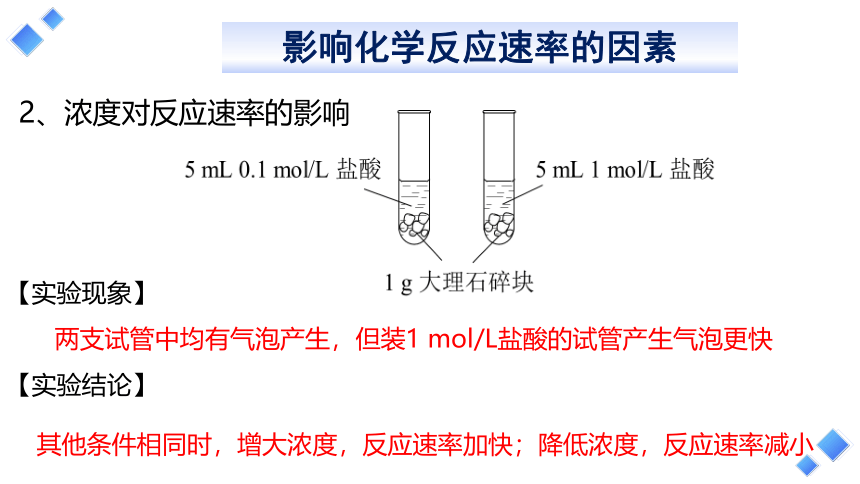
2、浓度对反应速率的影响
两支试管中均有气泡产生,但装1 mol/L盐酸的试管产生气泡更快
其他条件相同时,增大浓度,反应速率加快;降低浓度,反应速率减小
【实验现象】
【实验结论】
影响化学反应速率的因素
【实验现象】
【实验结论】
影响化学反应速率的因素
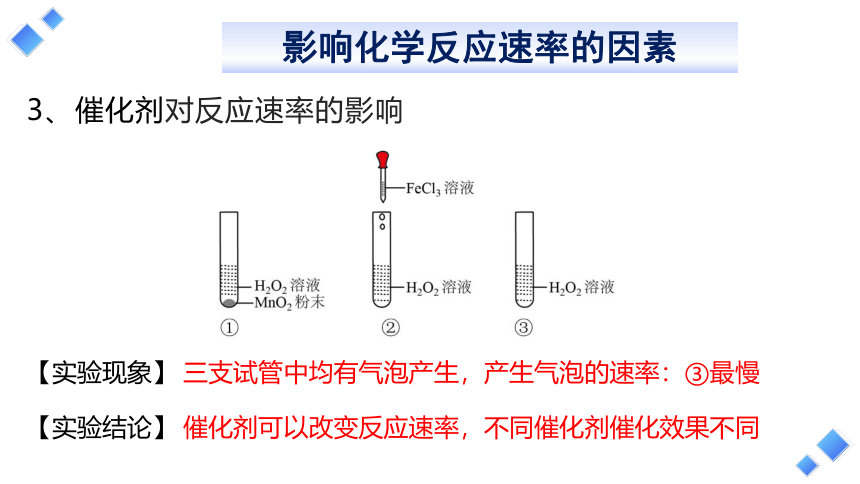
3、催化剂对反应速率的影响
三支试管中均有气泡产生,产生气泡的速率:③最慢
催化剂可以改变反应速率,不同催化剂催化效果不同
1.影响化学反应速率的主要因素——内因
2.影响化学反应速率的外界因素——外因
总结——影响化学反应速率的因素
反应物本身的性质
注意:固体或纯液体的浓度为常数,所以增加其用量时,化学反应速率
。
①浓度:
当其它条件不变时,增大反应物的浓度, ;减少反应物的浓度, 。
可以加快反应速率
可减缓反应速率
不变
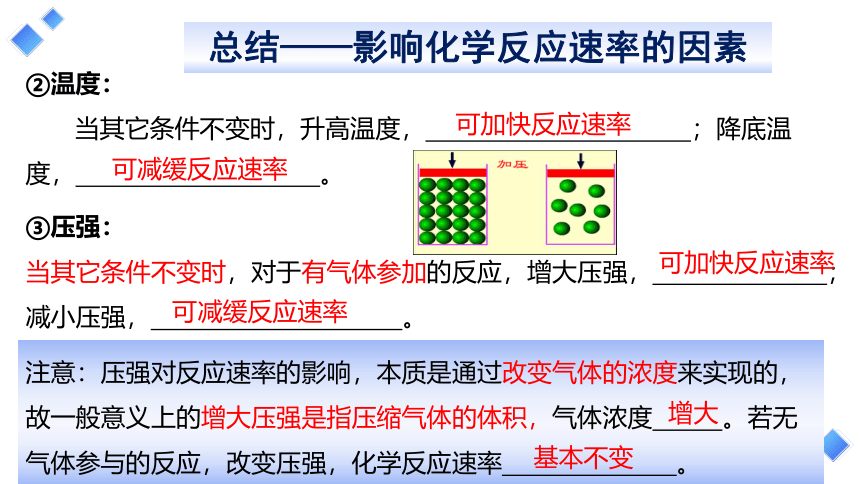
③压强:
当其它条件不变时,对于有气体参加的反应,增大压强, ;减小压强, 。
②温度:
当其它条件不变时,升高温度, ;降底温度, 。
可加快反应速率
可减缓反应速率
可加快反应速率
可减缓反应速率
总结——影响化学反应速率的因素
注意:压强对反应速率的影响,本质是通过改变气体的浓度来实现的,故一般意义上的增大压强是指压缩气体的体积,气体浓度 。若无气体参与的反应,改变压强,化学反应速率 。
基本不变
增大
④催化剂:
当其它条件不变时,加入正催化剂能加快反应速率
⑤其他因素:
a.反应物的接触面积。一般来说反应物接触面积大,反应速率加快;反应物接触面积小,反应速率减缓。
b.形成原电池可加快反应速率。
总结——影响化学反应速率的因素
课堂巩固
1、判断对错
(1)Na、Mg、Al的金属性决定了它们与水反应的速率大小( )
(2)增大反应物的用量一定能加快化学反应速率( )
(3)对于放热反应,升高温度化学反应速率减小( )
(4)改变压强,化学反应速率必然改变( )
(5)用铁和稀硫酸反应制取氢气时,硫酸浓度大,产生氢气的速率越快( )
(6)使用催化剂就一定能加快反应速率( )
(7)实验时,将固体药品研碎目的是为了增大反应物的接触面积,增大反应
速率( )
√
×
×
×
×
×
√
2、在一密闭容器中充入1 mol H2和1 mol I2,压强为p(Pa),在一定温度下使其发生反应:H2(g)+I2(g) 2HI(g)。(如图)。
(1)向下压缩活塞,容器内气体压强如何变化?气体浓度如何变
化?反应速率如何变化?
(2)保持容器的容积不变,向其中充入氦气(He),反应速率如何变化?
(3)保持容器内气体压强不变,向其中充入氦气(He),反应速率如何变化?
向下压缩活塞,气体压强增大,浓度增大,化学反应速率加快。
充入氦气,尽管压强增大,但反应物浓度不变,反应速率不变。
充入氦气,尽管压强不变,但容器的体积增大,反应物浓度减小,反应速率减小。
(1)压缩体积或充入气态反应物,使压强 ,都能 化学反应速率。
(2)充入非反应气体对化学反应速率的影响
①恒容时:
②恒压时:
压强改变 若物质浓度不变 → 反应速率不变
若物质浓度改度 → 反应速率改变
对有气体参加的反应,压强对化学反应速率的影响可理解为对浓度的影响
难点突破
充入非反应气体 → 压强增大,但各物质浓度不变 → 反应速率不变。
充入非反应气体 → 压强不变 → 体积增大 → 各物质浓度减小 → 速率减慢。
增大
加快
1.在带有活塞的密闭容器中发生如下反应:3Fe(s)+4H2O(g)==Fe3O4(s)+4H2(g),分析改变下列条件化学反应速率如何改变:
(1)增加铁片的质量(不考虑表面积的变化) ,
理由 。
(2)保持容器的体积不变,增加水蒸气的通入量 ,
理由 。
(3)保持容器内压强不变,充入一定量的氩气 ,理由
。
(4)保持容器的容积不变,充入一定量的氩气 ,理由 ,
理解应用
高温
纯固体的浓度视为常数,改变用量不影响化学反应速率
不变
变大
增大反应物浓度加快化学反应速率
变小
保持压强不变,充入Ar,容器体积增大,水蒸气浓度变小,反应速率变小
不变
容器的容积不变
充入氩气,反应物和生成物的浓度均不改变,因而化学反应速率不变。
2.用等质量的锌与等体积过量盐酸在不同条件下进行如下5组实验,测定收集相同条件下等体积的氢气所用时间。
{5940675A-B579-460E-94D1-54222C63F5DA}组别
A
B
C
D
E
盐酸浓度/mol·L-1
2.0
2.0
2.5
2.5
2.5
温度/℃
25
30
30
50
50
锌粒状态
块状
粉末
粉末
块状
粉末
理解应用
回答下列问题:
(1)探究浓度对化学反应速率的影响应选用哪两组实验数据 。
(2)探究温度对化学反应速率的影响应选用哪两组实验数据 。
(3)探究接触面积对化学反应速率的影响应选用哪两组实验数据 。
(4)上述5组实验中测定收集等体积的氢气需要时间最短的是 。
(5)实验完成后,某同学又用A组实验药品滴加两滴氯化铜,发现产生氢气的速率明显加快,解释速率加快的原因是:
理解应用
BC
CE
DE
E
Zn与Cu2+反应生成Cu单质,在锌块表面形成Zn—Cu原电池,
加快化学反应速率
3、等质量的两份锌粉a、b中分别加入过量的稀硫酸,同时向a中加入少量的CuSO4溶液,下列各图表示的是产生H2的体积V与时间t的关系,其中正确的是(?? ??)
理解应用
A
4、将镁带投入盛放在敞口容器的盐酸里,产生H2的速率与时间的关系可由右图表示。
(1)写出离子反应方程式 。
(2)在下列因素中:①H+的浓度,
②镁带的表面积,③溶液的温度,④Cl-的浓度,
能影响该反应速率的因素有__________(填序号);
(3)解释图中AB段形成的原因 。
(4)解释图中t1时刻后速率变小的原因 。
理解应用
Mg + 2H+ = Mg2+ + H2↑
①②③
反应放热,温度升高,速率加快
随着反应进行,盐酸浓度减小,反应物浓度减小,反应速率减慢
课时2 影响化学反应速率的因素
思考:
1.在通常情况下,Na与水的反应和Mg与水的反应哪个剧烈(反应速率快)?为什么?
2.为什么F2与H2黑暗即爆炸,而Cl2与H2光照或点燃才反应。
影响化学反应速率的因素
参加反应的物质自身的性质是决定化学反应速率的主要原因
——内因
1、温度对反应速率的影响
两支试管中均有气泡产生,但热水中产生气泡更快
其他条件相同时,升高温度,反应速率加快;降低温度,反应速率减小
影响化学反应速率的因素
【实验现象】
【实验结论】
2、浓度对反应速率的影响
两支试管中均有气泡产生,但装1 mol/L盐酸的试管产生气泡更快
其他条件相同时,增大浓度,反应速率加快;降低浓度,反应速率减小
【实验现象】
【实验结论】
影响化学反应速率的因素
【实验现象】
【实验结论】
影响化学反应速率的因素
3、催化剂对反应速率的影响
三支试管中均有气泡产生,产生气泡的速率:③最慢
催化剂可以改变反应速率,不同催化剂催化效果不同
1.影响化学反应速率的主要因素——内因
2.影响化学反应速率的外界因素——外因
总结——影响化学反应速率的因素
反应物本身的性质
注意:固体或纯液体的浓度为常数,所以增加其用量时,化学反应速率
。
①浓度:
当其它条件不变时,增大反应物的浓度, ;减少反应物的浓度, 。
可以加快反应速率
可减缓反应速率
不变
③压强:
当其它条件不变时,对于有气体参加的反应,增大压强, ;减小压强, 。
②温度:
当其它条件不变时,升高温度, ;降底温度, 。
可加快反应速率
可减缓反应速率
可加快反应速率
可减缓反应速率
总结——影响化学反应速率的因素
注意:压强对反应速率的影响,本质是通过改变气体的浓度来实现的,故一般意义上的增大压强是指压缩气体的体积,气体浓度 。若无气体参与的反应,改变压强,化学反应速率 。
基本不变
增大
④催化剂:
当其它条件不变时,加入正催化剂能加快反应速率
⑤其他因素:
a.反应物的接触面积。一般来说反应物接触面积大,反应速率加快;反应物接触面积小,反应速率减缓。
b.形成原电池可加快反应速率。
总结——影响化学反应速率的因素
课堂巩固
1、判断对错
(1)Na、Mg、Al的金属性决定了它们与水反应的速率大小( )
(2)增大反应物的用量一定能加快化学反应速率( )
(3)对于放热反应,升高温度化学反应速率减小( )
(4)改变压强,化学反应速率必然改变( )
(5)用铁和稀硫酸反应制取氢气时,硫酸浓度大,产生氢气的速率越快( )
(6)使用催化剂就一定能加快反应速率( )
(7)实验时,将固体药品研碎目的是为了增大反应物的接触面积,增大反应
速率( )
√
×
×
×
×
×
√
2、在一密闭容器中充入1 mol H2和1 mol I2,压强为p(Pa),在一定温度下使其发生反应:H2(g)+I2(g) 2HI(g)。(如图)。
(1)向下压缩活塞,容器内气体压强如何变化?气体浓度如何变
化?反应速率如何变化?
(2)保持容器的容积不变,向其中充入氦气(He),反应速率如何变化?
(3)保持容器内气体压强不变,向其中充入氦气(He),反应速率如何变化?
向下压缩活塞,气体压强增大,浓度增大,化学反应速率加快。
充入氦气,尽管压强增大,但反应物浓度不变,反应速率不变。
充入氦气,尽管压强不变,但容器的体积增大,反应物浓度减小,反应速率减小。
(1)压缩体积或充入气态反应物,使压强 ,都能 化学反应速率。
(2)充入非反应气体对化学反应速率的影响
①恒容时:
②恒压时:
压强改变 若物质浓度不变 → 反应速率不变
若物质浓度改度 → 反应速率改变
对有气体参加的反应,压强对化学反应速率的影响可理解为对浓度的影响
难点突破
充入非反应气体 → 压强增大,但各物质浓度不变 → 反应速率不变。
充入非反应气体 → 压强不变 → 体积增大 → 各物质浓度减小 → 速率减慢。
增大
加快
1.在带有活塞的密闭容器中发生如下反应:3Fe(s)+4H2O(g)==Fe3O4(s)+4H2(g),分析改变下列条件化学反应速率如何改变:
(1)增加铁片的质量(不考虑表面积的变化) ,
理由 。
(2)保持容器的体积不变,增加水蒸气的通入量 ,
理由 。
(3)保持容器内压强不变,充入一定量的氩气 ,理由
。
(4)保持容器的容积不变,充入一定量的氩气 ,理由 ,
理解应用
高温
纯固体的浓度视为常数,改变用量不影响化学反应速率
不变
变大
增大反应物浓度加快化学反应速率
变小
保持压强不变,充入Ar,容器体积增大,水蒸气浓度变小,反应速率变小
不变
容器的容积不变
充入氩气,反应物和生成物的浓度均不改变,因而化学反应速率不变。
2.用等质量的锌与等体积过量盐酸在不同条件下进行如下5组实验,测定收集相同条件下等体积的氢气所用时间。
{5940675A-B579-460E-94D1-54222C63F5DA}组别
A
B
C
D
E
盐酸浓度/mol·L-1
2.0
2.0
2.5
2.5
2.5
温度/℃
25
30
30
50
50
锌粒状态
块状
粉末
粉末
块状
粉末
理解应用
回答下列问题:
(1)探究浓度对化学反应速率的影响应选用哪两组实验数据 。
(2)探究温度对化学反应速率的影响应选用哪两组实验数据 。
(3)探究接触面积对化学反应速率的影响应选用哪两组实验数据 。
(4)上述5组实验中测定收集等体积的氢气需要时间最短的是 。
(5)实验完成后,某同学又用A组实验药品滴加两滴氯化铜,发现产生氢气的速率明显加快,解释速率加快的原因是:
理解应用
BC
CE
DE
E
Zn与Cu2+反应生成Cu单质,在锌块表面形成Zn—Cu原电池,
加快化学反应速率
3、等质量的两份锌粉a、b中分别加入过量的稀硫酸,同时向a中加入少量的CuSO4溶液,下列各图表示的是产生H2的体积V与时间t的关系,其中正确的是(?? ??)
理解应用
A
4、将镁带投入盛放在敞口容器的盐酸里,产生H2的速率与时间的关系可由右图表示。
(1)写出离子反应方程式 。
(2)在下列因素中:①H+的浓度,
②镁带的表面积,③溶液的温度,④Cl-的浓度,
能影响该反应速率的因素有__________(填序号);
(3)解释图中AB段形成的原因 。
(4)解释图中t1时刻后速率变小的原因 。
理解应用
Mg + 2H+ = Mg2+ + H2↑
①②③
反应放热,温度升高,速率加快
随着反应进行,盐酸浓度减小,反应物浓度减小,反应速率减慢
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
