6.2 化学反应速率与限度 第三课时 课件(23张ppt)【新教材】2020-2021学年人教版(2019)高一化学必修二
文档属性
| 名称 | 6.2 化学反应速率与限度 第三课时 课件(23张ppt)【新教材】2020-2021学年人教版(2019)高一化学必修二 |  | |
| 格式 | pptx | ||
| 文件大小 | 475.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-04-12 07:35:43 | ||
图片预览






文档简介
化学反应速率与限度
课时3 化学反应限度
(1)定义
在同一条件下 和 均能进行的化学反应。
书写可逆反应的化学方程式时,不用“=”,用“ ”。
正反应方向
逆反应方向
(2)特征
正反应和逆反应
正、逆反应是在 下 进行的
同一条件
双向性
双同性
共存性
反应物和生成物 存在
共同
同时
可逆反应
下列属于可逆反应的是 。
A.氯化钠溶解与结晶析出
B.氯气溶于水
C.电解水生成H2、O2 与H2在O2中燃烧生成H2O
D.反应物和生成物相反的反应
E.SO2被氧气氧化成SO3
F.H2和I2在高温下边化合边分解
G.品红溶液通入SO2褪色,加热后又恢复红色
H.Pb + PbO2 + 2H2SO4 2PbSO4 + 2H2O
I.SO2 + Br2 + 2H2O = H2SO4 + 2HBr与
2HBr + H2SO4(浓) = Br2 + SO2↑+ 2H2O
课堂巩固
BEF
放电
充电
化学平衡的建立
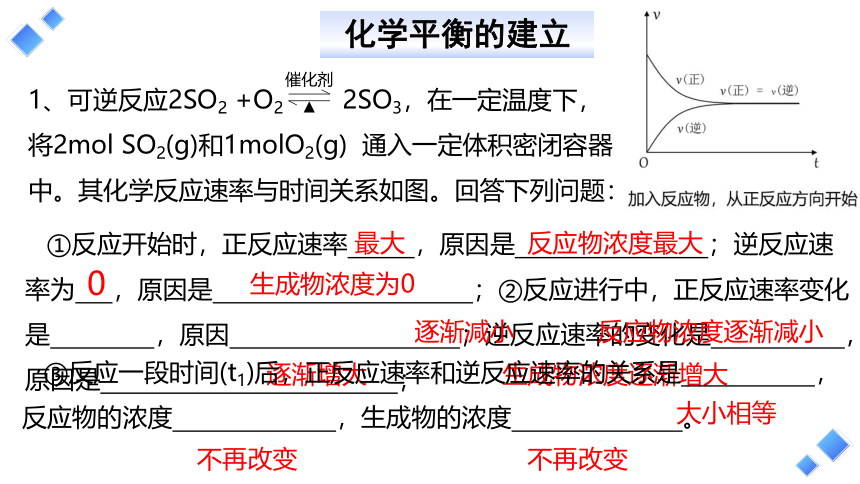
1、可逆反应2SO2 +O2 2SO3,在一定温度下,
将2mol SO2(g)和1molO2(g) 通入一定体积密闭容器
中。其化学反应速率与时间关系如图。回答下列问题:
催化剂
▲
①反应开始时,正反应速率 ,原因是 ;逆反应速率为 ,原因是 ;②反应进行中,正反应速率变化是 ,原因 ;逆反应速率的变化是 ,原因是 ;
最大
反应物浓度最大
0
生成物浓度为0
逐渐减小
反应物浓度逐渐减小
逐渐增大
生成物浓度逐渐增大
③反应一段时间(t1)后,正反应速率和逆反应速率的关系是 ,反应物的浓度 ,生成物的浓度 。
大小相等
不再改变
不再改变
化学平衡的建立
2、化学平衡状态也可从逆反应开始建立。如图:
3、化学平衡状态的概念
如果外界条件( 、 、 等)不发生改变,当
反应进行到一定程度时, 和 相等,反应物的 和生成物的 不再改变,达到一种表面静止的状态,称为“化学平衡状态”,简称化学平衡。
化学平衡研究的对象是 。
化学平衡状态
温度
浓度
压强
可逆
正反应速率
逆反应速率
浓度
浓度
可逆反应
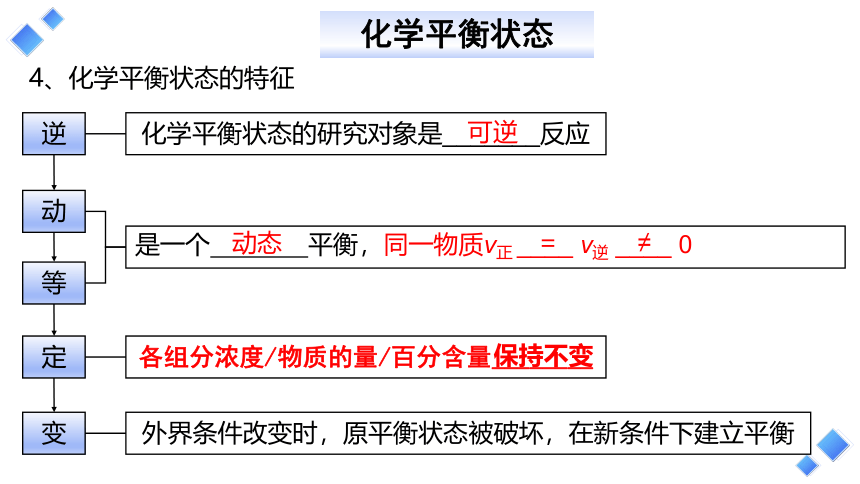
4、化学平衡状态的特征
化学平衡状态
逆
化学平衡状态的研究对象是_______反应
动
各组分浓度/物质的量/百分含量________
等
是一个 平衡,同一物质v正 ____ v逆 ____ 0
定
变
外界条件改变时,原平衡状态被破坏,在新条件下建立平衡
可逆
= ≠
保持不变
动态
在一定温度下,发生反应:N2(g)+3H2(g) 2NH3(g),起始时,充入的N2、H2和NH3的物质的量分别是3 mol、7 mol和1mol,10min后达到平衡状态,此时共消耗H2的物质的量是3 mol。已知容器的容积为5 L,试用“三段式”求: (1)该正反应各物质的平均反应速率是多少。
(2)平衡时H2、NH3的物质的量浓度各是多少。
(3)N2的转化率是多少。
课堂巩固
1、判断正误
(1)SO2溶于水时,完全与水反应生成H2SO3( )(2)通过改变反应条件,可逆反应中反应物的转化率可达100%( )(3)相同条件下,不同化学反应的限度可能不同( )(4)一定条件可以通过延长化学反应的时间来改变反应物的最大转化率( )(5)化学反应在一定条件下建立平衡状态时,化学反应将会停止( )
(6)1 mol N2和3 mol H2在一定条件下可生成2 mol NH3( )
×
×
√
×
×
课堂巩固
×
(7)可逆反应达到平衡状态时,各反应物、生成物的浓度相等( )
(8)化学平衡状态时,所有物质的速率都相等( )
(9)化学平衡状态时,各物质的浓度之比等于化学计量数之比( )
(10)任何反应,温度越高,反应速率越大,转化率越大 ( )
(11)化学反应的限度与时间的长短无关( )
(12)化学反应达到化学平衡状态时正、逆反应速率相等,是指同一物质的消耗速率和生成速率相等,若用不同物质表示时,反应速率不一定相等( )
(13)升高温度,正反应速率加快,逆反应速率减慢( )
×
×
×
课堂巩固
×
√
√
×
2、在密闭容器中进行如下反应:X2(g) + Y2(g) 2Z(g),已知X2、Y2、Z起始浓度分别为0.1 mol/L、0.3 mol/L、0.2 mol/L,在一定条件下当反应达到平衡时,各物质的浓度可能是( )
A.Z为0.4 mol/L
B.Y2为0.4 mol/L
C.X2为0.4 mol/L
D.Z为0.3 mol/L
课堂巩固
D
可逆反应有一定的限度
——不彻底性
3、在密闭容器中发生反应X(g) + 3Y(g) 2Z(g),若X、Y、Z的起始浓度分别为0.1 mol/L、0.3 mol/L和0.2 mol/L,则平衡时各物质的浓度不可能是( )
A.Y为0.1 mol/L B.Z为0.1 mol/L时,Y为0.45 mol/L
C.Z为0.3 mol/L D.X为0.2 mol/L
课堂巩固
D
4、14CO2 + C 2CO,达到化学平衡后,平衡混合物中含 14C的粒子有 。
14CO2 、 14C、 14CO
化学平衡状态的判断
(1)直接依据——根据速率关系
①同一物质:v生成=v消耗,即v正(A)=v逆(A)。
②不同物质:速率之比=化学计量数之比,必须是不同方向的速率
如aA+bB
逆向相等
—
速率必须一个是正反应速率,一个是逆反应速率,且经过换算后同一物质: v生成=v消耗
(2)间接依据——根据各组分的量
首先分析该量是“变量”还是“恒量”,如为“恒量”,即随反应的进行永远不变的量,则不能作为判断平衡状态的依据;如为“变量”,即该量随反应进行而改变,当其“不变”时,则为平衡状态。
化学平衡状态的判断
变量不变:各组分的物质的量n、浓度c、质量m、百分含量%、温度T、
达到化学平衡状态的判断:
其它量:总压强、总物质的量、平均相对分子质量、体系的密度、颜色、
化学键断裂与形成的物质的量等视具体情况而定
(多与气体化学计量数有关)
课堂巩固
3、在容积一定的密闭容器中进行反应H2(g)+I2(g) 2HI(g),
(1)混合气体的总的物质的量不再改变
(2)混合气体的压强不再改变
(3)混合气体的密度不再改变
(4)混合气体的平均相对分子质量不再改变
其中不能说明该反应达到平衡状态的是 。
(1)(2)(3)(4)
4、一定温度下恒容容器中发生反应:2A(g)+B(s) C(g)+D(g),下列描述中能表明反应已达到平衡状态的是 。①混合气体的压强不变
②混合气体的密度不变
③C(g)的物质的量浓度不变④容器内A、C、D三种气体的浓度之比为 2∶1∶1⑤单位时间内生成 n molC,同时生成 n molD⑥单位时间内生成 n molD,同时生成 2n molA
课堂巩固
②③⑥
一、控制化学反应条件的意义
促进有利反应,抑制有害反应。
?
二、控制化学反应条件的方法
化学反应条件的控制
改变化学反应速率,
改变可逆反应进行的限度。
改变速率 ≠ 改变限度
(2)基本措施
化学反应条件的控制
①改变化学反应速率:
改变反应体系的温度、物质的浓度、
气体的压强、固体的表面积以及催化剂的合理使用等。
改变可逆反应体系的温度、
物质的浓度、气体的压强等。
②改变可逆反应进行的限度:
(3)考虑因素:
控制反应条件的成本和实际可能性。
三、合成氨工业反应条件的控制
合成氨的生产在温度较低时,氨的产率较高;压强越大,氨的产率越高。但温度低,反应速率小,需要很长时间才能达到化学平衡,生产成本高,工业上通常选择在400~500℃下进行。而压强越大,对动力和生产设备的要求也越高,合成氨厂随着生产规模和设备条件的不同,采用的压强通常为10~30MPa。
化学反应条件的控制
四、煤燃烧反应条件的控制
思考与讨论
1、将固体煤粉碎以增大接触面积,同时空气适当过量,以提高转化率。
2、炉膛材料尽量选择保温性能好的,减少热量流失。
3、烟道废气中的热量用来加热水、发电等,以提高热量利用率。
1、下列措施可以提高燃料燃烧效率的是_________(填序号)。
①提高燃料的着火点
②降低燃料的着火点
③将固体燃料粉碎
④将液体燃料雾化处理
⑤将煤进行气化处理
⑥通入适当过量的空气
课堂巩固
③④⑤⑥
2、在2 L的密闭容器中放入4 mol N2O5,发生如下反应:
2N2O5(g) 4NO2(g) + O2(g)。
反应至5 min时,测得N2O5转化了20%,v(NO2)为__________ ;5 min时,N2O5在混合气体中的体积分数是______________。
课堂巩固
0.16 mol·L-1·min-1
61.5%
气体体积分数(物质的量分数) φ(A)= n(A)/n总 ×100%。
3、一定条件下在2 L的密闭容器中,X、Y、
Z三种物质的物质的量变化的曲线如图所示:
①该反应的化学方程式为____________________________。
②若X、Y、Z均为气体,2 min时反应达到平衡,此时体系内压强与开始时的压强之比为___________。
③若X、Y、Z均为气体,则达平衡时,容器内混合气体的平均相对分子质量比起始投料时_________(填“增大、减小、相等”)。
3Y+X 2Z
课堂巩固
9∶10
增大
课时3 化学反应限度
(1)定义
在同一条件下 和 均能进行的化学反应。
书写可逆反应的化学方程式时,不用“=”,用“ ”。
正反应方向
逆反应方向
(2)特征
正反应和逆反应
正、逆反应是在 下 进行的
同一条件
双向性
双同性
共存性
反应物和生成物 存在
共同
同时
可逆反应
下列属于可逆反应的是 。
A.氯化钠溶解与结晶析出
B.氯气溶于水
C.电解水生成H2、O2 与H2在O2中燃烧生成H2O
D.反应物和生成物相反的反应
E.SO2被氧气氧化成SO3
F.H2和I2在高温下边化合边分解
G.品红溶液通入SO2褪色,加热后又恢复红色
H.Pb + PbO2 + 2H2SO4 2PbSO4 + 2H2O
I.SO2 + Br2 + 2H2O = H2SO4 + 2HBr与
2HBr + H2SO4(浓) = Br2 + SO2↑+ 2H2O
课堂巩固
BEF
放电
充电
化学平衡的建立
1、可逆反应2SO2 +O2 2SO3,在一定温度下,
将2mol SO2(g)和1molO2(g) 通入一定体积密闭容器
中。其化学反应速率与时间关系如图。回答下列问题:
催化剂
▲
①反应开始时,正反应速率 ,原因是 ;逆反应速率为 ,原因是 ;②反应进行中,正反应速率变化是 ,原因 ;逆反应速率的变化是 ,原因是 ;
最大
反应物浓度最大
0
生成物浓度为0
逐渐减小
反应物浓度逐渐减小
逐渐增大
生成物浓度逐渐增大
③反应一段时间(t1)后,正反应速率和逆反应速率的关系是 ,反应物的浓度 ,生成物的浓度 。
大小相等
不再改变
不再改变
化学平衡的建立
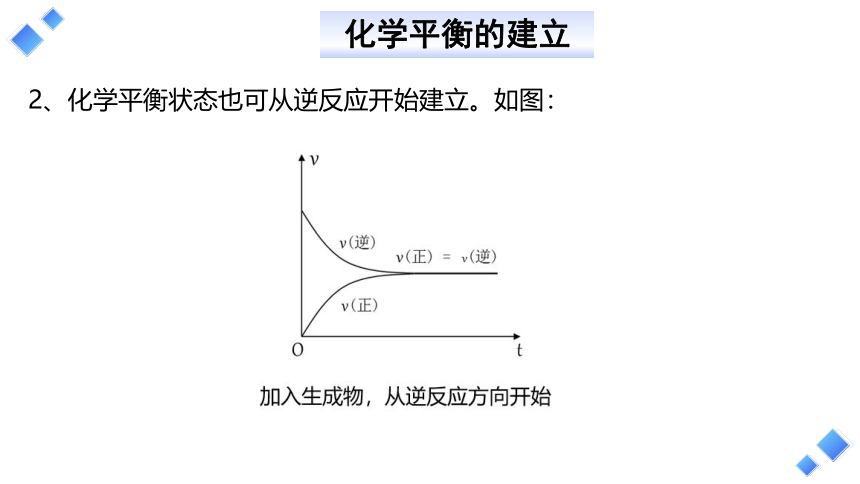
2、化学平衡状态也可从逆反应开始建立。如图:
3、化学平衡状态的概念
如果外界条件( 、 、 等)不发生改变,当
反应进行到一定程度时, 和 相等,反应物的 和生成物的 不再改变,达到一种表面静止的状态,称为“化学平衡状态”,简称化学平衡。
化学平衡研究的对象是 。
化学平衡状态
温度
浓度
压强
可逆
正反应速率
逆反应速率
浓度
浓度
可逆反应
4、化学平衡状态的特征
化学平衡状态
逆
化学平衡状态的研究对象是_______反应
动
各组分浓度/物质的量/百分含量________
等
是一个 平衡,同一物质v正 ____ v逆 ____ 0
定
变
外界条件改变时,原平衡状态被破坏,在新条件下建立平衡
可逆
= ≠
保持不变
动态
在一定温度下,发生反应:N2(g)+3H2(g) 2NH3(g),起始时,充入的N2、H2和NH3的物质的量分别是3 mol、7 mol和1mol,10min后达到平衡状态,此时共消耗H2的物质的量是3 mol。已知容器的容积为5 L,试用“三段式”求: (1)该正反应各物质的平均反应速率是多少。
(2)平衡时H2、NH3的物质的量浓度各是多少。
(3)N2的转化率是多少。
课堂巩固
1、判断正误
(1)SO2溶于水时,完全与水反应生成H2SO3( )(2)通过改变反应条件,可逆反应中反应物的转化率可达100%( )(3)相同条件下,不同化学反应的限度可能不同( )(4)一定条件可以通过延长化学反应的时间来改变反应物的最大转化率( )(5)化学反应在一定条件下建立平衡状态时,化学反应将会停止( )
(6)1 mol N2和3 mol H2在一定条件下可生成2 mol NH3( )
×
×
√
×
×
课堂巩固
×
(7)可逆反应达到平衡状态时,各反应物、生成物的浓度相等( )
(8)化学平衡状态时,所有物质的速率都相等( )
(9)化学平衡状态时,各物质的浓度之比等于化学计量数之比( )
(10)任何反应,温度越高,反应速率越大,转化率越大 ( )
(11)化学反应的限度与时间的长短无关( )
(12)化学反应达到化学平衡状态时正、逆反应速率相等,是指同一物质的消耗速率和生成速率相等,若用不同物质表示时,反应速率不一定相等( )
(13)升高温度,正反应速率加快,逆反应速率减慢( )
×
×
×
课堂巩固
×
√
√
×
2、在密闭容器中进行如下反应:X2(g) + Y2(g) 2Z(g),已知X2、Y2、Z起始浓度分别为0.1 mol/L、0.3 mol/L、0.2 mol/L,在一定条件下当反应达到平衡时,各物质的浓度可能是( )
A.Z为0.4 mol/L
B.Y2为0.4 mol/L
C.X2为0.4 mol/L
D.Z为0.3 mol/L
课堂巩固
D
可逆反应有一定的限度
——不彻底性
3、在密闭容器中发生反应X(g) + 3Y(g) 2Z(g),若X、Y、Z的起始浓度分别为0.1 mol/L、0.3 mol/L和0.2 mol/L,则平衡时各物质的浓度不可能是( )
A.Y为0.1 mol/L B.Z为0.1 mol/L时,Y为0.45 mol/L
C.Z为0.3 mol/L D.X为0.2 mol/L
课堂巩固
D
4、14CO2 + C 2CO,达到化学平衡后,平衡混合物中含 14C的粒子有 。
14CO2 、 14C、 14CO
化学平衡状态的判断
(1)直接依据——根据速率关系
①同一物质:v生成=v消耗,即v正(A)=v逆(A)。
②不同物质:速率之比=化学计量数之比,必须是不同方向的速率
如aA+bB
逆向相等
—
速率必须一个是正反应速率,一个是逆反应速率,且经过换算后同一物质: v生成=v消耗
(2)间接依据——根据各组分的量
首先分析该量是“变量”还是“恒量”,如为“恒量”,即随反应的进行永远不变的量,则不能作为判断平衡状态的依据;如为“变量”,即该量随反应进行而改变,当其“不变”时,则为平衡状态。
化学平衡状态的判断
变量不变:各组分的物质的量n、浓度c、质量m、百分含量%、温度T、
达到化学平衡状态的判断:
其它量:总压强、总物质的量、平均相对分子质量、体系的密度、颜色、
化学键断裂与形成的物质的量等视具体情况而定
(多与气体化学计量数有关)
课堂巩固
3、在容积一定的密闭容器中进行反应H2(g)+I2(g) 2HI(g),
(1)混合气体的总的物质的量不再改变
(2)混合气体的压强不再改变
(3)混合气体的密度不再改变
(4)混合气体的平均相对分子质量不再改变
其中不能说明该反应达到平衡状态的是 。
(1)(2)(3)(4)
4、一定温度下恒容容器中发生反应:2A(g)+B(s) C(g)+D(g),下列描述中能表明反应已达到平衡状态的是 。①混合气体的压强不变
②混合气体的密度不变
③C(g)的物质的量浓度不变④容器内A、C、D三种气体的浓度之比为 2∶1∶1⑤单位时间内生成 n molC,同时生成 n molD⑥单位时间内生成 n molD,同时生成 2n molA
课堂巩固
②③⑥
一、控制化学反应条件的意义
促进有利反应,抑制有害反应。
?
二、控制化学反应条件的方法
化学反应条件的控制
改变化学反应速率,
改变可逆反应进行的限度。
改变速率 ≠ 改变限度
(2)基本措施
化学反应条件的控制
①改变化学反应速率:
改变反应体系的温度、物质的浓度、
气体的压强、固体的表面积以及催化剂的合理使用等。
改变可逆反应体系的温度、
物质的浓度、气体的压强等。
②改变可逆反应进行的限度:
(3)考虑因素:
控制反应条件的成本和实际可能性。
三、合成氨工业反应条件的控制
合成氨的生产在温度较低时,氨的产率较高;压强越大,氨的产率越高。但温度低,反应速率小,需要很长时间才能达到化学平衡,生产成本高,工业上通常选择在400~500℃下进行。而压强越大,对动力和生产设备的要求也越高,合成氨厂随着生产规模和设备条件的不同,采用的压强通常为10~30MPa。
化学反应条件的控制
四、煤燃烧反应条件的控制
思考与讨论
1、将固体煤粉碎以增大接触面积,同时空气适当过量,以提高转化率。
2、炉膛材料尽量选择保温性能好的,减少热量流失。
3、烟道废气中的热量用来加热水、发电等,以提高热量利用率。
1、下列措施可以提高燃料燃烧效率的是_________(填序号)。
①提高燃料的着火点
②降低燃料的着火点
③将固体燃料粉碎
④将液体燃料雾化处理
⑤将煤进行气化处理
⑥通入适当过量的空气
课堂巩固
③④⑤⑥
2、在2 L的密闭容器中放入4 mol N2O5,发生如下反应:
2N2O5(g) 4NO2(g) + O2(g)。
反应至5 min时,测得N2O5转化了20%,v(NO2)为__________ ;5 min时,N2O5在混合气体中的体积分数是______________。
课堂巩固
0.16 mol·L-1·min-1
61.5%
气体体积分数(物质的量分数) φ(A)= n(A)/n总 ×100%。
3、一定条件下在2 L的密闭容器中,X、Y、
Z三种物质的物质的量变化的曲线如图所示:
①该反应的化学方程式为____________________________。
②若X、Y、Z均为气体,2 min时反应达到平衡,此时体系内压强与开始时的压强之比为___________。
③若X、Y、Z均为气体,则达平衡时,容器内混合气体的平均相对分子质量比起始投料时_________(填“增大、减小、相等”)。
3Y+X 2Z
课堂巩固
9∶10
增大
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
