6.1.1 化学反应与热能 课件(20张ppt)【新教材】2020-2021学年人教版(2019)高一化学必修二
文档属性
| 名称 | 6.1.1 化学反应与热能 课件(20张ppt)【新教材】2020-2021学年人教版(2019)高一化学必修二 |  | |
| 格式 | pptx | ||
| 文件大小 | 8.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-04-12 09:27:24 | ||
图片预览




文档简介
人教版必修第二册第六章第一节
化学反应与能量变化
第1课时
化学反应与热能
化学反应与热能
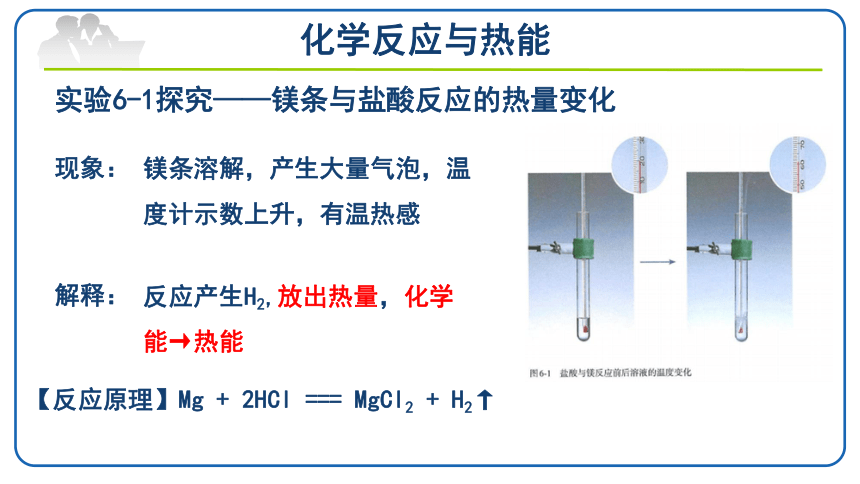
实验6-1探究——镁条与盐酸反应的热量变化
现象:
解释:
镁条溶解,产生大量气泡,温度计示数上升,有温热感
反应产生H2,放出热量,化学
能→热能
【反应原理】Mg + 2HCl === MgCl2 + H2↑
化学反应与热能
实验6-2探究——Ba(OH)2?8H2O 与 NH4Cl反应的热量变化
现象:
解释:
有刺激性气味产生;手摸烧杯感觉变冷;拿起烧杯,木片和烧杯黏结在一起。
反应产生NH3,吸收热量,热能→化学能
Ba(OH)2.8H2O + 2NH4Cl = BaCI2 + 10H2O + 2NH3↑
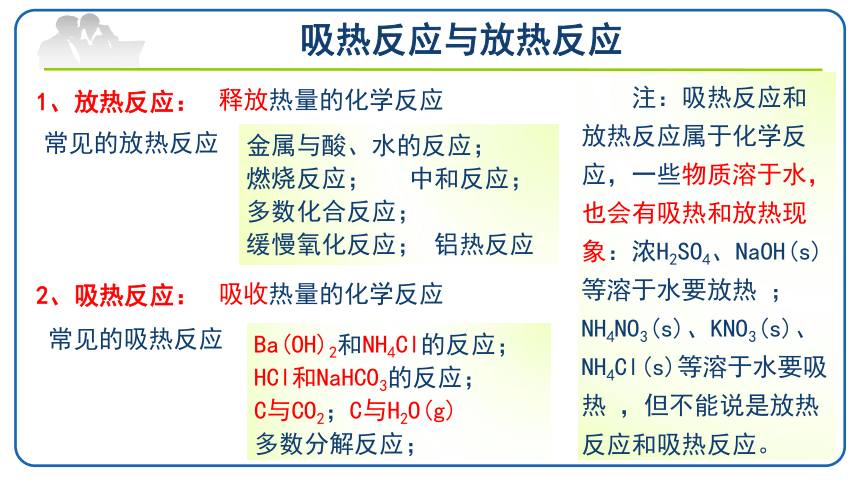
吸热反应与放热反应
1、放热反应:
2、吸热反应:
释放热量的化学反应
吸收热量的化学反应
金属与酸、水的反应;
燃烧反应; 中和反应;
多数化合反应;
缓慢氧化反应; 铝热反应
常见的放热反应
Ba(OH)2和NH4Cl的反应;
HCl和NaHCO3的反应;
C与CO2;C与H2O(g)
多数分解反应;
常见的吸热反应
注:吸热反应和放热反应属于化学反应,一些物质溶于水,也会有吸热和放热现象:浓H2SO4、NaOH(s)等溶于水要放热 ;NH4NO3(s)、KNO3(s)、NH4Cl(s)等溶于水要吸热 ,但不能说是放热反应和吸热反应。
1、下列是吸热反应的是 ;放热反应 ;⑴ 水蒸气冷凝 ⑵ 煅烧石灰石 ⑶ 浓硫酸稀释
⑷ 酸碱发生中和反应 ⑸ 生石灰跟水反应生成熟石灰
⑹ 干冰升华 ⑺ 液氨汽化 ⑻ 碳和二氧化碳在高温下反应
⑼ 氢原子两两结合为氢分子 ⑽ C + H2O(g) CO + H2
⑾ 胆矾受热变成白色粉末 ⑿ 食物腐烂 ⒀ 盐酸与碳酸氢钠反应
⒁ 人工固氮 ⒂ 硝酸铵溶于水
课堂巩固
高温
⑵ ⑻ ⑽ ⑾ ⒀
⑷ ⑸ ⑼ ⑿ ⒁
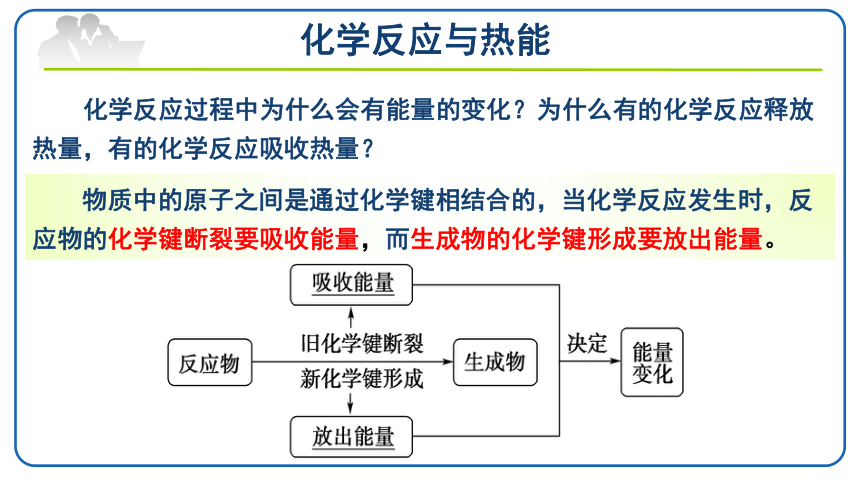
化学反应过程中为什么会有能量的变化?为什么有的化学反应释放热量,有的化学反应吸收热量?
物质中的原子之间是通过化学键相结合的,当化学反应发生时,反应物的化学键断裂要吸收能量,而生成物的化学键形成要放出能量。
化学反应与热能
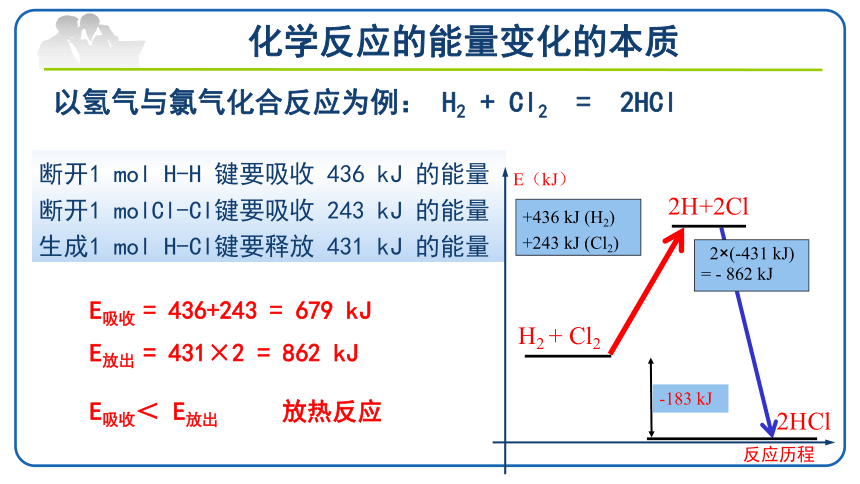
断开1 mol H-H 键要吸收 436 kJ 的能量
断开1 molCl-Cl键要吸收 243 kJ 的能量
生成1 mol H-Cl键要释放 431 kJ 的能量
以氢气与氯气化合反应为例: H2 + Cl2 = 2HCl
E吸收 = 436+243 = 679 kJ
E放出 = 431×2 = 862 kJ
E吸收< E放出 放热反应
E(kJ)
反应历程
H2 + Cl2
2H+2Cl
2HCl
-183 kJ
+436 kJ (H2)
+243 kJ (Cl2)
2×(-431 kJ)
= - 862 kJ
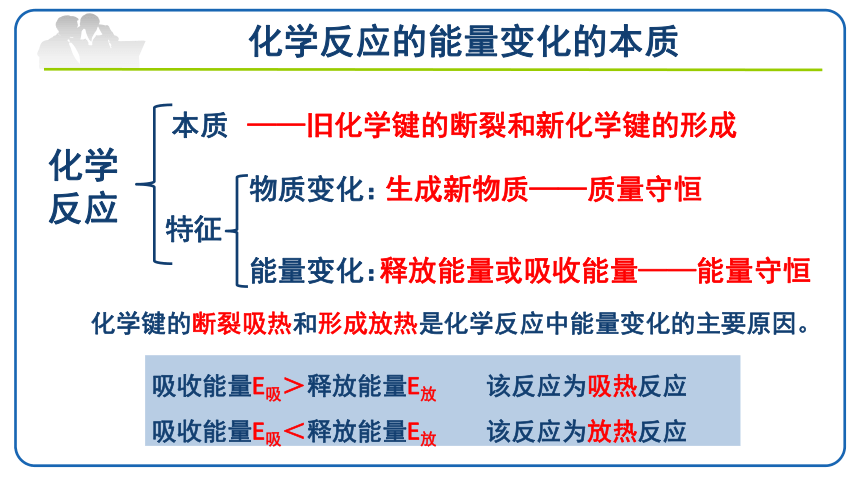
化学反应的能量变化的本质
化学反应的能量变化的本质
化学反应
本质
——旧化学键的断裂和新化学键的形成
特征
物质变化:
生成新物质——质量守恒
能量变化:
释放能量或吸收能量——能量守恒
吸收能量E吸>释放能量E放 该反应为吸热反应
吸收能量E吸<释放能量E放 该反应为放热反应
化学键的断裂吸热和形成放热是化学反应中能量变化的主要原因。
课堂巩固
1、判断对错
(1)有化学键断裂的,肯定发生了化学反应( )
(2)既有化学键断裂,又有化学键形成的,肯定发生了化学反应( )
(3)在化学键的形成过程中,肯定放出能量( )
(4)化学反应中原子一定发生重新组合( )
(5)化学变化中一定会发生电子转移( )
(6)所有化学反应必然伴随着能量的变化( )
×
×
√
√
×
√
化学反应的能量变化的宏观分析
各种物质都具有能量,物质的组成、结构与状态不同,所具有的能量也不同。放热反应可以看成是反应物所具有的化学能转化为热能释放出来,吸热反应可以看成是热能转化为化学能被生成物所“储存”。
反应物的总能量E反>生成物的总能量E生
反应放出能量,放热反应
反应物的总能量E反<生成物的总能量E生
反应吸收能量,吸热反应
物质键能越大,越稳定;能量越低,越稳定;能量越高,越活泼。
化学反应的能量变化的宏观分析——放热
E反
>
E生
E吸
<
E放
化学反应的能量变化的宏观分析——吸热
E反
<
E生
E吸
>
E放
课堂巩固
1、吸热反应和放热反应的对象都是化学变化,物理变化除外。
2、一个化学反应是吸热还是放热,取决于反应物和生成物具有总能量的相对大小,与反应条件(是否需要加热)无关。
(1)需要加热的反应一定是吸热反应( )
(2)吸热反应一定需要加热才可以进行( )
(3)放热反应不需要加热即可发生( )
(4)放出热量的变化过程一定是放热反应( )
(5)任何反应中的能量变化都表现为热量变化( )
×
×
×
×
×
1、已知反应A + B === C + D的能量变化如图所示,下列关于此反应的说法不正确的是( )
A.是吸热反应
B.该反应不符合能量守恒定律
C.生成物的总能量高于反应物的总能量
D.反应中断开化学键吸收的总能量高于
形成化学键放出的总能量
B
课堂巩固
2、反应A + B → C(放热)分两步进行:① A + B → X(吸热),② X → C(放热)。下列示意图中,能正确表示总反应过程中能量变化的是( )
课堂巩固
D
化学反应中能量变化计算
E吸表示反应物中化学键断裂时吸收的总能量,
E放表示生成物中化学键形成时放出的总能量。
△E = E吸 - E放
△E < 0,放热
△E > 0,吸热
注意: ①1mol物质中化学键的数目
②参加反应的各物质的物质的量;
【例5】已知部分键能如下表所示,计算下列三个反应中的能量变化情况。
(1)CH4 + 2O2 == CO2 + 2H2O,1 mol CH4完全反应时,________(填吸收/放出)________ kJ能量。
(2)已知N2 + 3H2 ==== 2NH3,消耗1 mol N2 时放出92 kJ的热量,则
上表中x的数值为 ________。
(3)如下图为白磷(P4)和P4O6的结构,
1mol 白磷完全燃烧生成P4O6,______(填吸收
/放出)________kJ能量。
放出
946
1638
{93296810-A885-4BE3-A3E7-6D5BEEA58F35}化学键
H—H
H—N
N≡N
O=O
C—H
C=O
H—O
P—P
P—O
键能
(kJ/mol)
436
391
x
498
414
750
465
198
360
708
放出
1.获取热能的途径——物质的燃烧
(1)早期:以树枝杂草为主要能源。
(2)现代:以煤、石油和天然气为主要能源。
2.面临问题
(1)短期内不可再生,储量有限;
(2)煤和石油产品燃烧排放的粉尘、SO2、NOx、CO等造成
大气污染。
人类对能源的利用
3.解决方法
(1)节能减排
(2)开发新能源——太阳能、风能、地热能、海洋能、氢能
人类对能源的利用
一次能源
二次能源
煤、石油、天然气、水能、风能、太阳能、
潮汐能、地热能
电能、氢能、蒸汽、汽油、柴油等
化学反应与能量变化
第1课时
化学反应与热能
化学反应与热能
实验6-1探究——镁条与盐酸反应的热量变化
现象:
解释:
镁条溶解,产生大量气泡,温度计示数上升,有温热感
反应产生H2,放出热量,化学
能→热能
【反应原理】Mg + 2HCl === MgCl2 + H2↑
化学反应与热能
实验6-2探究——Ba(OH)2?8H2O 与 NH4Cl反应的热量变化
现象:
解释:
有刺激性气味产生;手摸烧杯感觉变冷;拿起烧杯,木片和烧杯黏结在一起。
反应产生NH3,吸收热量,热能→化学能
Ba(OH)2.8H2O + 2NH4Cl = BaCI2 + 10H2O + 2NH3↑
吸热反应与放热反应
1、放热反应:
2、吸热反应:
释放热量的化学反应
吸收热量的化学反应
金属与酸、水的反应;
燃烧反应; 中和反应;
多数化合反应;
缓慢氧化反应; 铝热反应
常见的放热反应
Ba(OH)2和NH4Cl的反应;
HCl和NaHCO3的反应;
C与CO2;C与H2O(g)
多数分解反应;
常见的吸热反应
注:吸热反应和放热反应属于化学反应,一些物质溶于水,也会有吸热和放热现象:浓H2SO4、NaOH(s)等溶于水要放热 ;NH4NO3(s)、KNO3(s)、NH4Cl(s)等溶于水要吸热 ,但不能说是放热反应和吸热反应。
1、下列是吸热反应的是 ;放热反应 ;⑴ 水蒸气冷凝 ⑵ 煅烧石灰石 ⑶ 浓硫酸稀释
⑷ 酸碱发生中和反应 ⑸ 生石灰跟水反应生成熟石灰
⑹ 干冰升华 ⑺ 液氨汽化 ⑻ 碳和二氧化碳在高温下反应
⑼ 氢原子两两结合为氢分子 ⑽ C + H2O(g) CO + H2
⑾ 胆矾受热变成白色粉末 ⑿ 食物腐烂 ⒀ 盐酸与碳酸氢钠反应
⒁ 人工固氮 ⒂ 硝酸铵溶于水
课堂巩固
高温
⑵ ⑻ ⑽ ⑾ ⒀
⑷ ⑸ ⑼ ⑿ ⒁
化学反应过程中为什么会有能量的变化?为什么有的化学反应释放热量,有的化学反应吸收热量?
物质中的原子之间是通过化学键相结合的,当化学反应发生时,反应物的化学键断裂要吸收能量,而生成物的化学键形成要放出能量。
化学反应与热能
断开1 mol H-H 键要吸收 436 kJ 的能量
断开1 molCl-Cl键要吸收 243 kJ 的能量
生成1 mol H-Cl键要释放 431 kJ 的能量
以氢气与氯气化合反应为例: H2 + Cl2 = 2HCl
E吸收 = 436+243 = 679 kJ
E放出 = 431×2 = 862 kJ
E吸收< E放出 放热反应
E(kJ)
反应历程
H2 + Cl2
2H+2Cl
2HCl
-183 kJ
+436 kJ (H2)
+243 kJ (Cl2)
2×(-431 kJ)
= - 862 kJ
化学反应的能量变化的本质
化学反应的能量变化的本质
化学反应
本质
——旧化学键的断裂和新化学键的形成
特征
物质变化:
生成新物质——质量守恒
能量变化:
释放能量或吸收能量——能量守恒
吸收能量E吸>释放能量E放 该反应为吸热反应
吸收能量E吸<释放能量E放 该反应为放热反应
化学键的断裂吸热和形成放热是化学反应中能量变化的主要原因。
课堂巩固
1、判断对错
(1)有化学键断裂的,肯定发生了化学反应( )
(2)既有化学键断裂,又有化学键形成的,肯定发生了化学反应( )
(3)在化学键的形成过程中,肯定放出能量( )
(4)化学反应中原子一定发生重新组合( )
(5)化学变化中一定会发生电子转移( )
(6)所有化学反应必然伴随着能量的变化( )
×
×
√
√
×
√
化学反应的能量变化的宏观分析
各种物质都具有能量,物质的组成、结构与状态不同,所具有的能量也不同。放热反应可以看成是反应物所具有的化学能转化为热能释放出来,吸热反应可以看成是热能转化为化学能被生成物所“储存”。
反应物的总能量E反>生成物的总能量E生
反应放出能量,放热反应
反应物的总能量E反<生成物的总能量E生
反应吸收能量,吸热反应
物质键能越大,越稳定;能量越低,越稳定;能量越高,越活泼。
化学反应的能量变化的宏观分析——放热
E反
>
E生
E吸
<
E放
化学反应的能量变化的宏观分析——吸热
E反
<
E生
E吸
>
E放
课堂巩固
1、吸热反应和放热反应的对象都是化学变化,物理变化除外。
2、一个化学反应是吸热还是放热,取决于反应物和生成物具有总能量的相对大小,与反应条件(是否需要加热)无关。
(1)需要加热的反应一定是吸热反应( )
(2)吸热反应一定需要加热才可以进行( )
(3)放热反应不需要加热即可发生( )
(4)放出热量的变化过程一定是放热反应( )
(5)任何反应中的能量变化都表现为热量变化( )
×
×
×
×
×
1、已知反应A + B === C + D的能量变化如图所示,下列关于此反应的说法不正确的是( )
A.是吸热反应
B.该反应不符合能量守恒定律
C.生成物的总能量高于反应物的总能量
D.反应中断开化学键吸收的总能量高于
形成化学键放出的总能量
B
课堂巩固
2、反应A + B → C(放热)分两步进行:① A + B → X(吸热),② X → C(放热)。下列示意图中,能正确表示总反应过程中能量变化的是( )
课堂巩固
D
化学反应中能量变化计算
E吸表示反应物中化学键断裂时吸收的总能量,
E放表示生成物中化学键形成时放出的总能量。
△E = E吸 - E放
△E < 0,放热
△E > 0,吸热
注意: ①1mol物质中化学键的数目
②参加反应的各物质的物质的量;
【例5】已知部分键能如下表所示,计算下列三个反应中的能量变化情况。
(1)CH4 + 2O2 == CO2 + 2H2O,1 mol CH4完全反应时,________(填吸收/放出)________ kJ能量。
(2)已知N2 + 3H2 ==== 2NH3,消耗1 mol N2 时放出92 kJ的热量,则
上表中x的数值为 ________。
(3)如下图为白磷(P4)和P4O6的结构,
1mol 白磷完全燃烧生成P4O6,______(填吸收
/放出)________kJ能量。
放出
946
1638
{93296810-A885-4BE3-A3E7-6D5BEEA58F35}化学键
H—H
H—N
N≡N
O=O
C—H
C=O
H—O
P—P
P—O
键能
(kJ/mol)
436
391
x
498
414
750
465
198
360
708
放出
1.获取热能的途径——物质的燃烧
(1)早期:以树枝杂草为主要能源。
(2)现代:以煤、石油和天然气为主要能源。
2.面临问题
(1)短期内不可再生,储量有限;
(2)煤和石油产品燃烧排放的粉尘、SO2、NOx、CO等造成
大气污染。
人类对能源的利用
3.解决方法
(1)节能减排
(2)开发新能源——太阳能、风能、地热能、海洋能、氢能
人类对能源的利用
一次能源
二次能源
煤、石油、天然气、水能、风能、太阳能、
潮汐能、地热能
电能、氢能、蒸汽、汽油、柴油等
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
