3-2 分子晶体与原子晶体 (2)原子晶体 课件(29张ppt) 2020-2021学年人教版高二化学选修3
文档属性
| 名称 | 3-2 分子晶体与原子晶体 (2)原子晶体 课件(29张ppt) 2020-2021学年人教版高二化学选修3 |

|
|
| 格式 | pptx | ||
| 文件大小 | 3.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-04-12 09:30:11 | ||
图片预览






文档简介
晶体结构与性质
W:2021.4
第三章
11、水分子间存在着氢键的作用,使水分子彼此结合而成(H2O)n。在冰中每个水分子被4个水分子包围形成变形的正四面体,通过“氢键”相互连接成庞大的分子晶体,其结构如图:试分析:
①1mol
冰中有
mol氢键?
②H2O的熔沸点比H2S高还是低?为什么?
③已知氢键也有方向性,试分析为什么冬季河水总是从水面上开始结冰?
2
氢键
由于氢键的方向性,使冰晶体中每个水分子与四面体顶点的4个分子相互吸引,形成空隙较大的网状体,密度比水小,所以结的冰会浮在水面上
w
课堂
练习
学习
目标
1.
掌握原子晶体的概念,能够区分原子晶体和分子晶体
2.了解金刚石等典型原子晶体的结构特征,能描述金刚石、二氧化硅等原子晶体的结构与性质的关系。
重难点:
原子晶体的结构与性质的关系
第二节
分子晶体与原子晶体
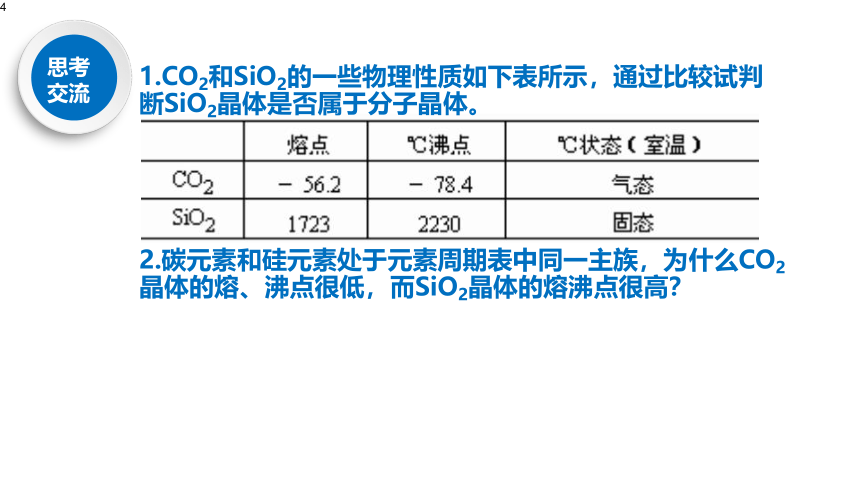
1.CO2和SiO2的一些物理性质如下表所示,通过比较试判断SiO2晶体是否属于分子晶体。
2.碳元素和硅元素处于元素周期表中同一主族,为什么CO2晶体的熔、沸点很低,而SiO2晶体的熔沸点很高?
4
思考交流
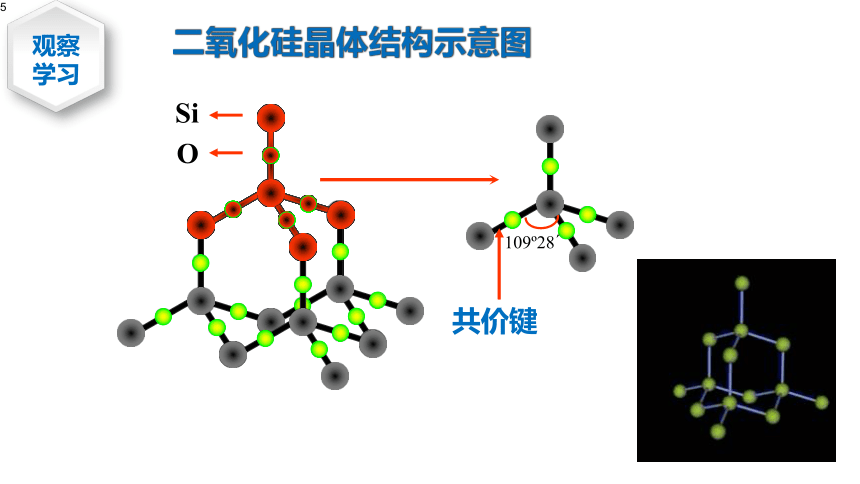
109?28?
Si
O
共价键
二氧化硅晶体结构示意图
5
观察
学习
①1个Si原子和4个O原子形成4个共价键,每个Si原子周围结合4个O原子;同时,每个O原子跟2个Si原子相结合。
6
SiO2的结构特征
在SiO2晶体中
实际上:SiO2晶体是由Si原子和O原子按1:2的比例所组成的立体网状的晶体。
②最小的碳环是由6个Si原子和6个O原子组成的12元环。
③1mol
SiO2中含
4
mol
Si—O键
1、概念
二、原子晶体
所有的相邻原子间都以共价键相结合而形成空间立体网状结构的晶体。
构成粒子:
作用力:
原子
思考:只由原子形成的晶体一定是原子晶体吗?
共价键
整块晶体是一个三维的共价键网状结构,是一个“巨分子”,又称共价晶体
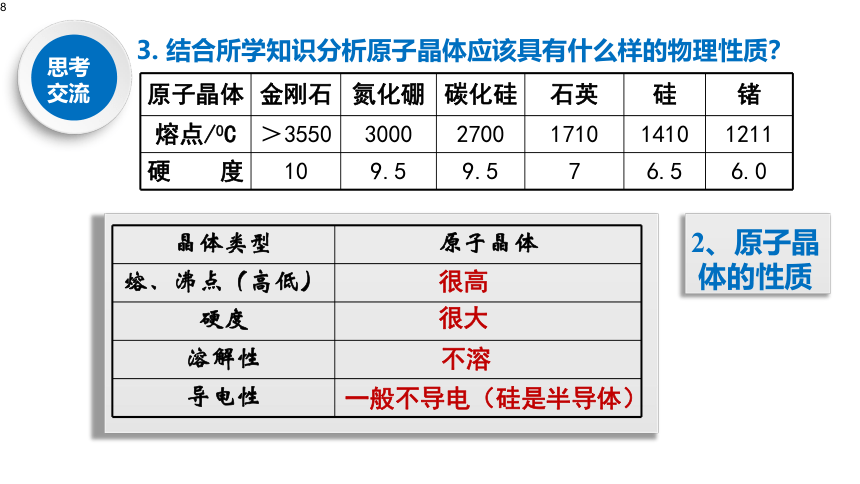
晶体类型
原子晶体
熔、沸点(高低)
硬度
溶解性
导电性
很高
很大
不溶
一般不导电(硅是半导体)
3.
结合所学知识分析原子晶体应该具有什么样的物理性质?
原子晶体
金刚石
氮化硼
碳化硅
石英
硅
锗
熔点/0C
>3550
3000
2700
1710
1410
1211
硬
度
10
9.5
9.5
7
6.5
6.0
2、原子晶体的性质
8
思考交流
5.晶体硅、碳化硅(SiC
)的结构与金刚石相似,比较这三种原子晶体的熔沸点高低?
金刚石>
SiC
>晶体硅
思考交流
4.如何比较原子晶体的熔沸点大小?
原子晶体的熔沸点取决于共价键的键长和键能,
键能越大,键长越短,共价键越强,熔沸点越高。
结构相似的原子晶体,原子半径越小,共价键越强,熔沸点越高
①每个碳原子与周围
个碳原子以
键结合成为
型结构,
向空间伸展,构成彼此联结的立体网状结构。
109?28?
154pm
键能:
347.7kj/mol
熔点:大于35500C
硬度:很大
3、典型的原子晶体
(1)金刚石
③最小碳环上有
个碳原子,每个碳原子被
个环共用,平均每个环有
个碳原子,1mol金刚石中含有的C-C共价键为
。
4
共价
正四面体
sp3
②碳原子采取
杂化,键角为
。
109°28?
6
12
1/2
2mol
金刚石
二氧化硅
Si
O
11
4、常见的原子晶体
(2)二氧化硅
(1)某些非金属单质:
(2)某些非金属化合物:
(3)某些氧化物:
碳化硅(SiC)
氮化硼(BN)
二氧化硅(
SiO2)
Al2O3晶体()
硼(B)硅(Si)锗(Ge)
①每个Si原子与周围
个氧原子形成以
个共价键,
每个O原子结合
个Si原子,晶体中Si原子与O原子的个数比为
。
③最小环上有
个原子,其中包含
个O原子,
个Si原子,1molSiO2中含有的Si-O共价键数目为
。
4
4
2
sp3
②Si原子采取
杂化,O-Si-O键角为
。
109°28?
12
6
6
4NA
1:2
解释:结构相似的原子晶体,原子半径越小,键长越短,键能越大,晶体熔点越高,例如:
金刚石
>
碳化硅
>
晶体硅
6、怎样从原子结构角度理解金刚石、硅和锗的熔点和硬度依次下降?
7、“具有共价键的晶体叫做原子晶体”。这种说法对吗?为什么?
解释:不对,分子晶体中通常也含有共价键,如CO2、O2,某些离子晶体中也含共价键,如NaOH、NH4Cl
12
思考交流
莫氏硬度是表示矿物硬度的一种标准,1824年由德国矿物学家莫斯(Frederich
Mohs)首先提出。确定这一标准的方法是,用棱锥形金刚石钻针刻划所试矿物的表面而产生划痕,用测得的划痕的深度来表示硬度。
资料
莫氏硬度
13
13
观察
学习
石
墨
晶
体
结
构
模
型
14
5、石墨及其结构
(混合型晶体)
如图所示,在石墨晶体的层状结构中,每一个最小的碳环完全拥有碳原子数为
,每个C完全拥有C-C数为
。
石墨中C-C夹角为:
1200
C-C键长:
1.42×10-10
m
层间距:
3.35×
10-10
m
空间层状结构
空间结构俯视图
15
5、石墨及其结构
2
1.5
(混合型晶体)
课堂
练习
一种结晶形碳,有天然出产的矿物。铁黑色至深钢灰色。质软具滑腻感,可沾污手指成灰黑色。有金属光泽。六方晶系,成叶片状、鳞片状和致密块状。密度2.25g/cm3,化学性质不活泼。具有耐腐蚀性,在空气或氧气中强热可以燃烧生成二氧化碳。石墨可用作润滑剂,并用于制造坩锅、电极、铅笔芯等。
知识拓展-石墨
16
16
观察
学习
8、石墨为什么很软?
9、石墨的熔沸点为什么很高(高于金刚石)?
10、石墨属于哪类晶体?为什么?
石墨为层状结构,各层之间是范德华力结合,容易滑动,所以石墨很软。
石墨各层均为平面网状结构,碳原子之间存在很强的共价键(大π键),故熔沸点很高。
石墨为混合键型晶体。
思考交流
科学视野
(1)金刚石
(2)天然金刚石的形成
高温、高压、长时间在地幔中形成的。
(3)金刚石的人工合成
①
高压合成
②低压合成
18
观察
学习
1.金刚石、石墨的比较
项目
金刚石
石墨
晶体形状
晶体中的键或作用力
由最少碳原子形成环的形状与个数
碳原子成键数
每个环上键的平均数
每个环上原子的平均数
正四面体空间网状
六边形平面层状
共价键
共价键与范德华力
6个原子不同面
6个原子同面
4
3
6×1/6=1
6×1/2=3
6×1/12=1/2
6×1/3=2
学习
小结
2.分子晶体与原子晶体的比较
晶体类型
原子晶体
分子晶体
概
念
组成微粒
作用力
熔沸点
硬
度
溶解性
导电性
相邻原子间以共价键相结合而形成空间网状结构
分子间以分子间作用力结合
原子
分子
共价键
分子间作用力
很高
较低
很大
较小
不溶于任何溶剂
部分溶于水
不导电,个别为半导体
固体和熔化状态都不导电,部分溶于水导电
学习
小结
1、下列各组物质的晶体中,化学键的类型相同,晶体的类型也相同的是(
)
A.
SO2和SiO2
B.
CO2和H2O
C.
BN和HCl
D.
CCl4和KCl
B
2、下列物质的晶体直接由原子构成的一组是(
)
①CO2
②SiO2
③晶体Si
④白磷
⑤氨基乙酸
⑥Fe
⑦Na2O
⑧固态He
A.
①②③④⑤⑥⑦⑧
B.
②③④⑥⑧
C.
②③⑧
D.
①②⑤⑦⑧
C
课堂
练习
3、C60、金刚石和石墨的结构模型如下图所示(石墨仅表示出其中的一层)
(1)C60、金刚石和石墨三者互为
;
(2)固态时,C60属于
(填“离子”、“原子”或“分子”);
A、同分异构体
B、同素异形体
C、同系物
D、同位素
(3)硅晶体的结构跟金刚石相似,1mol硅晶体中含有硅硅单键的数目约是
NA个。硅、氧原子形成的最小环上氧原子的数目是
;
(4)石墨层状结构中,平均每个正六边形占有
个碳原子。
B
分子
2
6
2
22
课堂
练习
4、判断下列说法的正误:
ⅰ分子晶体中一定存在范德华力,可能有共价键
ⅱ分子晶体中,共价键键能越大,该分子晶体熔沸点一定越高
ⅲ分子晶体中,分子间作用力越大,该物质越稳定
ⅳ非金属单质都是分子晶体
ⅴ分子晶体比原子晶体(如金刚石)的熔沸点低,是因为分子晶体中只存在分子间作用力而不存在化学键
ⅵ干冰(固态CO2)升华时,分子内共价键会发生断裂
√
×
×
×
×
×
课堂
练习
①与每个C相邻有
个Si,与每个Si相邻有
个C,形成空间网状结构晶体,键角
。
②虚线所示结构单元中,有
个共价键,
个C,
个Si,1molSiC形成
molSi—C;
5、根据SiC的晶体结构回答:
4
4
109°28?
4
1
4
4
课堂
练习
课堂
练习
6、分析下列物质的物理性质,判断其晶体类型:
A、碳化铝,黄色晶体,熔点2200℃,熔融态不导电;________________
B、溴化铝,无色晶体,熔点98
℃,熔融态不导电;________________
C、五氟化钒,无色晶体,熔点19.5℃,易溶于乙醇、氯仿、丙酮中;_______________
D、物质A,无色晶体,熔融时或溶于水中都能导电_____________
原子晶体
分子晶体
分子晶体
离子晶体
课堂
练习
7.关于SiO2晶体的叙述中,正确的是( )
A.通常状况下,60
g
SiO2晶体中含有的分子数为NA(NA表示阿伏加德罗常数)
B.60
g
SiO2晶体中,含有2NA个Si—O键
C.晶体中与同一硅原子相连的4个氧原子处于同一四面体的4个顶点
D.SiO2晶体中含有1个硅原子和2个氧原子
C
试卷原子晶体答案
1-6
ADCCCA
7.(1)原子
熔沸点高,硬度大
(2)
12
60°
8.BD
9.D
10.(1)sp3
极性共价键
SiC>Si
(2)Si原子半径大,p-p轨道肩并肩重叠程度小,不能形成π键
原子
分子
<
(3)
原子
原子
原子
分子
共价键
共价键
共价键
范德华力
1-5
BBADB
6-8
CCD
9.(1)3s23P4
14
(2)
2Al+2H2O+2OH-=2AlO2-+3H2↑
(3)H2S
HCl
(4)SiO2
CO2是分子晶体,SiO2是原子晶体
演示结束.
感谢聆听
2021
W:2021.4
第三章
11、水分子间存在着氢键的作用,使水分子彼此结合而成(H2O)n。在冰中每个水分子被4个水分子包围形成变形的正四面体,通过“氢键”相互连接成庞大的分子晶体,其结构如图:试分析:
①1mol
冰中有
mol氢键?
②H2O的熔沸点比H2S高还是低?为什么?
③已知氢键也有方向性,试分析为什么冬季河水总是从水面上开始结冰?
2
氢键
由于氢键的方向性,使冰晶体中每个水分子与四面体顶点的4个分子相互吸引,形成空隙较大的网状体,密度比水小,所以结的冰会浮在水面上
w
课堂
练习
学习
目标
1.
掌握原子晶体的概念,能够区分原子晶体和分子晶体
2.了解金刚石等典型原子晶体的结构特征,能描述金刚石、二氧化硅等原子晶体的结构与性质的关系。
重难点:
原子晶体的结构与性质的关系
第二节
分子晶体与原子晶体
1.CO2和SiO2的一些物理性质如下表所示,通过比较试判断SiO2晶体是否属于分子晶体。
2.碳元素和硅元素处于元素周期表中同一主族,为什么CO2晶体的熔、沸点很低,而SiO2晶体的熔沸点很高?
4
思考交流
109?28?
Si
O
共价键
二氧化硅晶体结构示意图
5
观察
学习
①1个Si原子和4个O原子形成4个共价键,每个Si原子周围结合4个O原子;同时,每个O原子跟2个Si原子相结合。
6
SiO2的结构特征
在SiO2晶体中
实际上:SiO2晶体是由Si原子和O原子按1:2的比例所组成的立体网状的晶体。
②最小的碳环是由6个Si原子和6个O原子组成的12元环。
③1mol
SiO2中含
4
mol
Si—O键
1、概念
二、原子晶体
所有的相邻原子间都以共价键相结合而形成空间立体网状结构的晶体。
构成粒子:
作用力:
原子
思考:只由原子形成的晶体一定是原子晶体吗?
共价键
整块晶体是一个三维的共价键网状结构,是一个“巨分子”,又称共价晶体
晶体类型
原子晶体
熔、沸点(高低)
硬度
溶解性
导电性
很高
很大
不溶
一般不导电(硅是半导体)
3.
结合所学知识分析原子晶体应该具有什么样的物理性质?
原子晶体
金刚石
氮化硼
碳化硅
石英
硅
锗
熔点/0C
>3550
3000
2700
1710
1410
1211
硬
度
10
9.5
9.5
7
6.5
6.0
2、原子晶体的性质
8
思考交流
5.晶体硅、碳化硅(SiC
)的结构与金刚石相似,比较这三种原子晶体的熔沸点高低?
金刚石>
SiC
>晶体硅
思考交流
4.如何比较原子晶体的熔沸点大小?
原子晶体的熔沸点取决于共价键的键长和键能,
键能越大,键长越短,共价键越强,熔沸点越高。
结构相似的原子晶体,原子半径越小,共价键越强,熔沸点越高
①每个碳原子与周围
个碳原子以
键结合成为
型结构,
向空间伸展,构成彼此联结的立体网状结构。
109?28?
154pm
键能:
347.7kj/mol
熔点:大于35500C
硬度:很大
3、典型的原子晶体
(1)金刚石
③最小碳环上有
个碳原子,每个碳原子被
个环共用,平均每个环有
个碳原子,1mol金刚石中含有的C-C共价键为
。
4
共价
正四面体
sp3
②碳原子采取
杂化,键角为
。
109°28?
6
12
1/2
2mol
金刚石
二氧化硅
Si
O
11
4、常见的原子晶体
(2)二氧化硅
(1)某些非金属单质:
(2)某些非金属化合物:
(3)某些氧化物:
碳化硅(SiC)
氮化硼(BN)
二氧化硅(
SiO2)
Al2O3晶体()
硼(B)硅(Si)锗(Ge)
①每个Si原子与周围
个氧原子形成以
个共价键,
每个O原子结合
个Si原子,晶体中Si原子与O原子的个数比为
。
③最小环上有
个原子,其中包含
个O原子,
个Si原子,1molSiO2中含有的Si-O共价键数目为
。
4
4
2
sp3
②Si原子采取
杂化,O-Si-O键角为
。
109°28?
12
6
6
4NA
1:2
解释:结构相似的原子晶体,原子半径越小,键长越短,键能越大,晶体熔点越高,例如:
金刚石
>
碳化硅
>
晶体硅
6、怎样从原子结构角度理解金刚石、硅和锗的熔点和硬度依次下降?
7、“具有共价键的晶体叫做原子晶体”。这种说法对吗?为什么?
解释:不对,分子晶体中通常也含有共价键,如CO2、O2,某些离子晶体中也含共价键,如NaOH、NH4Cl
12
思考交流
莫氏硬度是表示矿物硬度的一种标准,1824年由德国矿物学家莫斯(Frederich
Mohs)首先提出。确定这一标准的方法是,用棱锥形金刚石钻针刻划所试矿物的表面而产生划痕,用测得的划痕的深度来表示硬度。
资料
莫氏硬度
13
13
观察
学习
石
墨
晶
体
结
构
模
型
14
5、石墨及其结构
(混合型晶体)
如图所示,在石墨晶体的层状结构中,每一个最小的碳环完全拥有碳原子数为
,每个C完全拥有C-C数为
。
石墨中C-C夹角为:
1200
C-C键长:
1.42×10-10
m
层间距:
3.35×
10-10
m
空间层状结构
空间结构俯视图
15
5、石墨及其结构
2
1.5
(混合型晶体)
课堂
练习
一种结晶形碳,有天然出产的矿物。铁黑色至深钢灰色。质软具滑腻感,可沾污手指成灰黑色。有金属光泽。六方晶系,成叶片状、鳞片状和致密块状。密度2.25g/cm3,化学性质不活泼。具有耐腐蚀性,在空气或氧气中强热可以燃烧生成二氧化碳。石墨可用作润滑剂,并用于制造坩锅、电极、铅笔芯等。
知识拓展-石墨
16
16
观察
学习
8、石墨为什么很软?
9、石墨的熔沸点为什么很高(高于金刚石)?
10、石墨属于哪类晶体?为什么?
石墨为层状结构,各层之间是范德华力结合,容易滑动,所以石墨很软。
石墨各层均为平面网状结构,碳原子之间存在很强的共价键(大π键),故熔沸点很高。
石墨为混合键型晶体。
思考交流
科学视野
(1)金刚石
(2)天然金刚石的形成
高温、高压、长时间在地幔中形成的。
(3)金刚石的人工合成
①
高压合成
②低压合成
18
观察
学习
1.金刚石、石墨的比较
项目
金刚石
石墨
晶体形状
晶体中的键或作用力
由最少碳原子形成环的形状与个数
碳原子成键数
每个环上键的平均数
每个环上原子的平均数
正四面体空间网状
六边形平面层状
共价键
共价键与范德华力
6个原子不同面
6个原子同面
4
3
6×1/6=1
6×1/2=3
6×1/12=1/2
6×1/3=2
学习
小结
2.分子晶体与原子晶体的比较
晶体类型
原子晶体
分子晶体
概
念
组成微粒
作用力
熔沸点
硬
度
溶解性
导电性
相邻原子间以共价键相结合而形成空间网状结构
分子间以分子间作用力结合
原子
分子
共价键
分子间作用力
很高
较低
很大
较小
不溶于任何溶剂
部分溶于水
不导电,个别为半导体
固体和熔化状态都不导电,部分溶于水导电
学习
小结
1、下列各组物质的晶体中,化学键的类型相同,晶体的类型也相同的是(
)
A.
SO2和SiO2
B.
CO2和H2O
C.
BN和HCl
D.
CCl4和KCl
B
2、下列物质的晶体直接由原子构成的一组是(
)
①CO2
②SiO2
③晶体Si
④白磷
⑤氨基乙酸
⑥Fe
⑦Na2O
⑧固态He
A.
①②③④⑤⑥⑦⑧
B.
②③④⑥⑧
C.
②③⑧
D.
①②⑤⑦⑧
C
课堂
练习
3、C60、金刚石和石墨的结构模型如下图所示(石墨仅表示出其中的一层)
(1)C60、金刚石和石墨三者互为
;
(2)固态时,C60属于
(填“离子”、“原子”或“分子”);
A、同分异构体
B、同素异形体
C、同系物
D、同位素
(3)硅晶体的结构跟金刚石相似,1mol硅晶体中含有硅硅单键的数目约是
NA个。硅、氧原子形成的最小环上氧原子的数目是
;
(4)石墨层状结构中,平均每个正六边形占有
个碳原子。
B
分子
2
6
2
22
课堂
练习
4、判断下列说法的正误:
ⅰ分子晶体中一定存在范德华力,可能有共价键
ⅱ分子晶体中,共价键键能越大,该分子晶体熔沸点一定越高
ⅲ分子晶体中,分子间作用力越大,该物质越稳定
ⅳ非金属单质都是分子晶体
ⅴ分子晶体比原子晶体(如金刚石)的熔沸点低,是因为分子晶体中只存在分子间作用力而不存在化学键
ⅵ干冰(固态CO2)升华时,分子内共价键会发生断裂
√
×
×
×
×
×
课堂
练习
①与每个C相邻有
个Si,与每个Si相邻有
个C,形成空间网状结构晶体,键角
。
②虚线所示结构单元中,有
个共价键,
个C,
个Si,1molSiC形成
molSi—C;
5、根据SiC的晶体结构回答:
4
4
109°28?
4
1
4
4
课堂
练习
课堂
练习
6、分析下列物质的物理性质,判断其晶体类型:
A、碳化铝,黄色晶体,熔点2200℃,熔融态不导电;________________
B、溴化铝,无色晶体,熔点98
℃,熔融态不导电;________________
C、五氟化钒,无色晶体,熔点19.5℃,易溶于乙醇、氯仿、丙酮中;_______________
D、物质A,无色晶体,熔融时或溶于水中都能导电_____________
原子晶体
分子晶体
分子晶体
离子晶体
课堂
练习
7.关于SiO2晶体的叙述中,正确的是( )
A.通常状况下,60
g
SiO2晶体中含有的分子数为NA(NA表示阿伏加德罗常数)
B.60
g
SiO2晶体中,含有2NA个Si—O键
C.晶体中与同一硅原子相连的4个氧原子处于同一四面体的4个顶点
D.SiO2晶体中含有1个硅原子和2个氧原子
C
试卷原子晶体答案
1-6
ADCCCA
7.(1)原子
熔沸点高,硬度大
(2)
12
60°
8.BD
9.D
10.(1)sp3
极性共价键
SiC>Si
(2)Si原子半径大,p-p轨道肩并肩重叠程度小,不能形成π键
原子
分子
<
(3)
原子
原子
原子
分子
共价键
共价键
共价键
范德华力
1-5
BBADB
6-8
CCD
9.(1)3s23P4
14
(2)
2Al+2H2O+2OH-=2AlO2-+3H2↑
(3)H2S
HCl
(4)SiO2
CO2是分子晶体,SiO2是原子晶体
演示结束.
感谢聆听
2021
