3-4 离子晶体(2)晶格能 课件(17张ppt) 2020-2021学年人教版高二化学选修3
文档属性
| 名称 | 3-4 离子晶体(2)晶格能 课件(17张ppt) 2020-2021学年人教版高二化学选修3 |

|
|
| 格式 | pptx | ||
| 文件大小 | 2.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-04-12 00:00:00 | ||
图片预览




文档简介
晶体结构与性质
W:2021.4
第三章
学习
目标
重难点:
理解离子晶体的晶格能与性质的关系;
第四节 离子晶体
1.理解离子晶体的晶格能与性质的关系
知识
回顾
1、什么是离子晶体?
2、常见的离子晶体有那些?
3、决定离子晶体结构的因素有那些?
思考探究
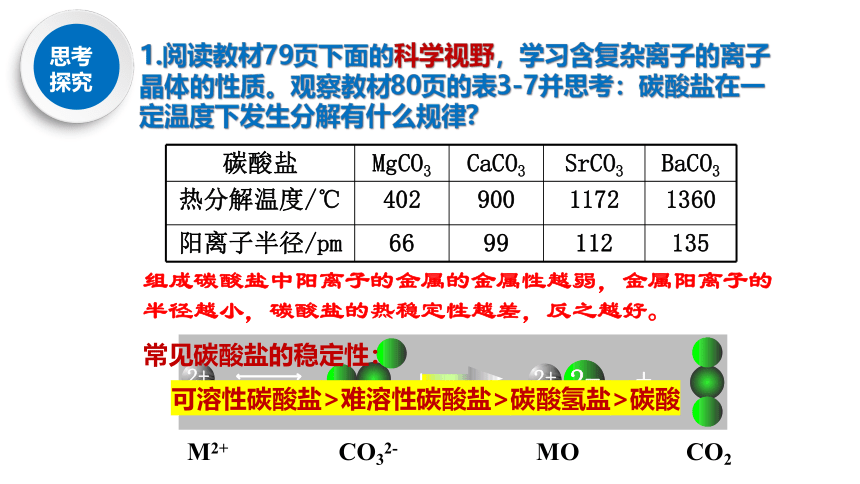
1.阅读教材79页下面的科学视野,学习含复杂离子的离子晶体的性质。观察教材80页的表3-7并思考:碳酸盐在一定温度下发生分解有什么规律?
碳酸盐
MgCO3
CaCO3
SrCO3
BaCO3
热分解温度/℃
402
900
1172
1360
阳离子半径/pm
66
99
112
135
组成碳酸盐中阳离子的金属的金属性越弱,金属阳离子的半径越小,碳酸盐的热稳定性越差,反之越好。
M2+ CO32- MO CO2
常见碳酸盐的稳定性:
可溶性碳酸盐>难溶性碳酸盐>碳酸氢盐>碳酸
对于组成和结构相似的物质,阴、阳离子半径越小,所带电荷数越多,离子键越强,熔沸点越高,晶体越稳定。
离子键的强弱在一定程度上可以用离子晶体的晶格能来衡量。
思考探究
2.如何判断离子晶体的稳定性和熔沸点高低?
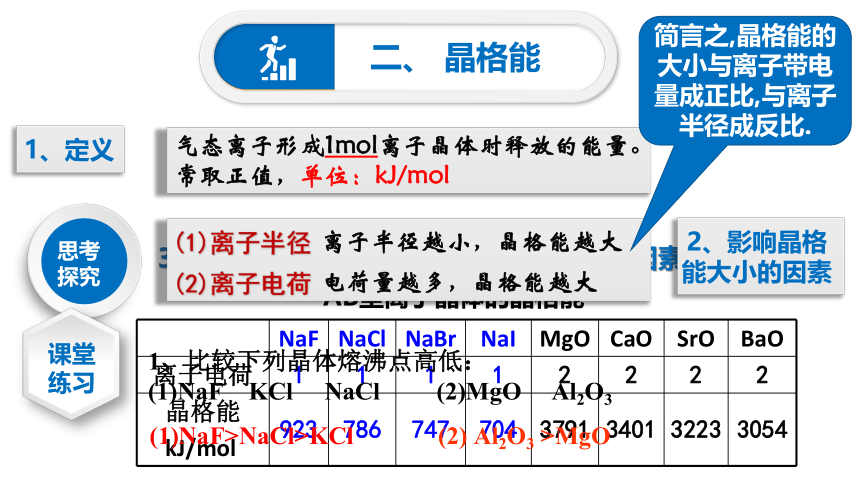
1、定义
气态离子形成1mol离子晶体时释放的能量。
常取正值,单位:kJ/mol
二、 晶格能
思考探究
3.根据下列表格数据讨论影响晶格能大小的因素有哪些?
NaF
NaCl
NaBr
NaI
MgO
CaO
SrO
BaO
离子电荷
1
1
1
1
2
2
2
2
晶格能
kJ/mol
923
786
747
704
3791
3401
3223
3054
AB型离子晶体的晶格能
2、影响晶格能大小的因素
(1)离子半径
(2)离子电荷
离子半径越小,晶格能越大
电荷量越多,晶格能越大
课堂
练习
1、比较下列晶体熔沸点高低:
(1)NaF KCl NaCl (2)MgO Al2O3
(1)NaF>NaCl>KCl
(2) Al2O3 >MgO
简言之,晶格能的大小与离子带电量成正比,与离子半径成反比.
思考探究
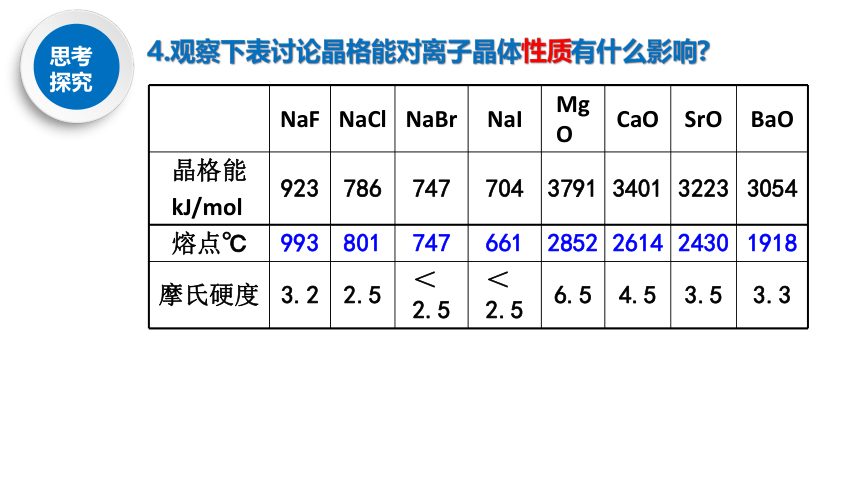
4.观察下表讨论晶格能对离子晶体性质有什么影响?
NaF
NaCl
NaBr
NaI
MgO
CaO
SrO
BaO
晶格能
kJ/mol
923
786
747
704
3791
3401
3223
3054
熔点℃
993
801
747
661
2852
2614
2430
1918
摩氏硬度
3.2
2.5
<2.5
<2.5
6.5
4.5
3.5
3.3
3、晶格能的应用
晶格能越大,离子晶体越稳定,熔点越高,硬度越大。
(1)对晶体性质的影响:
思考探究
5.阅读教材81下面的科学视野,学习岩浆晶出规则与晶格能并思考:岩浆晶出次序与晶格能大小有什么关系?
晶格能高的晶体熔点较高,更容易在岩浆冷却过程中冷却下来,从而先结晶。
(2)岩浆晶出规则与晶格能大小的关系:
课堂
练习
C
2、下列物质固态时熔点的比较正确的是( )
A.F2>Cl2>Br2
B. NaBr>NaCl>NaF
C.金刚石>金刚砂>硅
D.Na>Mg>Al
三、 晶体熔沸点高低的比较方法
1、常温下的状态
固体>液体>气体
熔沸点:
原子晶体>离子晶体>分子晶体
一般情况下:
2、不同类型晶体
3、同种类型晶体
根据共价键强弱比较
(1)原子晶体:
结构相似时,原子半径越小,键长越小、键能越大,熔沸点越高
例如:刚才例子中的C.金刚石>金刚砂>硅正确的顺序应该是?
3、同种类型晶体
根据金属键强弱比较
(2)金属晶体:
离子半径越小,离子电荷越高,金属键就越强,熔沸点就越高。
注意:合金的熔沸点低于其成分金属
根据离子键强弱比较
(3)离子晶体:
结构相似时,离子半径越小,离子电荷越高,离子键就越强,熔沸点就越高。
根据分子间作用力强弱比较
(4)分子晶体:
①先看有无氢键:有氢键的分子间作用力强,熔沸点高
②组成和结构相似,相对分子质量越大,范德华力越强,熔沸点越高。
③相对分子质量相同或相近看分子极性越大,范德华力越强,熔沸点越高。
思考:对羟基苯甲醛熔沸点高于邻羟基苯甲醛的原因?
例如:有机物同系物熔沸点的变化规律
四种晶体的结构性质比较
晶体结构
离子晶体
分子晶体
原子晶体
金属晶体
结构
构成微粒
作用力
性质
硬度
熔沸点
导电性
延展性
溶解性
实例
存在范围
阴阳离子
分子
原子
阳离子、电子
离子键
分子间作用
共价键
金属键
较大、脆
小
很大
差异大
较高
低
很高
差异大
熔融、溶液导电
固态、熔融态不导电,
有些在水溶液中导电.
不或半导
导电
差
差
差
好
溶水、不溶有机
相似相溶
不溶
不溶
NaCl
干冰
金刚石
Na
离子化合物
多数共价化合物
多数非金属单质
某些非金属单质
某些共价化合物
金属、合金
课堂
小结
3、泽维尔研究发现,当激光脉冲照射NaI时,Na+和I-两核间距为1~1.5nm,呈现离子键;当两核靠近相距为0.28nm时,呈现共价键.根据泽维尔的研究成果,能得到的结论是( )
A.离子晶体可能含有共价键
B.共价键和离子键没有明显的界限
C.NaI晶体中既有离子键,又有共价键
D.NaI晶体是离子化合物和共价化合物的混合物
课堂
练习
B
课堂
练习
4、溴化钠、氯化钠和氧化镁的核间距和晶格能(部分)如下表所示。
{5940675A-B579-460E-94D1-54222C63F5DA}
NaBr
NaCl
MgO
离子的核间距/pm
290
276
205
晶格能/kJ?mol-1
787
3890
(1)溴化钠晶体的晶格能比氯化钠晶体的晶格能 (填“大”或“小”),主要原因是 。
(2)氧化镁晶体的晶格能比氯化钠晶体的晶格能大,主要原因是 。
(3)溴化钠、氯化钠和氧化镁晶体中,硬度最大的是 。
工业制取单质镁时,往往电解的是氯化镁而不是氧化镁,主要原因是 。
小
NaBr比NaCl中离子的核间距大
MgO中阴阳离子所带电荷数大,并且离子核间距小
氧化镁
MgO晶体比MgCl2晶体晶格能大,熔沸点高,电解时消耗的电能大
5、参照下表中物质的熔点,回答有关问题:
物质
NaF
NaCl
NaBr
NaI
NaCl
KCl
RbCl
CsCl
熔点℃
995
801
755
651
801
776
715
646
物质
SiF4
SiCl4
SiBr4
SiI4
SiCl4
GeCl4
SnCl4
PbCl4
熔点℃
-90.2
-70.4
5.2
12.05
-70.4
-49.5
-36.2
-15.0
① 钠的卤化物及碱金属的氯化物的熔点高低取决于其______,在这种情况下,_____越大,_______越弱,故熔点依次降低。
② 硅的卤化物及硅、锗、锡、铅的氯化物的熔点高低取决于其 , 越大, 越大,故熔点依次升高。
③ 钠的卤化物的熔点比相应硅的卤化物的熔点高得多,这是由______________。
课堂
练习
半径
半径
离子键
相对分子质量
相对分子质量
分子间作用力
钠的卤化物为离子晶体,硅的卤化物为分子晶体
6、如图所示是某些晶体的结构,它们分别是NaCl、CsCl、干冰、金刚石、石墨结构中的某一部分。
⑴ 其中代表金刚石的是(填编号字母,下同)_____,其中每个碳原子与____个碳原子最接近且距离相等。金刚石属于____晶体。
⑵ 其中代表石墨的是_______,其中每个正六边形占有的碳原子数平均为______个。
⑶ 其中代表NaCl的是______,距每个Na+等距离且最近的Na+有 个
⑷ 代表CsCl的是___,它属于___晶体,每个Cs+与__个Cl—紧邻。
⑸ 代表干冰的是_________,它属于______晶体,每个CO2分子与______个CO2分子紧邻。
⑹ 上述五种物质熔点由高到低的顺序______________________。
课堂
练习
D
4
原子
E
2
A
12
C
离子
8
B
分子
12
石墨>金刚石>NaCl>CsCl>干冰
演示结束. 感谢聆听
2021
W:2021.4
第三章
学习
目标
重难点:
理解离子晶体的晶格能与性质的关系;
第四节 离子晶体
1.理解离子晶体的晶格能与性质的关系
知识
回顾
1、什么是离子晶体?
2、常见的离子晶体有那些?
3、决定离子晶体结构的因素有那些?
思考探究
1.阅读教材79页下面的科学视野,学习含复杂离子的离子晶体的性质。观察教材80页的表3-7并思考:碳酸盐在一定温度下发生分解有什么规律?
碳酸盐
MgCO3
CaCO3
SrCO3
BaCO3
热分解温度/℃
402
900
1172
1360
阳离子半径/pm
66
99
112
135
组成碳酸盐中阳离子的金属的金属性越弱,金属阳离子的半径越小,碳酸盐的热稳定性越差,反之越好。
M2+ CO32- MO CO2
常见碳酸盐的稳定性:
可溶性碳酸盐>难溶性碳酸盐>碳酸氢盐>碳酸
对于组成和结构相似的物质,阴、阳离子半径越小,所带电荷数越多,离子键越强,熔沸点越高,晶体越稳定。
离子键的强弱在一定程度上可以用离子晶体的晶格能来衡量。
思考探究
2.如何判断离子晶体的稳定性和熔沸点高低?
1、定义
气态离子形成1mol离子晶体时释放的能量。
常取正值,单位:kJ/mol
二、 晶格能
思考探究
3.根据下列表格数据讨论影响晶格能大小的因素有哪些?
NaF
NaCl
NaBr
NaI
MgO
CaO
SrO
BaO
离子电荷
1
1
1
1
2
2
2
2
晶格能
kJ/mol
923
786
747
704
3791
3401
3223
3054
AB型离子晶体的晶格能
2、影响晶格能大小的因素
(1)离子半径
(2)离子电荷
离子半径越小,晶格能越大
电荷量越多,晶格能越大
课堂
练习
1、比较下列晶体熔沸点高低:
(1)NaF KCl NaCl (2)MgO Al2O3
(1)NaF>NaCl>KCl
(2) Al2O3 >MgO
简言之,晶格能的大小与离子带电量成正比,与离子半径成反比.
思考探究
4.观察下表讨论晶格能对离子晶体性质有什么影响?
NaF
NaCl
NaBr
NaI
MgO
CaO
SrO
BaO
晶格能
kJ/mol
923
786
747
704
3791
3401
3223
3054
熔点℃
993
801
747
661
2852
2614
2430
1918
摩氏硬度
3.2
2.5
<2.5
<2.5
6.5
4.5
3.5
3.3
3、晶格能的应用
晶格能越大,离子晶体越稳定,熔点越高,硬度越大。
(1)对晶体性质的影响:
思考探究
5.阅读教材81下面的科学视野,学习岩浆晶出规则与晶格能并思考:岩浆晶出次序与晶格能大小有什么关系?
晶格能高的晶体熔点较高,更容易在岩浆冷却过程中冷却下来,从而先结晶。
(2)岩浆晶出规则与晶格能大小的关系:
课堂
练习
C
2、下列物质固态时熔点的比较正确的是( )
A.F2>Cl2>Br2
B. NaBr>NaCl>NaF
C.金刚石>金刚砂>硅
D.Na>Mg>Al
三、 晶体熔沸点高低的比较方法
1、常温下的状态
固体>液体>气体
熔沸点:
原子晶体>离子晶体>分子晶体
一般情况下:
2、不同类型晶体
3、同种类型晶体
根据共价键强弱比较
(1)原子晶体:
结构相似时,原子半径越小,键长越小、键能越大,熔沸点越高
例如:刚才例子中的C.金刚石>金刚砂>硅正确的顺序应该是?
3、同种类型晶体
根据金属键强弱比较
(2)金属晶体:
离子半径越小,离子电荷越高,金属键就越强,熔沸点就越高。
注意:合金的熔沸点低于其成分金属
根据离子键强弱比较
(3)离子晶体:
结构相似时,离子半径越小,离子电荷越高,离子键就越强,熔沸点就越高。
根据分子间作用力强弱比较
(4)分子晶体:
①先看有无氢键:有氢键的分子间作用力强,熔沸点高
②组成和结构相似,相对分子质量越大,范德华力越强,熔沸点越高。
③相对分子质量相同或相近看分子极性越大,范德华力越强,熔沸点越高。
思考:对羟基苯甲醛熔沸点高于邻羟基苯甲醛的原因?
例如:有机物同系物熔沸点的变化规律
四种晶体的结构性质比较
晶体结构
离子晶体
分子晶体
原子晶体
金属晶体
结构
构成微粒
作用力
性质
硬度
熔沸点
导电性
延展性
溶解性
实例
存在范围
阴阳离子
分子
原子
阳离子、电子
离子键
分子间作用
共价键
金属键
较大、脆
小
很大
差异大
较高
低
很高
差异大
熔融、溶液导电
固态、熔融态不导电,
有些在水溶液中导电.
不或半导
导电
差
差
差
好
溶水、不溶有机
相似相溶
不溶
不溶
NaCl
干冰
金刚石
Na
离子化合物
多数共价化合物
多数非金属单质
某些非金属单质
某些共价化合物
金属、合金
课堂
小结
3、泽维尔研究发现,当激光脉冲照射NaI时,Na+和I-两核间距为1~1.5nm,呈现离子键;当两核靠近相距为0.28nm时,呈现共价键.根据泽维尔的研究成果,能得到的结论是( )
A.离子晶体可能含有共价键
B.共价键和离子键没有明显的界限
C.NaI晶体中既有离子键,又有共价键
D.NaI晶体是离子化合物和共价化合物的混合物
课堂
练习
B
课堂
练习
4、溴化钠、氯化钠和氧化镁的核间距和晶格能(部分)如下表所示。
{5940675A-B579-460E-94D1-54222C63F5DA}
NaBr
NaCl
MgO
离子的核间距/pm
290
276
205
晶格能/kJ?mol-1
787
3890
(1)溴化钠晶体的晶格能比氯化钠晶体的晶格能 (填“大”或“小”),主要原因是 。
(2)氧化镁晶体的晶格能比氯化钠晶体的晶格能大,主要原因是 。
(3)溴化钠、氯化钠和氧化镁晶体中,硬度最大的是 。
工业制取单质镁时,往往电解的是氯化镁而不是氧化镁,主要原因是 。
小
NaBr比NaCl中离子的核间距大
MgO中阴阳离子所带电荷数大,并且离子核间距小
氧化镁
MgO晶体比MgCl2晶体晶格能大,熔沸点高,电解时消耗的电能大
5、参照下表中物质的熔点,回答有关问题:
物质
NaF
NaCl
NaBr
NaI
NaCl
KCl
RbCl
CsCl
熔点℃
995
801
755
651
801
776
715
646
物质
SiF4
SiCl4
SiBr4
SiI4
SiCl4
GeCl4
SnCl4
PbCl4
熔点℃
-90.2
-70.4
5.2
12.05
-70.4
-49.5
-36.2
-15.0
① 钠的卤化物及碱金属的氯化物的熔点高低取决于其______,在这种情况下,_____越大,_______越弱,故熔点依次降低。
② 硅的卤化物及硅、锗、锡、铅的氯化物的熔点高低取决于其 , 越大, 越大,故熔点依次升高。
③ 钠的卤化物的熔点比相应硅的卤化物的熔点高得多,这是由______________。
课堂
练习
半径
半径
离子键
相对分子质量
相对分子质量
分子间作用力
钠的卤化物为离子晶体,硅的卤化物为分子晶体
6、如图所示是某些晶体的结构,它们分别是NaCl、CsCl、干冰、金刚石、石墨结构中的某一部分。
⑴ 其中代表金刚石的是(填编号字母,下同)_____,其中每个碳原子与____个碳原子最接近且距离相等。金刚石属于____晶体。
⑵ 其中代表石墨的是_______,其中每个正六边形占有的碳原子数平均为______个。
⑶ 其中代表NaCl的是______,距每个Na+等距离且最近的Na+有 个
⑷ 代表CsCl的是___,它属于___晶体,每个Cs+与__个Cl—紧邻。
⑸ 代表干冰的是_________,它属于______晶体,每个CO2分子与______个CO2分子紧邻。
⑹ 上述五种物质熔点由高到低的顺序______________________。
课堂
练习
D
4
原子
E
2
A
12
C
离子
8
B
分子
12
石墨>金刚石>NaCl>CsCl>干冰
演示结束. 感谢聆听
2021
