2020-2021学年人教版(五四学制)化学九年级全册 第三单元 酸和碱复习 课件(29张PPT)
文档属性
| 名称 | 2020-2021学年人教版(五四学制)化学九年级全册 第三单元 酸和碱复习 课件(29张PPT) |

|
|
| 格式 | ppt | ||
| 文件大小 | 1.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(五四学制) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-04-11 10:24:04 | ||
图片预览








文档简介
(共29张PPT)
3、掌握酸的通性、碱的通性及酸碱中和反应、PH。
1、掌握盐酸、硫酸的物理性质和化学性质。
2、掌握氢氧化钠、氢氧化钙物理性质和化学性质。
1、什么叫酸?
由氢离子和酸根离子构成的化合物叫酸.
2、什么叫碱?
由金属离子和氢氧根离子构成的化合物叫碱。
如:
硫酸
盐酸
硝酸
碳酸
醋酸
如:
氢氧化钠
氢氧化钙
氢氧化钾
氨水
H2SO4
HCl
HNO3
H2CO3
CH3COOH
NaOH
Ca(OH)2
KOH
NH3.H2O
思考
盐酸
硫酸
颜色、状态
打开瓶盖后的现象
气味
特性
一、常见的酸和碱
(一)盐酸和硫酸
无色液体
无色粘稠油状液体
瓶口出现白雾
无现象
有刺激性气味
无味
挥发性(浓)
吸水性(浓)
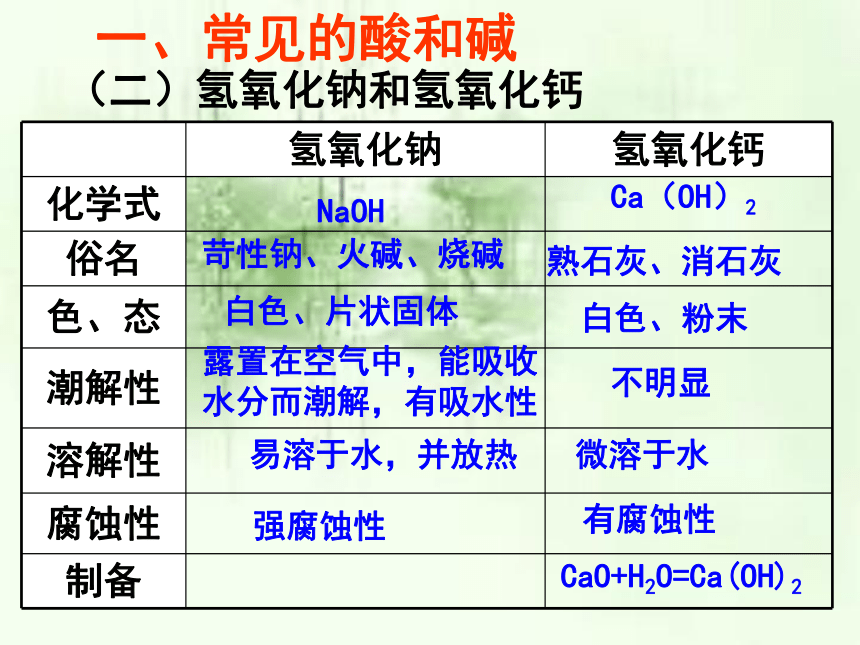
氢氧化钠
氢氧化钙
化学式
俗名
色、态
潮解性
溶解性
腐蚀性
制备
NaOH
Ca(OH)2
苛性钠、火碱、烧碱
熟石灰、消石灰
白色、片状固体
白色、粉末
露置在空气中,能吸收水分而潮解,有吸水性
不明显
易溶于水,并放热
微溶于水
强腐蚀性
有腐蚀性
CaO+H2O=Ca(OH)2
一、常见的酸和碱
(二)氢氧化钠和氢氧化钙
二、酸和碱的化学性质
1、酸和碱都能与酸碱指示剂反应,使指示剂显示不同的颜色。
遇酸溶液
遇碱溶液
石蕊溶液
酚酞溶液
红
红
蓝
无
二、酸和碱的化学性质
2、酸能与多种活泼金属反应,
生成盐和氢气。
与稀盐酸反应
的化学方程式
与稀硫酸反应
的化学方程式
Mg
Mg+2HCl=MgCl2+H2↑
Mg+H2SO4=MgSO4+H2↑
Zn
Zn+2HCl=ZnCl2+H2↑
Zn+H2SO4=ZnSO4+H2↑
Fe
Fe+2HCl=FeCl2+H2↑
Fe+H2SO4=FeSO4+H2↑
二、酸和碱的化学性质
3、酸能与某些金属氧化物反应,生成盐和水。
化学方程式
稀盐酸与铁锈
稀硫酸与铁锈
稀盐酸与氧化铜
Fe2O3+6HCl=2FeCl3+3H2O
Fe2O3+3H2SO4=Fe2(SO4)3+3H2O
CuO+2HCl=CuCl2+H2O
二、酸和碱的化学性质
4、酸能与碱发生中和反应,生成盐和水。
化学方程式
盐酸与氢氧化钠
硫酸与氢氧化钙
盐酸与氢氧化铝
HCl+NaOH=NaCl+H2O
H2SO4+Ca(OH)2=CaCl2+2H2O
3HCl+Al(OH)3=AlCl3+3H2O
二、酸和碱的化学性质
5、酸能与某些盐发生复分
解反应,生成新盐和新酸。
化学方程式
盐酸与
碳酸钠
盐酸与
硝酸银
硫酸与
氯化钡
Na2CO3
+
2HCl
=
2NaCl
+
H2O
+
CO2↑
AgNO3+
HCl
=
AgCl↓+HNO3
BaCl2+
H2SO4
=
BaSO4↓
+
2HCl
二、酸和碱的化学性质
6、碱能与某些非金属氧化物反应,生成盐和水。
化学方程式
火碱与二氧化碳
消石灰与二氧化碳
烧碱与三氧化硫
Ca(OH)2+CO2=CaCO3↓+H2O
2NaOH+SO2=Na2SO3+H2O
2NaOH+CO2=Na2CO3+H2O
二、酸和碱的化学性质
7、碱能与某些非金属氧化物
反应,生成新盐和新碱。
化学方程式
火碱与
氯化铁
消石灰与
碳酸钠
烧碱与
氯化镁
3NaOH
+
FeCl3
=
Fe(OH)3↓
+
3NaCl
Na2CO3
+
Ca(OH)2
=
CaCO3↓+2NaOH
2NaOH+MgCl2=2NaCl+Mg(OH)2↓
1.能使指示剂变色
2.酸+金属=盐+氢气
3.酸+金属氧化物=盐+水
4.酸+碱=盐+水(中和反应)
5.酸+盐=新酸+新盐
酸能使石蕊变红,
不能使酚酞变色
.
条件:(1)金属指排在H
前面的活泼金属
Zn+H2SO4=ZnSO4+H2↑
Fe
+H2SO4=FeSO4+H2↑
CuO+H2SO4=CuSO4+H2O
Fe2O3+6HCl=2FeCl3+3H2O
NaOH+HCl=NaCl+H2O
Cu(OH)2+H2SO4=CuSO4+2H2O
总结:酸的通性
Na2CO3
+
2HCl
=
2NaCl
+
H2O
+
CO2↑
AgNO3+
HCl
=
AgCl↓+HNO3
BaCl2+
H2SO4
=
BaSO4↓
+
2HCl
1.能使指示剂变色
2.碱+非金属氧化物=盐+水
3.碱+酸=盐+水(中和反应)
4.碱+盐=新碱+新盐(反应物都溶于水)
CO2+Ca(OH)2=CaCO
3↓
+H2O
CO2+2NaOH=Na2CO3+H2O
SO2
+2NaOH=Na2SO3+H2O
使紫色的石蕊试液变(
)色,使无色的酚酞试变(
)色
NaOH+HCl=NaCl+H2O
Cu(OH)2+H2SO4=CuSO4+2H2O
总结:碱的通性
蓝
红
3NaOH
+
FeCl3
=
Fe(OH)3↓
+
3NaCl
Na2CO3
+
Ca(OH)2
=
CaCO3
↓+2NaOH
HCl
+
NaOH
NaCl+H2O
HCl
+
Ca(OH)
2
H2SO4+
NaOH
CaCl2+2H2O
Na2SO4+2H2O
2
2
酸
+
碱=
盐
+
水
1、概念:
2、实质:是酸中的氢离子和碱中的氢氧根离子结合生成水分子的过程.
三、中和反应
好难受!
浓硫酸泄漏
在干嘛?
这馒头咋酸的?
怎么办?
3、中和反应的运用
四、pH应用
碱性增强
酸性增强
0
1
2
3
4
5
6
7
8
9
10
11
12
13
14
1、
pH的范围是0-14
2、
酸性溶液的pH<7;
中性溶液的pH=7;
碱性溶液的pH>7。
溶液的酸碱度可以用
表示,范围通常为
。用
可以测定溶液的酸碱度。
使用pH试纸测定酸碱度的正确
操作
pH
0-14
pH试纸
用玻璃棒蘸取溶液滴到pH试纸上,把试纸显示的颜色与标准比色卡比较,读出pH值。
小勇在化学晚会上观看了“瓶吞鸡蛋”的魔术(如下图),感到很神奇,注射器里到底装的什么液体呢?你能告诉他其中的奥妙吗?
再请思考:吞到瓶口的蛋,还能不能再吐出来呢?
1、下列物质露置在空气中质量增加的是(
)
A浓盐酸
B浓硫酸
C稀硫酸
D食盐水
回顾训练
B
2、向某一无色溶液中滴入无色酚酞,溶液呈红色,若向该无色溶液中滴入紫色石蕊试液,溶液显示的颜色__________。
蓝色
3、下列有关浓硫酸的稀释正确的是(
)
C
A
B
C
D
回顾训练
4、通过初三化学的学习,我们认识了“酸”和“碱”,请回答下列问题:
回顾训练
(1)酸和碱能发生中和反应,它在日常生活和工农业生产中有广泛的应用,如硫酸厂的污水中含有硫酸等杂质,可用________进行处理。
(2)2月20日盐城标新化工厂水污染事件后,为了人民群众的饮水安全,卫生防疫部门要经常对水源进行监测,获得可靠的科学依据。若现有一瓶水样,要获取它的酸碱度,应如何操作:________________
。
(3)硝酸铵(NH4NO3)是一种含氮量较高的氮肥,施用该类肥料时,要避免与______
(填“酸”或“碱”)性物质混用,否则会减低肥效。
(4)常见的酸有硫酸、盐酸等,在它们的水溶液里由于存在相同的____(填符号)离子,它们有很多相似的化学性质,如_______……等。
(5)常见的碱有氢氧化钠、氢氧化钙等,在它们的水溶液里由于存在相同的________(填符号)离子,它们有很多相似的化学性质。不能用氢氧化钠固体干燥的气体是________
。
思考:什么情况下才会出现A、B、C、D各图中PH变化?
(1)向稀硫酸中逐滴加入稀氢氧化钠溶液(
)
(2)向氢氧化钠溶液中逐滴加水稀释(
)
(3)向水中不断通入二氧化碳(
)
(4)向水中加生石灰(
)
学校化学兴趣小组的同学,取一定质量的氢氧化钠溶液与稀盐酸反应,不知二者是否恰好完全中和。
例1
典例分析
提出问题:溶液中的溶质可能是什么?
你的猜想是___________________
某实验员发现实验室有三瓶失去标签的无色溶液,可能是氯化钠溶液、稀盐酸、石灰水中的一种,请帮助实验员将其鉴别出来。你的方法是……
例2
典例解析
取废液40mL于烧杯中,逐滴滴入Na2CO3溶液充分搅拌,至过量。记录滴入Na2CO3溶液质量(x)与有关量的变化关系如图所示。
某工厂排放的废液中有一定量的盐酸和氯化钙(不考虑其他杂质)。为了对废液进行处理,做了如下实验:
(2)图中纵坐标(y)表示_____________
例3
(1)刚开始滴入Na2CO3溶液观察到(
)
A、有气泡产生
C、无明显现象
B、有白色沉淀
典例解析
A
产生碳酸钙的质量
A
B
a
5
15
x/g
y
0
(3)反应进行到B点时溶液中的溶质是_________
(4)若滴入的碳酸钠溶液中溶质质量分数为10.6%则a为______g
氯化钠
典例解析
1.0
3、掌握酸的通性、碱的通性及酸碱中和反应、PH。
1、掌握盐酸、硫酸的物理性质和化学性质。
2、掌握氢氧化钠、氢氧化钙物理性质和化学性质。
1、什么叫酸?
由氢离子和酸根离子构成的化合物叫酸.
2、什么叫碱?
由金属离子和氢氧根离子构成的化合物叫碱。
如:
硫酸
盐酸
硝酸
碳酸
醋酸
如:
氢氧化钠
氢氧化钙
氢氧化钾
氨水
H2SO4
HCl
HNO3
H2CO3
CH3COOH
NaOH
Ca(OH)2
KOH
NH3.H2O
思考
盐酸
硫酸
颜色、状态
打开瓶盖后的现象
气味
特性
一、常见的酸和碱
(一)盐酸和硫酸
无色液体
无色粘稠油状液体
瓶口出现白雾
无现象
有刺激性气味
无味
挥发性(浓)
吸水性(浓)
氢氧化钠
氢氧化钙
化学式
俗名
色、态
潮解性
溶解性
腐蚀性
制备
NaOH
Ca(OH)2
苛性钠、火碱、烧碱
熟石灰、消石灰
白色、片状固体
白色、粉末
露置在空气中,能吸收水分而潮解,有吸水性
不明显
易溶于水,并放热
微溶于水
强腐蚀性
有腐蚀性
CaO+H2O=Ca(OH)2
一、常见的酸和碱
(二)氢氧化钠和氢氧化钙
二、酸和碱的化学性质
1、酸和碱都能与酸碱指示剂反应,使指示剂显示不同的颜色。
遇酸溶液
遇碱溶液
石蕊溶液
酚酞溶液
红
红
蓝
无
二、酸和碱的化学性质
2、酸能与多种活泼金属反应,
生成盐和氢气。
与稀盐酸反应
的化学方程式
与稀硫酸反应
的化学方程式
Mg
Mg+2HCl=MgCl2+H2↑
Mg+H2SO4=MgSO4+H2↑
Zn
Zn+2HCl=ZnCl2+H2↑
Zn+H2SO4=ZnSO4+H2↑
Fe
Fe+2HCl=FeCl2+H2↑
Fe+H2SO4=FeSO4+H2↑
二、酸和碱的化学性质
3、酸能与某些金属氧化物反应,生成盐和水。
化学方程式
稀盐酸与铁锈
稀硫酸与铁锈
稀盐酸与氧化铜
Fe2O3+6HCl=2FeCl3+3H2O
Fe2O3+3H2SO4=Fe2(SO4)3+3H2O
CuO+2HCl=CuCl2+H2O
二、酸和碱的化学性质
4、酸能与碱发生中和反应,生成盐和水。
化学方程式
盐酸与氢氧化钠
硫酸与氢氧化钙
盐酸与氢氧化铝
HCl+NaOH=NaCl+H2O
H2SO4+Ca(OH)2=CaCl2+2H2O
3HCl+Al(OH)3=AlCl3+3H2O
二、酸和碱的化学性质
5、酸能与某些盐发生复分
解反应,生成新盐和新酸。
化学方程式
盐酸与
碳酸钠
盐酸与
硝酸银
硫酸与
氯化钡
Na2CO3
+
2HCl
=
2NaCl
+
H2O
+
CO2↑
AgNO3+
HCl
=
AgCl↓+HNO3
BaCl2+
H2SO4
=
BaSO4↓
+
2HCl
二、酸和碱的化学性质
6、碱能与某些非金属氧化物反应,生成盐和水。
化学方程式
火碱与二氧化碳
消石灰与二氧化碳
烧碱与三氧化硫
Ca(OH)2+CO2=CaCO3↓+H2O
2NaOH+SO2=Na2SO3+H2O
2NaOH+CO2=Na2CO3+H2O
二、酸和碱的化学性质
7、碱能与某些非金属氧化物
反应,生成新盐和新碱。
化学方程式
火碱与
氯化铁
消石灰与
碳酸钠
烧碱与
氯化镁
3NaOH
+
FeCl3
=
Fe(OH)3↓
+
3NaCl
Na2CO3
+
Ca(OH)2
=
CaCO3↓+2NaOH
2NaOH+MgCl2=2NaCl+Mg(OH)2↓
1.能使指示剂变色
2.酸+金属=盐+氢气
3.酸+金属氧化物=盐+水
4.酸+碱=盐+水(中和反应)
5.酸+盐=新酸+新盐
酸能使石蕊变红,
不能使酚酞变色
.
条件:(1)金属指排在H
前面的活泼金属
Zn+H2SO4=ZnSO4+H2↑
Fe
+H2SO4=FeSO4+H2↑
CuO+H2SO4=CuSO4+H2O
Fe2O3+6HCl=2FeCl3+3H2O
NaOH+HCl=NaCl+H2O
Cu(OH)2+H2SO4=CuSO4+2H2O
总结:酸的通性
Na2CO3
+
2HCl
=
2NaCl
+
H2O
+
CO2↑
AgNO3+
HCl
=
AgCl↓+HNO3
BaCl2+
H2SO4
=
BaSO4↓
+
2HCl
1.能使指示剂变色
2.碱+非金属氧化物=盐+水
3.碱+酸=盐+水(中和反应)
4.碱+盐=新碱+新盐(反应物都溶于水)
CO2+Ca(OH)2=CaCO
3↓
+H2O
CO2+2NaOH=Na2CO3+H2O
SO2
+2NaOH=Na2SO3+H2O
使紫色的石蕊试液变(
)色,使无色的酚酞试变(
)色
NaOH+HCl=NaCl+H2O
Cu(OH)2+H2SO4=CuSO4+2H2O
总结:碱的通性
蓝
红
3NaOH
+
FeCl3
=
Fe(OH)3↓
+
3NaCl
Na2CO3
+
Ca(OH)2
=
CaCO3
↓+2NaOH
HCl
+
NaOH
NaCl+H2O
HCl
+
Ca(OH)
2
H2SO4+
NaOH
CaCl2+2H2O
Na2SO4+2H2O
2
2
酸
+
碱=
盐
+
水
1、概念:
2、实质:是酸中的氢离子和碱中的氢氧根离子结合生成水分子的过程.
三、中和反应
好难受!
浓硫酸泄漏
在干嘛?
这馒头咋酸的?
怎么办?
3、中和反应的运用
四、pH应用
碱性增强
酸性增强
0
1
2
3
4
5
6
7
8
9
10
11
12
13
14
1、
pH的范围是0-14
2、
酸性溶液的pH<7;
中性溶液的pH=7;
碱性溶液的pH>7。
溶液的酸碱度可以用
表示,范围通常为
。用
可以测定溶液的酸碱度。
使用pH试纸测定酸碱度的正确
操作
pH
0-14
pH试纸
用玻璃棒蘸取溶液滴到pH试纸上,把试纸显示的颜色与标准比色卡比较,读出pH值。
小勇在化学晚会上观看了“瓶吞鸡蛋”的魔术(如下图),感到很神奇,注射器里到底装的什么液体呢?你能告诉他其中的奥妙吗?
再请思考:吞到瓶口的蛋,还能不能再吐出来呢?
1、下列物质露置在空气中质量增加的是(
)
A浓盐酸
B浓硫酸
C稀硫酸
D食盐水
回顾训练
B
2、向某一无色溶液中滴入无色酚酞,溶液呈红色,若向该无色溶液中滴入紫色石蕊试液,溶液显示的颜色__________。
蓝色
3、下列有关浓硫酸的稀释正确的是(
)
C
A
B
C
D
回顾训练
4、通过初三化学的学习,我们认识了“酸”和“碱”,请回答下列问题:
回顾训练
(1)酸和碱能发生中和反应,它在日常生活和工农业生产中有广泛的应用,如硫酸厂的污水中含有硫酸等杂质,可用________进行处理。
(2)2月20日盐城标新化工厂水污染事件后,为了人民群众的饮水安全,卫生防疫部门要经常对水源进行监测,获得可靠的科学依据。若现有一瓶水样,要获取它的酸碱度,应如何操作:________________
。
(3)硝酸铵(NH4NO3)是一种含氮量较高的氮肥,施用该类肥料时,要避免与______
(填“酸”或“碱”)性物质混用,否则会减低肥效。
(4)常见的酸有硫酸、盐酸等,在它们的水溶液里由于存在相同的____(填符号)离子,它们有很多相似的化学性质,如_______……等。
(5)常见的碱有氢氧化钠、氢氧化钙等,在它们的水溶液里由于存在相同的________(填符号)离子,它们有很多相似的化学性质。不能用氢氧化钠固体干燥的气体是________
。
思考:什么情况下才会出现A、B、C、D各图中PH变化?
(1)向稀硫酸中逐滴加入稀氢氧化钠溶液(
)
(2)向氢氧化钠溶液中逐滴加水稀释(
)
(3)向水中不断通入二氧化碳(
)
(4)向水中加生石灰(
)
学校化学兴趣小组的同学,取一定质量的氢氧化钠溶液与稀盐酸反应,不知二者是否恰好完全中和。
例1
典例分析
提出问题:溶液中的溶质可能是什么?
你的猜想是___________________
某实验员发现实验室有三瓶失去标签的无色溶液,可能是氯化钠溶液、稀盐酸、石灰水中的一种,请帮助实验员将其鉴别出来。你的方法是……
例2
典例解析
取废液40mL于烧杯中,逐滴滴入Na2CO3溶液充分搅拌,至过量。记录滴入Na2CO3溶液质量(x)与有关量的变化关系如图所示。
某工厂排放的废液中有一定量的盐酸和氯化钙(不考虑其他杂质)。为了对废液进行处理,做了如下实验:
(2)图中纵坐标(y)表示_____________
例3
(1)刚开始滴入Na2CO3溶液观察到(
)
A、有气泡产生
C、无明显现象
B、有白色沉淀
典例解析
A
产生碳酸钙的质量
A
B
a
5
15
x/g
y
0
(3)反应进行到B点时溶液中的溶质是_________
(4)若滴入的碳酸钠溶液中溶质质量分数为10.6%则a为______g
氯化钠
典例解析
1.0
同课章节目录
- 第一单元 金属和金属材料
- 课题1 金属材料
- 课题2 金属的化学性质
- 课题3 金属资源的利用和保护
- 实验活动1 金属的物理性质和某些化学性质
- 第二单元 溶液
- 课题1 溶液的形成
- 课题2 溶解度
- 课题3 溶液的浓度
- 实验活动2 一定溶质质量分数的氯化钠溶液的配制
- 第三单元 酸和碱
- 课题1 常见的酸和碱
- 课题2 酸和碱的中和反应
- 实验活动3 酸、碱的化学性质
- 实验活动4 溶液酸碱性的检验
- 第四单元 盐 化肥
- 课题1 生活中常见的盐
- 课题2 化学肥料
- 实验活动5 粗盐中难溶性杂志的去除
- 第五单元 化学与生活
- 课题1 人类重要的营养物质
- 课题2 化学元素与人体健康
- 课题3 有机合成材料
- 旧版目录
- 课题3 溶质的质量分数
- 课题2 酸和碱之间会发生什么反应
