高中化学人教版(2019)必修二6.2.2 化学反应的速率与限度(共21张ppt)
文档属性
| 名称 | 高中化学人教版(2019)必修二6.2.2 化学反应的速率与限度(共21张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 1.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-04-12 15:57:25 | ||
图片预览






文档简介
(共21张PPT)
化学反应的速率与限度
化学反应的限度
阅读:P48
科学史话,从这一材料中,你得到什么启示?
思考:我们知道在化学反应中,反应物之间是按照化学方程式中的系数比进行反应的,那么,在实际反应中,反应物能否按相应的计量关系完全转化为生成物呢?
①
2H2
+
O2
=
2H2O
已知:2mol
1mol
②
2SO2
+
O2
=
2SO3
已知:2mol
1mol
2mol
?
<2mol
?
?
一、可逆反应
概念:在同一条件下既能向正反应方向进行,又能向逆反应方向进行的反应。
典型的可逆反应有:
N2+3H2
2NH3
催化剂
2SO2+O2
2SO3
催化剂
SO2
+H2O
H2SO3
NH3
+H2O
NH3
·H2O
高温、高压
可逆反应的特点:
①正反应和逆反应是两个方向完全相反的不同的化学反应,但同时存在
③不能进行到底,反应物、生成物共同存在;任何一种物质的存在量都大于0
②正反应和逆反应发生的条件相同
④可逆反应有一定的限度
N2+3H2
2NH3
催化剂
高温高压
2SO2+O2
2SO3
催化剂
高温
Cd+2NiO(OH)+2H2O
Cd(OH)2+2Ni(OH)2
放电
充电
2H2O
H2↑+O2
↑
电解
点燃
√
×
√
×
14CO2、14C、14CO
2、14CO2
+
C
CO,达到化学平衡后,平衡混合物中含14C
的粒子有
。
1、以下几个反应是否是可逆反应?为什么?
【练习】
二、化学平衡状态的建立
在固定容积的密闭容器中,加入
1
mol
N2和
3
mol
H2,在催化剂加热的条件下进行反应:
思考.
反应开始的瞬间,以N2为例,
其v正(正反应速率)
、v逆(逆反应速率)分别是什么状态?
v正
v逆
时间
速率
N2+3H2
2NH3
高温高压
催化剂
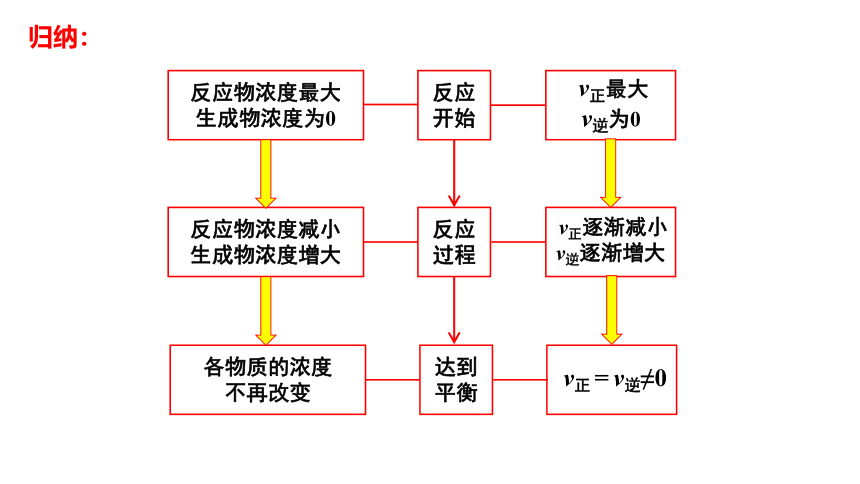
反应物浓度最大
生成物浓度为0
v正最大
v逆为0
反应
开始
反应过程
达到平衡
反应物浓度减小
生成物浓度增大
各物质的浓度
不再改变
v正逐渐减小
v逆逐渐增大
v正
=
v逆≠0
归纳:
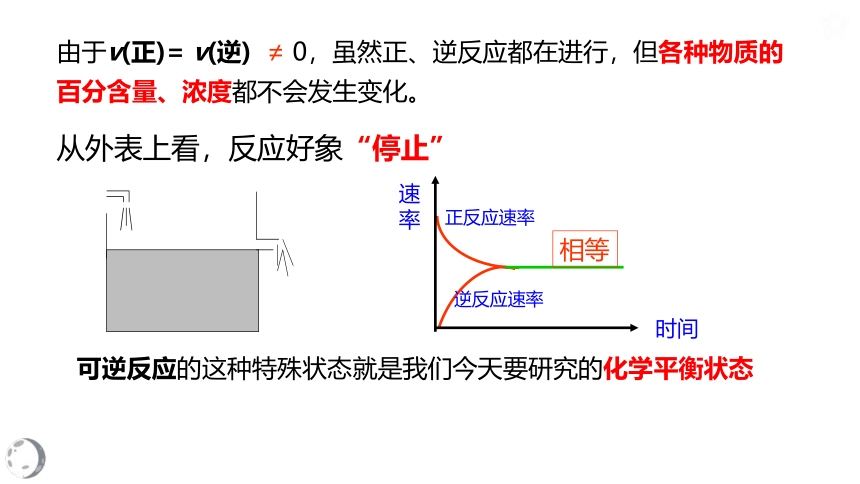
由于v(正)=
v(逆)
≠
0,虽然正、逆反应都在进行,但各种物质的百分含量、浓度都不会发生变化。
从外表上看,反应好象“停止”
可逆反应的这种特殊状态就是我们今天要研究的化学平衡状态
正反应速率
逆反应速率
相等
时间
速率
1、定义:一定条件下可逆反应进行到一定程度,正反应速率和逆反应速率相等,反应物和生成物浓度不再改变,达到一种表面静止的状态,这种状态称为化学平衡状态,简称化学平衡。
二、化学平衡状态:
化学平衡是可逆反应一定条件下能达到的最大程度,即该反应的限度。反应限度决定了反应物在该条件下转化为生成物的最大转化率。
转化率:
已被转化的反应物的物质的量与其初始物质的量之比
2、化学平衡状态的特征:
逆、等、动、定、变
(1)
逆:讨论的对象是可逆反应
(前提)
(2)
等:同一物质
v正
=
v逆≠0
(实质)
(3)
动:化学平衡是一种动态平衡。化学反应达到平衡时,反应并没有停止。
(4)
定:在平衡混合物中,各组成成分的含量保持不变
(标志)
(5)
变:化学平衡状态是有条件的,当影响化学平衡的外界条件发生改变,化学平衡就会被破坏,在新的条件下建立新的化学平衡。
练习
1.可逆反应达到平衡的重要特征( )
A.反应停止了
B.正、逆反应速率都为零
C.反应物和生成物的浓度相等
D.正、逆反应的速率相等
D
思考:还有哪些特征可以判断可逆反应已达到了平衡状态?
3、常用于判断反应达到平衡的依据
达到平衡的标志:
v正=v逆
浓度不再改变
(一定条件下)
(1)直接标志
(2)间接标志
以xA
+
yB
zC为例:
VA耗
=
VA生
VA耗
:
VC耗
=
x
:
z
VB生
:
VC生
=
y
:
z
VA耗
:
VB生
=
x
:
y
a、能说明V正=V逆的标志:
b、反应物与生成物浓度不再改变:各物质的物质的量、百分含量、体积分数等保持恒定;
变量不再改变
C、方程式左右两边气体系数之和不同的反应,压强、气体密度、气体的总物质的量、气体平均分子质量、容器压强(恒容条件)、容器体积(恒压条件)不变。
d、有色物质参加或生成的反应,颜色不再变时,或绝热容器中的温度不再
改变。
1、以3H2+N2
2NH3为列分析,判断下列情形是否达到平衡状态?
(1)
若有1molN2消耗,则有1molN2生成。
(2)
若有1molN2消耗,则有3molH2生成。
(3)
若有1molN2消耗,则有2molNH3生成。
(4)
若有1molN≡N键断裂,则有6molN﹣H键断裂。
(5)
若有1molN≡N键断裂,则有6molN﹣H键生成。
(6)
若反应体系中N2、H2、NH3的百分含量不变。
(7)
反应体系中平均相对分子质量一定。
(8)
若体系的体积一定,气体的密度一定。
(9)
若体系的体积一定,气体的压强一定。
是
否
是
是
是
是
否
是
否
2、下列各关系中能说明可逆反应:N2
+
3H2
2NH3
,已达平衡状态的是
(
)
A.
3υ正(
N2
)=υ正(H2)
B.υ正(
N2
)=υ逆(
NH3
)
C.
2υ正(
H2
)=3υ逆(
NH3
)
D.
υ正(
N2
)=
3
υ逆(H2)
?
3、在一定温度下的恒容容器中,当下列物理量不再发生变化时,不能表明反应N2O4(g,无色)
2NO2(g)已达
平衡状态的是(
)
A.
混合气体的压强
B.
混合气体的密度
C.
混合气体的平均相对分子量
D.
气体的总物质的量
?
高
炉
炼
铁
高炉炼铁过程中发生的反应包括了可逆反应,而可逆反应存在一定的限度,当反应达到其限度以后,各物质的量就不变了,因此炼铁过程中,原料是不可能完全转化为产物的。
对炼铁的反应进行深入研究还有没有意义?
对炼铁的反应进行深入研究的意义:
可逆反应的限度是建立在一定条件的基础上的,改变反应条件可以在一定程度上改变反应的限度。
趋
利
避
害
!
所以通过对反应条件的控制,可以促进有利的化学反应,抑制有害的化学反应。
三、化学反应条件的控制
在生产和生活中,人们希望促进有利的化学反应,抑制有害的化学反应。这就涉及到反应条件的控制。
1.控制
化学反应条件的基本措施:
(1)改变反应物的温度、浓度、气体压强、固体表面积以及催化剂的使用等来改变反应速率;
(2)通过改变可逆反应体系的温度、溶液浓度、气体压强等,改变可逆反应进行的限度。
催化剂
高温、高压
N2
+
3H2
2NH3
达到平衡时平衡混合物中NH3的含量(体积分数)
资料1
压强增大,氨的含量增大
温度升高,氨的含量降低
合成氨的
速率增大
使混合物中氨
的含量提高
压强
高压
温度
高温
催化剂
使用
分析角度
反应条件
高压
低温
不影响
一致
矛盾
10~30MPa
合成氨的适宜条件
400~500℃
铁触媒
4.下图所示为工业合成氨的流程图。下列有关生产条件的调控作用分析正确的是___________(填序号)。
(1)步骤①中“净化”可以防止催化剂中毒
(2)步骤②中“加压”可以加快反应速率
(3)步骤②采用的压强是2×107
Pa,因为在该压强下铁触媒的活性最大
(4)步骤③,选择高效催化剂是合成氨反应的重要条件
(5)目前,步骤③一般选择控制反应温度为700
℃左右
(6)步骤④⑤有利于提高原料的利用率,能节约生产成本
(1)(2)(4)(6)
化学反应的速率与限度
化学反应的限度
阅读:P48
科学史话,从这一材料中,你得到什么启示?
思考:我们知道在化学反应中,反应物之间是按照化学方程式中的系数比进行反应的,那么,在实际反应中,反应物能否按相应的计量关系完全转化为生成物呢?
①
2H2
+
O2
=
2H2O
已知:2mol
1mol
②
2SO2
+
O2
=
2SO3
已知:2mol
1mol
2mol
?
<2mol
?
?
一、可逆反应
概念:在同一条件下既能向正反应方向进行,又能向逆反应方向进行的反应。
典型的可逆反应有:
N2+3H2
2NH3
催化剂
2SO2+O2
2SO3
催化剂
SO2
+H2O
H2SO3
NH3
+H2O
NH3
·H2O
高温、高压
可逆反应的特点:
①正反应和逆反应是两个方向完全相反的不同的化学反应,但同时存在
③不能进行到底,反应物、生成物共同存在;任何一种物质的存在量都大于0
②正反应和逆反应发生的条件相同
④可逆反应有一定的限度
N2+3H2
2NH3
催化剂
高温高压
2SO2+O2
2SO3
催化剂
高温
Cd+2NiO(OH)+2H2O
Cd(OH)2+2Ni(OH)2
放电
充电
2H2O
H2↑+O2
↑
电解
点燃
√
×
√
×
14CO2、14C、14CO
2、14CO2
+
C
CO,达到化学平衡后,平衡混合物中含14C
的粒子有
。
1、以下几个反应是否是可逆反应?为什么?
【练习】
二、化学平衡状态的建立
在固定容积的密闭容器中,加入
1
mol
N2和
3
mol
H2,在催化剂加热的条件下进行反应:
思考.
反应开始的瞬间,以N2为例,
其v正(正反应速率)
、v逆(逆反应速率)分别是什么状态?
v正
v逆
时间
速率
N2+3H2
2NH3
高温高压
催化剂
反应物浓度最大
生成物浓度为0
v正最大
v逆为0
反应
开始
反应过程
达到平衡
反应物浓度减小
生成物浓度增大
各物质的浓度
不再改变
v正逐渐减小
v逆逐渐增大
v正
=
v逆≠0
归纳:
由于v(正)=
v(逆)
≠
0,虽然正、逆反应都在进行,但各种物质的百分含量、浓度都不会发生变化。
从外表上看,反应好象“停止”
可逆反应的这种特殊状态就是我们今天要研究的化学平衡状态
正反应速率
逆反应速率
相等
时间
速率
1、定义:一定条件下可逆反应进行到一定程度,正反应速率和逆反应速率相等,反应物和生成物浓度不再改变,达到一种表面静止的状态,这种状态称为化学平衡状态,简称化学平衡。
二、化学平衡状态:
化学平衡是可逆反应一定条件下能达到的最大程度,即该反应的限度。反应限度决定了反应物在该条件下转化为生成物的最大转化率。
转化率:
已被转化的反应物的物质的量与其初始物质的量之比
2、化学平衡状态的特征:
逆、等、动、定、变
(1)
逆:讨论的对象是可逆反应
(前提)
(2)
等:同一物质
v正
=
v逆≠0
(实质)
(3)
动:化学平衡是一种动态平衡。化学反应达到平衡时,反应并没有停止。
(4)
定:在平衡混合物中,各组成成分的含量保持不变
(标志)
(5)
变:化学平衡状态是有条件的,当影响化学平衡的外界条件发生改变,化学平衡就会被破坏,在新的条件下建立新的化学平衡。
练习
1.可逆反应达到平衡的重要特征( )
A.反应停止了
B.正、逆反应速率都为零
C.反应物和生成物的浓度相等
D.正、逆反应的速率相等
D
思考:还有哪些特征可以判断可逆反应已达到了平衡状态?
3、常用于判断反应达到平衡的依据
达到平衡的标志:
v正=v逆
浓度不再改变
(一定条件下)
(1)直接标志
(2)间接标志
以xA
+
yB
zC为例:
VA耗
=
VA生
VA耗
:
VC耗
=
x
:
z
VB生
:
VC生
=
y
:
z
VA耗
:
VB生
=
x
:
y
a、能说明V正=V逆的标志:
b、反应物与生成物浓度不再改变:各物质的物质的量、百分含量、体积分数等保持恒定;
变量不再改变
C、方程式左右两边气体系数之和不同的反应,压强、气体密度、气体的总物质的量、气体平均分子质量、容器压强(恒容条件)、容器体积(恒压条件)不变。
d、有色物质参加或生成的反应,颜色不再变时,或绝热容器中的温度不再
改变。
1、以3H2+N2
2NH3为列分析,判断下列情形是否达到平衡状态?
(1)
若有1molN2消耗,则有1molN2生成。
(2)
若有1molN2消耗,则有3molH2生成。
(3)
若有1molN2消耗,则有2molNH3生成。
(4)
若有1molN≡N键断裂,则有6molN﹣H键断裂。
(5)
若有1molN≡N键断裂,则有6molN﹣H键生成。
(6)
若反应体系中N2、H2、NH3的百分含量不变。
(7)
反应体系中平均相对分子质量一定。
(8)
若体系的体积一定,气体的密度一定。
(9)
若体系的体积一定,气体的压强一定。
是
否
是
是
是
是
否
是
否
2、下列各关系中能说明可逆反应:N2
+
3H2
2NH3
,已达平衡状态的是
(
)
A.
3υ正(
N2
)=υ正(H2)
B.υ正(
N2
)=υ逆(
NH3
)
C.
2υ正(
H2
)=3υ逆(
NH3
)
D.
υ正(
N2
)=
3
υ逆(H2)
?
3、在一定温度下的恒容容器中,当下列物理量不再发生变化时,不能表明反应N2O4(g,无色)
2NO2(g)已达
平衡状态的是(
)
A.
混合气体的压强
B.
混合气体的密度
C.
混合气体的平均相对分子量
D.
气体的总物质的量
?
高
炉
炼
铁
高炉炼铁过程中发生的反应包括了可逆反应,而可逆反应存在一定的限度,当反应达到其限度以后,各物质的量就不变了,因此炼铁过程中,原料是不可能完全转化为产物的。
对炼铁的反应进行深入研究还有没有意义?
对炼铁的反应进行深入研究的意义:
可逆反应的限度是建立在一定条件的基础上的,改变反应条件可以在一定程度上改变反应的限度。
趋
利
避
害
!
所以通过对反应条件的控制,可以促进有利的化学反应,抑制有害的化学反应。
三、化学反应条件的控制
在生产和生活中,人们希望促进有利的化学反应,抑制有害的化学反应。这就涉及到反应条件的控制。
1.控制
化学反应条件的基本措施:
(1)改变反应物的温度、浓度、气体压强、固体表面积以及催化剂的使用等来改变反应速率;
(2)通过改变可逆反应体系的温度、溶液浓度、气体压强等,改变可逆反应进行的限度。
催化剂
高温、高压
N2
+
3H2
2NH3
达到平衡时平衡混合物中NH3的含量(体积分数)
资料1
压强增大,氨的含量增大
温度升高,氨的含量降低
合成氨的
速率增大
使混合物中氨
的含量提高
压强
高压
温度
高温
催化剂
使用
分析角度
反应条件
高压
低温
不影响
一致
矛盾
10~30MPa
合成氨的适宜条件
400~500℃
铁触媒
4.下图所示为工业合成氨的流程图。下列有关生产条件的调控作用分析正确的是___________(填序号)。
(1)步骤①中“净化”可以防止催化剂中毒
(2)步骤②中“加压”可以加快反应速率
(3)步骤②采用的压强是2×107
Pa,因为在该压强下铁触媒的活性最大
(4)步骤③,选择高效催化剂是合成氨反应的重要条件
(5)目前,步骤③一般选择控制反应温度为700
℃左右
(6)步骤④⑤有利于提高原料的利用率,能节约生产成本
(1)(2)(4)(6)
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
