5.2 氮及其化合物 第2课时 课件(18张ppt)【新教材】2020-2021学年人教版(2019)高一化学必修二
文档属性
| 名称 | 5.2 氮及其化合物 第2课时 课件(18张ppt)【新教材】2020-2021学年人教版(2019)高一化学必修二 |  | |
| 格式 | pptx | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-04-13 08:29:44 | ||
图片预览





文档简介
第二节 氮及其化合物
第2课时 氨和铵盐
必修第二册 第五章 化工生产中的重要非金属元素
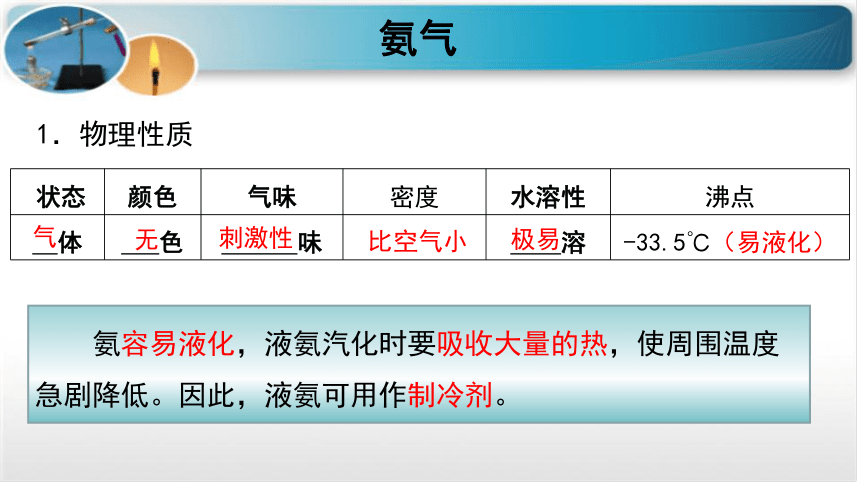
氨气
1.物理性质
?状态
颜色
气味
密度
水溶性
沸点
体
色
味
溶
-33.5℃(易液化)
无
刺激性
极易
气
比空气小
氨容易液化,液氨汽化时要吸收大量的热,使周围温度急剧降低。因此,液氨可用作制冷剂。
2. 化学性质
(1)氨与水的反应——(实验5-6 喷泉实验)
现象:
结论:
烧杯中的溶液由玻璃管进入烧瓶中,形成喷泉,
瓶内液体呈红色。
氨极易溶于水,氨溶于水后形成的氨水呈碱性。
(1)为什么会形成喷泉?
(2)实验成败的关键是什么?
通过实验操作使容器内外产生较大压强差
a.烧瓶干燥;b.装置的气密性好;
c.收集的气体纯度尽可能高。
氨气
1、如图的装置中,干燥烧瓶内盛有某种气体,烧杯和胶头滴管内盛放某种溶液。挤压胶头滴管的胶头,下列与实验事实不相符的是( )
A.CO2(浓NaOH溶液)/无色喷泉
B.NH3(H2O含酚酞)/红色喷泉
C.SO2(浓NaOH溶液)/红色喷泉
D.HCl(AgNO3溶液)/白色喷泉
课堂巩固
【解析】气体易溶于液体或与液体易发生反应,使装置内气压小于外界的大气压,即可形成喷泉。CO2→NaOH溶液反应,无色喷泉;NH3→H2O(酚酞),易溶显红色,形成红色喷泉;SO2→NaOH溶液反应,无色喷泉;HCl→AgNO3溶液反应,生成白色沉淀,形成白色喷泉。
C
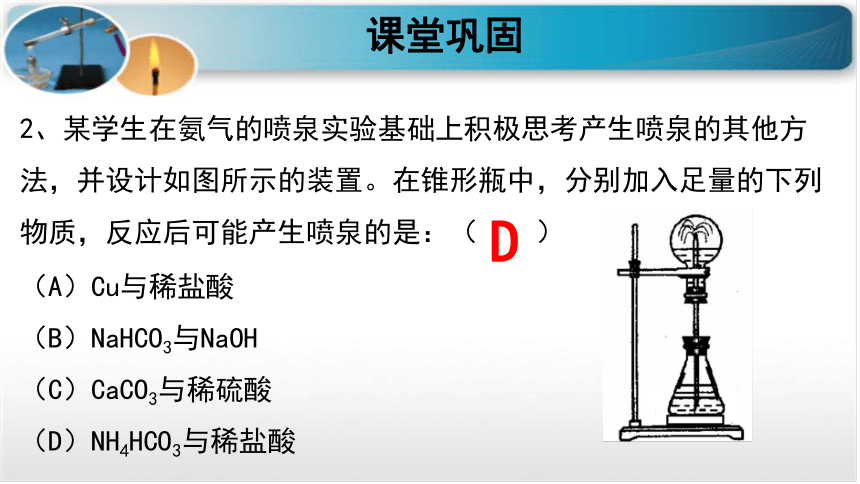
2、某学生在氨气的喷泉实验基础上积极思考产生喷泉的其他方法,并设计如图所示的装置。在锥形瓶中,分别加入足量的下列物质,反应后可能产生喷泉的是:( )
(A)Cu与稀盐酸
(B)NaHCO3与NaOH
(C)CaCO3与稀硫酸
(D)NH4HCO3与稀盐酸
课堂巩固
D
氨水的成分和性质
三分子:NH3·H2O、 NH3、 H2O。
三离子:NH4+、 OH-、 H+(微量)。
1、氨水成分
2、氨水性质
①弱碱性
② NH3·H2O 不稳定,易分解
③使Mg2+、Al3+、Fe3+等离子沉淀
氨溶于水时,会与水结合成一水合氨(NH3·H2O),一水合氨中有一小部分电离形成NH4+和OH-。
氨的水溶液(俗称氨水)显弱碱性,能使酚酞溶液变红或使红色石蕊试纸变蓝。
NH3 + H2O NH3·H2O NH4+ + OH-
NH3·H2O =NH3↑+H2O
课堂巩固
1.下列关于氨水的叙述正确的是( )
A.氨水显碱性,是因为氨水是一种弱碱
B.氨水和液氨成分相同
C.氨水中物质的量浓度最大的粒子是NH3(除水外)
D.1 mol·L-1的氨水指在1 L溶液中含NH3、NH3·H2O、NH4+物质的量之和
为1 mol
解析:选D 溶于水的氨气大部分与水反应生成NH3·H2O,所以除水外,物质的量浓度最大的粒子是NH3·H2O;NH3·H2O是一种弱碱,在水中发生部分电离使溶液呈碱性;氨水中共含有六种粒子,分别是H2O、NH3、NH3·H2O、NH、OH-和少量的H+,是一种混合物,液氨是纯净物。
D
(2)氨与酸的反应
氨的化学性质
氨 + 酸 = 铵盐
NH3 + HCl = NH4Cl(白色晶体)
NH3 + HNO3 = NH4NO3
2NH3 + H2SO4 = (NH4)2SO4
氨与酸反应的本质
NH3 与 H+ 结合形成 NH4+
NH3 几乎与所有的酸反应生成盐,除了难溶性酸(H2SiO3等)
氨与较浓的挥发性酸(浓盐酸、浓硝酸等)靠近,均能出现白烟,可以用该原理检验氨。
蘸有浓盐酸的玻璃棒
NH3 + H+ =NH4+
(3)氨的还原性——与O2反应
氨的化学性质
氨中氮元素的化合价为-3价,具有还原性。在加热和有催化剂的条件下,能被氧气氧化生成NO和H2O。
(工业制硝酸的基础)
工业制硝酸过程
N2+3H2 2NH3;
高温、高压
催化剂
2NO+O2 = 2NO2
3NO2+H2O =2HNO3+NO
1、下列说法中正确的是( )
A.NH3可以使湿润的红色石蕊试纸变蓝,因此NH3是一种碱
B.可以用浓硫酸作为干燥剂干燥NH3
C.将红热的Pt丝伸入装有浓氨水的锥形瓶中,瓶口出现少量红棕色气体,说明氨气的氧化产物为NO2
D. 用NH3可以制备硝酸铵和硫酸铵等化肥
【解析】 NH3是非电解质,本身不能使红色石蕊试纸变蓝,与水反应后生成的NH3·H2O才是碱,A错误;NH3可以与浓硫酸反应,因此不能用浓硫酸干燥NH3,B错误; NH3 的氧化产物是NO,NO在空气中继续被氧气氧化成NO2,瓶口才会出现少量红棕色气体,C错误; NH3可以与酸反应生成各种铵盐,D正确。
课堂巩固
D
1、铵盐的构成:
2、铵盐的性质:
铵盐
铵根离子(NH4+) + 酸根离子
①不稳定性:
绝大多数铵盐易溶于水,受热分解,与碱反应生成NH3。
并不是所有的铵盐受热分解都能产生氨气,如NH4NO3
NH4Cl== NH3↑+HCl↑、
△
NH4HCO3 == NH3↑+H2O+CO2↑。
△
2NH4NO3 == 4H2O + 2N2 ↑ +O2 ↑
△
NH4NO3 == N2O ↑ + 2H2O
△
思考:怎样贮存铵态氮肥?
为防止受热分解,应密封包装并放在阴凉通风处。
②与碱的反应
(1)固体反应:NH4Cl与NaOH反应的化学方程式为
(2)溶液中铵盐与强碱反应的离子方程式(加热):
稀溶液中铵盐与强碱反应的离子方程式(不加热):
铵盐
NH4Cl+NaOH == NH3↑+NaCl+H2O。
△
NH4++OH- == NH3↑+H2O。
△
NH4++OH- == NH3·H2O。
3.铵盐与碱反应的两个应用
(1)检验NH4+:
铵盐
(2)实验室制备NH3
——用氯化铵晶体与消石灰混合加热制得
待测液中加碱(NaOH溶液)并加热,
——说明溶液中含NH4+。
①用湿润的红色石蕊试纸靠近试管口,试纸变蓝;
②用蘸有浓盐酸的玻璃棒靠近管口,产生白烟;
2NH4Cl+Ca(OH)2 == CaCl2+2NH3↑+2H2O
△
氨气的制备
2、氨气的实验室制法:
(1)原料:用氯化铵晶体与消石灰混合加热制得
1、工业制法:
N2+3H2 2NH3;
高温、高压
催化剂
2NH4Cl+Ca(OH)2 == CaCl2+2NH3↑+2H2O
一般实验室制备气体的四个基本流程:
反应装置→净化装置→收集装置→尾气处理装置
(2)原理:
氨的实验室制法
(3)反应装置:
(4)净化装置:
(5)收集装置:
(6)验满方法:
(7)尾气处理:
固 + 固,加热
碱石灰干燥(②无水CaCl2不能用来干燥NH3(形成CaCl2·8NH3)
向下排空气法(在管口塞一团棉花,可减小NH3与空气的对流速度,收集到纯净的NH3,同时也可避免污染空气。 )
①用湿润的红色石蕊试纸置于试管口,试纸变蓝色
②蘸有浓盐酸的玻璃棒置于试管口,现象是产生白烟。
在管口塞一团用水或稀硫酸浸湿的棉花;或者通入水或者酸中(注意防倒吸)
实验室快速制取氨气的其他方法:
【分析】
(1)加热浓氨水制氨,利用NH3·H2O == H2O+NH3↑。其装置如图甲所示。
(2)浓氨水与生石灰:利用生石灰和水反应减少水的同时放出大量的热,增大OH-浓度,有利于NH3逸出。其装置如图乙所示。
(3)浓氨水和固体NaOH:利用NaOH的吸水性和溶于水放热的性质,使NH3逸出。
(4)浓氨水与碱石灰:利用(2)(3)方法的原理。
1、实验室制取少量干燥的氨气涉及下列装置,其中正确的是( )
【解析】①装置NH4Cl加热分解生成HCl和NH3,在试管口处NH3和HCl反应生成NH4Cl,收集不到NH3,A错误,②装置,防倒吸装置中漏斗口与液面应接触,但插入液面之下不能防止倒吸,B错误; ③装置向CaO或NaOH固体中滴加浓氨水,可制得NH3 ,C正确;收集NH3时为防止与空气对流应在试管口塞一团棉花,D错误。
【答案】C
A.①是氨气发生装置 B.②是氨气吸收装置
C.③是氨气发生装置 D.④是氨气收集、检验装置
①
NH4Cl固体
碱石灰
②
NH3
H2O
③
NH3
④
NH3
湿润的红色石蕊试纸
课堂巩固
C
2、下列关于铵盐的叙述正确的是( )
①所有铵盐中,氮元素化合价都是-3 ②绝大多数铵盐都易溶于水 ③铵态氮肥不宜与碱性肥料混合施用④铵盐是由离子构成的化合物 ⑤铵盐都能与碱反应,不能与酸反应 ⑥铵盐受热分解一定都会产生氨气
A.①③④ B.②③④
C.②③④⑤ D.①②③④⑤⑥
B
课堂巩固
NH4HCO3+ 2NaOH == Na2CO3 +NH3↑+2H2O
△
NH4HCO3+ HCl == NH4Cl + CO2↑+H2O
第2课时 氨和铵盐
必修第二册 第五章 化工生产中的重要非金属元素
氨气
1.物理性质
?状态
颜色
气味
密度
水溶性
沸点
体
色
味
溶
-33.5℃(易液化)
无
刺激性
极易
气
比空气小
氨容易液化,液氨汽化时要吸收大量的热,使周围温度急剧降低。因此,液氨可用作制冷剂。
2. 化学性质
(1)氨与水的反应——(实验5-6 喷泉实验)
现象:
结论:
烧杯中的溶液由玻璃管进入烧瓶中,形成喷泉,
瓶内液体呈红色。
氨极易溶于水,氨溶于水后形成的氨水呈碱性。
(1)为什么会形成喷泉?
(2)实验成败的关键是什么?
通过实验操作使容器内外产生较大压强差
a.烧瓶干燥;b.装置的气密性好;
c.收集的气体纯度尽可能高。
氨气
1、如图的装置中,干燥烧瓶内盛有某种气体,烧杯和胶头滴管内盛放某种溶液。挤压胶头滴管的胶头,下列与实验事实不相符的是( )
A.CO2(浓NaOH溶液)/无色喷泉
B.NH3(H2O含酚酞)/红色喷泉
C.SO2(浓NaOH溶液)/红色喷泉
D.HCl(AgNO3溶液)/白色喷泉
课堂巩固
【解析】气体易溶于液体或与液体易发生反应,使装置内气压小于外界的大气压,即可形成喷泉。CO2→NaOH溶液反应,无色喷泉;NH3→H2O(酚酞),易溶显红色,形成红色喷泉;SO2→NaOH溶液反应,无色喷泉;HCl→AgNO3溶液反应,生成白色沉淀,形成白色喷泉。
C
2、某学生在氨气的喷泉实验基础上积极思考产生喷泉的其他方法,并设计如图所示的装置。在锥形瓶中,分别加入足量的下列物质,反应后可能产生喷泉的是:( )
(A)Cu与稀盐酸
(B)NaHCO3与NaOH
(C)CaCO3与稀硫酸
(D)NH4HCO3与稀盐酸
课堂巩固
D
氨水的成分和性质
三分子:NH3·H2O、 NH3、 H2O。
三离子:NH4+、 OH-、 H+(微量)。
1、氨水成分
2、氨水性质
①弱碱性
② NH3·H2O 不稳定,易分解
③使Mg2+、Al3+、Fe3+等离子沉淀
氨溶于水时,会与水结合成一水合氨(NH3·H2O),一水合氨中有一小部分电离形成NH4+和OH-。
氨的水溶液(俗称氨水)显弱碱性,能使酚酞溶液变红或使红色石蕊试纸变蓝。
NH3 + H2O NH3·H2O NH4+ + OH-
NH3·H2O =NH3↑+H2O
课堂巩固
1.下列关于氨水的叙述正确的是( )
A.氨水显碱性,是因为氨水是一种弱碱
B.氨水和液氨成分相同
C.氨水中物质的量浓度最大的粒子是NH3(除水外)
D.1 mol·L-1的氨水指在1 L溶液中含NH3、NH3·H2O、NH4+物质的量之和
为1 mol
解析:选D 溶于水的氨气大部分与水反应生成NH3·H2O,所以除水外,物质的量浓度最大的粒子是NH3·H2O;NH3·H2O是一种弱碱,在水中发生部分电离使溶液呈碱性;氨水中共含有六种粒子,分别是H2O、NH3、NH3·H2O、NH、OH-和少量的H+,是一种混合物,液氨是纯净物。
D
(2)氨与酸的反应
氨的化学性质
氨 + 酸 = 铵盐
NH3 + HCl = NH4Cl(白色晶体)
NH3 + HNO3 = NH4NO3
2NH3 + H2SO4 = (NH4)2SO4
氨与酸反应的本质
NH3 与 H+ 结合形成 NH4+
NH3 几乎与所有的酸反应生成盐,除了难溶性酸(H2SiO3等)
氨与较浓的挥发性酸(浓盐酸、浓硝酸等)靠近,均能出现白烟,可以用该原理检验氨。
蘸有浓盐酸的玻璃棒
NH3 + H+ =NH4+
(3)氨的还原性——与O2反应
氨的化学性质
氨中氮元素的化合价为-3价,具有还原性。在加热和有催化剂的条件下,能被氧气氧化生成NO和H2O。
(工业制硝酸的基础)
工业制硝酸过程
N2+3H2 2NH3;
高温、高压
催化剂
2NO+O2 = 2NO2
3NO2+H2O =2HNO3+NO
1、下列说法中正确的是( )
A.NH3可以使湿润的红色石蕊试纸变蓝,因此NH3是一种碱
B.可以用浓硫酸作为干燥剂干燥NH3
C.将红热的Pt丝伸入装有浓氨水的锥形瓶中,瓶口出现少量红棕色气体,说明氨气的氧化产物为NO2
D. 用NH3可以制备硝酸铵和硫酸铵等化肥
【解析】 NH3是非电解质,本身不能使红色石蕊试纸变蓝,与水反应后生成的NH3·H2O才是碱,A错误;NH3可以与浓硫酸反应,因此不能用浓硫酸干燥NH3,B错误; NH3 的氧化产物是NO,NO在空气中继续被氧气氧化成NO2,瓶口才会出现少量红棕色气体,C错误; NH3可以与酸反应生成各种铵盐,D正确。
课堂巩固
D
1、铵盐的构成:
2、铵盐的性质:
铵盐
铵根离子(NH4+) + 酸根离子
①不稳定性:
绝大多数铵盐易溶于水,受热分解,与碱反应生成NH3。
并不是所有的铵盐受热分解都能产生氨气,如NH4NO3
NH4Cl== NH3↑+HCl↑、
△
NH4HCO3 == NH3↑+H2O+CO2↑。
△
2NH4NO3 == 4H2O + 2N2 ↑ +O2 ↑
△
NH4NO3 == N2O ↑ + 2H2O
△
思考:怎样贮存铵态氮肥?
为防止受热分解,应密封包装并放在阴凉通风处。
②与碱的反应
(1)固体反应:NH4Cl与NaOH反应的化学方程式为
(2)溶液中铵盐与强碱反应的离子方程式(加热):
稀溶液中铵盐与强碱反应的离子方程式(不加热):
铵盐
NH4Cl+NaOH == NH3↑+NaCl+H2O。
△
NH4++OH- == NH3↑+H2O。
△
NH4++OH- == NH3·H2O。
3.铵盐与碱反应的两个应用
(1)检验NH4+:
铵盐
(2)实验室制备NH3
——用氯化铵晶体与消石灰混合加热制得
待测液中加碱(NaOH溶液)并加热,
——说明溶液中含NH4+。
①用湿润的红色石蕊试纸靠近试管口,试纸变蓝;
②用蘸有浓盐酸的玻璃棒靠近管口,产生白烟;
2NH4Cl+Ca(OH)2 == CaCl2+2NH3↑+2H2O
△
氨气的制备
2、氨气的实验室制法:
(1)原料:用氯化铵晶体与消石灰混合加热制得
1、工业制法:
N2+3H2 2NH3;
高温、高压
催化剂
2NH4Cl+Ca(OH)2 == CaCl2+2NH3↑+2H2O
一般实验室制备气体的四个基本流程:
反应装置→净化装置→收集装置→尾气处理装置
(2)原理:
氨的实验室制法
(3)反应装置:
(4)净化装置:
(5)收集装置:
(6)验满方法:
(7)尾气处理:
固 + 固,加热
碱石灰干燥(②无水CaCl2不能用来干燥NH3(形成CaCl2·8NH3)
向下排空气法(在管口塞一团棉花,可减小NH3与空气的对流速度,收集到纯净的NH3,同时也可避免污染空气。 )
①用湿润的红色石蕊试纸置于试管口,试纸变蓝色
②蘸有浓盐酸的玻璃棒置于试管口,现象是产生白烟。
在管口塞一团用水或稀硫酸浸湿的棉花;或者通入水或者酸中(注意防倒吸)
实验室快速制取氨气的其他方法:
【分析】
(1)加热浓氨水制氨,利用NH3·H2O == H2O+NH3↑。其装置如图甲所示。
(2)浓氨水与生石灰:利用生石灰和水反应减少水的同时放出大量的热,增大OH-浓度,有利于NH3逸出。其装置如图乙所示。
(3)浓氨水和固体NaOH:利用NaOH的吸水性和溶于水放热的性质,使NH3逸出。
(4)浓氨水与碱石灰:利用(2)(3)方法的原理。
1、实验室制取少量干燥的氨气涉及下列装置,其中正确的是( )
【解析】①装置NH4Cl加热分解生成HCl和NH3,在试管口处NH3和HCl反应生成NH4Cl,收集不到NH3,A错误,②装置,防倒吸装置中漏斗口与液面应接触,但插入液面之下不能防止倒吸,B错误; ③装置向CaO或NaOH固体中滴加浓氨水,可制得NH3 ,C正确;收集NH3时为防止与空气对流应在试管口塞一团棉花,D错误。
【答案】C
A.①是氨气发生装置 B.②是氨气吸收装置
C.③是氨气发生装置 D.④是氨气收集、检验装置
①
NH4Cl固体
碱石灰
②
NH3
H2O
③
NH3
④
NH3
湿润的红色石蕊试纸
课堂巩固
C
2、下列关于铵盐的叙述正确的是( )
①所有铵盐中,氮元素化合价都是-3 ②绝大多数铵盐都易溶于水 ③铵态氮肥不宜与碱性肥料混合施用④铵盐是由离子构成的化合物 ⑤铵盐都能与碱反应,不能与酸反应 ⑥铵盐受热分解一定都会产生氨气
A.①③④ B.②③④
C.②③④⑤ D.①②③④⑤⑥
B
课堂巩固
NH4HCO3+ 2NaOH == Na2CO3 +NH3↑+2H2O
△
NH4HCO3+ HCl == NH4Cl + CO2↑+H2O
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
