高中化学人教版(2019)必修二7.1.2烷烃的性质(共16张ppt)
文档属性
| 名称 | 高中化学人教版(2019)必修二7.1.2烷烃的性质(共16张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 3.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-04-14 14:49:05 | ||
图片预览




文档简介
(共16张PPT)
第七章
有机化合物
第一认节
识有机化合物
第2课时
烷烃的性质
一、烷烃的物理性质
?
相似性
递变性(随分子中碳原子数增加)
熔、沸点
密度
状态
溶解性
逐渐升高
逐渐增大
难溶于水,易溶于汽油等有机溶剂
比水小
较低
气态→液态→固态,常温常压下分子中碳原子数n≤4的烷烃为气态(常温常压下,新戊烷为气态)
1.烷烃的物理性质
2.甲烃的物理性质
无色、无味、极难溶于水的气体
2.可燃性
二、烷烃的化学性质
发生氧化反应
CH4
+
2O2
CO2
+
2H2O
点燃
C3H8
+
5O2
3CO2
+
4H2O
点燃
链状烷烃燃烧方程式:
CnH2n+2
+
O2
nCO2
+
(n+1)H2O
点燃
注意:有机反应式通常用箭头!
煤矿中的爆炸事故多与甲烷气体爆炸有关。为了保证安全生产,必须采取通风、严禁烟火等措施。点燃之前要验纯。
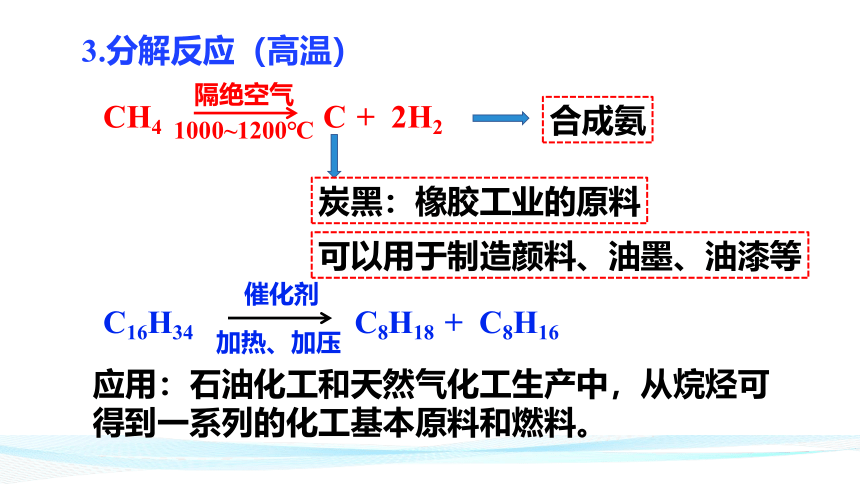
炭黑:橡胶工业的原料
可以用于制造颜料、油墨、油漆等
合成氨
3.分解反应(高温)
C16H34
C8H18
+
C8H16
催化剂
加热、加压
CH4
C
+
2H2
隔绝空气
1000~1200℃
应用:石油化工和天然气化工生产中,从烷烃可得到一系列的化工基本原料和燃料。
甲烷与氯气的反应
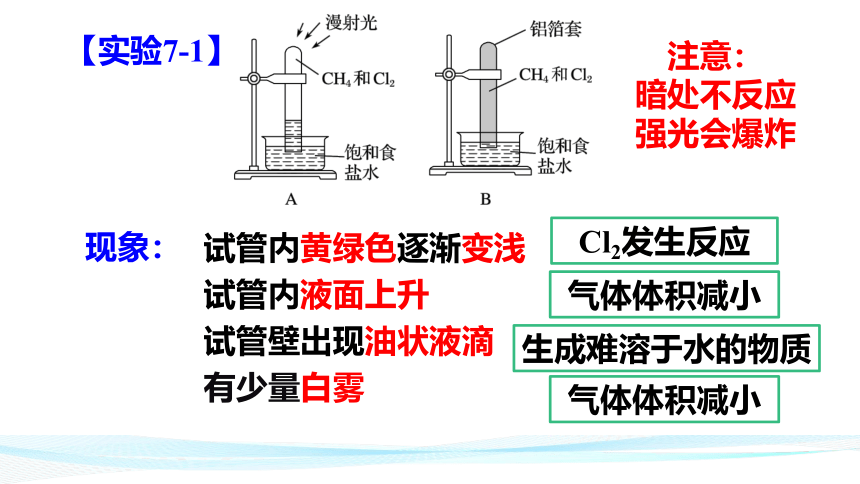
试管内黄绿色逐渐变浅
试管内液面上升
试管壁出现油状液滴
有少量白雾
【实验7-1】
现象:
Cl2发生反应
气体体积减小
生成难溶于水的物质
气体体积减小
注意:
暗处不反应
强光会爆炸
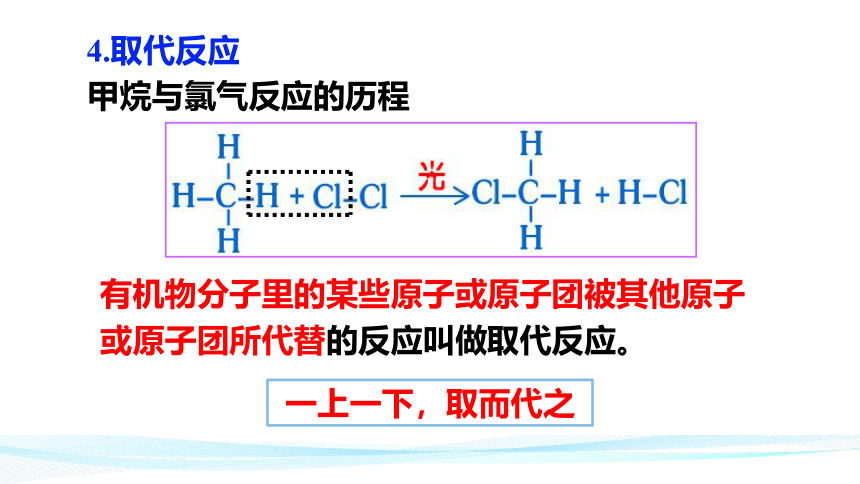
甲烷与氯气反应的历程
有机物分子里的某些原子或原子团被其他原子或原子团所代替的反应叫做取代反应。
4.取代反应
一上一下,取而代之
二氯甲烷(液体)
三氯甲烷又叫氯仿(液体)
四氯甲烷又叫四氯化碳(有机溶剂,灭火剂)
甲烷的取代反应的历程
一氯甲烷(气体)
CH4
+
Cl2
CH3Cl
+HCl
光照
CH3Cl
+
Cl2
CH2Cl2
+
HCl
光照
CH2Cl2
+
Cl2
CHCl3
+
HCl
光照
CHCl3
+
Cl2
CCl4
+
HCl
光照
甲烷的取代反应的化学方程式
1.甲烷与氯气发生取代反应后产物可能有几种?
【思考】
2.乙烷与氯气发生取代反应后产物可能有几种?
哪种产物最多?
5种
CH3Cl
CH2Cl2
CHCl3
CCl4
HCl
7种
HCl一定是最多的
3.计算1mol甲烷与4mol氯气在光照条件下反应足够长时间后得到的产物的物质的量。
最终得到
1mol
CCl4
和
4mol
HCl
反应物
反应条件
生成物
反应特点
甲烷与氯气(不能用氯水,需纯卤素单质)
漫散光照射(不用太阳光直射,以防爆炸)
甲烷与氯气反应生成四种有机产物:CH3Cl、CH2Cl2、CHCl3、CCl4和无机物HCl,其中HCl的产量最多(产物复杂)
连锁反应
甲烷中的氢原子被氯原子逐步取代,各步反应同时进行,即第一步反应一旦开始,后续反应立即进行
数量关系
每取代1
mol氢原子,消耗1
mol
Cl2,生成1
mol
HCl
【小结】甲烷与氯气的取代反应
烷烃
物理性质
化学性质
难溶于水
熔点、沸点和密度随分子中碳原子数的增加而升高
气态→液态→固态
可燃性
热分解
取代反应
小结
稳定性
1.试写出乙烷和氯气反应生成一氯代物的方程式。
2.将下列气体通入酸性高锰酸钾,酸性高锰酸钾褪色的是(
)
A.
CH4
B.
CO2
C.
SO2
D.
H2
C
H
H
H
H
H
C
C
H
光照
H
H
H
H
H
C
C
Cl
+Cl
Cl
+H
Cl
键断裂
【课堂练习】
3.下列关于甲烷与Cl2的取代反应所得产物的说法正确的是(
)
A.都是有机物
B.都不溶于水
C.有一种气态物质,其余均是液体
D.除一种外均是四面体结构
D
4.在光照条件下,将等物质的量的CH4和Cl2充分反应后,产物中物质的量最多的是(
)
A.CH3Cl
B.CH2Cl2
C.CCl4
D.HCl
D
【课堂练习】
5.下列反应属于取代反应的是
(填序号)。
①CH4
C+2H2
②CuSO4+Fe
==
FeSO4+Cu
③CH3Cl+Cl2
CH2Cl2+HCl
④2NaBr+Cl2
==
2NaCl+Br2
⑤CH3OH+HCl
CH3Cl+H2O
⑥CH3CH2Br+H2O
CH3CH2OH+HBr
⑦CH4+2O2
CO2+2H2O
③⑤⑥
【课堂练习】
6.如图所示,某气体X可能由H2、CO、CH4中的一种或几种组成,将X气体燃烧把燃烧后生成的气体通过A、B两个洗气瓶。试回答下列问题。
气体
A
B
浓H2SO4
澄清石灰水
(1)
若A洗气瓶的质量增加,
B洗气瓶的质量不变,则气体X是
。
(2)
若A洗气瓶的质量不变,B洗气瓶的质量增加,则气体X是
。
(3)
若A、B两个洗气瓶的质量都增加,则气体X是
。
H2
CO
CH4或H2、CO或H2、CH4或CO、CH4或H2、CO、CH4
【课堂练习】
第七章
有机化合物
第一认节
识有机化合物
第2课时
烷烃的性质
一、烷烃的物理性质
?
相似性
递变性(随分子中碳原子数增加)
熔、沸点
密度
状态
溶解性
逐渐升高
逐渐增大
难溶于水,易溶于汽油等有机溶剂
比水小
较低
气态→液态→固态,常温常压下分子中碳原子数n≤4的烷烃为气态(常温常压下,新戊烷为气态)
1.烷烃的物理性质
2.甲烃的物理性质
无色、无味、极难溶于水的气体
2.可燃性
二、烷烃的化学性质
发生氧化反应
CH4
+
2O2
CO2
+
2H2O
点燃
C3H8
+
5O2
3CO2
+
4H2O
点燃
链状烷烃燃烧方程式:
CnH2n+2
+
O2
nCO2
+
(n+1)H2O
点燃
注意:有机反应式通常用箭头!
煤矿中的爆炸事故多与甲烷气体爆炸有关。为了保证安全生产,必须采取通风、严禁烟火等措施。点燃之前要验纯。
炭黑:橡胶工业的原料
可以用于制造颜料、油墨、油漆等
合成氨
3.分解反应(高温)
C16H34
C8H18
+
C8H16
催化剂
加热、加压
CH4
C
+
2H2
隔绝空气
1000~1200℃
应用:石油化工和天然气化工生产中,从烷烃可得到一系列的化工基本原料和燃料。
甲烷与氯气的反应
试管内黄绿色逐渐变浅
试管内液面上升
试管壁出现油状液滴
有少量白雾
【实验7-1】
现象:
Cl2发生反应
气体体积减小
生成难溶于水的物质
气体体积减小
注意:
暗处不反应
强光会爆炸
甲烷与氯气反应的历程
有机物分子里的某些原子或原子团被其他原子或原子团所代替的反应叫做取代反应。
4.取代反应
一上一下,取而代之
二氯甲烷(液体)
三氯甲烷又叫氯仿(液体)
四氯甲烷又叫四氯化碳(有机溶剂,灭火剂)
甲烷的取代反应的历程
一氯甲烷(气体)
CH4
+
Cl2
CH3Cl
+HCl
光照
CH3Cl
+
Cl2
CH2Cl2
+
HCl
光照
CH2Cl2
+
Cl2
CHCl3
+
HCl
光照
CHCl3
+
Cl2
CCl4
+
HCl
光照
甲烷的取代反应的化学方程式
1.甲烷与氯气发生取代反应后产物可能有几种?
【思考】
2.乙烷与氯气发生取代反应后产物可能有几种?
哪种产物最多?
5种
CH3Cl
CH2Cl2
CHCl3
CCl4
HCl
7种
HCl一定是最多的
3.计算1mol甲烷与4mol氯气在光照条件下反应足够长时间后得到的产物的物质的量。
最终得到
1mol
CCl4
和
4mol
HCl
反应物
反应条件
生成物
反应特点
甲烷与氯气(不能用氯水,需纯卤素单质)
漫散光照射(不用太阳光直射,以防爆炸)
甲烷与氯气反应生成四种有机产物:CH3Cl、CH2Cl2、CHCl3、CCl4和无机物HCl,其中HCl的产量最多(产物复杂)
连锁反应
甲烷中的氢原子被氯原子逐步取代,各步反应同时进行,即第一步反应一旦开始,后续反应立即进行
数量关系
每取代1
mol氢原子,消耗1
mol
Cl2,生成1
mol
HCl
【小结】甲烷与氯气的取代反应
烷烃
物理性质
化学性质
难溶于水
熔点、沸点和密度随分子中碳原子数的增加而升高
气态→液态→固态
可燃性
热分解
取代反应
小结
稳定性
1.试写出乙烷和氯气反应生成一氯代物的方程式。
2.将下列气体通入酸性高锰酸钾,酸性高锰酸钾褪色的是(
)
A.
CH4
B.
CO2
C.
SO2
D.
H2
C
H
H
H
H
H
C
C
H
光照
H
H
H
H
H
C
C
Cl
+Cl
Cl
+H
Cl
键断裂
【课堂练习】
3.下列关于甲烷与Cl2的取代反应所得产物的说法正确的是(
)
A.都是有机物
B.都不溶于水
C.有一种气态物质,其余均是液体
D.除一种外均是四面体结构
D
4.在光照条件下,将等物质的量的CH4和Cl2充分反应后,产物中物质的量最多的是(
)
A.CH3Cl
B.CH2Cl2
C.CCl4
D.HCl
D
【课堂练习】
5.下列反应属于取代反应的是
(填序号)。
①CH4
C+2H2
②CuSO4+Fe
==
FeSO4+Cu
③CH3Cl+Cl2
CH2Cl2+HCl
④2NaBr+Cl2
==
2NaCl+Br2
⑤CH3OH+HCl
CH3Cl+H2O
⑥CH3CH2Br+H2O
CH3CH2OH+HBr
⑦CH4+2O2
CO2+2H2O
③⑤⑥
【课堂练习】
6.如图所示,某气体X可能由H2、CO、CH4中的一种或几种组成,将X气体燃烧把燃烧后生成的气体通过A、B两个洗气瓶。试回答下列问题。
气体
A
B
浓H2SO4
澄清石灰水
(1)
若A洗气瓶的质量增加,
B洗气瓶的质量不变,则气体X是
。
(2)
若A洗气瓶的质量不变,B洗气瓶的质量增加,则气体X是
。
(3)
若A、B两个洗气瓶的质量都增加,则气体X是
。
H2
CO
CH4或H2、CO或H2、CH4或CO、CH4或H2、CO、CH4
【课堂练习】
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
