山东省济南市章丘区第一高级中学校2020-2021学年高一下学期4月月考化学试卷(PDF版)
文档属性
| 名称 | 山东省济南市章丘区第一高级中学校2020-2021学年高一下学期4月月考化学试卷(PDF版) |  | |
| 格式 | |||
| 文件大小 | 808.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-04-14 20:06:49 | ||
图片预览



文档简介
章丘一中 2020-2021 学年高一下学期第一次月考
化学试题
相对原子质量:
H1 He4 C12 N14 O16 S32 Na23 Cl35.5 Zn65 Cu64 Ag108
一、选择题(共20小题,每小题2分,共40分。在每小题只有一项符合题目要求。)
1.下列叙述正确的是( )
A. H2和 D2互为同素异形体
B. 金刚石和石墨互为同位素
40 40
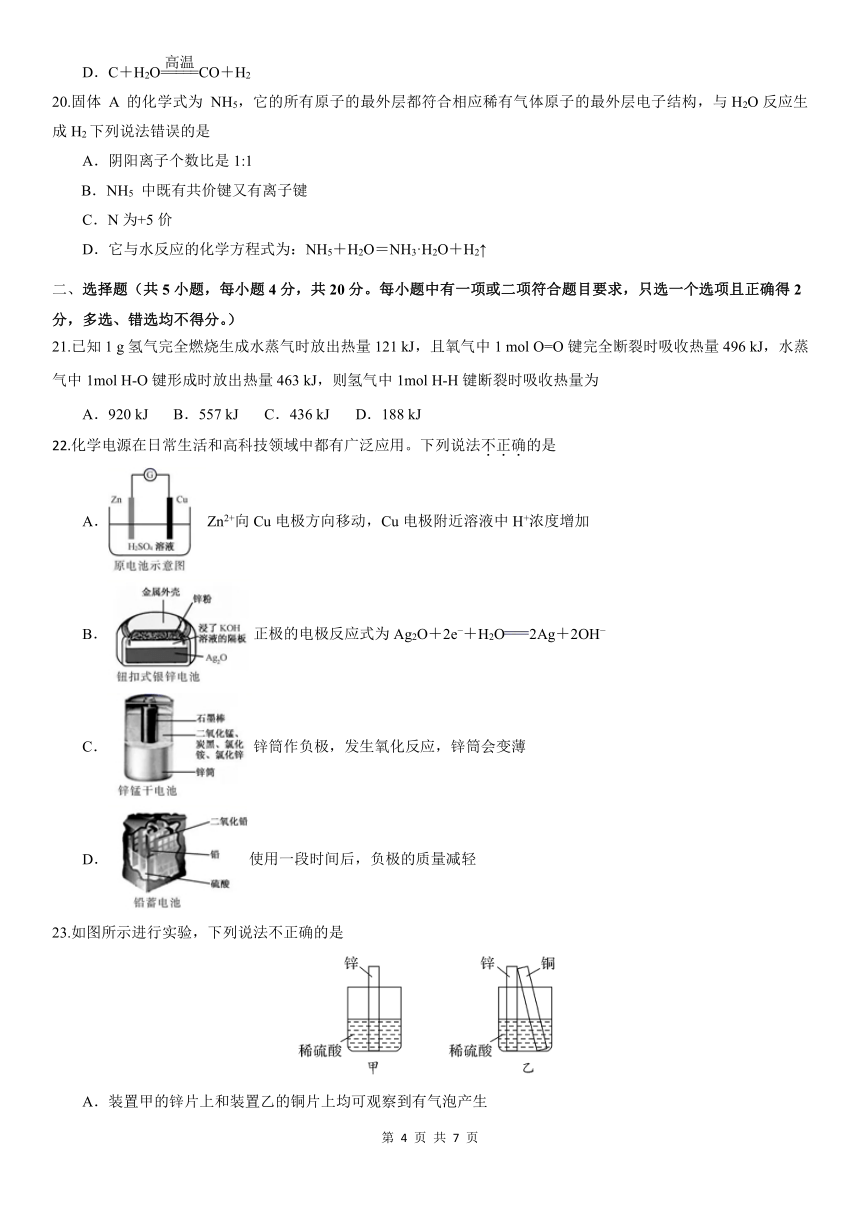
C. K 和 Ca 原子中质子数和中子数都不相等
D. 某物质只含一种元素,该物质一定是纯净物
2.不能作为判断硫、氯两种元素非金属性强弱的依据是( )
A.单质氧化性的强弱 B.简单氢化物的稳定性
C.单质与氢气化合的难易 D.氧化物对应的水化物酸性的强弱
3.下列化学用语书写不.正.确.的是( )
A.中子数为1的氢原子:2
1H B.HCl的电子式: H+
C.Na+的结构示意图: D.CH4的结构式:
4.下列说法不正确的是( )
A.需要加热才能发生的反应一定是吸热反应
B.等量的硫蒸气和硫固体分别完全燃烧,前者放出的热量多
C.生成物总能量高于反应物总能量的反应是吸热反应
D.由C(石墨)→C(金刚石) ΔH=+1.9kJ/mol,可知石墨比金刚石稳定
5.下列各组性质比较中,正确的是( )
①沸点: 2- - - -
HF>HCl>HBr>HI ②离子还原性:S >Cl >Br >I
③酸性:HClO4 ?HBrO4 ?HIO4 ④金属性:K>Na>Mg>Al
2- - + 2+
⑤气态氢化物稳定性:HF?HCl?H2S ⑥半径:O >F >Na >Mg
A.①②③ B.③④⑤⑥ C.②③④ D.①③④⑤⑥
6.四种短周期元素 X、Y、Z 和 W 在周期表中的位置如图所示,原子序数之和为 48。下列说法不正确的
是( )
A.同周期元素的简单离子中 W 的简单离子半径最小 X Y
B.是 X 和 W 可形成共价化合物 XW3,其分子构型为三角锥形
Z W
C.W 的非金属性比 Z 的强,所以 W 氢化物比 Z 的稳定
D.Z 的最低价单核阴离子的失电子能力比 Y 的强
第 1 页 共 7 页
7.下列各物质间关系描述正确的是( )
A.Na2O2和Na2O、红磷和白磷均属于同素异形体
B.氕、氘、氚的质子数相同,中子数不同。
C.金刚石和石墨物理性质不同,化学性质相似
D.14 13 ?
6C和 6C、I2和I 都属于同位素
8.元素周期表对化学学习和研究都有重要意义。下列说法错.误.的是
A.通过主族元素原子的最外层电子数,推测其常见的化合价
B.在金属与非金属分界线附近,寻找半导体材料
C.研究氯、硫、磷、砷等所在区域的元素,制造新品种的农药
D.在IA族和ⅡA族的金属中寻找催化剂
9.在 NH3 和 NH4Cl 存在条件下,以活性炭为催化剂,用 H2O2 氧化 CoCl2 溶液来制备化工产品[Co(NH3)6]Cl3,
下列表述正确的是
32
A.中子数为 32,质子数为 27 的钴原子:27Co
B.H2O2 的电子式:
C.NH3 和 NH4Cl 化学键类型相同
D.[Co(NH3)6]Cl3 中 Co 的化合价是+3
10.下列说法不正确的是( )
A.CS2中所含所有原子的最外层电子数均为8
B.沸点:CH4C.惰性气体中不含化学键,存在分子间作用力
D.金刚石和冰在熔化时均要破坏共价键
b n-
11.某元素的一个原子形成的离子可表示为aX ,下列有关该原子的说法正确的是( )
A.含有的中子数为a+b B.含有的电子数为a-n
C.质量数为a+b+n D.1mol该原子的质量约为bg
12.依据元素周期表及元素周期律,下列推断正确的是
A.H3BO3的酸性比H2CO3的强
B.HCl、HBr、HI的酸性增强
C.Tl(OH)3是两性氢氧化物
D.若 + 2-
M 和R 的核外电子层结构相同,则离子半径: + 2-
M >R
13.短周期主族元素A、B、C、D的原子序数依次增大,A、C的原子序数相差8,A原子的最外层电子数是其
次外层电子数的3倍,B单质的焰色试验呈黄色。下列说法正确的是( )
A.气态氢化物的热稳定性:A?C
B.元素A与B只能形成一种化合物
第 2 页 共 7 页
C.最高价氧化物对应的水化物的酸性:C?D
D.原子半径的大小顺序: B>C>A
14.下列叙述正确的是( )
A.因为Na2CO3+SiO2 Na2SiO3+CO2↑,所以硅酸的酸性比碳酸强
B.碳和硅都是ⅣA族的元素,所以二氧化碳和二氧化硅的物理性质相似
C.二氧化硅既能溶于氢氧化钠溶液又能溶于氢氟酸,所以二氧化硅是两性氧化物
D.二氧化硅和二氧化碳都是酸性氧化物,但二氧化硅不能和水反应生成硅酸
15.下列各组性质比较中正确的是
①颜色:氯化银、溴化银、碘化银,颜色逐渐加深
②离子还原性: 2- - - -
S >Cl >Br >I
③酸性:HClO4>HBrO4>HIO4
④金属性:K>Na>Mg>Al
⑤气态氢化物稳定性:HF>HCl>H2S
A.①②③ B.①④⑤ C.②③④ D.①③④⑤
16.下列每组物质发生转化所克服的粒子间的相互作用属于同种类型的是( )
A.碘和干冰升华 B.氯化钠的熔化与冰的融化
C.氯化氢和酒精溶于水 D.氯化钠和氯化氢溶于水
17. 反应物X转化为Y和Z的能量变化如图所示,下列说法正确的是( )
A.由X→Y反应的能量变化为E5-E2
B.由X→Z反应的为吸热反应
C.由图可知等物质的量的Y的能量一定比X的能量高
D.X→Z的反应中断裂旧化学键吸收的能量为E4-E2
18.海水是一个巨大的化学资源宝库,下列有关海水综合利用的说法正确的是( )
A.从海水中可以得到NaCl,电解熔融NaCl可制备Cl2
B.海水蒸发制海盐的过程中只发生了化学变化
C.海水中含有钾元素,只需经过物理变化就可以得到钾单质
D.利用潮汐发电是将化学能转化为电能
19.下列反应过程中的能量变化与右图一致的是
高温
A.2Al+Fe2O3=====2Fe+Al2O3 能
量
加热 反应物
B.C+CO2=====2CO
高温 生成物
C.CaCO3=====CaO+CO2↑
反应过程
第 3 页 共 7 页
高温
D.C+H2O=====CO+H2
20.固体 A 的化学式为 NH5,它的所有原子的最外层都符合相应稀有气体原子的最外层电子结构,与H2O反应生
成H2下列说法错误的是
A.阴阳离子个数比是1:1
B.NH5 中既有共价键又有离子键
C.N为+5价
D.它与水反应的化学方程式为:NH5+H2O=NH3·H2O+H2↑
二、选择题(共5小题,每小题4分,共20分。每小题中有一项或二项符合题目要求,只选一个选项且正确得2
分,多选、错选均不得分。)
21.已知1g氢气完全燃烧生成水蒸气时放出热量121kJ,且氧气中1molO=O键完全断裂时吸收热量496kJ,水蒸
气中1molH-O键形成时放出热量463kJ,则氢气中1molH-H键断裂时吸收热量为
A.920kJ B.557kJ C.436kJ D.188kJ
22.化学电源在日常生活和高科技领域中都有广泛应用。下列说法不.正.确.的是
A. Zn2+向Cu电极方向移动,Cu电极附近溶液中H+浓度增加
B. 正极的电极反应式为Ag2O+2e?+H2O 2Ag+2OH?
C. 锌筒作负极,发生氧化反应,锌筒会变薄
D. 使用一段时间后,负极的质量减轻
23.如图所示进行实验,下列说法不正确的是
A.装置甲的锌片上和装置乙的铜片上均可观察到有气泡产生
第 4 页 共 7 页
B.甲、乙装置中的能量变化均为化学能转化为电能
C.装置乙中的锌、铜之间用导线连接电流计,可观察到电流计指针发生偏转
- +
D.装置乙中负极的电极反应式:Zn-2e ===Zn2
24.膦(PH3)在常温下是一种无色有大蒜臭味的有毒气体,电石气的杂质中常含之。它的分子是三角锥形。以下关
于PH3的叙述中,正确的是( )
A.PH3属于共价化合物
B.PH3分子中有未成键的电子对
C.PH3中所有原子都满足8电子稳定结构
D.PH3分子中的P-H键是非极性键
25.过氧化氢俗称双氧水,医疗上常用质量分数为 3%的双氧水进行伤口消毒。H2O2能与 SO2,
反应生成 H+,SO42-,H2O2 的分子结构如下图所示。下列说法错误的是
A.H2O2分子中氧元素的化合价是-1,所以O的最外层不满足8电子结构
B.H2O2为含有极性键和非极性键的共价化合物
C.H2O2与 SO2在水溶液中反应的离子方程式为 SO2+H2O2=2H++SO42-
D.H2O2与 SO2反应过程中有共价键断裂,同时有共价键和离子键形成
三、非选择题:本题共4小题,共40分。
26.(共0分)
a
b c d e
f g h
i j
(1)现己知N2(g)和H2(g)反应生成1molNH3(g)过程中能量变化如图所示。根据下列键能数据计算N-H
-
键键能为 kJ?mol 1。
(2)a、b组成的离子化合物的形成过程为
(3)已知i原子的最外层有2个电子,则i的原子结构示意图为
第 5 页 共 7 页
(4)h和j的最高价氧化物的水化物的酸性顺序为 > (填化学式)
(5)g的位于金属和非金属分界线附近,其单质可以与f的最高价氧化物的水化物反应,请写出该反应的离子方程
式
27.C和Si是构成非金属材料的主要元素,有关C和Si请回答下列问题:
(1)水泥、玻璃和陶瓷是三大传统无机非金属材料,其中制备水泥和玻璃的共同原料是 (填写名称)
(2)下列说法正确的是
A. 光导纤维是传播电信号的新型无机非金属材料,它的主要成份是晶体硅
B. SiC俗称金刚砂,它硬度大,熔点高,可以制造汽车的发动机和轴承
C. 碳纳米材料在能源、医疗、信息等领域有广阔的应用前景,它主要包括富勒烯、碳纳米管、石墨烯等
D. 石墨烯是只有一个碳原子直径厚度的单层石墨,它是目前世界上已知的最硬、最轻的新型材料
E. 金刚石、石墨和富勒烯互为同素异形体,其中富勒烯的摩尔质量为720
(3)高纯硅是制备高性能芯片的原料,下列是制备高纯硅的工艺流程:
①制备粗硅的化学方程式
②SiHCl3可以看做是SiH4中的3个H被Cl取代了,那么SiHCl3的结构式为
③整个制备过程必须严格控制无水、无氧。SiHCl3遇水剧烈反应生成H2SiO3、HCl和另一种物质,写出该反应
的化学方程式:_______________________________________。
28.依据氧化还原反应:2Ag+(aq) +Cu(s) =Cu2+(aq) +2Ag(s)设计的原电池如图所示。请回答下列问题:
(1)电极X的材料是石墨,则电极Y的材料是______________;
(2)x 电极为电池的___________极,发生的电极反应为________________________________;
(3)溶液中的NO3-中的流向___________电极(填电极材料名称)。
(4)假设水槽中有100mL溶液,当X电极的质量增加5.4g时,溶液中C(Cu2+)= mol·L-1
第 6 页 共 7 页
29氢氧燃料电池是符合绿色化学理念的新型发电装置。下图为电池示意图,该电池电极表面镀一层细小的铂粉,铂
吸附气体的能力强,性质稳定。请回答:
(1)在导线中电子流动方向为________(用a、b表示)。
(2)负极反应式为______________________________________
正极反应式为______________________________________
(3)该电池工作时,H2和O2连续由外部供给,电池可连续不断提供电能。因此,大量安
全储氢是关键技术之一。金属锂是一种重要的储氢材料,吸氢和放氢原理如下:
Ⅰ.2Li+H2 2LiH
Ⅱ.LiH+H2O===LiOH+H2↑
①反应Ⅱ中的氧化剂是______________。
②已知用锂吸收224 L(标准状况)H2,生成的LiH与H2O作用,放出的H2用作电池燃料,若能量转化率为80%
则导线中通过电子的物质的量为________mol。
第 7 页 共 7 页
高一化学四月份月考试题答案
一.单选题(每题 2 分,共 40 分)
1.C 2.D 3.B 4.A 5.B 6.A 7.B 8.D 9.D 10.D
11.D 12.C 13.D 14.D 15.D 16.A 17.D 18.A 19.A 20.C
二.不定项选择(全对的 4 分,只选一个选项2 分,多选、错选不得分)
21.C 22.A D 23.B 24.A B 25.A D
三.填空题
26.(每个空 2 分,共 10 分)
(1)391 (2)Li·+ ·H (3)
- -
(4)HClO4>H2SeO4 (5)2Al +2OH + 2H2O = 2AlO2 + 3H2
27.(每个空 2 分,共 10 分)
(1)石灰石 (2)B C D
(2)① 2C+SiO2 2CO+Si ②
③ SiHCl3 + 3H2O = H2SiO3 + 3HCl + H2
28.(每个空 2 分,共 10 分)
+ -
(1)Cu (2)正 Ag + e = Ag (3)铜 (4)0.25
29.(每个空 2 分,共 10 分)
(1)a b
- - - -
(2) 2H2 + 4OH - 4e = 4H2O O2 + 2H2O + 4e = 4OH
(3)① H2O ② 32
化学试题
相对原子质量:
H1 He4 C12 N14 O16 S32 Na23 Cl35.5 Zn65 Cu64 Ag108
一、选择题(共20小题,每小题2分,共40分。在每小题只有一项符合题目要求。)
1.下列叙述正确的是( )
A. H2和 D2互为同素异形体
B. 金刚石和石墨互为同位素
40 40
C. K 和 Ca 原子中质子数和中子数都不相等
D. 某物质只含一种元素,该物质一定是纯净物
2.不能作为判断硫、氯两种元素非金属性强弱的依据是( )
A.单质氧化性的强弱 B.简单氢化物的稳定性
C.单质与氢气化合的难易 D.氧化物对应的水化物酸性的强弱
3.下列化学用语书写不.正.确.的是( )
A.中子数为1的氢原子:2
1H B.HCl的电子式: H+
C.Na+的结构示意图: D.CH4的结构式:
4.下列说法不正确的是( )
A.需要加热才能发生的反应一定是吸热反应
B.等量的硫蒸气和硫固体分别完全燃烧,前者放出的热量多
C.生成物总能量高于反应物总能量的反应是吸热反应
D.由C(石墨)→C(金刚石) ΔH=+1.9kJ/mol,可知石墨比金刚石稳定
5.下列各组性质比较中,正确的是( )
①沸点: 2- - - -
HF>HCl>HBr>HI ②离子还原性:S >Cl >Br >I
③酸性:HClO4 ?HBrO4 ?HIO4 ④金属性:K>Na>Mg>Al
2- - + 2+
⑤气态氢化物稳定性:HF?HCl?H2S ⑥半径:O >F >Na >Mg
A.①②③ B.③④⑤⑥ C.②③④ D.①③④⑤⑥
6.四种短周期元素 X、Y、Z 和 W 在周期表中的位置如图所示,原子序数之和为 48。下列说法不正确的
是( )
A.同周期元素的简单离子中 W 的简单离子半径最小 X Y
B.是 X 和 W 可形成共价化合物 XW3,其分子构型为三角锥形
Z W
C.W 的非金属性比 Z 的强,所以 W 氢化物比 Z 的稳定
D.Z 的最低价单核阴离子的失电子能力比 Y 的强
第 1 页 共 7 页
7.下列各物质间关系描述正确的是( )
A.Na2O2和Na2O、红磷和白磷均属于同素异形体
B.氕、氘、氚的质子数相同,中子数不同。
C.金刚石和石墨物理性质不同,化学性质相似
D.14 13 ?
6C和 6C、I2和I 都属于同位素
8.元素周期表对化学学习和研究都有重要意义。下列说法错.误.的是
A.通过主族元素原子的最外层电子数,推测其常见的化合价
B.在金属与非金属分界线附近,寻找半导体材料
C.研究氯、硫、磷、砷等所在区域的元素,制造新品种的农药
D.在IA族和ⅡA族的金属中寻找催化剂
9.在 NH3 和 NH4Cl 存在条件下,以活性炭为催化剂,用 H2O2 氧化 CoCl2 溶液来制备化工产品[Co(NH3)6]Cl3,
下列表述正确的是
32
A.中子数为 32,质子数为 27 的钴原子:27Co
B.H2O2 的电子式:
C.NH3 和 NH4Cl 化学键类型相同
D.[Co(NH3)6]Cl3 中 Co 的化合价是+3
10.下列说法不正确的是( )
A.CS2中所含所有原子的最外层电子数均为8
B.沸点:CH4
D.金刚石和冰在熔化时均要破坏共价键
b n-
11.某元素的一个原子形成的离子可表示为aX ,下列有关该原子的说法正确的是( )
A.含有的中子数为a+b B.含有的电子数为a-n
C.质量数为a+b+n D.1mol该原子的质量约为bg
12.依据元素周期表及元素周期律,下列推断正确的是
A.H3BO3的酸性比H2CO3的强
B.HCl、HBr、HI的酸性增强
C.Tl(OH)3是两性氢氧化物
D.若 + 2-
M 和R 的核外电子层结构相同,则离子半径: + 2-
M >R
13.短周期主族元素A、B、C、D的原子序数依次增大,A、C的原子序数相差8,A原子的最外层电子数是其
次外层电子数的3倍,B单质的焰色试验呈黄色。下列说法正确的是( )
A.气态氢化物的热稳定性:A?C
B.元素A与B只能形成一种化合物
第 2 页 共 7 页
C.最高价氧化物对应的水化物的酸性:C?D
D.原子半径的大小顺序: B>C>A
14.下列叙述正确的是( )
A.因为Na2CO3+SiO2 Na2SiO3+CO2↑,所以硅酸的酸性比碳酸强
B.碳和硅都是ⅣA族的元素,所以二氧化碳和二氧化硅的物理性质相似
C.二氧化硅既能溶于氢氧化钠溶液又能溶于氢氟酸,所以二氧化硅是两性氧化物
D.二氧化硅和二氧化碳都是酸性氧化物,但二氧化硅不能和水反应生成硅酸
15.下列各组性质比较中正确的是
①颜色:氯化银、溴化银、碘化银,颜色逐渐加深
②离子还原性: 2- - - -
S >Cl >Br >I
③酸性:HClO4>HBrO4>HIO4
④金属性:K>Na>Mg>Al
⑤气态氢化物稳定性:HF>HCl>H2S
A.①②③ B.①④⑤ C.②③④ D.①③④⑤
16.下列每组物质发生转化所克服的粒子间的相互作用属于同种类型的是( )
A.碘和干冰升华 B.氯化钠的熔化与冰的融化
C.氯化氢和酒精溶于水 D.氯化钠和氯化氢溶于水
17. 反应物X转化为Y和Z的能量变化如图所示,下列说法正确的是( )
A.由X→Y反应的能量变化为E5-E2
B.由X→Z反应的为吸热反应
C.由图可知等物质的量的Y的能量一定比X的能量高
D.X→Z的反应中断裂旧化学键吸收的能量为E4-E2
18.海水是一个巨大的化学资源宝库,下列有关海水综合利用的说法正确的是( )
A.从海水中可以得到NaCl,电解熔融NaCl可制备Cl2
B.海水蒸发制海盐的过程中只发生了化学变化
C.海水中含有钾元素,只需经过物理变化就可以得到钾单质
D.利用潮汐发电是将化学能转化为电能
19.下列反应过程中的能量变化与右图一致的是
高温
A.2Al+Fe2O3=====2Fe+Al2O3 能
量
加热 反应物
B.C+CO2=====2CO
高温 生成物
C.CaCO3=====CaO+CO2↑
反应过程
第 3 页 共 7 页
高温
D.C+H2O=====CO+H2
20.固体 A 的化学式为 NH5,它的所有原子的最外层都符合相应稀有气体原子的最外层电子结构,与H2O反应生
成H2下列说法错误的是
A.阴阳离子个数比是1:1
B.NH5 中既有共价键又有离子键
C.N为+5价
D.它与水反应的化学方程式为:NH5+H2O=NH3·H2O+H2↑
二、选择题(共5小题,每小题4分,共20分。每小题中有一项或二项符合题目要求,只选一个选项且正确得2
分,多选、错选均不得分。)
21.已知1g氢气完全燃烧生成水蒸气时放出热量121kJ,且氧气中1molO=O键完全断裂时吸收热量496kJ,水蒸
气中1molH-O键形成时放出热量463kJ,则氢气中1molH-H键断裂时吸收热量为
A.920kJ B.557kJ C.436kJ D.188kJ
22.化学电源在日常生活和高科技领域中都有广泛应用。下列说法不.正.确.的是
A. Zn2+向Cu电极方向移动,Cu电极附近溶液中H+浓度增加
B. 正极的电极反应式为Ag2O+2e?+H2O 2Ag+2OH?
C. 锌筒作负极,发生氧化反应,锌筒会变薄
D. 使用一段时间后,负极的质量减轻
23.如图所示进行实验,下列说法不正确的是
A.装置甲的锌片上和装置乙的铜片上均可观察到有气泡产生
第 4 页 共 7 页
B.甲、乙装置中的能量变化均为化学能转化为电能
C.装置乙中的锌、铜之间用导线连接电流计,可观察到电流计指针发生偏转
- +
D.装置乙中负极的电极反应式:Zn-2e ===Zn2
24.膦(PH3)在常温下是一种无色有大蒜臭味的有毒气体,电石气的杂质中常含之。它的分子是三角锥形。以下关
于PH3的叙述中,正确的是( )
A.PH3属于共价化合物
B.PH3分子中有未成键的电子对
C.PH3中所有原子都满足8电子稳定结构
D.PH3分子中的P-H键是非极性键
25.过氧化氢俗称双氧水,医疗上常用质量分数为 3%的双氧水进行伤口消毒。H2O2能与 SO2,
反应生成 H+,SO42-,H2O2 的分子结构如下图所示。下列说法错误的是
A.H2O2分子中氧元素的化合价是-1,所以O的最外层不满足8电子结构
B.H2O2为含有极性键和非极性键的共价化合物
C.H2O2与 SO2在水溶液中反应的离子方程式为 SO2+H2O2=2H++SO42-
D.H2O2与 SO2反应过程中有共价键断裂,同时有共价键和离子键形成
三、非选择题:本题共4小题,共40分。
26.(共0分)
a
b c d e
f g h
i j
(1)现己知N2(g)和H2(g)反应生成1molNH3(g)过程中能量变化如图所示。根据下列键能数据计算N-H
-
键键能为 kJ?mol 1。
(2)a、b组成的离子化合物的形成过程为
(3)已知i原子的最外层有2个电子,则i的原子结构示意图为
第 5 页 共 7 页
(4)h和j的最高价氧化物的水化物的酸性顺序为 > (填化学式)
(5)g的位于金属和非金属分界线附近,其单质可以与f的最高价氧化物的水化物反应,请写出该反应的离子方程
式
27.C和Si是构成非金属材料的主要元素,有关C和Si请回答下列问题:
(1)水泥、玻璃和陶瓷是三大传统无机非金属材料,其中制备水泥和玻璃的共同原料是 (填写名称)
(2)下列说法正确的是
A. 光导纤维是传播电信号的新型无机非金属材料,它的主要成份是晶体硅
B. SiC俗称金刚砂,它硬度大,熔点高,可以制造汽车的发动机和轴承
C. 碳纳米材料在能源、医疗、信息等领域有广阔的应用前景,它主要包括富勒烯、碳纳米管、石墨烯等
D. 石墨烯是只有一个碳原子直径厚度的单层石墨,它是目前世界上已知的最硬、最轻的新型材料
E. 金刚石、石墨和富勒烯互为同素异形体,其中富勒烯的摩尔质量为720
(3)高纯硅是制备高性能芯片的原料,下列是制备高纯硅的工艺流程:
①制备粗硅的化学方程式
②SiHCl3可以看做是SiH4中的3个H被Cl取代了,那么SiHCl3的结构式为
③整个制备过程必须严格控制无水、无氧。SiHCl3遇水剧烈反应生成H2SiO3、HCl和另一种物质,写出该反应
的化学方程式:_______________________________________。
28.依据氧化还原反应:2Ag+(aq) +Cu(s) =Cu2+(aq) +2Ag(s)设计的原电池如图所示。请回答下列问题:
(1)电极X的材料是石墨,则电极Y的材料是______________;
(2)x 电极为电池的___________极,发生的电极反应为________________________________;
(3)溶液中的NO3-中的流向___________电极(填电极材料名称)。
(4)假设水槽中有100mL溶液,当X电极的质量增加5.4g时,溶液中C(Cu2+)= mol·L-1
第 6 页 共 7 页
29氢氧燃料电池是符合绿色化学理念的新型发电装置。下图为电池示意图,该电池电极表面镀一层细小的铂粉,铂
吸附气体的能力强,性质稳定。请回答:
(1)在导线中电子流动方向为________(用a、b表示)。
(2)负极反应式为______________________________________
正极反应式为______________________________________
(3)该电池工作时,H2和O2连续由外部供给,电池可连续不断提供电能。因此,大量安
全储氢是关键技术之一。金属锂是一种重要的储氢材料,吸氢和放氢原理如下:
Ⅰ.2Li+H2 2LiH
Ⅱ.LiH+H2O===LiOH+H2↑
①反应Ⅱ中的氧化剂是______________。
②已知用锂吸收224 L(标准状况)H2,生成的LiH与H2O作用,放出的H2用作电池燃料,若能量转化率为80%
则导线中通过电子的物质的量为________mol。
第 7 页 共 7 页
高一化学四月份月考试题答案
一.单选题(每题 2 分,共 40 分)
1.C 2.D 3.B 4.A 5.B 6.A 7.B 8.D 9.D 10.D
11.D 12.C 13.D 14.D 15.D 16.A 17.D 18.A 19.A 20.C
二.不定项选择(全对的 4 分,只选一个选项2 分,多选、错选不得分)
21.C 22.A D 23.B 24.A B 25.A D
三.填空题
26.(每个空 2 分,共 10 分)
(1)391 (2)Li·+ ·H (3)
- -
(4)HClO4>H2SeO4 (5)2Al +2OH + 2H2O = 2AlO2 + 3H2
27.(每个空 2 分,共 10 分)
(1)石灰石 (2)B C D
(2)① 2C+SiO2 2CO+Si ②
③ SiHCl3 + 3H2O = H2SiO3 + 3HCl + H2
28.(每个空 2 分,共 10 分)
+ -
(1)Cu (2)正 Ag + e = Ag (3)铜 (4)0.25
29.(每个空 2 分,共 10 分)
(1)a b
- - - -
(2) 2H2 + 4OH - 4e = 4H2O O2 + 2H2O + 4e = 4OH
(3)① H2O ② 32
同课章节目录
