6.3 金属矿物与冶炼 课件(31张PPT)
文档属性
| 名称 | 6.3 金属矿物与冶炼 课件(31张PPT) |

|
|
| 格式 | ppt | ||
| 文件大小 | 2.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 粤教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-04-14 00:00:00 | ||
图片预览










文档简介
3CO+Fe2O3===2Fe+3CO2
高温
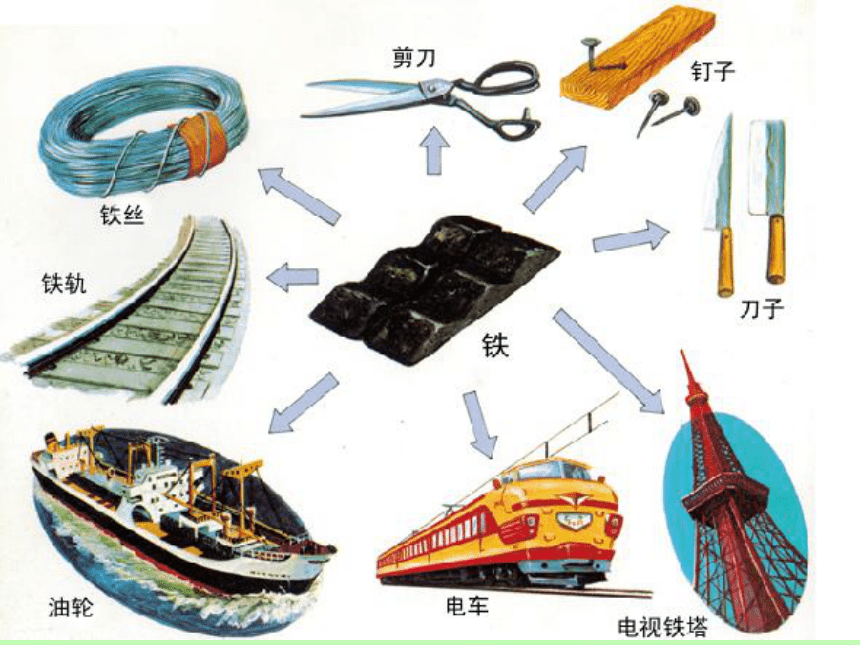
1、在生产和日常生活中应用最广泛的金属是什么?
2、你对它还有什么了解?
1、铁的化学性质如何?
2、地壳中铁的含量怎么样?
3、铁在自然界中主要以化合物形式还是单质的形式存在?
较活泼泼
4.75%
化合物
一、常见的金属矿物
赤铁矿(Fe2O3)
磁铁矿(Fe3O4)
孔雀石(Cu2(OH)2CO3)
软锰矿(MnO2)
常见的金属矿物
黄铁矿(FeS2)
褐铁矿(Fe2O3·nH2O)
黄铜矿(CuFeS2)
方铅矿(PbS)
由于铁的化学性质比较活泼,它在自然界中以化合物的形式存在, 在地壳中含量位居金属元素的第二位,仅次于铝,约占地壳总质量的4.75%。
我国大型铁矿有:辽宁鞍山、湖北大冶、四川攀枝花,马鞍山。
使金属矿物变成金属的过程,叫做金属的冶炼。
小资料
Fe2O3和Fe的组成上均含有Fe元素,不同之处在于Fe少了O元素,要使Fe2O3转变成Fe ,可从哪方面入手?
可在 一定条件下,可加入某类物质,让其与Fe2O3中的O元素结合, 主动夺取Fe2O3中的“O”元素,使Fe2O3转变成金属Fe。
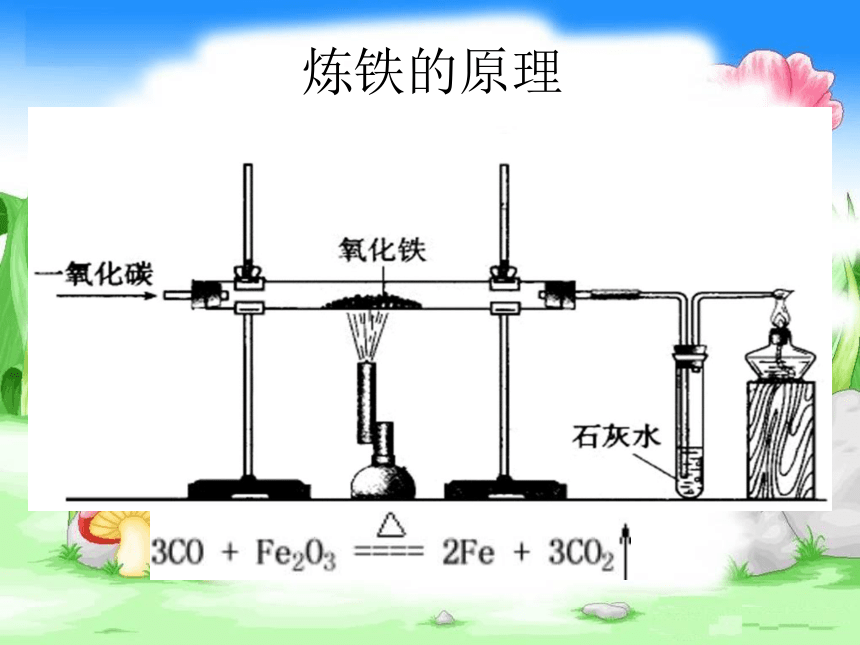
二、炼铁的原理
金属铁的冶炼,以赤铁矿为例,通常使用的还原剂是CO,用CO 去抢Fe2O3中的O 。其化学方程式为:
CO+ Fe2O3 —— Fe+
高温
3
2
3
CO2
在高温条件下,用还原剂一氧化碳从铁的氧化物中将铁还原出来。
-----炼铁的原理
O3
氧化还原反应
像Fe2O3这样,氧化物失去氧的反应,叫做还原反应。
像CO这样,能夺取含氧化合物里的氧,使它发生还原反应的物质,具有还原性,化学实验和生产中可做为还原剂,H2、C都可以作还原剂。
还原剂:是在氧化还原反应里,失去电子或有电子偏离的物质,具有还原性,被氧化,其产物叫氧化产物
氧化剂:是氧化还原反应里得到电子或有电子对偏向的物质,也即由高价变到低价的物质,生成还原产物
3CO + Fe2O3 =(高温)= 2Fe + 3CO2
炼铁的原理
实验现象
1、红色的固体逐渐变成黑色,且能被磁铁吸引;
2、澄清的石灰水变浑浊。
3CO+ Fe2O3 3CO2 + 2 Fe
高温
CO2+Ca(OH)2===CaCO3 +H2O
化学方程式
观察与思考
1、通入一氧化碳前要先 。
2、澄清石灰水的作用是什么?实验中会出现
什么现象?
3、尾气应如何处理?
4、实验中为什么要先通一段时间CO,再加
热Fe2O3 ?
5、实验结束时应如何操作目?
6、如何验证实验中产生了铁?
检查装置的气密性
验证反应是否产生CO2;浑浊
CO有剧毒,要燃烧或收集起来 !
排尽里面的空气,以免和co混合在加热时发生爆炸!
先熄灭酒精灯,继续通一会儿一氧化碳,防止Fe又被氧化成Fe2O3以至实验失败。
用磁铁靠近,黑色粉末能被吸引说明
生成了铁,将固体加入稀盐酸中,有气泡放出,且溶液变为浅绿色,说明有铁生成。
三、铁的冶炼
炼铁
原料:
铁矿石、焦炭、石灰石
设备:
高炉
反应原理:
产品:
生铁
用还原剂将铁从它的化合物中还原出来
2、炼铁中各原料的作用:
铁矿石--
焦 炭--
石灰石--
空 气--
提供铁 元素
a、燃烧产生热量
b、产生还原剂 CO
制造炉渣
提供氧气
1、炼铁的主要设备是:
主要反应
C+O2==CO2
C+CO2==2CO
3CO+Fe2O3==2Fe+3CO2
高温
高温
点燃
高炉
纯铁
铁的合金
生铁
钢
(含碳量不同)
(2%~4.3%)硬度比纯铁硬
(0.03%~2%)硬度、抗腐蚀性能增强
炼钢和炼铁的比较
生铁冶炼
炼钢
原料
铁矿石、焦炭、空气、石灰石
生铁、废钢
原理
在高温下,用一氧化碳从铁的氧化物中将铁还原出来。
Fe2O3+3CO===2Fe+3CO2
用氧气或铁的氧化物除去生铁中多余的碳元素
主要
设备
高炉
转炉、平炉、电炉
产品
生铁
钢
高温
生铁和钢的比较
?
生铁
钢
组成
元素
铁及少量碳、硅、锰、硫、磷
铁及少量碳、硅、锰几乎不含硫、磷
碳元素含量
2%~4.3%
0.03%~2%
?
分类
用途
白口铁:用于炼钢
灰口铁:制造化工机械、铸件
球墨铸铁:机械强度高,可代替钢
碳素钢(低碳钢、中碳钢、高碳钢)
合金钢(锰钢、不锈钢、硅钢、钨钢)
机械
性能
硬而脆、无韧性、可铸不可锻
坚硬、韧性大、塑性好、可铸、可锻、可压延
对金属而言:
越活泼的金属,越容易与其他物质形成化合物,也就越难从化合物中还原出金属单质.
越不活泼的金属, 越不容易与其他物质形成化合物,也就越容易从化合物中还原出金属单质.
金属在自然界的存在
银、金、铂等金属,化学活动性很弱,在自然界里,它们常以游离态(单质形式)存在。
活泼金属都化合态(以化合物的形式)存在
课 堂 小 结
第六章 金 属
五、金属的冶炼方法
冶炼金属的常用方法:
1.活泼金属(如K Na Mg AI)
电解法: 2AI2O3 = 4AI+3O2
2.一般金属(如Zn Fe Sn Pb Cu)
热还原法: Fe2O3+3CO = 2Fe+3CO2
3.较稳定金属(如Hg Ag)
直接加热法: 2HgO = 2Hg+O2
4.稳定金属(如Pt、Au) : 直接以单质形式存在
通电
高温
加热
六、有关不纯物质的计算
例:要炼出含2%杂质的生铁1600吨,需要含氧化铁质量分数为80%的赤铁矿石多少吨?
解:设需要含80%的赤铁矿石的质量为x
=
1600吨生铁含纯铁的质量为:1600吨×(1-2%)= 1568吨
高温
Fe2O3+3CO 2Fe+3CO2
160 112
x×80% 1568吨
160 112
x×80% 1568吨
解得: x = 2800吨
答:需这种赤铁矿石2800吨。
小结:
1. 认识自然界常见的矿物;
2. 炼铁的原理和注意事项;
3. 铁和钢的冶炼;
4. 金属的冶炼方法;
5. 有关不纯物的计算。
1.工业上以赤铁矿(Fe2O3)为原料冶炼铁。某钢铁厂冶炼896Kg铁,需要含Fe2O364%的赤铁矿多少千克?
随堂练习
2、2.8gCO在高温下跟5.8g某种铁的氧化物完全反应,这种氧化物是( )
A、FeO B、Fe2O3 C、Fe3O4
高温
1、在生产和日常生活中应用最广泛的金属是什么?
2、你对它还有什么了解?
1、铁的化学性质如何?
2、地壳中铁的含量怎么样?
3、铁在自然界中主要以化合物形式还是单质的形式存在?
较活泼泼
4.75%
化合物
一、常见的金属矿物
赤铁矿(Fe2O3)
磁铁矿(Fe3O4)
孔雀石(Cu2(OH)2CO3)
软锰矿(MnO2)
常见的金属矿物
黄铁矿(FeS2)
褐铁矿(Fe2O3·nH2O)
黄铜矿(CuFeS2)
方铅矿(PbS)
由于铁的化学性质比较活泼,它在自然界中以化合物的形式存在, 在地壳中含量位居金属元素的第二位,仅次于铝,约占地壳总质量的4.75%。
我国大型铁矿有:辽宁鞍山、湖北大冶、四川攀枝花,马鞍山。
使金属矿物变成金属的过程,叫做金属的冶炼。
小资料
Fe2O3和Fe的组成上均含有Fe元素,不同之处在于Fe少了O元素,要使Fe2O3转变成Fe ,可从哪方面入手?
可在 一定条件下,可加入某类物质,让其与Fe2O3中的O元素结合, 主动夺取Fe2O3中的“O”元素,使Fe2O3转变成金属Fe。
二、炼铁的原理
金属铁的冶炼,以赤铁矿为例,通常使用的还原剂是CO,用CO 去抢Fe2O3中的O 。其化学方程式为:
CO+ Fe2O3 —— Fe+
高温
3
2
3
CO2
在高温条件下,用还原剂一氧化碳从铁的氧化物中将铁还原出来。
-----炼铁的原理
O3
氧化还原反应
像Fe2O3这样,氧化物失去氧的反应,叫做还原反应。
像CO这样,能夺取含氧化合物里的氧,使它发生还原反应的物质,具有还原性,化学实验和生产中可做为还原剂,H2、C都可以作还原剂。
还原剂:是在氧化还原反应里,失去电子或有电子偏离的物质,具有还原性,被氧化,其产物叫氧化产物
氧化剂:是氧化还原反应里得到电子或有电子对偏向的物质,也即由高价变到低价的物质,生成还原产物
3CO + Fe2O3 =(高温)= 2Fe + 3CO2
炼铁的原理
实验现象
1、红色的固体逐渐变成黑色,且能被磁铁吸引;
2、澄清的石灰水变浑浊。
3CO+ Fe2O3 3CO2 + 2 Fe
高温
CO2+Ca(OH)2===CaCO3 +H2O
化学方程式
观察与思考
1、通入一氧化碳前要先 。
2、澄清石灰水的作用是什么?实验中会出现
什么现象?
3、尾气应如何处理?
4、实验中为什么要先通一段时间CO,再加
热Fe2O3 ?
5、实验结束时应如何操作目?
6、如何验证实验中产生了铁?
检查装置的气密性
验证反应是否产生CO2;浑浊
CO有剧毒,要燃烧或收集起来 !
排尽里面的空气,以免和co混合在加热时发生爆炸!
先熄灭酒精灯,继续通一会儿一氧化碳,防止Fe又被氧化成Fe2O3以至实验失败。
用磁铁靠近,黑色粉末能被吸引说明
生成了铁,将固体加入稀盐酸中,有气泡放出,且溶液变为浅绿色,说明有铁生成。
三、铁的冶炼
炼铁
原料:
铁矿石、焦炭、石灰石
设备:
高炉
反应原理:
产品:
生铁
用还原剂将铁从它的化合物中还原出来
2、炼铁中各原料的作用:
铁矿石--
焦 炭--
石灰石--
空 气--
提供铁 元素
a、燃烧产生热量
b、产生还原剂 CO
制造炉渣
提供氧气
1、炼铁的主要设备是:
主要反应
C+O2==CO2
C+CO2==2CO
3CO+Fe2O3==2Fe+3CO2
高温
高温
点燃
高炉
纯铁
铁的合金
生铁
钢
(含碳量不同)
(2%~4.3%)硬度比纯铁硬
(0.03%~2%)硬度、抗腐蚀性能增强
炼钢和炼铁的比较
生铁冶炼
炼钢
原料
铁矿石、焦炭、空气、石灰石
生铁、废钢
原理
在高温下,用一氧化碳从铁的氧化物中将铁还原出来。
Fe2O3+3CO===2Fe+3CO2
用氧气或铁的氧化物除去生铁中多余的碳元素
主要
设备
高炉
转炉、平炉、电炉
产品
生铁
钢
高温
生铁和钢的比较
?
生铁
钢
组成
元素
铁及少量碳、硅、锰、硫、磷
铁及少量碳、硅、锰几乎不含硫、磷
碳元素含量
2%~4.3%
0.03%~2%
?
分类
用途
白口铁:用于炼钢
灰口铁:制造化工机械、铸件
球墨铸铁:机械强度高,可代替钢
碳素钢(低碳钢、中碳钢、高碳钢)
合金钢(锰钢、不锈钢、硅钢、钨钢)
机械
性能
硬而脆、无韧性、可铸不可锻
坚硬、韧性大、塑性好、可铸、可锻、可压延
对金属而言:
越活泼的金属,越容易与其他物质形成化合物,也就越难从化合物中还原出金属单质.
越不活泼的金属, 越不容易与其他物质形成化合物,也就越容易从化合物中还原出金属单质.
金属在自然界的存在
银、金、铂等金属,化学活动性很弱,在自然界里,它们常以游离态(单质形式)存在。
活泼金属都化合态(以化合物的形式)存在
课 堂 小 结
第六章 金 属
五、金属的冶炼方法
冶炼金属的常用方法:
1.活泼金属(如K Na Mg AI)
电解法: 2AI2O3 = 4AI+3O2
2.一般金属(如Zn Fe Sn Pb Cu)
热还原法: Fe2O3+3CO = 2Fe+3CO2
3.较稳定金属(如Hg Ag)
直接加热法: 2HgO = 2Hg+O2
4.稳定金属(如Pt、Au) : 直接以单质形式存在
通电
高温
加热
六、有关不纯物质的计算
例:要炼出含2%杂质的生铁1600吨,需要含氧化铁质量分数为80%的赤铁矿石多少吨?
解:设需要含80%的赤铁矿石的质量为x
=
1600吨生铁含纯铁的质量为:1600吨×(1-2%)= 1568吨
高温
Fe2O3+3CO 2Fe+3CO2
160 112
x×80% 1568吨
160 112
x×80% 1568吨
解得: x = 2800吨
答:需这种赤铁矿石2800吨。
小结:
1. 认识自然界常见的矿物;
2. 炼铁的原理和注意事项;
3. 铁和钢的冶炼;
4. 金属的冶炼方法;
5. 有关不纯物的计算。
1.工业上以赤铁矿(Fe2O3)为原料冶炼铁。某钢铁厂冶炼896Kg铁,需要含Fe2O364%的赤铁矿多少千克?
随堂练习
2、2.8gCO在高温下跟5.8g某种铁的氧化物完全反应,这种氧化物是( )
A、FeO B、Fe2O3 C、Fe3O4
