富集在海水中的元素氯练习题[无答案]
文档属性
| 名称 | 富集在海水中的元素氯练习题[无答案] |  | |
| 格式 | zip | ||
| 文件大小 | 97.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-02-23 15:59:06 | ||
图片预览


文档简介
广外中山外校 高一化学作业 作业设计:计庆国 2012-02-14
富集在海水中的元素 氯(3)
1. 检验Cl―时所用试剂稀HNO3的作用是( )
A.防止CO32―的干扰 B.防止Cl―的干扰 C.生成Ag2CO3沉淀 D.防止NO3―的干扰
2. 向NaI和NaBr的混合溶液中通入足量的氯气,充分反应后将溶液蒸干,灼烧上述残留物,最后得到的物质是( )
A.NaCl、I2 B.NaCl、NaBr C.NaBr、I2 D.NaCl
3. 将下列物质分别滴加到干燥的有色布条上,不能使其褪色的是( )
A.新制的氯水 B.液氯 C.次氯酸钙溶液 D.盐酸和次氯酸钠的混合溶液
4. 下列反应不属于氧化还原反应的是( )
A.2F2 + 2H2O = 4HF + O2 B.Cl2 + H2O = HCl + HClO
C.BrCl + H2O = HCl + HBrO D.2Cl2 + 2Ca(OH)2 = CaCl2 + Ca(ClO)2 + 2H2O
5.现有一种漂白粉的“有效氯”(过量HCl和漂白粉作用生成Cl2的质量和漂白粉质量之比)为35.5%,若该漂白粉的组成和化学式Ca(OH)2 3CaCl(ClO) nH2O相符,则式中n值应是( )
A.6.5 B.8 C.8.5 D.10
6. 甲、乙、丙三种溶液中各有一种X―(X―为Cl―、Br―、I― )离子,向甲中加入淀粉溶液和氯水,溶液变为橙色,再加丙溶液,颜色无明显变化,则甲、乙、丙依次含有( )
A.Br―、I―、Cl― B.Br―、Cl―、I― C.I― 、Br―、Cl― D.Cl―、I― 、Br―
7.为了证明氯酸钾晶体中含有氯元素,选用给出的试剂和操作,其操作顺序正确的是( )
①滴加AgNO3溶液 ②加水溶解 ③过滤、取滤液 ④与二氧化锰混合加热 ⑤加稀HNO3 ⑥与浓盐酸反应 ⑦加NaOH溶液加热 ⑧用淀粉碘化钾
A.④②③①⑤ B.⑥⑧ C.⑥⑦①⑤ D.②①⑤
8.将0.2 mol MnO2和50 mL 12 mol/L盐酸混合后缓缓加热,反应完全 后向留下的溶液中加入足量AgNO3溶液,生成AgCl沉淀物质的量为(不考虑盐酸的挥发) ( )
A.等于0.3 mol B.小于0.3 mol C.大于0.3 mol D.以上结论都不正确
9.下列说法正确的是 ( )
①氯气的性质活泼,它与氢气混合后立即发生爆炸
②实验室制取氯气时,为了防止环境污染,多余的氯气可以用氢氧化钙溶液吸收
③新制氯水的漂白性强于久置氯水
④检验HCl气体中是否混有Cl2方法是将气体通入硝酸银溶液
⑤除去HCl气体中的Cl2可将气体通入饱和食盐水
A.①②③ B.②③④ C.③ D.③⑤
10. ClO2是一种消毒杀菌效率高、二次污染小的处理剂。实验室可通过以下反应制得ClO2:2KClO3+H2C2O4+H2SO42ClO2↑+2CO2↑+2H2O+K2SO4下列说法正确的是 ( )
A.KClO3在反应中得电子 B.ClO2是氧化产物
C.H2C2O4在反应中被还原 D.1 mol KClO3参加反应有2 mol电子转移
11.下列关于氯气性质的叙述正确的是( )
A.钠在氯气中燃烧产生白色烟雾 B.红热的铜丝可以在氯气中燃烧,产生棕黄色烟雾
C.纯净的氢气可以在氯气中安静地燃烧,发出苍白色火焰
D.氯气可用于漂白,这是氯气的漂白作用
12.下列有关化学反应过程或实验现象的叙述中,正确的是( )
A.氯气的水溶液可以导电,说明氯气是电解质
B.漂白粉和明矾都常用于自来水的处理,二者的作用原理是相同的
C.氯气可以使湿润的有色布条褪色,但实际起漂白作用的物质是次氯酸而不是氯气
D.在滴有酚酞的Na2CO3溶液中,加入BaCl2溶液后溶液的红色褪去,说明BaCl2溶液具有酸性
13.漂白粉在空气中放置易失效的主要原因是( )
A.Ca(ClO)2不稳定,易分解 B.Ca(ClO)2易吸收水分而潮解
C.Ca(ClO)2跟空气中的水和CO2反应 D.Ca(ClO)2跟空气中的CO2反应
14.右图是一种试验某气体化学性质的实验装置,图中B为开关。如果先打开B,在A处通入干燥氯气,C中红色布条颜色无变化;当关闭B时,C中红色布条颜色褪去。则D瓶中盛有的溶液是 ( )
A.浓H2SO4 B.饱和NaCl溶液
C.浓NaOH溶液 D.浓NaBr溶液
15.下列关于氯的说法正确的是 ( )
A.Cl2具有很强的氧化性,在化学反应中只能作氧化剂
B. 干燥的Cl2 可以使湿润的红色布条褪色
C.实验室制备Cl2,可用排饱和食盐水集气法收集
D.1.12 L Cl2含有1.7NA个质子(NA 表示阿伏加德罗常数)
广外中山外校 高一化学作业 作业设计:计庆国 2012-02-15
富集在海水中的元素 氯(4)
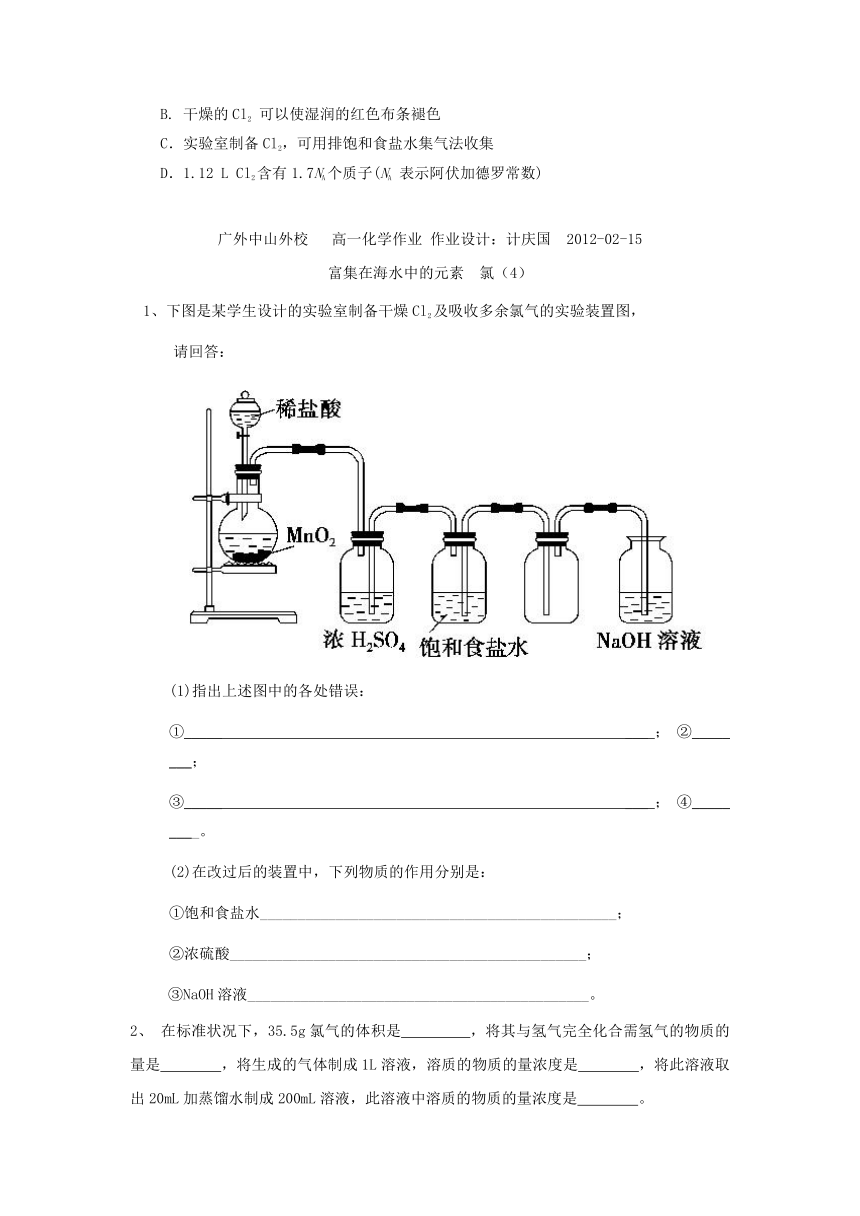
1、下图是某学生设计的实验室制备干燥Cl2及吸收多余氯气的实验装置图,
请回答:
(1)指出上述图中的各处错误:
①_____ ___;②_____ ___;
③_____ ___;④_____ ____。
(2)在改过后的装置中,下列物质的作用分别是:
①饱和食盐水_______________________________________________;
②浓硫酸_______________________________________________;
③NaOH溶液_____________________________________________。
2、 在标准状况下,35.5g氯气的体积是 ,将其与氢气完全化合需氢气的物质的量是 ,将生成的气体制成1L溶液,溶质的物质的量浓度是 ,将此溶液取出20mL加蒸馏水制成200mL溶液,此溶液中溶质的物质的量浓度是 。
3、 已知Br2跟NaOH溶液的反应类似于Cl2跟NaOH溶液的反应,写出此反应的化学方程式和离子方程式。
4、某校化学实验兴趣小组为了探究在实验室制备Cl2的过程中有水蒸气和HCl挥发出来,同时证明氯气的某些性质,甲同学设计了如图所示的实验装置(支撑用的铁架台省略),按要求回答问题.
(1)若用含有0.2 mol HCl的浓盐酸与足量的MnO2反应制Cl2,制得的Cl2体积(标准状
况下)总是小于1.12 L的原因是_______________________________ ___________
________________________________________________________________________.
(2)①装置B中盛放的试剂名称为________,作用是___________________,
现象是________________________________________.
②装置D和E中出现的不同现象说明的问题是
________________________________________________________________________
________________________________________________________________________.
③装置F的作用是____________________________________________________.
④写出装置G中发生反应的离子方程式_________________________________
(3)乙同学认为甲同学的实验有缺陷,不能确保最终通入AgNO3溶液中的气体只有一种.为了确保实验结论的可靠性,证明最终通入AgNO3溶液的气体只有一种,乙同学提出在某两个装置之间再加一个装置.你认为该装置应加在________与________之间(填装置字母序号),装置中应放入___ _____(填写试剂或用品名称).
5、 把滤纸用淀粉和碘化钾的溶液浸泡,晾干后就是实验室常用的淀粉碘化钾试纸,这种试纸润湿后遇到氯气会发生什么变化?为什么
广外中山外校 高一化学作业 作业设计:计庆国 2012-02-16
富集在海水中的元素 氯(5)
1、具有强氧化性的物质通常能表现出漂白性。氯水具有漂白性,但氯水含有的Cl2和HClO均具有强氧化性,为弄清楚到底是哪一种物质使氯水显示漂白性,某化学兴趣小组设计了如下实验:
请回答下列问题:
(1)该实验的目的是____________________________________________。
(2)浓硫酸的作用是____________________________________________。
与研究目的直接相关的实验现象是 __________________________________________________________。
(3)根据实验现象,可推知能使氯水显示漂白性的是________。
(4)从物质性质的方面来看,这样的实验设计还存在事故隐患,事故表现是__ ______________。
请在图D处以图的形式表明克服事故隐患的措拖。
2、氯气在实验室主要用二氧化锰和浓盐酸共热制得,其反应的离子方程式为:
_____________ _______________,
制取漂白粉的化学方程式是_ __________,
制取漂白液的化学方程式是_ __________,
漂白粉长期放置于空气中会变质失效,其化学方程式是
_ ______
3、某同学用200 mL 12 mol·L-1浓HCl和足量MnO2缓缓加热来制取Cl2,并将生成的Cl2通入FeBr2溶液和FeI2溶液中来探究Fe2+、Br-和I-的还原性强弱.请回答下列问题:
(1)将少量的Cl2通入FeBr2溶液中,溶液由浅绿色变为棕黄色,则该反应的离子方程式为____________________________________________________________
(2)若将等物质的量的Cl2和FeI2充分反应,再向所得溶液中滴加KSCN溶液,无红色物质生成,则Fe2+、Br-和I-的还原性由强到弱的顺序为_________________________________.
4、如图所示是一个制取氯气并以氯气为原料进行特定反应的装置,多余的氯气可以贮存在b瓶中,其中各试剂瓶中所装试剂为:B(氢硫酸)、C(碘化钾淀粉溶液)、D(水)、F(紫色石蕊试液)。
(已知: Cl2+H2S==2HCl+S ,S难溶于水)
(1)若A中烧瓶中的固体为MnO2,液体为浓盐酸,则其发生反应的化学方程式为
_______ __________。
(2)G中b瓶内宜加入的液体是________,怎样检验装置G的气密性:
____________ ______________
____________ ______________。
____________ ______________。
(3)实验开始后B中的现象是___ ____,
C中的现象是_________ __________。
(4)E装置中硬质玻璃管内盛有炭粉,若E中发生氧化还原反应,其产物为二氧化碳和氯化氢,写出E中反应的化学方程式:_______________________________________________。
(5)在F中,紫色石蕊试液的颜色由紫色变为红色,再变为无色,其原因是
_____________
_____________
富集在海水中的元素 氯(3)
1. 检验Cl―时所用试剂稀HNO3的作用是( )
A.防止CO32―的干扰 B.防止Cl―的干扰 C.生成Ag2CO3沉淀 D.防止NO3―的干扰
2. 向NaI和NaBr的混合溶液中通入足量的氯气,充分反应后将溶液蒸干,灼烧上述残留物,最后得到的物质是( )
A.NaCl、I2 B.NaCl、NaBr C.NaBr、I2 D.NaCl
3. 将下列物质分别滴加到干燥的有色布条上,不能使其褪色的是( )
A.新制的氯水 B.液氯 C.次氯酸钙溶液 D.盐酸和次氯酸钠的混合溶液
4. 下列反应不属于氧化还原反应的是( )
A.2F2 + 2H2O = 4HF + O2 B.Cl2 + H2O = HCl + HClO
C.BrCl + H2O = HCl + HBrO D.2Cl2 + 2Ca(OH)2 = CaCl2 + Ca(ClO)2 + 2H2O
5.现有一种漂白粉的“有效氯”(过量HCl和漂白粉作用生成Cl2的质量和漂白粉质量之比)为35.5%,若该漂白粉的组成和化学式Ca(OH)2 3CaCl(ClO) nH2O相符,则式中n值应是( )
A.6.5 B.8 C.8.5 D.10
6. 甲、乙、丙三种溶液中各有一种X―(X―为Cl―、Br―、I― )离子,向甲中加入淀粉溶液和氯水,溶液变为橙色,再加丙溶液,颜色无明显变化,则甲、乙、丙依次含有( )
A.Br―、I―、Cl― B.Br―、Cl―、I― C.I― 、Br―、Cl― D.Cl―、I― 、Br―
7.为了证明氯酸钾晶体中含有氯元素,选用给出的试剂和操作,其操作顺序正确的是( )
①滴加AgNO3溶液 ②加水溶解 ③过滤、取滤液 ④与二氧化锰混合加热 ⑤加稀HNO3 ⑥与浓盐酸反应 ⑦加NaOH溶液加热 ⑧用淀粉碘化钾
A.④②③①⑤ B.⑥⑧ C.⑥⑦①⑤ D.②①⑤
8.将0.2 mol MnO2和50 mL 12 mol/L盐酸混合后缓缓加热,反应完全 后向留下的溶液中加入足量AgNO3溶液,生成AgCl沉淀物质的量为(不考虑盐酸的挥发) ( )
A.等于0.3 mol B.小于0.3 mol C.大于0.3 mol D.以上结论都不正确
9.下列说法正确的是 ( )
①氯气的性质活泼,它与氢气混合后立即发生爆炸
②实验室制取氯气时,为了防止环境污染,多余的氯气可以用氢氧化钙溶液吸收
③新制氯水的漂白性强于久置氯水
④检验HCl气体中是否混有Cl2方法是将气体通入硝酸银溶液
⑤除去HCl气体中的Cl2可将气体通入饱和食盐水
A.①②③ B.②③④ C.③ D.③⑤
10. ClO2是一种消毒杀菌效率高、二次污染小的处理剂。实验室可通过以下反应制得ClO2:2KClO3+H2C2O4+H2SO42ClO2↑+2CO2↑+2H2O+K2SO4下列说法正确的是 ( )
A.KClO3在反应中得电子 B.ClO2是氧化产物
C.H2C2O4在反应中被还原 D.1 mol KClO3参加反应有2 mol电子转移
11.下列关于氯气性质的叙述正确的是( )
A.钠在氯气中燃烧产生白色烟雾 B.红热的铜丝可以在氯气中燃烧,产生棕黄色烟雾
C.纯净的氢气可以在氯气中安静地燃烧,发出苍白色火焰
D.氯气可用于漂白,这是氯气的漂白作用
12.下列有关化学反应过程或实验现象的叙述中,正确的是( )
A.氯气的水溶液可以导电,说明氯气是电解质
B.漂白粉和明矾都常用于自来水的处理,二者的作用原理是相同的
C.氯气可以使湿润的有色布条褪色,但实际起漂白作用的物质是次氯酸而不是氯气
D.在滴有酚酞的Na2CO3溶液中,加入BaCl2溶液后溶液的红色褪去,说明BaCl2溶液具有酸性
13.漂白粉在空气中放置易失效的主要原因是( )
A.Ca(ClO)2不稳定,易分解 B.Ca(ClO)2易吸收水分而潮解
C.Ca(ClO)2跟空气中的水和CO2反应 D.Ca(ClO)2跟空气中的CO2反应
14.右图是一种试验某气体化学性质的实验装置,图中B为开关。如果先打开B,在A处通入干燥氯气,C中红色布条颜色无变化;当关闭B时,C中红色布条颜色褪去。则D瓶中盛有的溶液是 ( )
A.浓H2SO4 B.饱和NaCl溶液
C.浓NaOH溶液 D.浓NaBr溶液
15.下列关于氯的说法正确的是 ( )
A.Cl2具有很强的氧化性,在化学反应中只能作氧化剂
B. 干燥的Cl2 可以使湿润的红色布条褪色
C.实验室制备Cl2,可用排饱和食盐水集气法收集
D.1.12 L Cl2含有1.7NA个质子(NA 表示阿伏加德罗常数)
广外中山外校 高一化学作业 作业设计:计庆国 2012-02-15
富集在海水中的元素 氯(4)
1、下图是某学生设计的实验室制备干燥Cl2及吸收多余氯气的实验装置图,
请回答:
(1)指出上述图中的各处错误:
①_____ ___;②_____ ___;
③_____ ___;④_____ ____。
(2)在改过后的装置中,下列物质的作用分别是:
①饱和食盐水_______________________________________________;
②浓硫酸_______________________________________________;
③NaOH溶液_____________________________________________。
2、 在标准状况下,35.5g氯气的体积是 ,将其与氢气完全化合需氢气的物质的量是 ,将生成的气体制成1L溶液,溶质的物质的量浓度是 ,将此溶液取出20mL加蒸馏水制成200mL溶液,此溶液中溶质的物质的量浓度是 。
3、 已知Br2跟NaOH溶液的反应类似于Cl2跟NaOH溶液的反应,写出此反应的化学方程式和离子方程式。
4、某校化学实验兴趣小组为了探究在实验室制备Cl2的过程中有水蒸气和HCl挥发出来,同时证明氯气的某些性质,甲同学设计了如图所示的实验装置(支撑用的铁架台省略),按要求回答问题.
(1)若用含有0.2 mol HCl的浓盐酸与足量的MnO2反应制Cl2,制得的Cl2体积(标准状
况下)总是小于1.12 L的原因是_______________________________ ___________
________________________________________________________________________.
(2)①装置B中盛放的试剂名称为________,作用是___________________,
现象是________________________________________.
②装置D和E中出现的不同现象说明的问题是
________________________________________________________________________
________________________________________________________________________.
③装置F的作用是____________________________________________________.
④写出装置G中发生反应的离子方程式_________________________________
(3)乙同学认为甲同学的实验有缺陷,不能确保最终通入AgNO3溶液中的气体只有一种.为了确保实验结论的可靠性,证明最终通入AgNO3溶液的气体只有一种,乙同学提出在某两个装置之间再加一个装置.你认为该装置应加在________与________之间(填装置字母序号),装置中应放入___ _____(填写试剂或用品名称).
5、 把滤纸用淀粉和碘化钾的溶液浸泡,晾干后就是实验室常用的淀粉碘化钾试纸,这种试纸润湿后遇到氯气会发生什么变化?为什么
广外中山外校 高一化学作业 作业设计:计庆国 2012-02-16
富集在海水中的元素 氯(5)
1、具有强氧化性的物质通常能表现出漂白性。氯水具有漂白性,但氯水含有的Cl2和HClO均具有强氧化性,为弄清楚到底是哪一种物质使氯水显示漂白性,某化学兴趣小组设计了如下实验:
请回答下列问题:
(1)该实验的目的是____________________________________________。
(2)浓硫酸的作用是____________________________________________。
与研究目的直接相关的实验现象是 __________________________________________________________。
(3)根据实验现象,可推知能使氯水显示漂白性的是________。
(4)从物质性质的方面来看,这样的实验设计还存在事故隐患,事故表现是__ ______________。
请在图D处以图的形式表明克服事故隐患的措拖。
2、氯气在实验室主要用二氧化锰和浓盐酸共热制得,其反应的离子方程式为:
_____________ _______________,
制取漂白粉的化学方程式是_ __________,
制取漂白液的化学方程式是_ __________,
漂白粉长期放置于空气中会变质失效,其化学方程式是
_ ______
3、某同学用200 mL 12 mol·L-1浓HCl和足量MnO2缓缓加热来制取Cl2,并将生成的Cl2通入FeBr2溶液和FeI2溶液中来探究Fe2+、Br-和I-的还原性强弱.请回答下列问题:
(1)将少量的Cl2通入FeBr2溶液中,溶液由浅绿色变为棕黄色,则该反应的离子方程式为____________________________________________________________
(2)若将等物质的量的Cl2和FeI2充分反应,再向所得溶液中滴加KSCN溶液,无红色物质生成,则Fe2+、Br-和I-的还原性由强到弱的顺序为_________________________________.
4、如图所示是一个制取氯气并以氯气为原料进行特定反应的装置,多余的氯气可以贮存在b瓶中,其中各试剂瓶中所装试剂为:B(氢硫酸)、C(碘化钾淀粉溶液)、D(水)、F(紫色石蕊试液)。
(已知: Cl2+H2S==2HCl+S ,S难溶于水)
(1)若A中烧瓶中的固体为MnO2,液体为浓盐酸,则其发生反应的化学方程式为
_______ __________。
(2)G中b瓶内宜加入的液体是________,怎样检验装置G的气密性:
____________ ______________
____________ ______________。
____________ ______________。
(3)实验开始后B中的现象是___ ____,
C中的现象是_________ __________。
(4)E装置中硬质玻璃管内盛有炭粉,若E中发生氧化还原反应,其产物为二氧化碳和氯化氢,写出E中反应的化学方程式:_______________________________________________。
(5)在F中,紫色石蕊试液的颜色由紫色变为红色,再变为无色,其原因是
_____________
_____________
