8.4 常用的盐 课件(25张PPT)
文档属性
| 名称 | 8.4 常用的盐 课件(25张PPT) |  | |
| 格式 | ppt | ||
| 文件大小 | 908.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 粤教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-04-15 12:00:14 | ||
图片预览







文档简介
8.4 常用的盐
酸的通性
碱的通性
1、跟指示剂的反应
2、酸跟金属的反应
3、酸跟某些金属氧化物反应
4、酸跟碱的反应
5、酸跟盐反应
((2)AgNO3+HCl
(3)CaCO3+HCl
1、跟指示剂的反应
2、碱跟某些非金属氧化物反应
3.碱跟酸反应
4.碱跟盐反应
(1)NaOH+FeCl3
(2)NaOH+CuSO4
(3)Ca(OH)2+Na2CO3
一、几种常见的盐
用途很广。日常生活中用于调味和腌制食物,医疗上用与配制生理盐水,也是重要的化工原料。
1、氯化钠
粗盐中因含有________和________,易潮解。 (试用所学的化学知识,除去这两种杂质)
2NaCl+H2O=====2NaOH+H2↑+Cl2↑
通电
工业用盐中因含有_________(NaNO2),如果误作食盐,用于烹饪,会引起中毒事件。
A、加入稍过量的NaOH和Na2CO3溶液;过滤去沉淀。
B、加入稍过量的稀盐酸
C、蒸发结晶
亚硝酸钠
CaCl2
MgCl2
一、几种常见的盐
碳酸钠,俗称纯碱、天然碱、口碱、食用碱等。是重要的化工产品,用途广泛。
我国著名化学家侯德榜在改进纯碱的生产方面,曾做出杰出的贡献。
2、碳酸钠
由下面一组化学方程式想想,CO32-应如何检验?
Na2CO3+2HCl=2NaCl+H2O+CO2↑
K2CO3+2HCl=2KCl+H2O+CO2↑
MgCO3+2HCl=MgCl2+H2O+CO2↑
你会计算碳酸钠晶体Na2CO3·10H2O的相对分子质量吗?
含有CO32-的盐跟盐酸反应都能生成CO2,利用这种反应可鉴别CO32-。
一、几种常见的盐
硫酸铜有毒,在农业上用作杀菌剂,由它和石灰配制的波尔多液杀菌效率高,药害较小。
工业上,精炼铜、镀铜和制造铜的化合物都要用硫酸铜。
3、硫酸铜
CuSO4+5H2O==CuSO4·5H2O
CuSO4·5H2O==CuSO4+5H2O
△
有关CuSO4用途方面的化学反应
Cu←CuSO4→Cu(OH)2→CuO→Cu
二、盐的性质
物理性质
在常温下盐大都是晶体。不同种类的盐在水中的溶解性不同。
钾盐、钠盐、铵盐和硝酸盐都溶,盐酸盐除氯化银,硫酸盐除硫酸钡外其他都溶,碳酸盐、磷酸盐除钾盐、钠盐、铵盐溶,其他不溶。
部分酸、碱、盐的溶解性表
钾钠铵硝都要溶
盐酸要除银亚汞
硫酸铅钡它不溶
硫酸钙银是微溶
溶碱氨钡钾钠钙
常见的酸都要溶
助记口诀
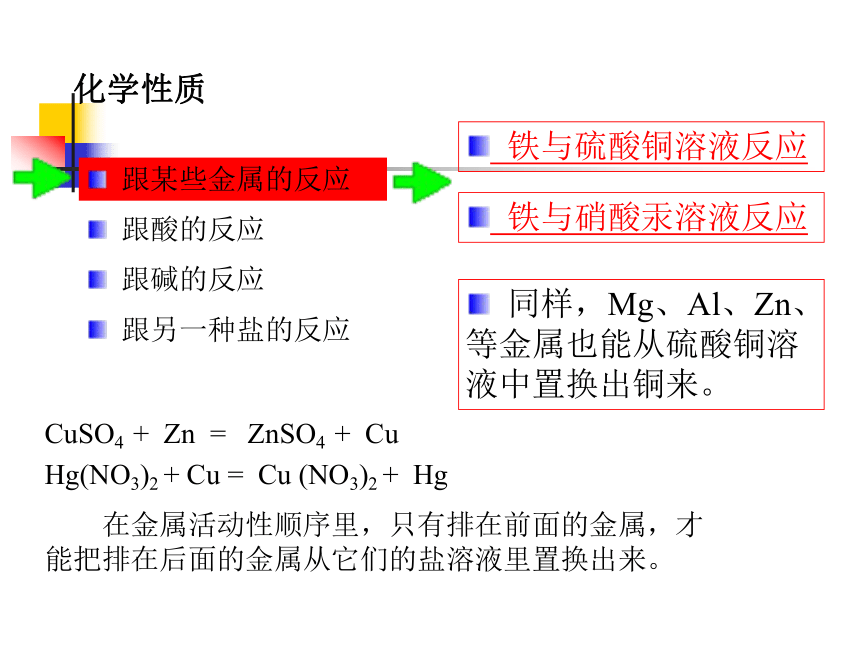
化学性质
跟某些金属的反应
跟酸的反应
跟碱的反应
跟另一种盐的反应
CuSO4 + Zn = ZnSO4 + Cu
Hg(NO3)2 + Cu = Cu (NO3)2 + Hg
在金属活动性顺序里,只有排在前面的金属,才能把排在后面的金属从它们的盐溶液里置换出来。
铁与硫酸铜溶液反应
铁与硝酸汞溶液反应
同样,Mg、Al、Zn、等金属也能从硫酸铜溶液中置换出铜来。
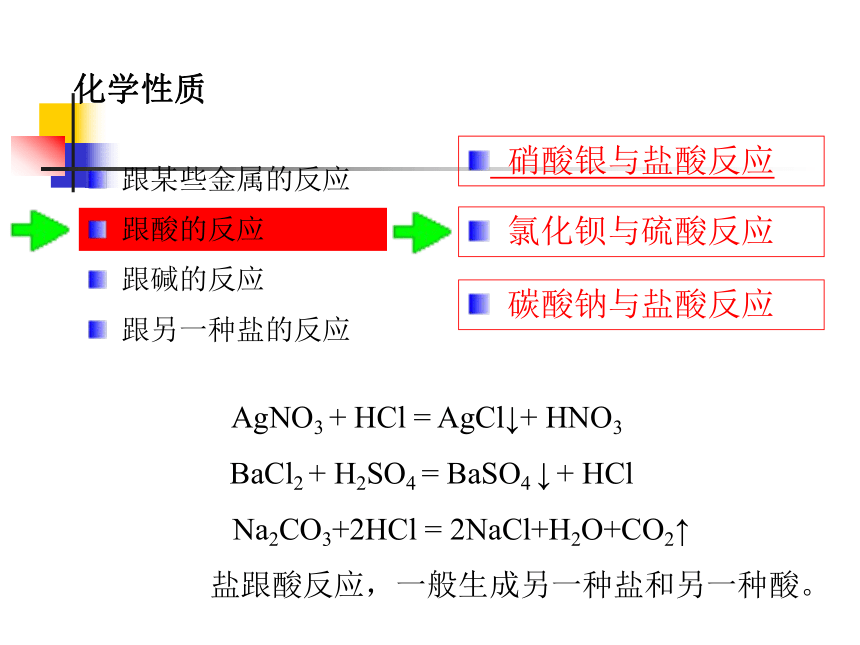
化学性质
跟某些金属的反应
跟酸的反应
跟碱的反应
跟另一种盐的反应
AgNO3 + HCl = AgCl↓+ HNO3
BaCl2 + H2SO4 = BaSO4 ↓ + HCl
Na2CO3+2HCl = 2NaCl+H2O+CO2↑
盐跟酸反应,一般生成另一种盐和另一种酸。
硝酸银与盐酸反应
氯化钡与硫酸反应
碳酸钠与盐酸反应
化学性质:
跟某些金属的反应
跟酸的反应
跟碱的反应
跟另一种盐的反应
CuSO4+2NaOH = Cu(OH)2↓Na2SO4
FeCl3 + 3NaOH = 3NaCl + Fe(OH)3↓
Na2CO3 + Ca(OH)2 = CaCO3↓+ 2NaOH
盐跟碱反应,一般生成另一种盐和另一种碱。
硫酸铜与氢氧化钠反应
氯化铁与氢氧化钠反应
碳酸钠与氢氧化钙反应
化学性质:
跟某些金属的反应
跟酸的反应
跟碱的反应
跟另一种盐的反应
AgNO3 + NaCl = AgCl↓+ NaNO3
BaCl2 + Na2SO4 = BaSO4 + 2NaCl
两种盐起反应,一般生成另外两种盐。
硝酸银和氯化钠反应
氯化钡和硫酸钠反应
氯离子Cl-的检验
硫酸根SO42-检验
复分解反应发生的条件
Cu(OH)2 + 2HCl = CuCl2 + 2H2O
HCl + AgNO3 = AgCl ↓ + HNO3
CaCO3+2HCl=CaCl2+H2O+CO2↑
H2O
H2O
H2O
↓
↓
↓
↑
↑
↑
有难溶的物质(如BaSO4、AgCl)或难电离的物质(如H2O)或挥发性的物质(如CO2)生成,只要具备上述条件之一,这类反应就能发生。
复分解反应发生的条件
碳酸钠晶体的化学式是Na2CO3·10H2O。常温时在干燥的空气里,碳酸钠晶体能逐渐失去结晶水而成为粉末,这种现象叫做风化。
1、根据下列物质的电离方程式:
氯化钠、硫酸亚铁、硝酸钾、碳酸钡、氯化铵
NaCl === Na+ + Cl-
FeSO4 === Fe2+ + SO42 —
KNO3 === K+ + NO3-
BaCO3 === Ba2+ + CO32-
NH4Cl === NH4+ + Cl-
请你找出上列电离方程式的共同点。
电离出的阳离子都是金属离子或铵根离子,阴离子都是酸根阴离子。
①电离时能产生金属阳离子(或铵根离子)和酸根阴离子的化合物,叫做盐。
1、碳酸钠
Na2CO3·10H2O
1) 俗称:______又称________.
2) 是一种__色粉末,易溶于___.
3) 从水溶液中析出时,碳酸钠晶体含有结晶水,化学式是______ _____
纯碱
苏打
白
水
这种含有一定数目水分子的物质称为结晶水合物。
说明:结晶水合物是纯净物,化学式中的“·”表示结合,计算相对分子量时,表示“加”。
结晶水合物在常温下,放在干燥的空气里逐渐失去结晶水的现象叫风化。
碳酸钠晶体常温下,晶体暴露在空气中易风化,而失去结晶水而成为____________
碳酸钠白色粉末。
1、“潮解”和结晶水合物的“风化”相同吗?为什么?
答:风化属化学变化;潮解是物理变化。
思考:
活动1:往碳酸钠溶液中滴入酚酞试剂,你发现什么了现象?
溶液变红
可见:碳酸钠的水溶液呈碱性。
3、与酸反应:
2、碳酸钠与酸碱指示剂反应
Na2CO3+2HCl=2NaCl+H2O+CO2↑
4、与碱反应:
Na2CO3+Ca(OH)2 = CaCO3↓ +2NaOH
应用:
可制造玻璃、肥皂、洗涤剂、以及在纺织工业上都利用它的碱性。
做馒头时可除去酸味,且使馒头多孔松软.
CaCO3 + 2HCl=== CaCl2 + H2O + CO2↑
Na2CO3 + 2 HCl===2 NaCl + H2O + CO2↑
含有CO32-
都加入盐酸
都有气体放出
而且所放出的气体能使澄清的石灰水变浑浊.或燃着的木条熄灭
化学方程式是:
Ca(OH)2 + CO2 ==== CaCO3↓ + H2O
CO32-的检验方法:
组成里含有CO32-的盐(碳酸盐)跟稀盐酸反应都能产生一种能使澄清的石灰水变浑浊的无色气体,利用这种反应可鉴别CO32-。
需要的试剂:
稀盐酸和澄清石灰水
思考:
1.如何验证氢氧化钠是否变质?若有变质如何除去杂质?
检验:Na2CO3 + 2 HCl===2NaCl + H2O + CO2↑
除杂质:Na2CO3+Ca(OH)2= CaCO3↓ +2NaOH
二、盐的复分解反应
我们已经学过盐的复分解反应,下面回顾一下。
1.盐与酸的反应
盐能跟酸发生复分解反应,生成新盐和新酸。
2.盐与碱的反应
盐能与碱发生复分解反应,生成新盐和新碱。
3.盐与盐的反应
两种盐之间可能发生复分解反应,生成另两种新盐。
Na2CO3 + HCl
2 === 2NaCl + H2O + CO2
3 === 3NaCl + Fe(OH) 3↓
FeCl3 + NaOH
=== AgCl↓ + NaNO3
AgNO3 +NaCl
反应原理
反应现象
有气泡产生
红褐色沉淀
白色沉淀
小结
Na2CO3 + 2HCl == 2NaCl + H2O + CO2↑
FeCl3 + 3NaOH ==Fe(OH)3↓ + 3NaCl
盐的性质
(1)盐 + 酸 = 新盐 + 新酸
(2)盐 + 碱 = 新盐 + 新碱
(3)盐 + 盐 = 两种新盐
小结
=== AgCl↓ + NaNO3
AgNO3 +NaCl
三、复分解反应发生的条件
有沉淀析出
或有气体生成
或有水生成
生成物
反应物
盐(可溶)+碱(可溶)
盐(可溶)+盐(可溶)
碱+酸
盐+酸
酸的通性
碱的通性
1、跟指示剂的反应
2、酸跟金属的反应
3、酸跟某些金属氧化物反应
4、酸跟碱的反应
5、酸跟盐反应
((2)AgNO3+HCl
(3)CaCO3+HCl
1、跟指示剂的反应
2、碱跟某些非金属氧化物反应
3.碱跟酸反应
4.碱跟盐反应
(1)NaOH+FeCl3
(2)NaOH+CuSO4
(3)Ca(OH)2+Na2CO3
一、几种常见的盐
用途很广。日常生活中用于调味和腌制食物,医疗上用与配制生理盐水,也是重要的化工原料。
1、氯化钠
粗盐中因含有________和________,易潮解。 (试用所学的化学知识,除去这两种杂质)
2NaCl+H2O=====2NaOH+H2↑+Cl2↑
通电
工业用盐中因含有_________(NaNO2),如果误作食盐,用于烹饪,会引起中毒事件。
A、加入稍过量的NaOH和Na2CO3溶液;过滤去沉淀。
B、加入稍过量的稀盐酸
C、蒸发结晶
亚硝酸钠
CaCl2
MgCl2
一、几种常见的盐
碳酸钠,俗称纯碱、天然碱、口碱、食用碱等。是重要的化工产品,用途广泛。
我国著名化学家侯德榜在改进纯碱的生产方面,曾做出杰出的贡献。
2、碳酸钠
由下面一组化学方程式想想,CO32-应如何检验?
Na2CO3+2HCl=2NaCl+H2O+CO2↑
K2CO3+2HCl=2KCl+H2O+CO2↑
MgCO3+2HCl=MgCl2+H2O+CO2↑
你会计算碳酸钠晶体Na2CO3·10H2O的相对分子质量吗?
含有CO32-的盐跟盐酸反应都能生成CO2,利用这种反应可鉴别CO32-。
一、几种常见的盐
硫酸铜有毒,在农业上用作杀菌剂,由它和石灰配制的波尔多液杀菌效率高,药害较小。
工业上,精炼铜、镀铜和制造铜的化合物都要用硫酸铜。
3、硫酸铜
CuSO4+5H2O==CuSO4·5H2O
CuSO4·5H2O==CuSO4+5H2O
△
有关CuSO4用途方面的化学反应
Cu←CuSO4→Cu(OH)2→CuO→Cu
二、盐的性质
物理性质
在常温下盐大都是晶体。不同种类的盐在水中的溶解性不同。
钾盐、钠盐、铵盐和硝酸盐都溶,盐酸盐除氯化银,硫酸盐除硫酸钡外其他都溶,碳酸盐、磷酸盐除钾盐、钠盐、铵盐溶,其他不溶。
部分酸、碱、盐的溶解性表
钾钠铵硝都要溶
盐酸要除银亚汞
硫酸铅钡它不溶
硫酸钙银是微溶
溶碱氨钡钾钠钙
常见的酸都要溶
助记口诀
化学性质
跟某些金属的反应
跟酸的反应
跟碱的反应
跟另一种盐的反应
CuSO4 + Zn = ZnSO4 + Cu
Hg(NO3)2 + Cu = Cu (NO3)2 + Hg
在金属活动性顺序里,只有排在前面的金属,才能把排在后面的金属从它们的盐溶液里置换出来。
铁与硫酸铜溶液反应
铁与硝酸汞溶液反应
同样,Mg、Al、Zn、等金属也能从硫酸铜溶液中置换出铜来。
化学性质
跟某些金属的反应
跟酸的反应
跟碱的反应
跟另一种盐的反应
AgNO3 + HCl = AgCl↓+ HNO3
BaCl2 + H2SO4 = BaSO4 ↓ + HCl
Na2CO3+2HCl = 2NaCl+H2O+CO2↑
盐跟酸反应,一般生成另一种盐和另一种酸。
硝酸银与盐酸反应
氯化钡与硫酸反应
碳酸钠与盐酸反应
化学性质:
跟某些金属的反应
跟酸的反应
跟碱的反应
跟另一种盐的反应
CuSO4+2NaOH = Cu(OH)2↓Na2SO4
FeCl3 + 3NaOH = 3NaCl + Fe(OH)3↓
Na2CO3 + Ca(OH)2 = CaCO3↓+ 2NaOH
盐跟碱反应,一般生成另一种盐和另一种碱。
硫酸铜与氢氧化钠反应
氯化铁与氢氧化钠反应
碳酸钠与氢氧化钙反应
化学性质:
跟某些金属的反应
跟酸的反应
跟碱的反应
跟另一种盐的反应
AgNO3 + NaCl = AgCl↓+ NaNO3
BaCl2 + Na2SO4 = BaSO4 + 2NaCl
两种盐起反应,一般生成另外两种盐。
硝酸银和氯化钠反应
氯化钡和硫酸钠反应
氯离子Cl-的检验
硫酸根SO42-检验
复分解反应发生的条件
Cu(OH)2 + 2HCl = CuCl2 + 2H2O
HCl + AgNO3 = AgCl ↓ + HNO3
CaCO3+2HCl=CaCl2+H2O+CO2↑
H2O
H2O
H2O
↓
↓
↓
↑
↑
↑
有难溶的物质(如BaSO4、AgCl)或难电离的物质(如H2O)或挥发性的物质(如CO2)生成,只要具备上述条件之一,这类反应就能发生。
复分解反应发生的条件
碳酸钠晶体的化学式是Na2CO3·10H2O。常温时在干燥的空气里,碳酸钠晶体能逐渐失去结晶水而成为粉末,这种现象叫做风化。
1、根据下列物质的电离方程式:
氯化钠、硫酸亚铁、硝酸钾、碳酸钡、氯化铵
NaCl === Na+ + Cl-
FeSO4 === Fe2+ + SO42 —
KNO3 === K+ + NO3-
BaCO3 === Ba2+ + CO32-
NH4Cl === NH4+ + Cl-
请你找出上列电离方程式的共同点。
电离出的阳离子都是金属离子或铵根离子,阴离子都是酸根阴离子。
①电离时能产生金属阳离子(或铵根离子)和酸根阴离子的化合物,叫做盐。
1、碳酸钠
Na2CO3·10H2O
1) 俗称:______又称________.
2) 是一种__色粉末,易溶于___.
3) 从水溶液中析出时,碳酸钠晶体含有结晶水,化学式是______ _____
纯碱
苏打
白
水
这种含有一定数目水分子的物质称为结晶水合物。
说明:结晶水合物是纯净物,化学式中的“·”表示结合,计算相对分子量时,表示“加”。
结晶水合物在常温下,放在干燥的空气里逐渐失去结晶水的现象叫风化。
碳酸钠晶体常温下,晶体暴露在空气中易风化,而失去结晶水而成为____________
碳酸钠白色粉末。
1、“潮解”和结晶水合物的“风化”相同吗?为什么?
答:风化属化学变化;潮解是物理变化。
思考:
活动1:往碳酸钠溶液中滴入酚酞试剂,你发现什么了现象?
溶液变红
可见:碳酸钠的水溶液呈碱性。
3、与酸反应:
2、碳酸钠与酸碱指示剂反应
Na2CO3+2HCl=2NaCl+H2O+CO2↑
4、与碱反应:
Na2CO3+Ca(OH)2 = CaCO3↓ +2NaOH
应用:
可制造玻璃、肥皂、洗涤剂、以及在纺织工业上都利用它的碱性。
做馒头时可除去酸味,且使馒头多孔松软.
CaCO3 + 2HCl=== CaCl2 + H2O + CO2↑
Na2CO3 + 2 HCl===2 NaCl + H2O + CO2↑
含有CO32-
都加入盐酸
都有气体放出
而且所放出的气体能使澄清的石灰水变浑浊.或燃着的木条熄灭
化学方程式是:
Ca(OH)2 + CO2 ==== CaCO3↓ + H2O
CO32-的检验方法:
组成里含有CO32-的盐(碳酸盐)跟稀盐酸反应都能产生一种能使澄清的石灰水变浑浊的无色气体,利用这种反应可鉴别CO32-。
需要的试剂:
稀盐酸和澄清石灰水
思考:
1.如何验证氢氧化钠是否变质?若有变质如何除去杂质?
检验:Na2CO3 + 2 HCl===2NaCl + H2O + CO2↑
除杂质:Na2CO3+Ca(OH)2= CaCO3↓ +2NaOH
二、盐的复分解反应
我们已经学过盐的复分解反应,下面回顾一下。
1.盐与酸的反应
盐能跟酸发生复分解反应,生成新盐和新酸。
2.盐与碱的反应
盐能与碱发生复分解反应,生成新盐和新碱。
3.盐与盐的反应
两种盐之间可能发生复分解反应,生成另两种新盐。
Na2CO3 + HCl
2 === 2NaCl + H2O + CO2
3 === 3NaCl + Fe(OH) 3↓
FeCl3 + NaOH
=== AgCl↓ + NaNO3
AgNO3 +NaCl
反应原理
反应现象
有气泡产生
红褐色沉淀
白色沉淀
小结
Na2CO3 + 2HCl == 2NaCl + H2O + CO2↑
FeCl3 + 3NaOH ==Fe(OH)3↓ + 3NaCl
盐的性质
(1)盐 + 酸 = 新盐 + 新酸
(2)盐 + 碱 = 新盐 + 新碱
(3)盐 + 盐 = 两种新盐
小结
=== AgCl↓ + NaNO3
AgNO3 +NaCl
三、复分解反应发生的条件
有沉淀析出
或有气体生成
或有水生成
生成物
反应物
盐(可溶)+碱(可溶)
盐(可溶)+盐(可溶)
碱+酸
盐+酸
