8.2 常见的酸和碱 课件(30张PPT)
文档属性
| 名称 | 8.2 常见的酸和碱 课件(30张PPT) |  | |
| 格式 | ppt | ||
| 文件大小 | 1.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 粤教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-04-15 12:01:05 | ||
图片预览









文档简介
8.2 常见的酸和碱
硝酸
盐酸
硫酸
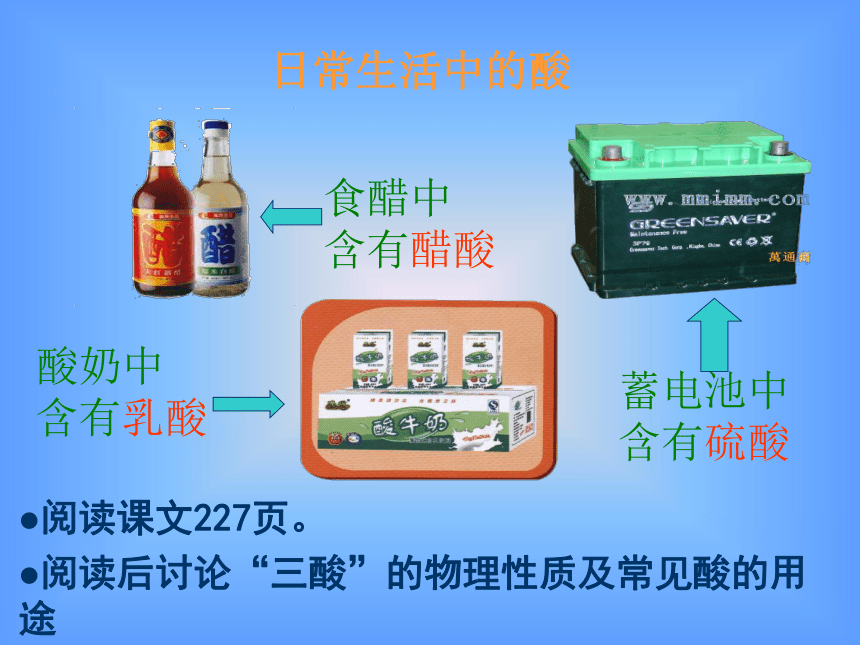
日常生活中的酸
酸奶中
含有乳酸
食醋中
含有醋酸
蓄电池中
含有硫酸
阅读课文227页。
阅读后讨论“三酸”的物理性质及常见酸的用途
1、产生白雾的原因:这两种浓酸易挥发,挥发出的氯化氢(硝酸)气体跟空气中的水蒸气结合形成盐酸(硝酸)的小液滴。
2、浓盐酸和浓硝酸易挥发,露置空气中质量会减少,溶质质量分数会减少。
3、浓硫酸有吸水性,露置空气中质量会增加,溶质质量分数会减少。
盐酸,无色液体,即氢氯酸 易挥发,有刺激性气味;
(瓶口有白雾)
硫酸,无色油状液体,强腐蚀性,不易挥发, 无味,
密度较大(1.84g/cm3) ;
硝酸,无色液体,强腐蚀性,易挥发,有特殊刺激性气味。
(瓶口有白雾)
知识拓展:
重要的酸
酸
化学式
常见用途
盐酸
HCl
用于电镀、食品、化工生产
硫酸
H2SO4
车用电池、化肥、农药、精炼石油
硝酸
HNO3
生产化肥、染料、炸药
①浓硫酸的脱水性
能夺取纸张、木材、棉布、 皮肤(由含C、H、O等元素
的化合物组成)里的水分,生成黑色的炭。
②浓硫酸的吸水性
做干燥剂
③浓硫酸的腐蚀性
浓硫酸的腐蚀性
1.浓硫酸的特性 【实验8-5】
稀释浓硫酸时,一定
要把浓硫酸沿容器壁
慢慢注入水里,并不
断搅拌。切不可将水
倒进浓硫酸里
浓硫酸的稀释【实验8-6】
化学晚会上小豆把一张白纸的正反两面向大家展示清楚,然后把白纸用电吹风的热风吹片刻,不一会,白纸上出现了一只小黑猫,大家惊奇不已.
你知道这是怎么回事吗?请你用学过的化学知识来解释:
(1)小豆事先用 ________画了一只猫;
(2)使白纸出现黑猫的物质是_______;表现该物质具有______性。
稀硫酸
浓硫酸
脱水
稀酸的化学性质
1、在碳酸溶液中,紫色石蕊溶液由 色变成了 色。
2、稀硫酸跟锌可发生什么反应?
3、盐酸跟碳酸钙能发生反应吗?
紫
红
H2SO4 + Zn= H2 ↑ + ZnSO4
2HCl + CaCO3 =CaCl2 + H2O + CO2 ↑
知识回顾
1、酸与指示剂的作用
使紫色的石蕊溶液变红色,但不能使无色的酚酞
溶液变色。这是稀酸的化学通性之一。
2、酸与金属的反应
(1)回顾:较活泼金属(如铁)跟稀硫酸的置换反应:
Fe + H2SO4 = FeSO4 + H2 ↑
(金属) (酸) (盐) (氢气)
FeSO4
这类由 金属离子 和 酸 根离子 组成的化合物通称为盐。
FeSO4
Fe 2+
SO4 2-
+
(金属离子)
(酸根离子)
CuSO4、CaCO3、NaCl、KNO3等均属于盐。
酸与金属的反应
拓展:镁或锌与稀盐酸的反应。【实验8-7】
现象:
在金属表面产生气泡(生成气体)。
化学方程式:
Mg + 2HCl = MgCl2 + H2 ↑
Zn + 2HCl = ZnCl2 + H2 ↑
Fe + H2SO4 = FeSO4 + H2 ↑
(金属) (酸) (盐) (氢气)
结论:
性质2 酸能跟较活泼金属(如镁、铝、锌和铁) 发生置换反应,放出氢气,并生成盐。
硝酸性质较特殊它与金属反应时,一般不生成氢气,而是氮氧化物
3、酸跟金属氧化物的反应
实验:【实验8-8】 (1)在试管中,加入少量氧化铜粉末,再加入约2ml稀硫酸,在酒精灯上加热,不停振荡,观察变化现象。
现象:
黑色粉末逐渐减少,无色溶液变蓝色。
化学方程式:
CuO + H2SO4 = Cu SO4 + H2O
(金属氧化物)(酸) (盐) (水)
酸跟金属氧化物的反应
实验(2) 把生锈的铁钉浸入盛有稀盐酸溶液的试管中,过一段时间后,取出,洗净,并观察它的变化。
现象:
铁锈消失,同时无色溶液变黄色。
化学方程式:
Fe2O3 + 6HCl = 2FeCl3 + 3H2O
(金属氧化物) (酸) (盐) (水)
结论:
性质3:酸能跟某些金属氧化物反应,生成盐和水
4、酸跟盐的反应
回顾:实验室制备二氧化碳的化学反应:
2HCl + CaCO3 = CaCl2 + H2CO3
∟ H2O+CO2 ↑
(酸) (盐) (新盐) (新酸)
拓展:将稀盐酸与硝酸银进行实验 [实验8-3]
现象:
生成白色沉淀(此实验常用于检验Cl- 阅读 P226)。
化学方程式:
HCl + AgNO3 = AgCl ↓ + HNO3
(酸) (盐) (新盐) (新酸)
结论:
性质4:酸能跟某些盐反应,生成其他酸和盐。
长话短说——酸的化学通性
项目
反应情况
使紫色石蕊溶液
变红
跟活泼金属
发生置换反应,放出氢气,并生成盐。
跟金属氧化物
发生反应生成盐和水。
跟某些盐
发生复分解反应生成新酸和新盐
检查站
1、写出下列反应的化学方程式:
(1)硫酸跟氧化镁反应,生成硫酸镁和水
(2)硫酸跟氢氧化钠溶液反应,生成硫酸钠和水
(3)硫酸跟氯化钡反应,生成硫酸钡和盐酸。
(4)稀硫酸跟锌反应,生成硫酸锌和氢气。
H2SO4 + MgO = MgSO4 + H2O
H2SO4 + 2NaOH = Na2SO4 + 2H2O
H2SO4 + BaCl2 = BaSO4 ↓+ 2HCl
H2SO4 +Zn = ZnSO4 + H2↑
2、举例说明以下转变关系(参照上题,把题号填在下面的括号内):
酸+
活泼金属
碱
金属氧化物
盐
盐+
氢气 例如 ( )
水 例如 ( )
水 例如 ( )
新酸 例如 ( )
1、H2SO4 + MgO = MgSO4 + H2O
2、H2SO4 + 2NaOH = Na2SO4 + 2H2O
3、H2SO4 + BaCl2 = BaSO4 ↓+ 2HCl
4、H2SO4 +Zn = ZnSO4 + H2↑
1
4
2
3
1.请你说出你所知道的碱还有哪些?他们有哪些用途你知道吗?请阅读课本232了解常见的碱的用途。
2.阅读课本232页了解生石灰与熟石灰,了解它们是如何制得。
常见三种碱的常见用途
名称
化学式
常见用途
氢氧化钙
Ca(OH)2
建筑材料、漂白粉、处理污水、改良土壤
氢氧化钠
NaOH
制肥皂、洗涤剂、造纸、纺织工业、炼制石油
氢氧化钾
KOH
电池工业
氢氧化钙的物理性质及用途
氢氧化钙的俗名叫熟石灰,(白色固体,微溶于水)用来检验二氧化碳的石灰水,就是它的水溶液。
在生产中,人们大量用熟石灰作建筑材料和改良土壤。
氢氧化钙这种材料是从哪里得到的呢?
碳酸钙 氧化钙 氢氧化钙
《石灰吟》
明朝---于谦
千锤万凿出深山,
烈火焚烧若等闲。
粉身碎骨浑不怕,
要留清白在人间。
CaCO3 === CaO + CO2↑
CaO + H2O === Ca(OH)2
生石灰遇水放出大量的热,并转变成熟石灰[Ca(OH)2]
Ca(OH)2 + CO2 === CaCO3 ↓+ H2O
高温
氢氧化钠的物理性质及用途
俗名
物理性质
用途
氢氧化钠
( )
————————————
是一种白色固体,极易溶于水,并放出热量;易吸收空气中的水蒸气而潮解,因此可作某些气体的干燥剂.
是一种工业原料,广泛应用于造纸、肥皂 等工业.
NaOH
苛性钠
火 碱
烧 碱
氢氧化钠
【实验8-10】氢氧化钠的潮解性、水溶性和腐蚀性
1、实验现象:
氢氧化钠固体逐渐溶解在水溶液中,试管壁发烫。
3、实验现象:
氢氧化钠表面潮湿并逐渐溶解。
2、实验现象:
鸡爪肉被腐蚀,变色。
碱的通性
1、碱与指示剂的作用
实验现象:无色酚酞溶液变红,紫色石蕊溶液变蓝。
性质1:碱能使无色酚酞溶液变红,使紫色石蕊溶液变蓝
2、碱与非金属氧化物的反应
【实验8-11】碱与非金属氧化物的作用
实验现象:
解释:
性质2: 碱能跟多种非金属氧化物起反应,生成盐和水。
回顾:二氧化碳与石灰水发生的反应
CO2+Ca(OH)2=CaCO3↓+H2O
非金属氧化物 碱 盐 水
倒插在氢氧化钠溶液中的试管里的液面上升较高。
说明氢氧化钠溶液可以跟二氧化碳反应。
Ca(OH)2 +CO2 = CaCO3 ↓ +H2O
NaOH + CO2 =
NaOH + SO2 =
Ca(OH)2 +CO2 =
2NaOH + CO2 =Na2CO3 + H2O
2NaOH + SO2 =Na2SO3 + H2O
讨论:NaOH 与CO2反应时是没有什么现象看到的,是不是它们不反应呢?那你如何设计一个实验来证明它们确实发生了化学反应呢?
???????????????????????
????????????????????????
???????????????????????
图一
图二
图三
???????????????????????
????????????????????????
???????????????????????
图四
图五
图六
1、氢氧化钠与硫酸铜反应
3、碱与盐的反应 【实验8-12】
实验现象:有蓝色的沉淀生成
CuSO4 + 2NaOH == Cu(OH)2↓+ Na2SO4
2、氢氧化钠与氯化铁反应
实验现象:有红褐色的沉淀生成
3NaOH +FeCl3 ==Fe(OH)3↓+3NaCl
性质3:碱能跟某些盐发生复分解反应,生成其他碱和盐。
碱 + 盐 → 新碱 + 新盐
畅谈收获
氢氧化钠和氢氧化钙的物理性质
碱的物
理性质
碱的化学性质
碱能使紫色石蕊溶液变蓝
碱能使无色酚酞溶液变红
碱+非金属氧化物→盐+水
碱+某些可溶性盐→新碱+新盐
小结
一、几种常见的碱
1、氢氧化钠(NaOH) 俗名:火碱、烧碱、苛性钠
2、氢氧化钙(Ca(OH)2) 俗名:熟石灰、消石灰
二、碱的通性
性质1 碱能使无色酚酞溶液变红,使紫色的石蕊溶液变蓝。
性质2 碱 + 酸 盐 + 水
性质3 碱 + 某些非金属氧化物 盐 + 水
NaOH和Ca(OH)2的保存和鉴别CO2的方法。
性质4 碱 + 盐 新盐 + 新碱
硝酸
盐酸
硫酸
日常生活中的酸
酸奶中
含有乳酸
食醋中
含有醋酸
蓄电池中
含有硫酸
阅读课文227页。
阅读后讨论“三酸”的物理性质及常见酸的用途
1、产生白雾的原因:这两种浓酸易挥发,挥发出的氯化氢(硝酸)气体跟空气中的水蒸气结合形成盐酸(硝酸)的小液滴。
2、浓盐酸和浓硝酸易挥发,露置空气中质量会减少,溶质质量分数会减少。
3、浓硫酸有吸水性,露置空气中质量会增加,溶质质量分数会减少。
盐酸,无色液体,即氢氯酸 易挥发,有刺激性气味;
(瓶口有白雾)
硫酸,无色油状液体,强腐蚀性,不易挥发, 无味,
密度较大(1.84g/cm3) ;
硝酸,无色液体,强腐蚀性,易挥发,有特殊刺激性气味。
(瓶口有白雾)
知识拓展:
重要的酸
酸
化学式
常见用途
盐酸
HCl
用于电镀、食品、化工生产
硫酸
H2SO4
车用电池、化肥、农药、精炼石油
硝酸
HNO3
生产化肥、染料、炸药
①浓硫酸的脱水性
能夺取纸张、木材、棉布、 皮肤(由含C、H、O等元素
的化合物组成)里的水分,生成黑色的炭。
②浓硫酸的吸水性
做干燥剂
③浓硫酸的腐蚀性
浓硫酸的腐蚀性
1.浓硫酸的特性 【实验8-5】
稀释浓硫酸时,一定
要把浓硫酸沿容器壁
慢慢注入水里,并不
断搅拌。切不可将水
倒进浓硫酸里
浓硫酸的稀释【实验8-6】
化学晚会上小豆把一张白纸的正反两面向大家展示清楚,然后把白纸用电吹风的热风吹片刻,不一会,白纸上出现了一只小黑猫,大家惊奇不已.
你知道这是怎么回事吗?请你用学过的化学知识来解释:
(1)小豆事先用 ________画了一只猫;
(2)使白纸出现黑猫的物质是_______;表现该物质具有______性。
稀硫酸
浓硫酸
脱水
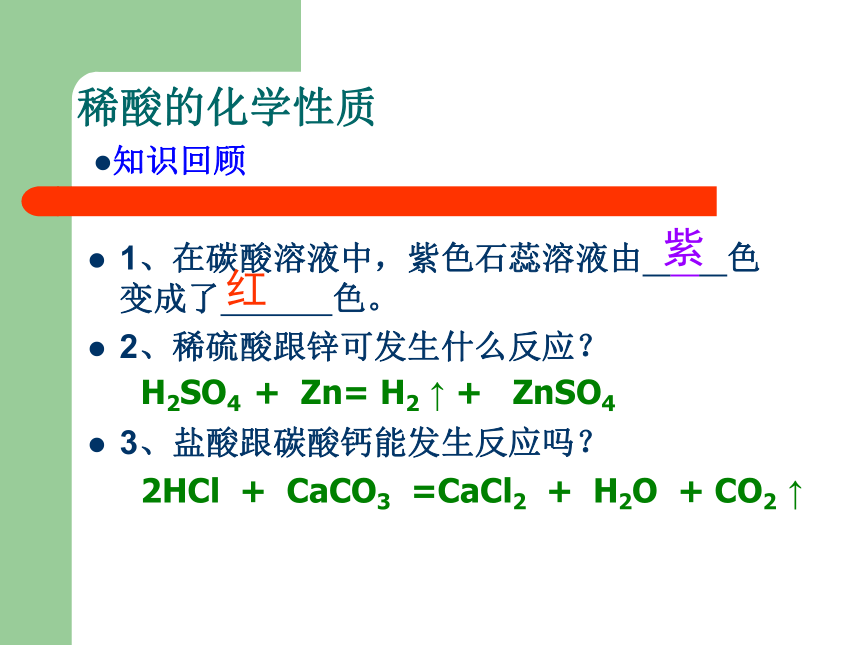
稀酸的化学性质
1、在碳酸溶液中,紫色石蕊溶液由 色变成了 色。
2、稀硫酸跟锌可发生什么反应?
3、盐酸跟碳酸钙能发生反应吗?
紫
红
H2SO4 + Zn= H2 ↑ + ZnSO4
2HCl + CaCO3 =CaCl2 + H2O + CO2 ↑
知识回顾
1、酸与指示剂的作用
使紫色的石蕊溶液变红色,但不能使无色的酚酞
溶液变色。这是稀酸的化学通性之一。
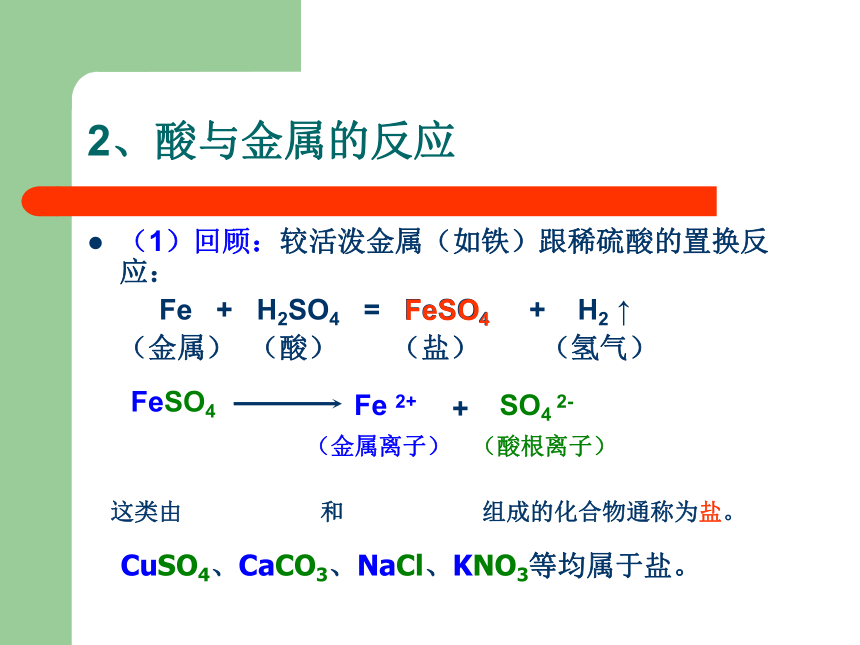
2、酸与金属的反应
(1)回顾:较活泼金属(如铁)跟稀硫酸的置换反应:
Fe + H2SO4 = FeSO4 + H2 ↑
(金属) (酸) (盐) (氢气)
FeSO4
这类由 金属离子 和 酸 根离子 组成的化合物通称为盐。
FeSO4
Fe 2+
SO4 2-
+
(金属离子)
(酸根离子)
CuSO4、CaCO3、NaCl、KNO3等均属于盐。
酸与金属的反应
拓展:镁或锌与稀盐酸的反应。【实验8-7】
现象:
在金属表面产生气泡(生成气体)。
化学方程式:
Mg + 2HCl = MgCl2 + H2 ↑
Zn + 2HCl = ZnCl2 + H2 ↑
Fe + H2SO4 = FeSO4 + H2 ↑
(金属) (酸) (盐) (氢气)
结论:
性质2 酸能跟较活泼金属(如镁、铝、锌和铁) 发生置换反应,放出氢气,并生成盐。
硝酸性质较特殊它与金属反应时,一般不生成氢气,而是氮氧化物
3、酸跟金属氧化物的反应
实验:【实验8-8】 (1)在试管中,加入少量氧化铜粉末,再加入约2ml稀硫酸,在酒精灯上加热,不停振荡,观察变化现象。
现象:
黑色粉末逐渐减少,无色溶液变蓝色。
化学方程式:
CuO + H2SO4 = Cu SO4 + H2O
(金属氧化物)(酸) (盐) (水)
酸跟金属氧化物的反应
实验(2) 把生锈的铁钉浸入盛有稀盐酸溶液的试管中,过一段时间后,取出,洗净,并观察它的变化。
现象:
铁锈消失,同时无色溶液变黄色。
化学方程式:
Fe2O3 + 6HCl = 2FeCl3 + 3H2O
(金属氧化物) (酸) (盐) (水)
结论:
性质3:酸能跟某些金属氧化物反应,生成盐和水
4、酸跟盐的反应
回顾:实验室制备二氧化碳的化学反应:
2HCl + CaCO3 = CaCl2 + H2CO3
∟ H2O+CO2 ↑
(酸) (盐) (新盐) (新酸)
拓展:将稀盐酸与硝酸银进行实验 [实验8-3]
现象:
生成白色沉淀(此实验常用于检验Cl- 阅读 P226)。
化学方程式:
HCl + AgNO3 = AgCl ↓ + HNO3
(酸) (盐) (新盐) (新酸)
结论:
性质4:酸能跟某些盐反应,生成其他酸和盐。
长话短说——酸的化学通性
项目
反应情况
使紫色石蕊溶液
变红
跟活泼金属
发生置换反应,放出氢气,并生成盐。
跟金属氧化物
发生反应生成盐和水。
跟某些盐
发生复分解反应生成新酸和新盐
检查站
1、写出下列反应的化学方程式:
(1)硫酸跟氧化镁反应,生成硫酸镁和水
(2)硫酸跟氢氧化钠溶液反应,生成硫酸钠和水
(3)硫酸跟氯化钡反应,生成硫酸钡和盐酸。
(4)稀硫酸跟锌反应,生成硫酸锌和氢气。
H2SO4 + MgO = MgSO4 + H2O
H2SO4 + 2NaOH = Na2SO4 + 2H2O
H2SO4 + BaCl2 = BaSO4 ↓+ 2HCl
H2SO4 +Zn = ZnSO4 + H2↑
2、举例说明以下转变关系(参照上题,把题号填在下面的括号内):
酸+
活泼金属
碱
金属氧化物
盐
盐+
氢气 例如 ( )
水 例如 ( )
水 例如 ( )
新酸 例如 ( )
1、H2SO4 + MgO = MgSO4 + H2O
2、H2SO4 + 2NaOH = Na2SO4 + 2H2O
3、H2SO4 + BaCl2 = BaSO4 ↓+ 2HCl
4、H2SO4 +Zn = ZnSO4 + H2↑
1
4
2
3
1.请你说出你所知道的碱还有哪些?他们有哪些用途你知道吗?请阅读课本232了解常见的碱的用途。
2.阅读课本232页了解生石灰与熟石灰,了解它们是如何制得。
常见三种碱的常见用途
名称
化学式
常见用途
氢氧化钙
Ca(OH)2
建筑材料、漂白粉、处理污水、改良土壤
氢氧化钠
NaOH
制肥皂、洗涤剂、造纸、纺织工业、炼制石油
氢氧化钾
KOH
电池工业
氢氧化钙的物理性质及用途
氢氧化钙的俗名叫熟石灰,(白色固体,微溶于水)用来检验二氧化碳的石灰水,就是它的水溶液。
在生产中,人们大量用熟石灰作建筑材料和改良土壤。
氢氧化钙这种材料是从哪里得到的呢?
碳酸钙 氧化钙 氢氧化钙
《石灰吟》
明朝---于谦
千锤万凿出深山,
烈火焚烧若等闲。
粉身碎骨浑不怕,
要留清白在人间。
CaCO3 === CaO + CO2↑
CaO + H2O === Ca(OH)2
生石灰遇水放出大量的热,并转变成熟石灰[Ca(OH)2]
Ca(OH)2 + CO2 === CaCO3 ↓+ H2O
高温
氢氧化钠的物理性质及用途
俗名
物理性质
用途
氢氧化钠
( )
————————————
是一种白色固体,极易溶于水,并放出热量;易吸收空气中的水蒸气而潮解,因此可作某些气体的干燥剂.
是一种工业原料,广泛应用于造纸、肥皂 等工业.
NaOH
苛性钠
火 碱
烧 碱
氢氧化钠
【实验8-10】氢氧化钠的潮解性、水溶性和腐蚀性
1、实验现象:
氢氧化钠固体逐渐溶解在水溶液中,试管壁发烫。
3、实验现象:
氢氧化钠表面潮湿并逐渐溶解。
2、实验现象:
鸡爪肉被腐蚀,变色。
碱的通性
1、碱与指示剂的作用
实验现象:无色酚酞溶液变红,紫色石蕊溶液变蓝。
性质1:碱能使无色酚酞溶液变红,使紫色石蕊溶液变蓝
2、碱与非金属氧化物的反应
【实验8-11】碱与非金属氧化物的作用
实验现象:
解释:
性质2: 碱能跟多种非金属氧化物起反应,生成盐和水。
回顾:二氧化碳与石灰水发生的反应
CO2+Ca(OH)2=CaCO3↓+H2O
非金属氧化物 碱 盐 水
倒插在氢氧化钠溶液中的试管里的液面上升较高。
说明氢氧化钠溶液可以跟二氧化碳反应。
Ca(OH)2 +CO2 = CaCO3 ↓ +H2O
NaOH + CO2 =
NaOH + SO2 =
Ca(OH)2 +CO2 =
2NaOH + CO2 =Na2CO3 + H2O
2NaOH + SO2 =Na2SO3 + H2O
讨论:NaOH 与CO2反应时是没有什么现象看到的,是不是它们不反应呢?那你如何设计一个实验来证明它们确实发生了化学反应呢?
???????????????????????
????????????????????????
???????????????????????
图一
图二
图三
???????????????????????
????????????????????????
???????????????????????
图四
图五
图六
1、氢氧化钠与硫酸铜反应
3、碱与盐的反应 【实验8-12】
实验现象:有蓝色的沉淀生成
CuSO4 + 2NaOH == Cu(OH)2↓+ Na2SO4
2、氢氧化钠与氯化铁反应
实验现象:有红褐色的沉淀生成
3NaOH +FeCl3 ==Fe(OH)3↓+3NaCl
性质3:碱能跟某些盐发生复分解反应,生成其他碱和盐。
碱 + 盐 → 新碱 + 新盐
畅谈收获
氢氧化钠和氢氧化钙的物理性质
碱的物
理性质
碱的化学性质
碱能使紫色石蕊溶液变蓝
碱能使无色酚酞溶液变红
碱+非金属氧化物→盐+水
碱+某些可溶性盐→新碱+新盐
小结
一、几种常见的碱
1、氢氧化钠(NaOH) 俗名:火碱、烧碱、苛性钠
2、氢氧化钙(Ca(OH)2) 俗名:熟石灰、消石灰
二、碱的通性
性质1 碱能使无色酚酞溶液变红,使紫色的石蕊溶液变蓝。
性质2 碱 + 酸 盐 + 水
性质3 碱 + 某些非金属氧化物 盐 + 水
NaOH和Ca(OH)2的保存和鉴别CO2的方法。
性质4 碱 + 盐 新盐 + 新碱
