2020-2021学年九年级化学鲁教版下册酸碱盐性质复习(24张PPT)
文档属性
| 名称 | 2020-2021学年九年级化学鲁教版下册酸碱盐性质复习(24张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-04-15 22:36:40 | ||
图片预览





文档简介
生活中常见的化合物
酸碱盐性质的复习
知识导航
任务一:从物质分类角度认识酸碱盐
任务二:从化学性质角度认识酸碱盐
任务三:从反应类型角度认识酸碱盐
任务四:判断复分解反应是否发生
实验室新进了一批药品:烧碱、氧化铜、硫酸、铜丝、纯碱、铁钉、熟石灰、氯化铜、硝酸银。
1、请写出以上药品的化学式。
2、试着对上述药品进行分类,并说出分类依据。
问题情境一
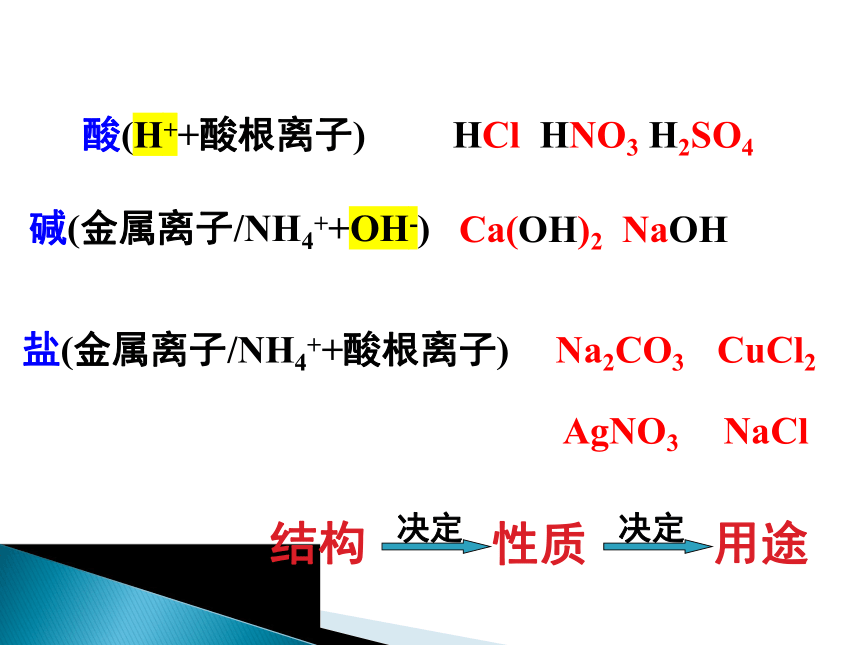
酸(H++酸根离子)
碱(金属离子/NH4++OH-)
盐(金属离子/NH4++酸根离子)
HCl HNO3 H2SO4
Ca(OH)2 NaOH
Na2CO3
CuCl2
AgNO3
NaCl
决定
决定
结构
性质
用途
小丽在使用“除垢净”去除热水瓶中的水垢时,发现有大量的气泡产生。联想到水垢中含有CaCO3 ,猜想“除垢净”的成分中可能有酸。请同学们设计实验方案,帮助小丽证实她的猜想。
1.滴加石蕊试液观察颜色变化;
2.取样加入氢前金属观察是否有气泡;
3. 加入难溶于水的金属氧化物,看是否溶解;
4. 加入难溶于水的碱,看是否溶解;
5. 加入碳酸盐,看是否有气泡生成;
6.pH试纸检验, pH 是否小于7;
问题情境二
知识梳理:酸的通性
酸碱指示剂:使紫色石蕊变红,使无色酚酞不变色
无方程式
酸 + 氢前金属 = 盐 + H2↑
酸+金属氧化物=盐+ H2O
酸 +盐(CO3) = 新酸 + 新盐
Fe + 2HCl= FeCl2 + H2↑
Fe2O3+6HCl=2FeCl3+3H2O
Na2CO3+2HCl==2NaCl+H2O+CO2↑
CuO+H2SO4=CuSO4+H2O
CaCO3+2HCl==CaCl2+H2O+CO2↑
酸 +碱 = 盐+ H2O
2NaOH + H2SO4 == Na2SO4 + 2H2O
Cu(OH)2+2HCl == CuCl2 + 2H2O
有现象-H+的检验方法
无现象
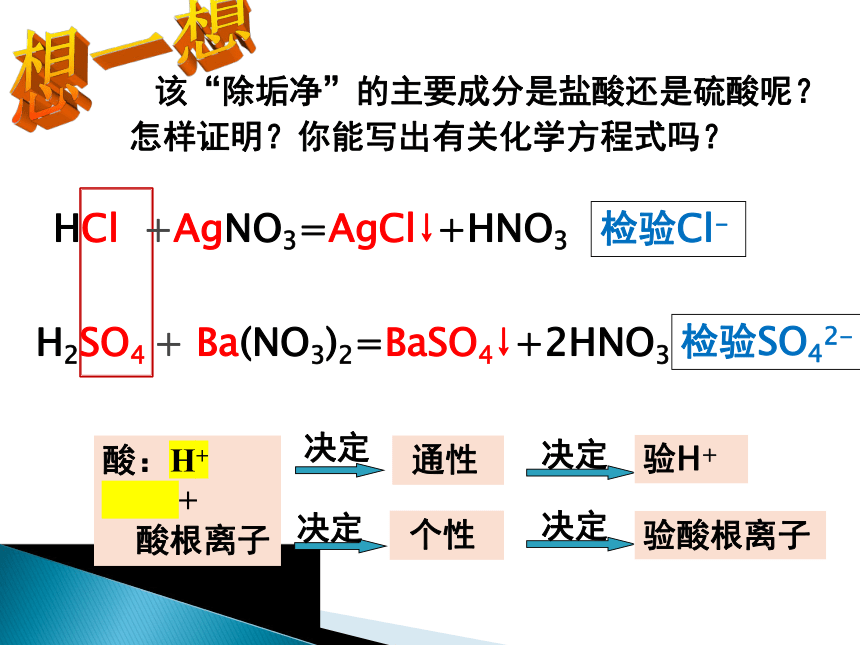
该“除垢净”的主要成分是盐酸还是硫酸呢?
怎样证明?你能写出有关化学方程式吗?
酸:H+
+
酸根离子
决定
通性
个性
决定
HCl +AgNO3=AgCl↓+HNO3
H2SO4 + Ba(NO3)2=BaSO4↓+2HNO3
检验Cl-
检验SO42-
决定
决定
验H+
验酸根离子
想一想
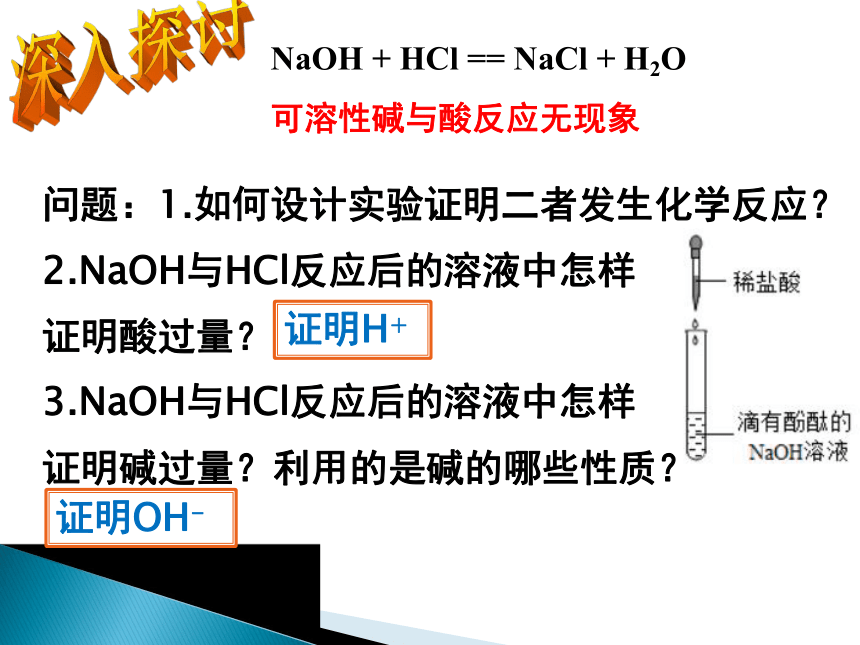
NaOH + HCl == NaCl + H2O
可溶性碱与酸反应无现象
深入探讨
问题:1.如何设计实验证明二者发生化学反应?
2.NaOH与HCl反应后的溶液中怎样
证明酸过量?
3.NaOH与HCl反应后的溶液中怎样
证明碱过量?利用的是碱的哪些性质?
证明H+
证明OH-
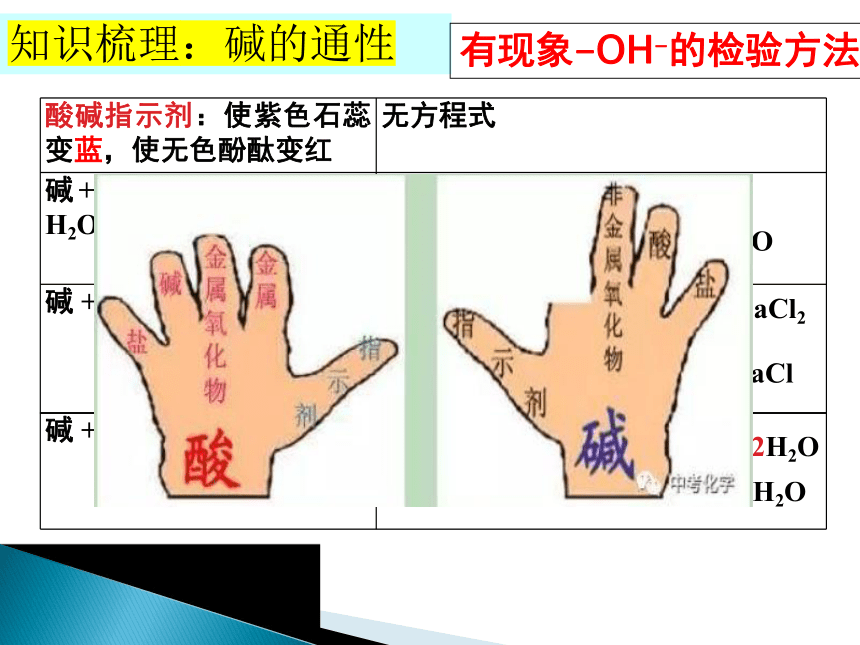
知识梳理:碱的通性
酸碱指示剂:使紫色石蕊变蓝,使无色酚酞变红
无方程式
碱+非金属氧化物=盐+ H2O
碱 +某些盐 = 新碱 + 新盐
碱 +酸 = 盐+ H2O
2NaOH + H2SO4 == Na2SO4 + 2H2O
Cu(OH)2+2HCl == CuCl2 + 2H2O
有现象-OH-的检验方法
2NaOH+CO2=Na2CO3+H2O
Ca(OH)2+CO2=CaCO3↓+H2O
Ca(OH)2+CuCl2=Cu(OH)2↓+CaCl2
3NaOH+FeCl3=Fe(OH)3↓+3NaCl
想一想
如何区分NaOH
和Ca(OH)2?
Na
Ca
Ca(OH)2+Na2CO3=2NaOH+CaCO3↓
NaOH+Na2CO3不反应
通入CO2
无现象-NaOH
白色沉淀-Ca(OH)2
加Na2CO3
无现象-NaOH
白色沉淀-Ca(OH)2
2 NaOH+CO2 = Na2CO3+H2O
Ca(OH)2+CO2=CaCO3↓+H2O
决 定
个 性
你还记得吗?
1、检验二氧化碳用_______,写出涉及的反应方程式___________________;吸收或除掉二氧化碳用________,涉及的反应方程式___________________.
2、如何改良被硝酸酸化的土壤?写出有关反应方程式。
3、工业上如何用熟石灰制烧碱?
问题情境三
小丽帮妈妈做饭时,发现了一种白色粉末.她取了少量该粉末于玻璃杯中,加入适量的醋酸后,发现有气泡冒出;然后,她把收集的气体通入到澄清的石灰水中,石灰水变浑浊.该白色粉末可能是 。
Na2CO3
你还知道关于碳酸钠的哪些化学性质呢?
酸
碱
盐
一次,葛洪之妻鲍姑用铁勺盛曾青(硫酸铜溶液),几天后,葛洪拿那铁勺使用,奇妙的现象出现了:铁勺变成“铜勺”了,红光闪闪的。葛洪的徒弟高兴得跳起来。
“点铁成金啦!”
Fe + CuSO4 == FeSO4 + Cu
金属+盐
金属
非金属氧化物
金属
氧化物
酸
碱
指示剂
知识网络
盐
盐
①
②
③
④
⑤
⑥
⑦
⑧
属于复分解反应的是 。
置
换
反
应
无基本
反应类型
② ③ ④ ⑥ ⑦
化合物和化合物互相交换成分生成两种化合物的反应
复分解反应的条件:生成水或气体或沉淀
2. 下列物质能在水溶液中大量共存的是( )
A.CuSO4和NaOH B.Ba(NO3)2和Na2SO4
C.Na2CO3和HCl D.CaCl2和KNO3
D
1.下列每组物质的溶液混合后,不能发生反应的是( )
A.NaCl和KNO3 B.NaOH和HCl
C.Na2CO3和CaCl2 D.MgCl2和NaOH
A
小试身手
当堂检测
谢谢各位老师的聆听,
请您批评指正。
深入探讨
小丽在探究氢氧化钠和盐酸反应的
实验过程中,意外发现滴加稀盐酸后
有气泡生成。
小丽在实验室整理化学试剂时,发现盛有无色液体(初中化学常用试剂)的试剂瓶,标签破损如图所示。
想一想:这可能是什么药品呢?
你猜一猜:
可能是:Na2CO3
可能是:Na2SO4
你有办法吗?
[提供的化学药品]:稀HCl 、Ba(NO3)2溶液、
酚酞试液、 Na2SO4溶液
问题情境三
写出有关化学反应方程式
1、Na CO3 + HCl == NaCl + CO2 ↑+ H2O
2、Na CO3 + Ba(NO3)2 == BaCO3 + NaNO3
3、BaCO3 + HCl == BaCl2 + CO2 ↑ + H2O
4、Na2SO4 +Ba(NO3)2 == BaSO4 ↓+
涉及到的化学反应的化学方程式有:
2
2 2
2
↓
2
2
总结归纳
盐的化学性质?
5、Na2CO3 + Ca(OH)2 == CaCO3↓+ 2NaOH
NaNO3
2
酸碱盐性质的复习
知识导航
任务一:从物质分类角度认识酸碱盐
任务二:从化学性质角度认识酸碱盐
任务三:从反应类型角度认识酸碱盐
任务四:判断复分解反应是否发生
实验室新进了一批药品:烧碱、氧化铜、硫酸、铜丝、纯碱、铁钉、熟石灰、氯化铜、硝酸银。
1、请写出以上药品的化学式。
2、试着对上述药品进行分类,并说出分类依据。
问题情境一
酸(H++酸根离子)
碱(金属离子/NH4++OH-)
盐(金属离子/NH4++酸根离子)
HCl HNO3 H2SO4
Ca(OH)2 NaOH
Na2CO3
CuCl2
AgNO3
NaCl
决定
决定
结构
性质
用途
小丽在使用“除垢净”去除热水瓶中的水垢时,发现有大量的气泡产生。联想到水垢中含有CaCO3 ,猜想“除垢净”的成分中可能有酸。请同学们设计实验方案,帮助小丽证实她的猜想。
1.滴加石蕊试液观察颜色变化;
2.取样加入氢前金属观察是否有气泡;
3. 加入难溶于水的金属氧化物,看是否溶解;
4. 加入难溶于水的碱,看是否溶解;
5. 加入碳酸盐,看是否有气泡生成;
6.pH试纸检验, pH 是否小于7;
问题情境二
知识梳理:酸的通性
酸碱指示剂:使紫色石蕊变红,使无色酚酞不变色
无方程式
酸 + 氢前金属 = 盐 + H2↑
酸+金属氧化物=盐+ H2O
酸 +盐(CO3) = 新酸 + 新盐
Fe + 2HCl= FeCl2 + H2↑
Fe2O3+6HCl=2FeCl3+3H2O
Na2CO3+2HCl==2NaCl+H2O+CO2↑
CuO+H2SO4=CuSO4+H2O
CaCO3+2HCl==CaCl2+H2O+CO2↑
酸 +碱 = 盐+ H2O
2NaOH + H2SO4 == Na2SO4 + 2H2O
Cu(OH)2+2HCl == CuCl2 + 2H2O
有现象-H+的检验方法
无现象
该“除垢净”的主要成分是盐酸还是硫酸呢?
怎样证明?你能写出有关化学方程式吗?
酸:H+
+
酸根离子
决定
通性
个性
决定
HCl +AgNO3=AgCl↓+HNO3
H2SO4 + Ba(NO3)2=BaSO4↓+2HNO3
检验Cl-
检验SO42-
决定
决定
验H+
验酸根离子
想一想
NaOH + HCl == NaCl + H2O
可溶性碱与酸反应无现象
深入探讨
问题:1.如何设计实验证明二者发生化学反应?
2.NaOH与HCl反应后的溶液中怎样
证明酸过量?
3.NaOH与HCl反应后的溶液中怎样
证明碱过量?利用的是碱的哪些性质?
证明H+
证明OH-
知识梳理:碱的通性
酸碱指示剂:使紫色石蕊变蓝,使无色酚酞变红
无方程式
碱+非金属氧化物=盐+ H2O
碱 +某些盐 = 新碱 + 新盐
碱 +酸 = 盐+ H2O
2NaOH + H2SO4 == Na2SO4 + 2H2O
Cu(OH)2+2HCl == CuCl2 + 2H2O
有现象-OH-的检验方法
2NaOH+CO2=Na2CO3+H2O
Ca(OH)2+CO2=CaCO3↓+H2O
Ca(OH)2+CuCl2=Cu(OH)2↓+CaCl2
3NaOH+FeCl3=Fe(OH)3↓+3NaCl
想一想
如何区分NaOH
和Ca(OH)2?
Na
Ca
Ca(OH)2+Na2CO3=2NaOH+CaCO3↓
NaOH+Na2CO3不反应
通入CO2
无现象-NaOH
白色沉淀-Ca(OH)2
加Na2CO3
无现象-NaOH
白色沉淀-Ca(OH)2
2 NaOH+CO2 = Na2CO3+H2O
Ca(OH)2+CO2=CaCO3↓+H2O
决 定
个 性
你还记得吗?
1、检验二氧化碳用_______,写出涉及的反应方程式___________________;吸收或除掉二氧化碳用________,涉及的反应方程式___________________.
2、如何改良被硝酸酸化的土壤?写出有关反应方程式。
3、工业上如何用熟石灰制烧碱?
问题情境三
小丽帮妈妈做饭时,发现了一种白色粉末.她取了少量该粉末于玻璃杯中,加入适量的醋酸后,发现有气泡冒出;然后,她把收集的气体通入到澄清的石灰水中,石灰水变浑浊.该白色粉末可能是 。
Na2CO3
你还知道关于碳酸钠的哪些化学性质呢?
酸
碱
盐
一次,葛洪之妻鲍姑用铁勺盛曾青(硫酸铜溶液),几天后,葛洪拿那铁勺使用,奇妙的现象出现了:铁勺变成“铜勺”了,红光闪闪的。葛洪的徒弟高兴得跳起来。
“点铁成金啦!”
Fe + CuSO4 == FeSO4 + Cu
金属+盐
金属
非金属氧化物
金属
氧化物
酸
碱
指示剂
知识网络
盐
盐
①
②
③
④
⑤
⑥
⑦
⑧
属于复分解反应的是 。
置
换
反
应
无基本
反应类型
② ③ ④ ⑥ ⑦
化合物和化合物互相交换成分生成两种化合物的反应
复分解反应的条件:生成水或气体或沉淀
2. 下列物质能在水溶液中大量共存的是( )
A.CuSO4和NaOH B.Ba(NO3)2和Na2SO4
C.Na2CO3和HCl D.CaCl2和KNO3
D
1.下列每组物质的溶液混合后,不能发生反应的是( )
A.NaCl和KNO3 B.NaOH和HCl
C.Na2CO3和CaCl2 D.MgCl2和NaOH
A
小试身手
当堂检测
谢谢各位老师的聆听,
请您批评指正。
深入探讨
小丽在探究氢氧化钠和盐酸反应的
实验过程中,意外发现滴加稀盐酸后
有气泡生成。
小丽在实验室整理化学试剂时,发现盛有无色液体(初中化学常用试剂)的试剂瓶,标签破损如图所示。
想一想:这可能是什么药品呢?
你猜一猜:
可能是:Na2CO3
可能是:Na2SO4
你有办法吗?
[提供的化学药品]:稀HCl 、Ba(NO3)2溶液、
酚酞试液、 Na2SO4溶液
问题情境三
写出有关化学反应方程式
1、Na CO3 + HCl == NaCl + CO2 ↑+ H2O
2、Na CO3 + Ba(NO3)2 == BaCO3 + NaNO3
3、BaCO3 + HCl == BaCl2 + CO2 ↑ + H2O
4、Na2SO4 +Ba(NO3)2 == BaSO4 ↓+
涉及到的化学反应的化学方程式有:
2
2 2
2
↓
2
2
总结归纳
盐的化学性质?
5、Na2CO3 + Ca(OH)2 == CaCO3↓+ 2NaOH
NaNO3
2
同课章节目录
- 第七单元 常见的酸和碱
- 第一节 酸及其性质
- 第二节 碱及其性质
- 第三节 溶液的酸碱性
- 第四节 酸碱中和反应
- 到实验室去:探究酸和碱的化学性质
- 第八单元 海水中的化学
- 第一节 海洋化学资源
- 第二节 海水“晒盐“
- 第三节 海水“制碱“
- 到实验室去:粗盐中难溶性杂质的去除
- 第九单元 金属
- 第一节 常见的金属材料
- 第二节 金属的化学性质
- 第三节 钢铁的锈蚀与防护
- 到实验室去 探究金属的性质
- 第十单元 化学与健康
- 第一节 食物中的有机物
- 第二节 化学元素与人体健康
- 第三节 远离有毒物质
- 第十一单元 化学与社会发展
- 第一节 化学与能源开发
- 第二节 化学与材料研制
- 第三节 化学与农业生产
- 第四节 化学与环境保护
