第三节 酸和碱的性质
图片预览







文档简介
(共51张PPT)
5-3 酸和碱的性质
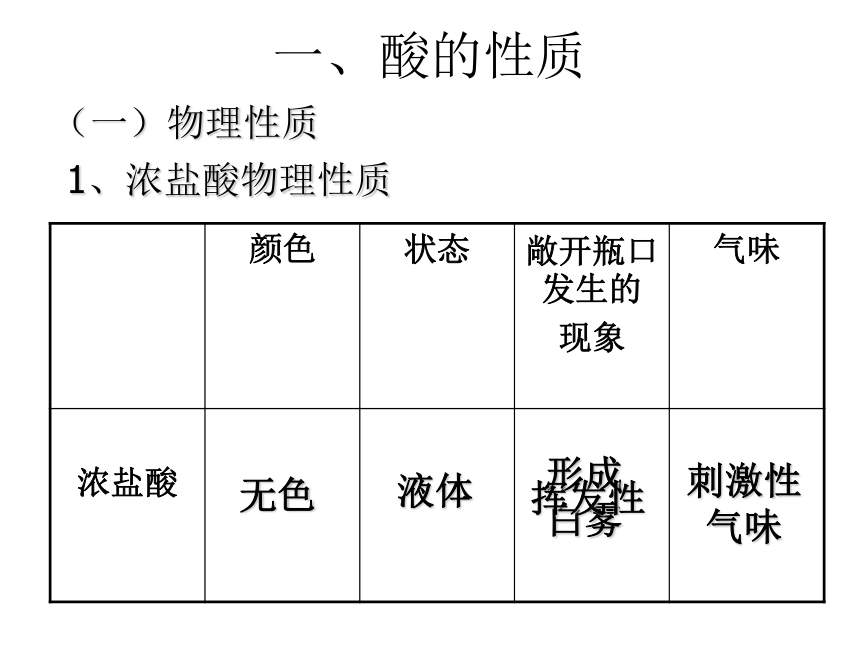
一、酸的性质
(一)物理性质
颜色 状态 敞开瓶口发生的
现象
气味
浓盐酸
无色
液体
刺激性
气味
形成
白雾
挥发性
1、浓盐酸物理性质
工业用浓盐酸以含有少量杂质而略显黄色。浓盐酸有强烈的腐蚀性。
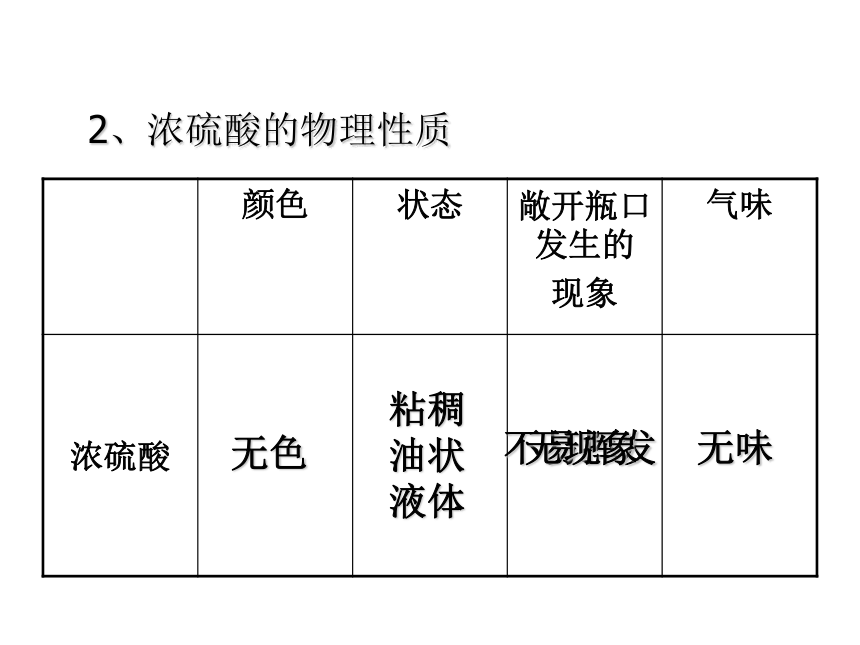
2、浓硫酸的物理性质
颜色 状态 敞开瓶口发生的
现象 气味
浓硫酸
无色
粘稠
油状
液体
无味
不易挥发
无现象
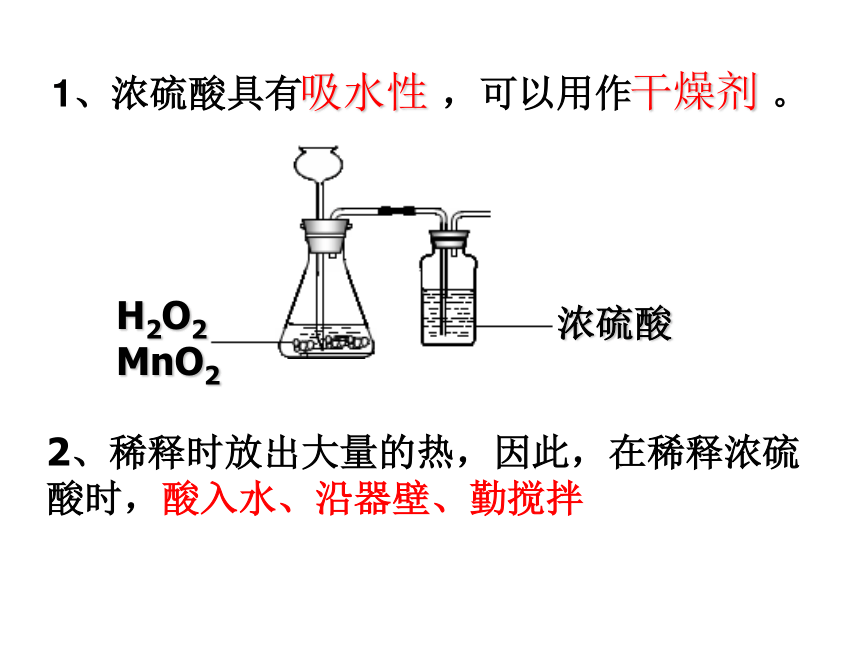
1、浓硫酸具有 ,可以用作 。
吸水性
干燥剂
2、稀释时放出大量的热,因此,在稀释浓硫
酸时,酸入水、沿器壁、勤搅拌
H2O2
MnO2
浓硫酸
另外,浓硫酸具有强烈的腐蚀性,在使用时应十分小心。
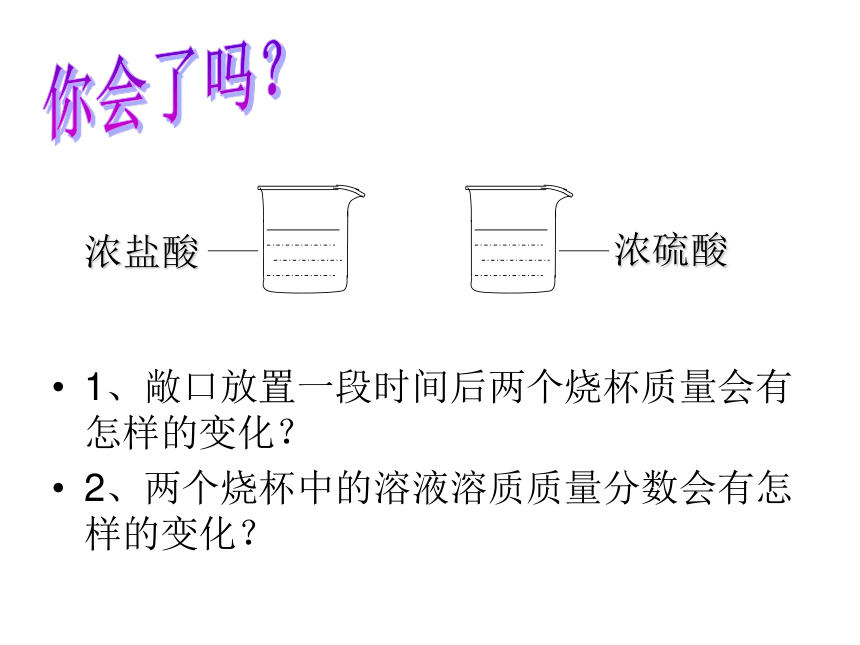
1、敞口放置一段时间后两个烧杯质量会有怎样的变化?
2、两个烧杯中的溶液溶质质量分数会有怎样的变化?
浓盐酸
浓硫酸
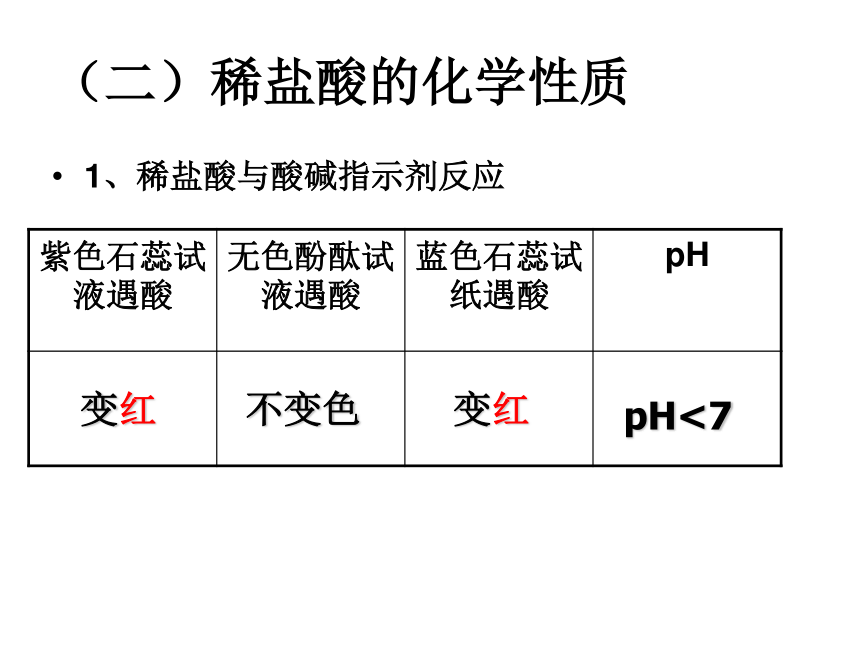
(二)稀盐酸的化学性质
1、稀盐酸与酸碱指示剂反应
紫色石蕊试液遇酸 无色酚酞试液遇酸 蓝色石蕊试纸遇酸 pH
变红
不变色
变红
pH<7
2、稀盐酸与碱发生中和反应
中和反应的实质:
酸+碱===盐+水
H++OH- ===H2O
练习:写出下列反应的化学方程式
口服含氢氧化铝的药物治疗胃酸过多。
氢氧化铜与盐酸反应
用熟石灰[Ca(OH)2]改良含硝酸的土壤
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
金属活动性顺序:
金属活动性由强变弱
实验探究:镁、锌、铁、铜与盐酸是否反应?若反应,剧烈程度如何?
结论:①铜不反应
②反应的剧烈程度:镁﹥锌﹥铁
写出锌、铁、镁、铝与稀盐酸反应的化学方程式
3、稀盐酸与H以前的金属反应
置换反应:一种单质与一种化合物,生成另一种单质和另一种化合物的反应
4、稀盐酸和金属氧化物的反应
实验探究:用盐酸除铁锈(铁锈主要成分Fe2O3)
因此:工业上可用盐酸除铁锈
Fe2O3+ HCl===
FeCl3
H2O
+
2
6
3
黄色溶液
练一练:
1、将生锈的铁钉加入稀盐酸中,现象
,反应的化学
方程式 ; 一段时间后,
现象 ,反应的化学方程式
。
2、试着写出下列反应的化学方程式
(1)氧化铜和稀盐酸
(2)氧化铝和稀盐酸
5、稀盐酸和某些盐的反应
CaCO3+2HCl==CaCl2+H2O+CO2
实验探究:稀盐酸和硝酸银反应
现象:生成不溶于稀硝酸白色沉淀
方程式:AgNO3+HCl==AgCl +HNO3
氯离子(Cl-)的检验:向待测液中加入硝酸银
溶液,如果生成不溶于稀硝酸的白色沉淀,
说明待测液中含Cl-。
小结:稀盐酸的化学性质
1、与酸碱指示剂反应
2、与活泼金属反应
3、与金属氧化物反应
4、与碱反应
5、与某些盐反应
(三)稀硫酸的化学性质
1、与酸碱指示剂反应
2、与氢前的金属反应
3、与金属氧化物的反应
写出锌、铁、镁、铝与稀硫酸反应的化学方程式
写出氧化铁、氧化铜与稀硫酸反应的化学方程式
5、与某些盐反应
4、与碱发生中和反应
写出碳酸钠与稀硫酸反应的化学方程式
写出氢氧化钠、氢氧化铜与稀硫酸反应的化学方程式
写出硝酸钡与稀硫酸反应的化学方程式
硫酸根(SO42-)的检验:向待测液中加入硝酸钡
溶液,如果生成不溶于稀硝酸的白色沉淀,
说明待测液中含SO42- 。
(四)酸的通性
1、与酸碱指示剂反应
2、与活泼金属反应,生成 和
3、与金属氧化物反应,生成 和
4、与碱反应,生成 和
5、与某些盐反应,生成 和
盐
水
盐
氢气
盐
水
新酸
新盐
二、碱的性质
(一)物理性质
1、NaOH固体的物理性质
颜色 状态 露置在空气中的变化 溶解
情况 其他
氢氧
化钠
白色
固体
吸收水蒸气
而逐渐溶解,
NaOH固体
可作干燥剂
易溶
于水,
溶解时
放热
腐蚀性
俗称火碱、
烧碱、
苛性钠
2、Ca(OH)2固体的物理性质
颜色 状态 露置在空气中的变化 溶解
情况 其他
氢氧
化钙
白色
固体
微溶
于水,
水溶液
俗称
石灰水
腐蚀性,
俗称熟石灰
或消石灰
无变化,
不可做
干燥剂
所需装置
练习:实验室欲制取并收集一瓶干燥的氧气,
H2O2
MnO2
浓硫酸
A
B
C
D
A D B
A E(F) B
NaOH固体
E
F
(二)化学性质
1、NaOH溶液、Ca(OH)2溶液与酸碱指示剂反应
紫色石蕊试液 无色酚酞试液 红色石蕊试纸 pH
NaOH、Ca(OH)2
变蓝色
变红色
变蓝色
pH>7
2、 NaOH溶液、Ca(OH)2溶液和酸反应
中和反应
酸+碱===盐+水
实质:
H++OH- ===H2O
3、 NaOH溶液、Ca(OH)2溶液与非金属
氧化物反应
CO2+Ca(OH)2==CaCO3 +H2O
CO2+2NaOH==Na2CO3+H2O
NaOH固体不仅吸收空气中的( )而
( ),而且与空气中的( )反应而( )
水蒸气
溶解
CO2
变质
因此, NaOH固体必须密封保存
4、 NaOH溶液、Ca(OH)2溶液与某些盐溶液反应
2NaOH+CuSO4==Cu(OH)2 +Na2SO4
蓝色沉淀
3NaOH+FeCl3==Fe(OH)3 +3NaCl
蓝色溶液
黄色溶液
红褐色沉淀
(三) NaOH、Ca(OH)2的制法
1、Ca(OH)2的制法
生石灰
=== Ca(OH)2
熟石灰
CaO
石灰石
CaCO3===CaO+CO2
高温
+H2O
CaO俗称生石灰,具有吸水性,
生石灰固体常用作干燥剂
2、NaOH的制法
Na2CO3+Ca(OH)2==CaCO3 +2NaOH
CaCO3===CaO+CO2
高温
=== Ca(OH)2
CaO+H2O
工业上用此反应制烧碱
小结:NaOH溶液、Ca(OH)2溶液的化学性质
1、NaOH溶液、Ca(OH)2溶液与酸碱指示剂反应
2、 NaOH溶液、Ca(OH)2溶液和酸反应,生成盐和水
3、 NaOH溶液、Ca(OH)2溶液与非金属氧化物反应
4、 NaOH溶液、Ca(OH)2溶液与盐溶液反应
多识一点
与酸不同,氢氧化钠和氢氧化钙不能与生锈
铁钉以及铁反应。
工业上,常用铁桶来储运烧碱,就是利用了
碱与铁不反应的性质。
3NaOH+FeCl3==Fe(OH)3 +3NaCl
Na2CO3+Ca(OH)2==CaCO3 +2NaOH
2NaOH+CuCl2==Cu(OH)2 +2NaCl
3、复分解反应
(1)定义:如果两种化合物互相交换成分,
生成另外两种新的化合物,那么这样的反应
就叫做复分解反应。
练习:写出下列反应的化学方程式
氢氧化钠与二氧化碳
盐酸与石灰石
盐酸与硝酸银
氢氧化钠与硫酸
氯化钠与硫酸
(2)复分解反应的条件:
有气体放出,或有沉淀析出,或有水生成。
(3)溶解性口诀:
钾钠铵盐硝酸盐,
氯化物难溶氯化银,
溶碱只有钾钠钙和钡,
均能溶于水中间,
硫酸盐难溶硫酸钡,
碳酸盐只溶钾钠铵。
碱的通性
1、碱与酸碱指示剂反应
2、碱和酸反应,生成盐和水
3、碱与非金属氧化物反应,生成 和
4、碱与盐溶液反应,生成 和
盐 水
新碱
新盐
碱和盐反应条件
生成气体、沉淀或水
反应物都可溶
缺一不可
纯净物
混和物
单质
化合物
金属单质
非金属单质
稀有气体
酸
碱
盐
氧化物
金属氧化物
非金属氧化物
物质
颜色小节
1、黄色溶液:
2、蓝色溶液:
3、浅绿色溶液:
4、蓝色沉淀:
5、红褐色沉淀:
6、不溶于稀硝酸的白色沉淀:
FeCl3
Fe2(SO4)3
Fe(NO3)3
含Fe3+的溶液
CuSO4
CuCl2
Cu(NO3)2
含Cu2+的溶液
FeCl2
FeSO4
Fe(NO3)2
含Fe2+的溶液
Cu(OH)2
Fe(OH)3
AgCl
BaSO4
离子对
1、生成水:
H++OH-==H2O
2、生成气体:
H++CO32-==H2O+CO2
3、生成沉淀:
Cu2++OH-==Cu(OH)2
Fe3++OH-==Fe(OH)3
Ag++Cl-==AgCl
Ba2++SO42-==BaSO4
Ba2++CO32-==BaCO3
Ca2++CO32-==CaCO3
Mg2++OH-==Mg(OH)2
挥发性:挥发出的氯化氢气体与空气中的
水蒸气结合,形成盐酸小液滴
三、盐的性质
1、碳酸钠Na2CO3
颜色 状态 溶解
情况 其他
碳酸钠
白色
固体
水溶液显碱性
俗称纯碱
或苏打
(一)物理性质
练习:写出下列反应的化学方程式
碳酸钠和盐酸
碳酸钙和盐酸
碳酸钡和硫酸
CO32-的检验:
向待测物中加入稀盐酸,如果产生能使
澄清石灰水变浑浊的气体,则待测物中
含CO32-。
实质:
H++CO32- ===H2O+CO2
2、硫酸铜CuSO4
颜色 状态 溶解
情况 其他
硫酸铜
蓝色
×
白色
固体
水溶液
呈蓝色
CuSO4·5H2O
俗称胆矾或
蓝矾
CuSO4+5H2O===CuSO4·5H2O
CuSO4·5H2O
CuSO4
△
===
+5H2O
白色
蓝色
硫酸铜固体可用来检验水的存在
白色
蓝色
所需装置
练习:实验室欲制取并收集一瓶干燥的氧气,
H2O2
MnO2
浓硫酸
A
B
C
D
A D E B
E
CuSO4
3、硫酸铜用途
(1)检验水的存在
(2)农业上用熟石灰和硫酸铜溶液配制农药波尔多液
(二)化学性质
1、盐溶液与金属单质反应
Fe+CuSO4===
FeSO4+Cu
反应条件:
a.盐必须可溶
b.前金属进,后金属出(K、Ca、Na除外)
Cu+ AgNO3=== Ag+Cu(NO3)2
2
2
2、盐与酸的反应
(1)硝酸银与盐酸
(2)氯化钡与硫酸
(3)碳酸钠与盐酸
3、盐与碱反应
(1)工业制烧碱:
碳酸钠溶液与氢氧化钙溶液
(2)氢氧化钠溶液与硫酸铜溶液
(3)氢氧化钠溶液与氯化铁溶液
碱和盐反应条件:
(1)生成气体、沉淀或水
(2)反应物都可溶
4、盐与盐反应
(1)碳酸钠溶液和氯化钙溶液
(2)碳酸钠溶液和氯化钡溶液
(3)碳酸钠溶液和氯化银
盐和盐反应条件:
(1)生成气体、沉淀或水
(2)反应物都可溶
×
碱和盐、盐和盐反应条件:
生成气体、沉淀或水
反应物都可溶
5-3 酸和碱的性质
一、酸的性质
(一)物理性质
颜色 状态 敞开瓶口发生的
现象
气味
浓盐酸
无色
液体
刺激性
气味
形成
白雾
挥发性
1、浓盐酸物理性质
工业用浓盐酸以含有少量杂质而略显黄色。浓盐酸有强烈的腐蚀性。
2、浓硫酸的物理性质
颜色 状态 敞开瓶口发生的
现象 气味
浓硫酸
无色
粘稠
油状
液体
无味
不易挥发
无现象
1、浓硫酸具有 ,可以用作 。
吸水性
干燥剂
2、稀释时放出大量的热,因此,在稀释浓硫
酸时,酸入水、沿器壁、勤搅拌
H2O2
MnO2
浓硫酸
另外,浓硫酸具有强烈的腐蚀性,在使用时应十分小心。
1、敞口放置一段时间后两个烧杯质量会有怎样的变化?
2、两个烧杯中的溶液溶质质量分数会有怎样的变化?
浓盐酸
浓硫酸
(二)稀盐酸的化学性质
1、稀盐酸与酸碱指示剂反应
紫色石蕊试液遇酸 无色酚酞试液遇酸 蓝色石蕊试纸遇酸 pH
变红
不变色
变红
pH<7
2、稀盐酸与碱发生中和反应
中和反应的实质:
酸+碱===盐+水
H++OH- ===H2O
练习:写出下列反应的化学方程式
口服含氢氧化铝的药物治疗胃酸过多。
氢氧化铜与盐酸反应
用熟石灰[Ca(OH)2]改良含硝酸的土壤
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
金属活动性顺序:
金属活动性由强变弱
实验探究:镁、锌、铁、铜与盐酸是否反应?若反应,剧烈程度如何?
结论:①铜不反应
②反应的剧烈程度:镁﹥锌﹥铁
写出锌、铁、镁、铝与稀盐酸反应的化学方程式
3、稀盐酸与H以前的金属反应
置换反应:一种单质与一种化合物,生成另一种单质和另一种化合物的反应
4、稀盐酸和金属氧化物的反应
实验探究:用盐酸除铁锈(铁锈主要成分Fe2O3)
因此:工业上可用盐酸除铁锈
Fe2O3+ HCl===
FeCl3
H2O
+
2
6
3
黄色溶液
练一练:
1、将生锈的铁钉加入稀盐酸中,现象
,反应的化学
方程式 ; 一段时间后,
现象 ,反应的化学方程式
。
2、试着写出下列反应的化学方程式
(1)氧化铜和稀盐酸
(2)氧化铝和稀盐酸
5、稀盐酸和某些盐的反应
CaCO3+2HCl==CaCl2+H2O+CO2
实验探究:稀盐酸和硝酸银反应
现象:生成不溶于稀硝酸白色沉淀
方程式:AgNO3+HCl==AgCl +HNO3
氯离子(Cl-)的检验:向待测液中加入硝酸银
溶液,如果生成不溶于稀硝酸的白色沉淀,
说明待测液中含Cl-。
小结:稀盐酸的化学性质
1、与酸碱指示剂反应
2、与活泼金属反应
3、与金属氧化物反应
4、与碱反应
5、与某些盐反应
(三)稀硫酸的化学性质
1、与酸碱指示剂反应
2、与氢前的金属反应
3、与金属氧化物的反应
写出锌、铁、镁、铝与稀硫酸反应的化学方程式
写出氧化铁、氧化铜与稀硫酸反应的化学方程式
5、与某些盐反应
4、与碱发生中和反应
写出碳酸钠与稀硫酸反应的化学方程式
写出氢氧化钠、氢氧化铜与稀硫酸反应的化学方程式
写出硝酸钡与稀硫酸反应的化学方程式
硫酸根(SO42-)的检验:向待测液中加入硝酸钡
溶液,如果生成不溶于稀硝酸的白色沉淀,
说明待测液中含SO42- 。
(四)酸的通性
1、与酸碱指示剂反应
2、与活泼金属反应,生成 和
3、与金属氧化物反应,生成 和
4、与碱反应,生成 和
5、与某些盐反应,生成 和
盐
水
盐
氢气
盐
水
新酸
新盐
二、碱的性质
(一)物理性质
1、NaOH固体的物理性质
颜色 状态 露置在空气中的变化 溶解
情况 其他
氢氧
化钠
白色
固体
吸收水蒸气
而逐渐溶解,
NaOH固体
可作干燥剂
易溶
于水,
溶解时
放热
腐蚀性
俗称火碱、
烧碱、
苛性钠
2、Ca(OH)2固体的物理性质
颜色 状态 露置在空气中的变化 溶解
情况 其他
氢氧
化钙
白色
固体
微溶
于水,
水溶液
俗称
石灰水
腐蚀性,
俗称熟石灰
或消石灰
无变化,
不可做
干燥剂
所需装置
练习:实验室欲制取并收集一瓶干燥的氧气,
H2O2
MnO2
浓硫酸
A
B
C
D
A D B
A E(F) B
NaOH固体
E
F
(二)化学性质
1、NaOH溶液、Ca(OH)2溶液与酸碱指示剂反应
紫色石蕊试液 无色酚酞试液 红色石蕊试纸 pH
NaOH、Ca(OH)2
变蓝色
变红色
变蓝色
pH>7
2、 NaOH溶液、Ca(OH)2溶液和酸反应
中和反应
酸+碱===盐+水
实质:
H++OH- ===H2O
3、 NaOH溶液、Ca(OH)2溶液与非金属
氧化物反应
CO2+Ca(OH)2==CaCO3 +H2O
CO2+2NaOH==Na2CO3+H2O
NaOH固体不仅吸收空气中的( )而
( ),而且与空气中的( )反应而( )
水蒸气
溶解
CO2
变质
因此, NaOH固体必须密封保存
4、 NaOH溶液、Ca(OH)2溶液与某些盐溶液反应
2NaOH+CuSO4==Cu(OH)2 +Na2SO4
蓝色沉淀
3NaOH+FeCl3==Fe(OH)3 +3NaCl
蓝色溶液
黄色溶液
红褐色沉淀
(三) NaOH、Ca(OH)2的制法
1、Ca(OH)2的制法
生石灰
=== Ca(OH)2
熟石灰
CaO
石灰石
CaCO3===CaO+CO2
高温
+H2O
CaO俗称生石灰,具有吸水性,
生石灰固体常用作干燥剂
2、NaOH的制法
Na2CO3+Ca(OH)2==CaCO3 +2NaOH
CaCO3===CaO+CO2
高温
=== Ca(OH)2
CaO+H2O
工业上用此反应制烧碱
小结:NaOH溶液、Ca(OH)2溶液的化学性质
1、NaOH溶液、Ca(OH)2溶液与酸碱指示剂反应
2、 NaOH溶液、Ca(OH)2溶液和酸反应,生成盐和水
3、 NaOH溶液、Ca(OH)2溶液与非金属氧化物反应
4、 NaOH溶液、Ca(OH)2溶液与盐溶液反应
多识一点
与酸不同,氢氧化钠和氢氧化钙不能与生锈
铁钉以及铁反应。
工业上,常用铁桶来储运烧碱,就是利用了
碱与铁不反应的性质。
3NaOH+FeCl3==Fe(OH)3 +3NaCl
Na2CO3+Ca(OH)2==CaCO3 +2NaOH
2NaOH+CuCl2==Cu(OH)2 +2NaCl
3、复分解反应
(1)定义:如果两种化合物互相交换成分,
生成另外两种新的化合物,那么这样的反应
就叫做复分解反应。
练习:写出下列反应的化学方程式
氢氧化钠与二氧化碳
盐酸与石灰石
盐酸与硝酸银
氢氧化钠与硫酸
氯化钠与硫酸
(2)复分解反应的条件:
有气体放出,或有沉淀析出,或有水生成。
(3)溶解性口诀:
钾钠铵盐硝酸盐,
氯化物难溶氯化银,
溶碱只有钾钠钙和钡,
均能溶于水中间,
硫酸盐难溶硫酸钡,
碳酸盐只溶钾钠铵。
碱的通性
1、碱与酸碱指示剂反应
2、碱和酸反应,生成盐和水
3、碱与非金属氧化物反应,生成 和
4、碱与盐溶液反应,生成 和
盐 水
新碱
新盐
碱和盐反应条件
生成气体、沉淀或水
反应物都可溶
缺一不可
纯净物
混和物
单质
化合物
金属单质
非金属单质
稀有气体
酸
碱
盐
氧化物
金属氧化物
非金属氧化物
物质
颜色小节
1、黄色溶液:
2、蓝色溶液:
3、浅绿色溶液:
4、蓝色沉淀:
5、红褐色沉淀:
6、不溶于稀硝酸的白色沉淀:
FeCl3
Fe2(SO4)3
Fe(NO3)3
含Fe3+的溶液
CuSO4
CuCl2
Cu(NO3)2
含Cu2+的溶液
FeCl2
FeSO4
Fe(NO3)2
含Fe2+的溶液
Cu(OH)2
Fe(OH)3
AgCl
BaSO4
离子对
1、生成水:
H++OH-==H2O
2、生成气体:
H++CO32-==H2O+CO2
3、生成沉淀:
Cu2++OH-==Cu(OH)2
Fe3++OH-==Fe(OH)3
Ag++Cl-==AgCl
Ba2++SO42-==BaSO4
Ba2++CO32-==BaCO3
Ca2++CO32-==CaCO3
Mg2++OH-==Mg(OH)2
挥发性:挥发出的氯化氢气体与空气中的
水蒸气结合,形成盐酸小液滴
三、盐的性质
1、碳酸钠Na2CO3
颜色 状态 溶解
情况 其他
碳酸钠
白色
固体
水溶液显碱性
俗称纯碱
或苏打
(一)物理性质
练习:写出下列反应的化学方程式
碳酸钠和盐酸
碳酸钙和盐酸
碳酸钡和硫酸
CO32-的检验:
向待测物中加入稀盐酸,如果产生能使
澄清石灰水变浑浊的气体,则待测物中
含CO32-。
实质:
H++CO32- ===H2O+CO2
2、硫酸铜CuSO4
颜色 状态 溶解
情况 其他
硫酸铜
蓝色
×
白色
固体
水溶液
呈蓝色
CuSO4·5H2O
俗称胆矾或
蓝矾
CuSO4+5H2O===CuSO4·5H2O
CuSO4·5H2O
CuSO4
△
===
+5H2O
白色
蓝色
硫酸铜固体可用来检验水的存在
白色
蓝色
所需装置
练习:实验室欲制取并收集一瓶干燥的氧气,
H2O2
MnO2
浓硫酸
A
B
C
D
A D E B
E
CuSO4
3、硫酸铜用途
(1)检验水的存在
(2)农业上用熟石灰和硫酸铜溶液配制农药波尔多液
(二)化学性质
1、盐溶液与金属单质反应
Fe+CuSO4===
FeSO4+Cu
反应条件:
a.盐必须可溶
b.前金属进,后金属出(K、Ca、Na除外)
Cu+ AgNO3=== Ag+Cu(NO3)2
2
2
2、盐与酸的反应
(1)硝酸银与盐酸
(2)氯化钡与硫酸
(3)碳酸钠与盐酸
3、盐与碱反应
(1)工业制烧碱:
碳酸钠溶液与氢氧化钙溶液
(2)氢氧化钠溶液与硫酸铜溶液
(3)氢氧化钠溶液与氯化铁溶液
碱和盐反应条件:
(1)生成气体、沉淀或水
(2)反应物都可溶
4、盐与盐反应
(1)碳酸钠溶液和氯化钙溶液
(2)碳酸钠溶液和氯化钡溶液
(3)碳酸钠溶液和氯化银
盐和盐反应条件:
(1)生成气体、沉淀或水
(2)反应物都可溶
×
碱和盐、盐和盐反应条件:
生成气体、沉淀或水
反应物都可溶
同课章节目录
- 第一单元 溶液
- 1 溶液的形成
- 2 溶液组成的定量表示
- 3物质的溶解性
- 到实验室去:配制一定溶质质量分数的溶液
- 第二单元 常见的酸和碱
- 1 酸及其性质
- 2 碱及其性质
- 3 溶液的酸碱性
- 4 酸碱中和反应
- 到实验室去:探究酸和碱的化学性质
- 到图书馆去:分子变成离子
- 第三单元 海水中的化学
- 1 海洋化学资源
- 2 海水“晒盐”
- 3 海水“制碱”
- 到实验室去:粗盐中难溶性杂质的去除
- 第四单元 金属
- 1 常见的金属材料
- 2 金属的化学性质
- 3 钢铁的锈蚀与防护
- 到实验室去:探究金属的性质
- 第五单元 化学与健康
- 1 食物中的有机物
- 2 化学元素与人体健康
- 3 远离有毒物质
- 第六单元 化学与社会发展
- 1 化学与能源开发
- 2 化学与材料研制
- 3 化学与农业生产
- 4 化学与环境保护
