6.1.1 化学反应与热能 课件(24张ppt)【新教材】2020-2021学年人教版(2019)高一化学必修二
文档属性
| 名称 | 6.1.1 化学反应与热能 课件(24张ppt)【新教材】2020-2021学年人教版(2019)高一化学必修二 |

|
|
| 格式 | pptx | ||
| 文件大小 | 3.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-04-17 00:00:00 | ||
图片预览








文档简介
第六章 化学反应与能量
第一节 化学反应与能量
第1课时 化学反应与热能
化学反应与光能、热能、电能...
化学反应伴随着物质的变化和能量的变化。
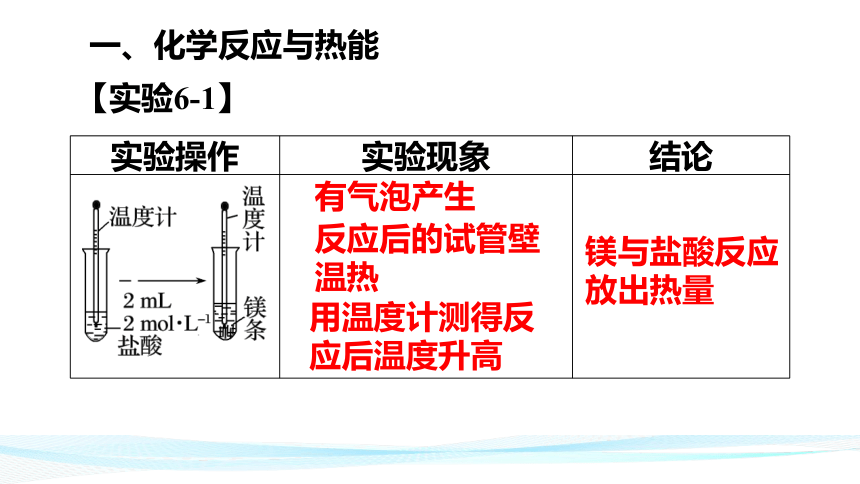
一、化学反应与热能
【实验6-1】
实验操作
实验现象
结论
反应后的试管壁温热
用温度计测得反应后温度升高
镁与盐酸反应放出热量
有气泡产生
【实验6-2】
实验操作
实验现象
实验结论
混合物呈糊状,有刺激性气味气体生成,烧杯壁冰凉,木片与烧杯粘在一起
该反应产生NH3,吸收热量
(2)闻到气味后迅速用玻璃片盖上烧杯
Ba(OH)2.8H2O+2NH4Cl=BaCl2+10H2O+2NH3↑
(一)放热反应与吸热反应
1.放热反应
(1)定义:释放热量的化学反应称为放热反应
(2)常见的放热反应
①所有燃烧反应
②酸碱中和反应
③大多数化合反应
④活泼金属跟水或酸的反应
⑤物质的缓慢氧化
2.吸热反应
(1)定义:
吸收热量的化学反应成为吸热反应
(2)常见的吸热反应
①大多数分解反应
②C+CO2(以C、H2为还原剂的氧化还原反应)
③Ba(OH)2·8H2O+NH4Cl(固态铵盐与碱的反应)
④NaHCO3与盐酸的反应
①吸热反应和放热反应属于化学反应,一些物理变化,也会有吸热和放热现象:浓H2SO4、NaOH(s)等溶于水要放热;干冰升华、冰融化、硝酸铵等铵盐溶于水会吸热。
②吸热反应、放热反应与反应是否需要加热等条件没有直接联系,需要持续加热才进行的反应为吸热反应,不需加热或加热停止后仍能进行的反应为放热反应。
【注意】
根据日常生活和回忆已学化学反应,对下列变化按吸热或放热的标准分类:
①钠投入水中 ②煅烧石灰石制生石灰 ③食物腐烂 ④炸药爆炸 ⑤氢气在氯气中燃烧 ⑥生石灰与水作用制熟石灰 ⑦碳与水蒸气制取水煤气(CO和H2) ⑧硫酸与氢氧化钠的中和反应 ⑨氦气球受热爆炸
(1)属于放热反应的有: (填序号,下同)。
(2)属于吸热反应的有: 。
①③④⑤⑥⑧
②⑦
练习
化学反应的特征?
化学反应的实质?
有新物质的生成
思考
旧键断裂,新键形成
吸收能量
释放能量
化学反应中能量变化的主要原因是什么?
化学键的断裂和形成
(二)化学反应中能量变化的原因
(二)化学反应中能量变化的原因
1.化学反应中能量变化的原因(微观)
E1>E2,反应 能量
E1<E2,反应 能量
吸收
放出
化学键的断裂与形成是化学反应中能量变化的主要原因
(吸热反应)
(放热反应)
在25℃和101kPa的条件下,断裂1molH-H需要吸收436kJ能量,断裂1molCl-Cl键需要吸收242kJ能量,形成1molH-Cl会放出431kJ能量。
H2 + Cl2 2HCl
点燃
通过计算说明上述反应是放热反应还是吸热反应?
1 mol H2与1 mol Cl2完全反应时,断开反应物中化学键所吸收能量之和:
形成生成物的化学键放出能量之和:
放出能量 > 吸收能量,该反应是放出能量。
436 kJ+243 kJ=679 kJ
2×431kJ=862kJ
H2的键能为436KJ/mol
键能越大物质越稳定
键能:气态基态原子形成1mol化学键所释放的能量。(或1mol化学键断裂成气态基态原子所吸收的能量)
注意
①化学反应的实质是旧键断裂和新键形成
②有化学键断裂的过程不一定是化学反应,如氯化钠溶于水的过程
③化学反应一定伴随能量变化,但有能量变化的过程不一定是化学反应,如物质的三态变化
水由高处向低处流要释放能量(势能转换为动能)
化学反应:
反应物的总能量
>生成物的总能量
化学反应放出能量
(二)化学反应中能量变化的原因
2.化学反应中能量变化的原因(宏观)
将水由低处抽向高处需提供能量(电能转换为机械能,再转换为势能)
化学反应:
反应物的总能量
<生成物的总能量
化学反应吸收能量
(二)化学反应中能量变化的原因
2.化学反应中能量变化的原因(宏观)
反应物的能量之和
E反
生成物的能量之和
E生
(1)若E反> E生,
(2)若E反< E生,
放出能量
吸收能量
放热反应
吸热反应
(二)化学反应中能量变化的原因
2.化学反应中能量变化的原因(宏观)
化学反应中能量变化取决于反应物和生成物的总能量相对大小
能量越低物质越稳定
已知反应A+B=C+D为放热反应,对该反应的下列说法中正确的是( )
A. A的能量一定高于C
B. B的能量一定高于D
C. A和B的总能量一定高于C和D的总能量
D. A和B的总能量一定低于C和D的总能量
C
练习
1.根据反应物和生成物的总能量大小判断
E反>E生 放热反应
2.根据化学键断裂和形成时能量大小关系判断
E吸>E放 吸热反应
3.根据常见反应类型判断
4.根据生成物和反应物的相对稳定性判断
稳定物生成不稳定物是吸热反应
5.根据反应条件(加热)判断
如何判断放热反应和吸热反应?
(三)人类对能源的利用及能源现状
1.人类对化学反应中热能的利用——燃烧
使用最多的常规能源:
2.化石燃料获取能量面临的问题
(1)储量有限,短期内不可再生。
(2)燃烧排放的粉尘、SO2、NOX、CO等造成了大气污染
化石燃料(煤、石油和天然气)
3.节能减排,寻找清洁的新能源
(1)节能:主要是充分有效地利用资源。提高燃料的燃烧效率;提高能源利用率
(2)理想新能源:应具有资源丰富、可以再生、对环境无污染的特点。如太阳能、风能、地热能、海洋能和氢能等。
(三)人类对能源的利用及能源现状
课堂小结
反应类型
放热反应
吸热反应
定义
释放热量的化学反应
吸收热量的化学反应
宏观原因
微观原因
图示
反应物具有的总能量大于生成物具有的总能量
反应物具有的总能量小于生成物具有的总能量
成键时释放的总能量大于断键时吸收的总能量
成键时释放的总能量小于断键时吸收的总能量
1.下列说法正确的是(双选)( )
A.需要加热才能发生的反应一定是吸热反应
B.任何放热反应在常温条件下一定能发生反应
C.反应物和生成物所具有的总能量决定了反应结果是放热还是吸热
D.吸热反应在一定条件下也能发生反应
CD
课堂练习
2.已知金刚石在一定条件下转化为石墨是放热的。据此,以下判断或说法不正确的是( )
A.石墨不如金刚石稳定
B.金刚石不如石墨稳定
C.金刚石和石墨互为同素异形体
D.这个反应属于化学变化
A
课堂练习
3.除了用手触摸和温度计测量外还可以借助其他方法感知温度的变化,如在探究过氧化钠与水反应为放热反应时,可采取如下两种方法:
(1)Ⅰ、Ⅱ装置能说明反应为放热反应的事实是:
;
。
(2)产生上述现象的原因是: 。
滴入水后,Ⅰ中U形管右侧液面下降,左侧液面上升
Ⅱ烧杯中导管口有气泡冒出
过氧化钠与水反应放热,锥形瓶内气体温度升高,气压增大
课堂练习
4.磷元素有多种性质不同的单质,红磷(结构复杂用“P”表示)和白磷(P4)是磷的两种同素异形体,充分燃烧之后的产物都是五氧化二磷。25 ℃,101 kPa下,31 g白磷完全转化为红磷,放出11 kJ的热量,根据以上事实回答下列问题:
(1)红磷转化为白磷属于 反应(填“放热”或“吸热”)。
(2)等质量的红磷和白磷分别完全燃烧,放出热量较多的是
(填“白磷”或“红磷”,下同)。
(3)31 g白磷与31 g红磷的能量较高的是 ,二者更稳定的是 。
吸热
白磷
白磷
红磷
课堂练习
第一节 化学反应与能量
第1课时 化学反应与热能
化学反应与光能、热能、电能...
化学反应伴随着物质的变化和能量的变化。
一、化学反应与热能
【实验6-1】
实验操作
实验现象
结论
反应后的试管壁温热
用温度计测得反应后温度升高
镁与盐酸反应放出热量
有气泡产生
【实验6-2】
实验操作
实验现象
实验结论
混合物呈糊状,有刺激性气味气体生成,烧杯壁冰凉,木片与烧杯粘在一起
该反应产生NH3,吸收热量
(2)闻到气味后迅速用玻璃片盖上烧杯
Ba(OH)2.8H2O+2NH4Cl=BaCl2+10H2O+2NH3↑
(一)放热反应与吸热反应
1.放热反应
(1)定义:释放热量的化学反应称为放热反应
(2)常见的放热反应
①所有燃烧反应
②酸碱中和反应
③大多数化合反应
④活泼金属跟水或酸的反应
⑤物质的缓慢氧化
2.吸热反应
(1)定义:
吸收热量的化学反应成为吸热反应
(2)常见的吸热反应
①大多数分解反应
②C+CO2(以C、H2为还原剂的氧化还原反应)
③Ba(OH)2·8H2O+NH4Cl(固态铵盐与碱的反应)
④NaHCO3与盐酸的反应
①吸热反应和放热反应属于化学反应,一些物理变化,也会有吸热和放热现象:浓H2SO4、NaOH(s)等溶于水要放热;干冰升华、冰融化、硝酸铵等铵盐溶于水会吸热。
②吸热反应、放热反应与反应是否需要加热等条件没有直接联系,需要持续加热才进行的反应为吸热反应,不需加热或加热停止后仍能进行的反应为放热反应。
【注意】
根据日常生活和回忆已学化学反应,对下列变化按吸热或放热的标准分类:
①钠投入水中 ②煅烧石灰石制生石灰 ③食物腐烂 ④炸药爆炸 ⑤氢气在氯气中燃烧 ⑥生石灰与水作用制熟石灰 ⑦碳与水蒸气制取水煤气(CO和H2) ⑧硫酸与氢氧化钠的中和反应 ⑨氦气球受热爆炸
(1)属于放热反应的有: (填序号,下同)。
(2)属于吸热反应的有: 。
①③④⑤⑥⑧
②⑦
练习
化学反应的特征?
化学反应的实质?
有新物质的生成
思考
旧键断裂,新键形成
吸收能量
释放能量
化学反应中能量变化的主要原因是什么?
化学键的断裂和形成
(二)化学反应中能量变化的原因
(二)化学反应中能量变化的原因
1.化学反应中能量变化的原因(微观)
E1>E2,反应 能量
E1<E2,反应 能量
吸收
放出
化学键的断裂与形成是化学反应中能量变化的主要原因
(吸热反应)
(放热反应)
在25℃和101kPa的条件下,断裂1molH-H需要吸收436kJ能量,断裂1molCl-Cl键需要吸收242kJ能量,形成1molH-Cl会放出431kJ能量。
H2 + Cl2 2HCl
点燃
通过计算说明上述反应是放热反应还是吸热反应?
1 mol H2与1 mol Cl2完全反应时,断开反应物中化学键所吸收能量之和:
形成生成物的化学键放出能量之和:
放出能量 > 吸收能量,该反应是放出能量。
436 kJ+243 kJ=679 kJ
2×431kJ=862kJ
H2的键能为436KJ/mol
键能越大物质越稳定
键能:气态基态原子形成1mol化学键所释放的能量。(或1mol化学键断裂成气态基态原子所吸收的能量)
注意
①化学反应的实质是旧键断裂和新键形成
②有化学键断裂的过程不一定是化学反应,如氯化钠溶于水的过程
③化学反应一定伴随能量变化,但有能量变化的过程不一定是化学反应,如物质的三态变化
水由高处向低处流要释放能量(势能转换为动能)
化学反应:
反应物的总能量
>生成物的总能量
化学反应放出能量
(二)化学反应中能量变化的原因
2.化学反应中能量变化的原因(宏观)
将水由低处抽向高处需提供能量(电能转换为机械能,再转换为势能)
化学反应:
反应物的总能量
<生成物的总能量
化学反应吸收能量
(二)化学反应中能量变化的原因
2.化学反应中能量变化的原因(宏观)
反应物的能量之和
E反
生成物的能量之和
E生
(1)若E反> E生,
(2)若E反< E生,
放出能量
吸收能量
放热反应
吸热反应
(二)化学反应中能量变化的原因
2.化学反应中能量变化的原因(宏观)
化学反应中能量变化取决于反应物和生成物的总能量相对大小
能量越低物质越稳定
已知反应A+B=C+D为放热反应,对该反应的下列说法中正确的是( )
A. A的能量一定高于C
B. B的能量一定高于D
C. A和B的总能量一定高于C和D的总能量
D. A和B的总能量一定低于C和D的总能量
C
练习
1.根据反应物和生成物的总能量大小判断
E反>E生 放热反应
2.根据化学键断裂和形成时能量大小关系判断
E吸>E放 吸热反应
3.根据常见反应类型判断
4.根据生成物和反应物的相对稳定性判断
稳定物生成不稳定物是吸热反应
5.根据反应条件(加热)判断
如何判断放热反应和吸热反应?
(三)人类对能源的利用及能源现状
1.人类对化学反应中热能的利用——燃烧
使用最多的常规能源:
2.化石燃料获取能量面临的问题
(1)储量有限,短期内不可再生。
(2)燃烧排放的粉尘、SO2、NOX、CO等造成了大气污染
化石燃料(煤、石油和天然气)
3.节能减排,寻找清洁的新能源
(1)节能:主要是充分有效地利用资源。提高燃料的燃烧效率;提高能源利用率
(2)理想新能源:应具有资源丰富、可以再生、对环境无污染的特点。如太阳能、风能、地热能、海洋能和氢能等。
(三)人类对能源的利用及能源现状
课堂小结
反应类型
放热反应
吸热反应
定义
释放热量的化学反应
吸收热量的化学反应
宏观原因
微观原因
图示
反应物具有的总能量大于生成物具有的总能量
反应物具有的总能量小于生成物具有的总能量
成键时释放的总能量大于断键时吸收的总能量
成键时释放的总能量小于断键时吸收的总能量
1.下列说法正确的是(双选)( )
A.需要加热才能发生的反应一定是吸热反应
B.任何放热反应在常温条件下一定能发生反应
C.反应物和生成物所具有的总能量决定了反应结果是放热还是吸热
D.吸热反应在一定条件下也能发生反应
CD
课堂练习
2.已知金刚石在一定条件下转化为石墨是放热的。据此,以下判断或说法不正确的是( )
A.石墨不如金刚石稳定
B.金刚石不如石墨稳定
C.金刚石和石墨互为同素异形体
D.这个反应属于化学变化
A
课堂练习
3.除了用手触摸和温度计测量外还可以借助其他方法感知温度的变化,如在探究过氧化钠与水反应为放热反应时,可采取如下两种方法:
(1)Ⅰ、Ⅱ装置能说明反应为放热反应的事实是:
;
。
(2)产生上述现象的原因是: 。
滴入水后,Ⅰ中U形管右侧液面下降,左侧液面上升
Ⅱ烧杯中导管口有气泡冒出
过氧化钠与水反应放热,锥形瓶内气体温度升高,气压增大
课堂练习
4.磷元素有多种性质不同的单质,红磷(结构复杂用“P”表示)和白磷(P4)是磷的两种同素异形体,充分燃烧之后的产物都是五氧化二磷。25 ℃,101 kPa下,31 g白磷完全转化为红磷,放出11 kJ的热量,根据以上事实回答下列问题:
(1)红磷转化为白磷属于 反应(填“放热”或“吸热”)。
(2)等质量的红磷和白磷分别完全燃烧,放出热量较多的是
(填“白磷”或“红磷”,下同)。
(3)31 g白磷与31 g红磷的能量较高的是 ,二者更稳定的是 。
吸热
白磷
白磷
红磷
课堂练习
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
