鲁教版九年级下册化学 8.3海水“制碱” 课件第二课时纯碱的性质(35张PPT)
文档属性
| 名称 | 鲁教版九年级下册化学 8.3海水“制碱” 课件第二课时纯碱的性质(35张PPT) |

|
|
| 格式 | ppt | ||
| 文件大小 | 848.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-04-17 00:00:00 | ||
图片预览











文档简介
6、下列各组物质的名称、俗名、化学式表示同一物质的是( )
A 氢氧化钠、纯碱、NaOH
B 氢氧化钙、生石灰Ca(OH)2
C 氯化钠、食盐、NaCl
D 碳酸氢钠、小苏打、Na2CO3
纯碱的性质
(1)水溶液显碱性
(2)能与大多数酸反应
(3)能与氢氧化钙反应
(4)能与氯化钡反应
碳酸根离子的检验:
药品:稀盐酸 澄清石灰水
方法:取样品少许放入试管中,加
入稀盐酸,有气泡产生,将
生成的气体通入澄清石灰水
中,石灰水变浑浊
盐的化学性质
(1)盐+酸 → 新盐+新酸
(2)盐+碱 → 新碱+新盐
(3)盐+盐 → 新盐+新盐
你有哪些收获?
酸碱盐溶解性记忆
复分解反应发生的条件
生成物中
第二课时
纯碱的性质
氨碱法制纯碱所得到的最终产物是
_________________
石灰石
1.食盐不仅是必不可少的生活用品,也是重要的化工原料。碳酸钠就是以食盐、___为原料,以______为媒介,采用氨碱法制的。
2.试用化学方程式表示海水制碱的原理
石灰石
氨
纯碱和氯化铵
3.被称为我国制碱工业先驱的科学家是( )
A 张青莲 B 钱学森 C 侯德榜 D 道尔顿
4.试用 ①NaHCO3 ②Na2CO3 ③NaCl 填写下列空白
(1)用作调味品的是_ __
(2)是发酵粉的主要成分,医疗上可用于胃酸过多的是______
(3)用于生产玻璃的是_ __
(4)用作洗涤剂的是_ __
(5)俗名是苏打的是___,俗名是小苏打的是__
③
①
②
②
②
①
C
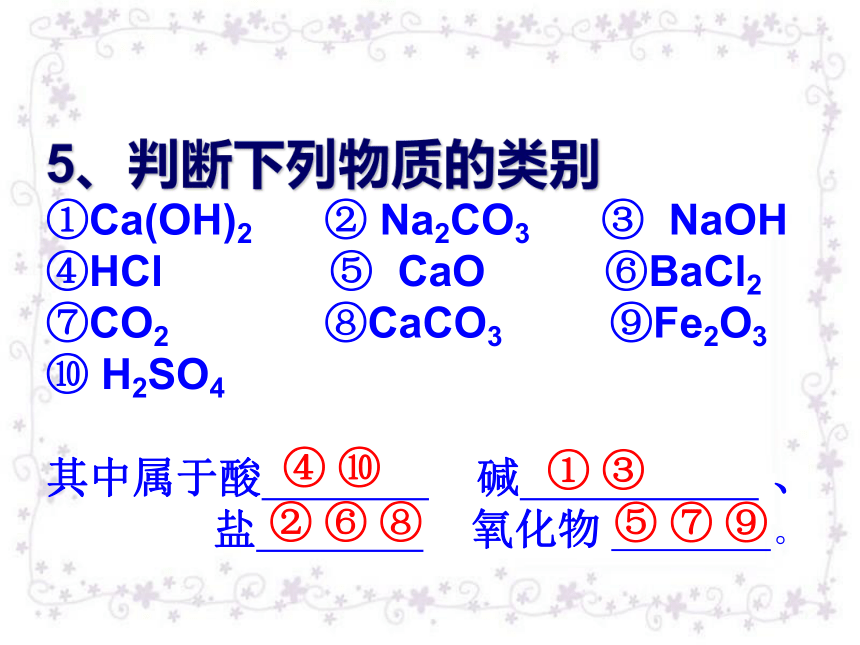
5、判断下列物质的类别
①Ca(OH)2 ② Na2CO3 ③ NaOH?
④HCl ⑤ CaO ⑥BaCl2 ⑦CO2 ⑧CaCO3 ⑨Fe2O3
⑩ H2SO4
其中属于酸 碱 、
盐 氧化物 。
④ ⑩
① ③
② ⑥ ⑧
⑤ ⑦ ⑨
C
纯碱的物理性质:
颜色
状态
溶解性
白色
固态
易溶于水
实验报告
BaCl2 + Na2CO3
有_ 产生
4、与氯化钡反应
Ca(OH)2+Na2CO3
有_ 产生
3、与氢氧化钙反应
Na2C03+ HCl
2、与酸反应
1、与指示剂作用
结论或化学方程式
实验现象
酚酞试液变红
碳酸钠溶液显碱性
有气泡产生,燃着火柴熄灭
=2NaCl+ CO2↑+H2O
2
实验报告
BaCl2 + Na2CO3
有_ 产生
4、与氯化钡反应
Ca(OH)2+Na2CO3
有_ 产生
3、与氢氧化钙反应
Na2C03+ HCl
2、与酸反应
1、与指示剂作用
结论或化学方程式
实验现象
酚酞试液变红
碳酸钠溶液显碱性
有气泡产生,燃着火柴熄灭
=2NaCl+ CO2↑+H2O
2
白色沉淀
白色沉淀
=CaCO3↓+ 2NaOH
=BaCO3↓+ 2NaCl
两种可溶
必有一种不溶(沉淀)
两种可溶
必有一种不溶(沉淀)
1.下列物质中不属于碱的是( )。
A.火碱 B.纯碱 C.消石灰 D.氨水
2.腌制松花蛋常用熟石灰和纯碱等原料。因此,食用它时常有涩
味,可以在食用前加调味品,这种调味品最好是( )
A.食醋 B.酱油 C.味精 D.食盐
3、食盐、食醋、纯碱等均为家庭厨房中常用的物质.利用这些物
质你不能完成的实验是( )
A. 鉴别食盐和纯碱 B.检验自来水中是否含有氯离子
C. 检验鸡蛋壳能否溶于酸 D.除去热水瓶中的水垢
4、用一种试剂鉴别盐酸、氯化钠和氢氧化钙三种溶液,应选用的
试剂是( )。
A.稀硫酸 B.碳酸钠溶液 C.氯化钡溶液 D.氢氧化钾溶液
B
A
B
B
已知家庭常用的发酵粉主要成分为小苏打(NaHCO3)受热易分解为Na2CO3和两种氧化物A、B,且其中一种为植物光合作用所需要的气体,一种为生活中常见的无色液体。请根据下列图示关系回答下列问题:
(1)请你从上述图示中推断出A、D、F各是什么物质(写化学式)
A_________ D_________ F____________
NaHCO3
加热
Na2CO3
气体A
无色液体B
溶液C
Na2CO3
溶液D
固体E
熟石灰
气体A
白色固体F
②
气体A、B和NaCl
③
(2)反应②③的化学方程式为:
② ________________ 反应的基本类型为_____
③_________________ 反应的基本类型为_____
复分解反应发生的条件
A
+
C
=
B
A
B
D
C
D
+
酸、碱、盐、氧化物
由两种化合物互相交换成分生成另外两种化合物的反应叫做复分解反应。
︸
复分解反应包括:
酸+碱——盐+水
酸+盐——新酸+新盐
碱+盐——新碱+新盐
盐+盐——新盐+新盐
酸+金属氧化物——盐+水
那么酸碱盐之间一定能发生复分解反应吗?
类型一:酸+碱——盐+水
H
Cl
Na
O
H
+
H
Cl
Na
O
H
=
+
H2O
H2SO4
+
Cu(OH)2
=
H
SO4
Cu
OH
H
OH
+
2H2O
酸和碱反应的其他例子
① HNO3+ Fe(OH)3
② HCl +Ca(OH)2
=Fe(NO3)3+ H2O
3
3
= CaCl2 + H2O
2
2
条件:
(1)酸和碱至少有一种可溶;
(2)有水生成
注:初中都能进行。所有酸都可溶。
类型二:酸+盐——新酸+新盐
HCl + AgNO3
H
Cl
NO3
Ag
=
↓
+
类型二:酸+盐——新酸+新盐
① HNO3+CaCO3
② H2SO4+BaCl2
③ BaSO4+HNO3
=Ca(NO3)2+H2O+CO2↑
2
条件:
(1)除了BaSO4和AgCl外,其他盐都能参加反应;
(2)生成物中有沉淀、气体或水生成。
×
=BaSO4↓+ 2 HCl
类型三:碱+盐——新碱+新盐
① NaOH+CaCO3
② Ca(OH)2+Na2CO3
③ Al(OH)3+NaCl
④ KOH+Na2SO4
=CaCO3 + NaOH
2
↓
碱+盐——新碱+新盐
条件(初中阶段):
(1)反应物中的碱和盐都须能溶
于水;
(2)生成物中至少有一种是沉淀。
特例:
Ca(OH)2+2NH4Cl=CaCl2+2NH3↑+2H2O
类型四:盐+盐——新盐+新盐
① KNO3+CaCO3
② BaCl2+K2CO3
③ NaCl+AgNO3
④ NaNO3+K2CO3
=BaCO3 + KCl
=AgCl + KNO3
2
↓
↓
盐+盐——新盐+新盐
条件:
(1)参加反应的两种盐都必须可溶;
(2)新生成的两种盐中至少有一种是
沉淀。
类型五:酸+金属氧化物=盐+水
Fe2O3+6HCl=2FeCl3+3H2O
CuO+H2SO4=CuSO4+H2O
CaO+2HNO3 =Ca(NO3)2+2H2O
CaO+H2O=Ca(OH)2
钾钠铵盐硝酸盐,
水中全部溶解完;
盐酸盐除氯化银,
硫酸盐除硫酸钡;
碳酸盐溶钾钠铵,
碱溶钾钠钡钙铵。
Ca2+、OH-
H+、SO4 2 -
Ca2+、SO42-
反应前
反应后
溶液中离子种类发生改变
Ca(OH)2+ H2SO4——
CaSO4+2H2O
——
√
溶液中反应的离子变化
H+、SO42-
Na+、CO3 2 -
Na+、SO42-
反应前
反应后
溶液中离子种类发生改变
H2SO4+Na2CO3——
Na2SO4+ + H2O
——
CO2↑
√
溶液中反应的离子变化
Ca2+、OH-
Na+、CO3 2 -
Na+、OH-
反应前
反应后
溶液中离子种类发生改变
Ca(OH)2+ Na2CO3——
2NaOH+
——
CaCO3↓
√
溶液中反应的离子变化
K2SO4 + NaNO3
×
Na+、SO42-
K+、NO3-
K+、SO42-
反应前
反应后
溶液中离子种类没有改变
Na2SO4 + KNO3 ——
Na+、NO3-
溶液中反应的离子变化
或有气体(↑)
或有水(H2O)
有沉淀(↓)
复分解反应才能发生
实质:溶液中离子种类发生改变
离子种类发生了改变,数目也发生了变化,就说这样的离子不能共存
练习:完成下列能发生反应的方程式
1.BaCl2+H2SO4=
2.Na2CO3+ HCl=
3.K2SO4+HCl=
4.FeCl3+ NaOH=
5.KCl+AgNO3=
6.K2SO4+NaNO3=
7.Fe(OH)3+ HNO3=
8.Ba(OH)2+ HCl=
BaSO4↓+2HCl
2 2NaCl+H2O+CO2↑
3 Fe(OH)3↓+3NaCl
AgCl↓+KNO3
3 Fe(NO3)3+3H2O
2 BaCl2+2H2O
下列各组离子在溶液中一定能大量共存的是( )
A.H+、C1—、OH—
B.H+、SO42— 、HCO3—;
C.Ba2+、H+、SO42—
D.Cu2+、C1—、N03—
练习:
D
谢谢大家
A 氢氧化钠、纯碱、NaOH
B 氢氧化钙、生石灰Ca(OH)2
C 氯化钠、食盐、NaCl
D 碳酸氢钠、小苏打、Na2CO3
纯碱的性质
(1)水溶液显碱性
(2)能与大多数酸反应
(3)能与氢氧化钙反应
(4)能与氯化钡反应
碳酸根离子的检验:
药品:稀盐酸 澄清石灰水
方法:取样品少许放入试管中,加
入稀盐酸,有气泡产生,将
生成的气体通入澄清石灰水
中,石灰水变浑浊
盐的化学性质
(1)盐+酸 → 新盐+新酸
(2)盐+碱 → 新碱+新盐
(3)盐+盐 → 新盐+新盐
你有哪些收获?
酸碱盐溶解性记忆
复分解反应发生的条件
生成物中
第二课时
纯碱的性质
氨碱法制纯碱所得到的最终产物是
_________________
石灰石
1.食盐不仅是必不可少的生活用品,也是重要的化工原料。碳酸钠就是以食盐、___为原料,以______为媒介,采用氨碱法制的。
2.试用化学方程式表示海水制碱的原理
石灰石
氨
纯碱和氯化铵
3.被称为我国制碱工业先驱的科学家是( )
A 张青莲 B 钱学森 C 侯德榜 D 道尔顿
4.试用 ①NaHCO3 ②Na2CO3 ③NaCl 填写下列空白
(1)用作调味品的是_ __
(2)是发酵粉的主要成分,医疗上可用于胃酸过多的是______
(3)用于生产玻璃的是_ __
(4)用作洗涤剂的是_ __
(5)俗名是苏打的是___,俗名是小苏打的是__
③
①
②
②
②
①
C
5、判断下列物质的类别
①Ca(OH)2 ② Na2CO3 ③ NaOH?
④HCl ⑤ CaO ⑥BaCl2 ⑦CO2 ⑧CaCO3 ⑨Fe2O3
⑩ H2SO4
其中属于酸 碱 、
盐 氧化物 。
④ ⑩
① ③
② ⑥ ⑧
⑤ ⑦ ⑨
C
纯碱的物理性质:
颜色
状态
溶解性
白色
固态
易溶于水
实验报告
BaCl2 + Na2CO3
有_ 产生
4、与氯化钡反应
Ca(OH)2+Na2CO3
有_ 产生
3、与氢氧化钙反应
Na2C03+ HCl
2、与酸反应
1、与指示剂作用
结论或化学方程式
实验现象
酚酞试液变红
碳酸钠溶液显碱性
有气泡产生,燃着火柴熄灭
=2NaCl+ CO2↑+H2O
2
实验报告
BaCl2 + Na2CO3
有_ 产生
4、与氯化钡反应
Ca(OH)2+Na2CO3
有_ 产生
3、与氢氧化钙反应
Na2C03+ HCl
2、与酸反应
1、与指示剂作用
结论或化学方程式
实验现象
酚酞试液变红
碳酸钠溶液显碱性
有气泡产生,燃着火柴熄灭
=2NaCl+ CO2↑+H2O
2
白色沉淀
白色沉淀
=CaCO3↓+ 2NaOH
=BaCO3↓+ 2NaCl
两种可溶
必有一种不溶(沉淀)
两种可溶
必有一种不溶(沉淀)
1.下列物质中不属于碱的是( )。
A.火碱 B.纯碱 C.消石灰 D.氨水
2.腌制松花蛋常用熟石灰和纯碱等原料。因此,食用它时常有涩
味,可以在食用前加调味品,这种调味品最好是( )
A.食醋 B.酱油 C.味精 D.食盐
3、食盐、食醋、纯碱等均为家庭厨房中常用的物质.利用这些物
质你不能完成的实验是( )
A. 鉴别食盐和纯碱 B.检验自来水中是否含有氯离子
C. 检验鸡蛋壳能否溶于酸 D.除去热水瓶中的水垢
4、用一种试剂鉴别盐酸、氯化钠和氢氧化钙三种溶液,应选用的
试剂是( )。
A.稀硫酸 B.碳酸钠溶液 C.氯化钡溶液 D.氢氧化钾溶液
B
A
B
B
已知家庭常用的发酵粉主要成分为小苏打(NaHCO3)受热易分解为Na2CO3和两种氧化物A、B,且其中一种为植物光合作用所需要的气体,一种为生活中常见的无色液体。请根据下列图示关系回答下列问题:
(1)请你从上述图示中推断出A、D、F各是什么物质(写化学式)
A_________ D_________ F____________
NaHCO3
加热
Na2CO3
气体A
无色液体B
溶液C
Na2CO3
溶液D
固体E
熟石灰
气体A
白色固体F
②
气体A、B和NaCl
③
(2)反应②③的化学方程式为:
② ________________ 反应的基本类型为_____
③_________________ 反应的基本类型为_____
复分解反应发生的条件
A
+
C
=
B
A
B
D
C
D
+
酸、碱、盐、氧化物
由两种化合物互相交换成分生成另外两种化合物的反应叫做复分解反应。
︸
复分解反应包括:
酸+碱——盐+水
酸+盐——新酸+新盐
碱+盐——新碱+新盐
盐+盐——新盐+新盐
酸+金属氧化物——盐+水
那么酸碱盐之间一定能发生复分解反应吗?
类型一:酸+碱——盐+水
H
Cl
Na
O
H
+
H
Cl
Na
O
H
=
+
H2O
H2SO4
+
Cu(OH)2
=
H
SO4
Cu
OH
H
OH
+
2H2O
酸和碱反应的其他例子
① HNO3+ Fe(OH)3
② HCl +Ca(OH)2
=Fe(NO3)3+ H2O
3
3
= CaCl2 + H2O
2
2
条件:
(1)酸和碱至少有一种可溶;
(2)有水生成
注:初中都能进行。所有酸都可溶。
类型二:酸+盐——新酸+新盐
HCl + AgNO3
H
Cl
NO3
Ag
=
↓
+
类型二:酸+盐——新酸+新盐
① HNO3+CaCO3
② H2SO4+BaCl2
③ BaSO4+HNO3
=Ca(NO3)2+H2O+CO2↑
2
条件:
(1)除了BaSO4和AgCl外,其他盐都能参加反应;
(2)生成物中有沉淀、气体或水生成。
×
=BaSO4↓+ 2 HCl
类型三:碱+盐——新碱+新盐
① NaOH+CaCO3
② Ca(OH)2+Na2CO3
③ Al(OH)3+NaCl
④ KOH+Na2SO4
=CaCO3 + NaOH
2
↓
碱+盐——新碱+新盐
条件(初中阶段):
(1)反应物中的碱和盐都须能溶
于水;
(2)生成物中至少有一种是沉淀。
特例:
Ca(OH)2+2NH4Cl=CaCl2+2NH3↑+2H2O
类型四:盐+盐——新盐+新盐
① KNO3+CaCO3
② BaCl2+K2CO3
③ NaCl+AgNO3
④ NaNO3+K2CO3
=BaCO3 + KCl
=AgCl + KNO3
2
↓
↓
盐+盐——新盐+新盐
条件:
(1)参加反应的两种盐都必须可溶;
(2)新生成的两种盐中至少有一种是
沉淀。
类型五:酸+金属氧化物=盐+水
Fe2O3+6HCl=2FeCl3+3H2O
CuO+H2SO4=CuSO4+H2O
CaO+2HNO3 =Ca(NO3)2+2H2O
CaO+H2O=Ca(OH)2
钾钠铵盐硝酸盐,
水中全部溶解完;
盐酸盐除氯化银,
硫酸盐除硫酸钡;
碳酸盐溶钾钠铵,
碱溶钾钠钡钙铵。
Ca2+、OH-
H+、SO4 2 -
Ca2+、SO42-
反应前
反应后
溶液中离子种类发生改变
Ca(OH)2+ H2SO4——
CaSO4+2H2O
——
√
溶液中反应的离子变化
H+、SO42-
Na+、CO3 2 -
Na+、SO42-
反应前
反应后
溶液中离子种类发生改变
H2SO4+Na2CO3——
Na2SO4+ + H2O
——
CO2↑
√
溶液中反应的离子变化
Ca2+、OH-
Na+、CO3 2 -
Na+、OH-
反应前
反应后
溶液中离子种类发生改变
Ca(OH)2+ Na2CO3——
2NaOH+
——
CaCO3↓
√
溶液中反应的离子变化
K2SO4 + NaNO3
×
Na+、SO42-
K+、NO3-
K+、SO42-
反应前
反应后
溶液中离子种类没有改变
Na2SO4 + KNO3 ——
Na+、NO3-
溶液中反应的离子变化
或有气体(↑)
或有水(H2O)
有沉淀(↓)
复分解反应才能发生
实质:溶液中离子种类发生改变
离子种类发生了改变,数目也发生了变化,就说这样的离子不能共存
练习:完成下列能发生反应的方程式
1.BaCl2+H2SO4=
2.Na2CO3+ HCl=
3.K2SO4+HCl=
4.FeCl3+ NaOH=
5.KCl+AgNO3=
6.K2SO4+NaNO3=
7.Fe(OH)3+ HNO3=
8.Ba(OH)2+ HCl=
BaSO4↓+2HCl
2 2NaCl+H2O+CO2↑
3 Fe(OH)3↓+3NaCl
AgCl↓+KNO3
3 Fe(NO3)3+3H2O
2 BaCl2+2H2O
下列各组离子在溶液中一定能大量共存的是( )
A.H+、C1—、OH—
B.H+、SO42— 、HCO3—;
C.Ba2+、H+、SO42—
D.Cu2+、C1—、N03—
练习:
D
谢谢大家
同课章节目录
- 第七单元 常见的酸和碱
- 第一节 酸及其性质
- 第二节 碱及其性质
- 第三节 溶液的酸碱性
- 第四节 酸碱中和反应
- 到实验室去:探究酸和碱的化学性质
- 第八单元 海水中的化学
- 第一节 海洋化学资源
- 第二节 海水“晒盐“
- 第三节 海水“制碱“
- 到实验室去:粗盐中难溶性杂质的去除
- 第九单元 金属
- 第一节 常见的金属材料
- 第二节 金属的化学性质
- 第三节 钢铁的锈蚀与防护
- 到实验室去 探究金属的性质
- 第十单元 化学与健康
- 第一节 食物中的有机物
- 第二节 化学元素与人体健康
- 第三节 远离有毒物质
- 第十一单元 化学与社会发展
- 第一节 化学与能源开发
- 第二节 化学与材料研制
- 第三节 化学与农业生产
- 第四节 化学与环境保护
