2020-2021学年高一化学下学期苏教版(2019)必修第二册专题9金属与人类文明第三单元金属材料的性能及应用课时训练
文档属性
| 名称 | 2020-2021学年高一化学下学期苏教版(2019)必修第二册专题9金属与人类文明第三单元金属材料的性能及应用课时训练 |

|
|
| 格式 | docx | ||
| 文件大小 | 276.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-04-19 00:00:00 | ||
图片预览




文档简介
2020-2021学年高一化学第二学期苏教版(2019)必修第二册专题9金属与人类文明第三单元金属材料的性能及应用课时训练
一、选择题
1.2020年5月5日我国成功发射了长征五号B运载火箭。科学家通过远程操控在火箭运送的新一代载人飞船中完成了我国首次太空3D打印实验。下列叙述错误的是
A.火箭助推剂中的煤油属于混合物
B.硅单质可以用于制作飞船上的太阳能电池板
C.太空3D打印实验的原材料碳纤维属于有机高分子材料
D.火箭采用的高强度新型钛合金构件,属于金属材料
2.镁铝合金可用于制作窗框、卷帘门、防护拦等。下列性质与这些用途无关的是
A.不易生锈
B.强度高
C.密度小
D.导电性好
3.现代社会的发展与进步离不开材料,下列有关材料的说法错误的是
A.制作N95型口罩的“熔喷布”,其主要组成为聚丙烯,聚丙烯是有机高分子化合物
B.华为5G手机芯片的主要成分是二氧化硅
C.中国天眼FAST用到的高性能碳化硅是一种新型的无机非金属材料
D.“蛟龙号”深潜器的外壳是特种钛合金,该钛合金比金属钛硬度高、耐高压、耐腐蚀
4.新材料的发展充分体现了“中国技术”“中国制造”和“中国力量”。下列说法错误的是
A.蛟龙号潜水器用到了钛合金,22号钛元素属于过渡元素
B.港珠澳大桥用到的合金材料,具有强度大、密度小、耐腐蚀等性能
C.国产大飞机C919使用的“现代工业骨骼”碳纤维是一种新型有机高分子材料
D.“华为麒麟980”手机中芯片的主要成分是硅单质
5.胡粉[主要成分是]具有败毒抗癌、杀虫疗疮的功效,东汉炼丹理论家魏伯阳说著的《周易参同契》中记载:“胡粉投火中,色坏还为铅”,下列说法错误的是
A.胡粉不溶于水
B.胡粉可与盐酸或硝酸反应
C.“火”中含有炭、
D.“还为铅”中的铅是指
6.下列说法中,正确的是
A.碱金属单质的化学性质活泼,易从盐溶液中置换其它金属。
B.碱金属单质在空气中燃烧生成的都是过氧化物。
C.随核电荷数增加,碱金属单质溶、沸点降低。
D.碱金属的原子半径越大,越易失电子,其还原性越弱。
7.2020
年11月10日8时12分,中国“奋斗者”号载人潜水器在马里亚纳海沟成功坐底。“奋斗者”号研制及海试的成功,标志着我国具有了进入世界海洋最深处开展科学探索的能力,体现了我国在海洋高技术领域的综合实力。其中,“奋斗者”号使用了钛合金材料。有关合金的说法中错误的的是
A.钛合金是一种新型金属单质
B.在合金中加入稀土金属,能大大改善合金的性能,使合金具有更优良的性能
C.钛合金熔点比成分金属低,但硬度大
D.钛合金的化学性质具有其各成分金属的化学性质
8.下列有关对金属和金属材料的认识不正确的是
A.铁有良好的导热性,常用来制作炊具
B.铝表面易形成致密的氧化膜,可阻止铝进一步被氧化
C.废旧电池的回收,可减少对环境的污染
D.合金的硬度一般小于成分金属的硬度
9.下列有关金属的说法中,正确的是
A.生铁是合金,钢是纯金属
B.活泼的金属往往采用电解法冶炼
C.纯金属与其合金相比,一般具有更低的熔点
D.铝的化学性质不活泼,因此铝合金在生产、生活中应用非常广泛
10.下列说法不正确的是
A.铝合金密度小、强度高,是制造飞机和宇宙飞船的理想材料
B.过氧化钠可在呼吸面具或潜水艇中作为氧气的来源
C.四氧化三铁俗称铁红,常用作油漆、涂料、油墨和橡胶的颜料
D.在合金中加入适量稀土金属,能大大改善合金的性能
11.下列金属材料中,最适合用于制造飞机部件的是
A.镁铝合金
B.铜合金
C.不锈钢
D.铅锡合金
12.下列生活物品中所涉及的合金材料属于新型合金的是
A.生铁
B.不锈钢
C.储氢合金
D.硬铝
A.A
B.B
C.C
D.D
13.2020年12月17日凌晨,嫦娥五号返回器携带月壤着陆地球,关于嫦娥五号说法不正确的是
A.嫦娥五号主体框架为钛合金和神墙铝合金材料,质量轻,强度高
B.嫦娥五号光学望远镜的某些部件由碳化硅特种陶瓷材料制成,硬度大,耐高温
C.月壤中含有,原子核内含有3个中子,可以作为核聚变的理想核燃料
D.国家天文台已建成国内首个“月球样品实验室”,以避免月壤受到地球大气、水等环境污染
14.下列关于无机非金属材料的说法中,不正确的是
A.高纯硅可用于制造半导体材料
B.氧化铝陶瓷属于新型无机非金属材料,它是生物陶瓷
C.氮化硅陶瓷属于新型无机非金属材料,可用于制造陶瓷发动机的受热面
D.二氧化硅制成的光导纤维,由于导电能力强而被用于制造光缆
15.新材料的发展充分体现了“中国技术”、“中国制造”和“中国力量”。下列说法正确的是
A.华为首款5G手机搭载了智能7nm制程SoC“麒麟980”手机芯片的主要成分是二氧化硅
B.制造“后母戊鼎”的青铜和举世轰动的“超级钢”均属于合金
C.国产飞机C919用到氮化硅陶瓷是传统无机非金属材料
D.碳纳米管属于胶体分散系,该材料具有较强的吸附能力
二、实验题
16.水合草酸亚铁(FeC2O4·xH2O)是生产锂电池的原料,难溶于水,受热易分解。某化学兴趣小组对草酸亚铁的一些性质进行探究。回答下列问题:
(1)实验室用硫酸亚铁溶液和草酸制备水合草酸亚铁,反应的化学方程式是_________。
(2)将水合草酸亚铁溶于适量盐酸。分别取2
mL此溶液于3支试管中,进行实验:
①第一支试管中加入几滴KSCN溶液,溶液不变红;
②第二支试管中加入几滴K3[Fe(CN)6]溶液,生成蓝色沉淀;
③第三支试管中加入几滴酸性KMnO4溶液,溶液紫红色褪去。
上述实验能证明水合草酸亚铁中存在Fe2+的是_________(填编号)。
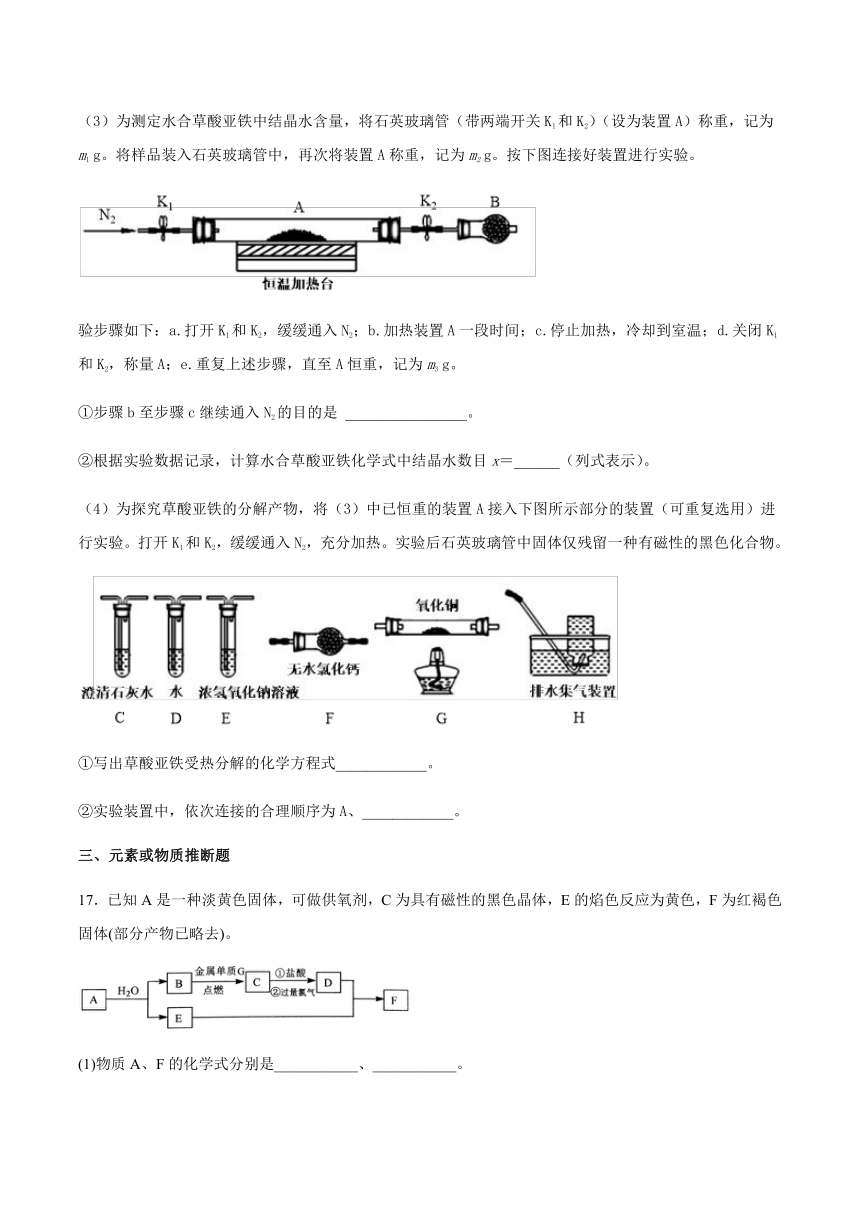
(3)为测定水合草酸亚铁中结晶水含量,将石英玻璃管(带两端开关K1和K2)(设为装置A)称重,记为m1
g。将样品装入石英玻璃管中,再次将装置A称重,记为m2
g。按下图连接好装置进行实验。
验步骤如下:a.打开K1和K2,缓缓通入N2;b.加热装置A一段时间;c.停止加热,冷却到室温;d.关闭K1和K2,称量A;e.重复上述步骤,直至A恒重,记为m3
g。
①步骤b至步骤c继续通入N2的目的是
________________。
②根据实验数据记录,计算水合草酸亚铁化学式中结晶水数目x=______(列式表示)。
(4)为探究草酸亚铁的分解产物,将(3)中已恒重的装置A接入下图所示部分的装置(可重复选用)进行实验。打开K1和K2,缓缓通入N2,充分加热。实验后石英玻璃管中固体仅残留一种有磁性的黑色化合物。
①写出草酸亚铁受热分解的化学方程式____________。
②实验装置中,依次连接的合理顺序为A、____________。
三、元素或物质推断题
17.已知A是一种淡黄色固体,可做供氧剂,C为具有磁性的黑色晶体,E的焰色反应为黄色,F为红褐色固体(部分产物已略去)。
(1)物质A、F的化学式分别是___________、___________。
(2)A→B+E的反应的化学方程式是___________。
(3)如何检验D中的金属阳离子,说明具体的操作和实验现象___________。
(4)E溶液与地壳中含量最多的金属元素的单质发生反应的离子方程式为___________。
(5)G与D溶液也能发生反应,其反应的类型为___________(填序号)。
a.化合反应
b.置换反应
c.复分解反应
d.氧化还原反应
四、工业流程题
18.铁是人类较早使用的金属之一,铁及其化合物在现代社会各个领域仍有广泛的应用。
I.氧化物—Fe2O3:用工业FeCl3粗品(含Ca、Mn、Cu等杂质离子)制取高纯铁红,实验室常用萃取剂X(甲基异丁基甲酮)萃取法制取高纯铁红的主要实验步骤如下:
已知:HCl(浓)+
FeCl3HFeCl4。试回答下列问题:
(1)用萃取剂X萃取,该步骤中:
①
Ca2+、Mn2+、Cu2+等杂质离子主要在__________(填“水”或“有机”)相。
②
若实验时共用萃取剂X
150mL,萃取率最高的方法是__________(填字母)。
a.一次性萃取,150mL
b.分2次萃取,每次75mL
c.分3次萃取,每次50mL
(2)用高纯水反萃取,萃取后水相中铁的存在形式是________________(写化学式);反萃取能发生的原因是___________________。
(3)所得草酸铁沉淀需用冰水洗涤,其目的一是洗去沉淀表面吸附的杂质离子,二是________________。
(4)测定产品中铁的含量需经酸溶、还原为Fe2+,然后在酸性条件下用标准K2Cr2O7溶液滴定,已知铬的还原产物为Cr3+,写出该滴定反应的离子方程式
___________________。
II.含氧酸盐—铁酸铜(CuFe2O4)是很有前景的热化学分解水制氢的材料,CuFe2O4在制氢过程中可以循环使用。在热化学循环分解水制氢的过程中,铁酸铜(CuFe2O4)先要煅烧成氧缺位体(CuFe2O4-a),氧缺位值(a)越大,活性越高,制氢越容易。
(5)根据以上提示,写出氧缺位体与水常温下反应制氢的化学方程式____________。
(6)课外小组将铁酸铜样品在N2的气氛中充分煅烧,得氧缺位体的质量为原质量的96.6%,则氧缺位值(a)=__________。(结果保留小数点后2位)
参考答案
1.C
【详解】
A.煤油为碳原子数C11~C17的高沸点烃类混合物,主要成分是饱和烃类,还含有不饱和烃和芳香烃,A正确;
B.太阳能电池板主要材料就是硅,B正确;
C.碳纤维不是有机物,C错误;
D.钛合金属于金属材料,D正确;
故选C。
2.D
【详解】
镁铝合金不易生锈、强度高且密度小,所以可用于制作窗框、卷帘门、防护拦等。这与镁铝合金的导电性好没有关系。
答案选D。
3.B
【详解】
A.
“熔喷布”的主要组成为聚丙烯,聚丙烯是有机高分子化合物,A项正确;
B.芯片的主要成分是单质硅,B项错误;
C.SiC属于新型无机非金属材料,C项正确;
D.钛合金材料具有强度大、密度小、耐腐蚀等特性,D项正确;
答案选B。
4.C
【详解】
A.22号钛元素位于第四周期ⅣB族,属于过渡元素,A项正确;
B.港珠澳大桥用到的合金材料,必须具有强度大、密度小、耐腐蚀等特性才能抵御恶劣环境及海水的侵蚀,B项正确;
C.碳纤维主要成分是碳单质,属于无机物,C项错误;
D.硅晶体是良好的半导体材料,常用于制作收集芯片,D项正确;
综上所述答案为C。
5.D
【详解】
A.由胡粉的主要成分是可知,其难溶于水,A项正确;
B.PbCO3和Pb(OH)2均可与盐酸或硝酸反应,故胡粉可与盐酸或硝酸反应,B项正确;
C.古代的“火”是由木材(主要成分为纤维素)燃烧产生的,纤维素不完全燃烧时会产生一氧化碳、炭,C项正确;
D.“还为铅”指胡粉通过一系列反应被还原为Pb,D项错误;
答案选D。
6.C
【详解】
A.K、Na等过于活泼的碱金属先和水反应,生成强碱,而不是与盐溶液发生置换反应,故A错误;
B.金属Li在空气中燃烧生成氧化锂,金属钾在空气中燃烧生成超氧化钾,只有金属钠在空气中燃烧生成过氧化钠,故B错误;
C.随核电荷数增加,其阳离子半径越来越大,与自由电子的作用力越来越弱,所以碱金属单质溶、沸点降低,故C正确;
D.碱金属的原子半径越大,原子核对最外层电子的吸引能力减弱,则越易失电子,其还原性越强,故D错误。
答案选C。
7.A
【详解】
A.合金是指在一种金属中加热熔合其它金属或非金属而形成的具有金属特性的物质,钛合金含有多种物质,属于混合物,不是新型金属单质,A错误;
B.在钛合金中加入稀土金属,能提高钛合金的拉伸性能、蠕变性能、热稳定性、加工性能、工艺性能等多种性能,使钛合金具有更优良的性能,B正确;
C.由于合金中组成元素之间相互作用的情况不同,形成合金后熔点比成分金属低,硬度大,C正确;
D.合金的化学性质与其各成分金属的化学性质是相同的,钛合金除具备钛单质性质外,还具备其他组成成分的性质,D正确;
故选A。
8.D
【详解】
A.铁具有良好的导热性,而且铁元素也是人体必需的元素,常用铁制作炊具,故A正确;
B.铝具有抗腐蚀性,铝表面易形成致密的氧化膜,可阻止里面的金属进一步被氧化,故B正确;
C.废旧电池中汞等重金属元素会污染环境,不能随意丢弃,需要回收,故C正确;
D.合金的硬度一般大于成分金属的硬度,故D错误;
故选D。
9.B
【详解】
A.钢是铁与碳的合金,A错误;
B.活泼的金属一般的还原剂很难将其还原出来,往往采用电解法冶炼,B正确;
C.纯金属的熔点比合金一般要高,C错误;
D.铝的性质活泼,D错误;
故选B。
10.C
【详解】
A.纯铝的硬度和强度较小,不适合制造机器零件;若向铝中加入少量的合金元素,如Cu、Mg及稀土元素等,可制成铝合金,如硬铝是指铝合金中以Cu为主要合金元素的一类合金,密度小、强度高,具有较强的抗腐蚀能力,是制造飞机和宇宙飞船的理想材料,故A正确;
B.过氧化钠与人呼出的二氧化碳或水蒸气反应均生成氧气,过氧化钠可用于呼吸面具或潜水艇中作为氧气的来源,故B正确;
C.四氧化三铁是一种黑色粉末,俗称磁性氧化铁,氧化铁是红色固体,俗称铁红,常用作油漆、涂料、油墨和橡胶的红色颜料,故C错误;
D.在合金中加入适量稀土金属可以制成合金,能大大改善合金的性能,故D正确。
故选C。
11.A
【详解】
A.镁铝合金密度校,符合制造飞机部件密度校、硬度大、耐腐蚀的特点,A正确;
B.铜合金中通属于重金属,且容易生成铜绿,不符合飞机部件的要求,B错误;
C.不锈钢属于铁合金,容易形成电化学腐蚀,不符合飞机部件的要求,C错误;
D.铅锡合金中铅属于重金属,不符合题意制造飞机部件的要求,D正确;
故选A。
12.C
【详解】
新型合金包括储氢合金、形状记忆合金、钛合金、耐热合金等,生铁、硬铝、不锈钢、黄铜等属于普通合金,故答案为C。
13.C
【详解】
A.运载火箭主体结构件框所用高精尖合金材料是铝合金,铝合金材料具有强度大、质量轻、抗腐蚀能力强等优点,故A正确;
B.碳化硅是一种新型无机非金属材料,硬度大,耐高温,故B正确;
C.的质量数是3,质子数是2,中子数=质量数-质子数=3-2=1,有1个中子,故C错误;
D.地球环境和月球环境有明显差异,建立“月球样品实验室”,可避免月壤受到地球大气、水等环境污染,故D正确;
故选:C。
14.D
【详解】
A.高纯硅可用于制造半导体材料,制造芯片,故A正确;
B.氧化铝陶瓷属于新型无机非金属材料,它是生物陶瓷具有特定的生物或生理功能,可直接用于人体,故B正确;
C.氮化硅陶瓷属于新型无机非金属材料,是高温结构材料,可用于制造陶瓷发动机的受热面,故C正确;
D.二氧化硅不具有导电能,故D错误;
故选D。
15.B
【详解】
A.手机芯片主要成分是硅单质,不是二氧化硅,A错误;
B.青铜是铜锡合金,“超级钢”是铁碳等形成的合金,均属于合金,B正确;
C.氮化硅陶瓷是新型无机非金属材料,不是传统无机非金属材料,C错误;
D.碳纳米管不是分散系,不属于胶体分散系,D错误;
答案选B。
16.FeSO4+H2C2O4+xH2O=FeC2O4·xH2O↓+H2SO4
②
将装置A中的水蒸气带走;同时防止FeC2O4冷却时被氧化
3FeC2O4
Fe3O4
+
4CO↑+
2CO2↑
C
E
(C)
F
G
C
H
【详解】
(1)硫酸亚铁溶液和草酸反应的化学方程式是FeSO4+H2C2O4+xH2O=FeC2O4·xH2O↓+H2SO4;
(2)①向试管中加入几滴KSCN溶液,溶液不变红,不能说明肯定存在Fe2+;向试管中加入几滴K3[Fe(CN)6]溶液,生成蓝色沉淀,说明肯定存在Fe2+;草酸根离子、Fe2+均能与紫红色酸性KMnO4溶液反应,不能说明肯定存在Fe2+;故答案选②。
(3)①在无氧环境中进行反应,防止FeC2O4冷却时被氧化,同时将装置A中的水蒸气转移出A装置;②m(H2O)=(m3-m1)g,m(FeC2O4)=
(m2-m3)g,根据FeC2O4·xH2O=
FeC2O4
+
xH2O反应可知:144:18x=(m2-m3)g:(m3-m1)g,x=;
(4)①由于分解后有磁性的黑色化合物生成,该化合物为Fe3O4,铁元素化合价有变化,说明分解过程中发生了氧化还原反应,化学方程式为:3FeC2O4
Fe3O4
+
4CO↑+
2CO2↑;
②生成的气体先通过澄清石灰水来证明二氧化碳的存在,再通过浓的氢氧化钠吸收二氧化碳,再通过澄清石灰水来证明二氧化碳已吸收完全,气体经干燥灼热的氧化铜,将产生后气体澄清石灰水来证明又生成了二氧化碳,最后进行尾气处理;依次连接的合理顺序为A、C
E
(C)
F
G
C
H。
17.Na2O2
Fe(OH)3
2Na2O2+2H2O=4NaOH+O2↑
取D溶液少许于一试管,向其中加入少量的KSCN溶液,溶液立即变为血红色,说明含有Fe3+
2Al+2OH-+2H2O=2+3H2↑
a
d
【分析】
由题干信息可知,A是一种淡黄色固体,可做供氧剂,故A为Na2O2,2Na2O2+2H2O=4NaOH+O2↑,E的焰色反应为黄色,故B为O2,E为NaOH,C为具有磁性的黑色晶体,故C为Fe3O4,Fe在O2中燃烧生成Fe3O4,故G为Fe,F为红褐色固体是Fe(OH)3,故D为FeCl3,Fe3O4+8HCl=2FeCl3+FeCl2+4H2O,2FeCl2+Cl2=2FeCl3,据此分析解题。
【详解】
(1)由分析可知,物质A、F的化学式分别是Na2O2、Fe(OH)3,故答案为:Na2O2;Fe(OH)3;
(2)A→B+E的反应即过氧化钠与水反应,故该化学方程式为2Na2O2+2H2O=4NaOH+O2↑,故答案为:2Na2O2+2H2O=4NaOH+O2↑;
(3)由分析可知,D中含有的金属阳离子为Fe3+,故检验D中的金属阳离子具体的操作和实验现象:取D溶液少许于一试管,向其中加入少量的KSCN溶液,溶液立即变为血红色,说明含有Fe3+,故答案为:取D溶液少许于一试管,向其中加入少量的KSCN溶液,溶液立即变为血红色,说明含有Fe3+;
(4)E溶液与地壳中含量最多的金属元素的单质发生反应即NaOH与Al反应,方程式为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑,故离子方程式为2Al+2OH-+2H2O=2+3H2↑,故答案为:2Al+2OH-+2H2O=2+3H2↑;
(5)G与D溶液也能发生反应,即Fe+2FeCl3=3FeCl2,故其反应的类型为化合反应和氧化还原反应,故答案为:a
d。
18.水
c
FeCl3
加高纯水时,酸度[或c(H+)]降低,HCl(浓)+FeCl3HFeCl4平衡向转化为FeCl3的方向移动
减少草酸铁晶体的溶解损耗
6Fe2++
+14H+=6Fe3++2Cr3++7H2O
CuFe2O4-a
+aH2O=CuFe2O4+aH2↑
0.51
【分析】
FeCl3和浓盐酸反应生成HFeCl4,用萃取剂萃取后有机相中含HFeCl4,用蒸馏水对有机相反萃取,得到FeCl3溶液,向溶液中加入草酸,得到草酸铁,蒸发灼烧后得到高纯氧化铁。
【详解】
(1)
①用萃取剂X萃取,Ca2+、Mn2+、Cu2+等杂质离子溶于水,则主要在水相;
②若实验时共用萃取剂X
150mL,萃取率最高的方法是应是少量多次,答案应选c.分3次萃取,每次50mL;
(2)用高纯水反萃取时,c(H+)降低,HCl(浓)+FeCl3HFeCl4平衡向转化为FeCl3的方向移动,所以萃取后水相中铁的存在形式是FeCl3;
(3)所得草酸铁沉淀需用冰水洗涤,其目的一是洗去沉淀表面吸附的杂质离子,二是因为冰水温度较低,可减少草酸铁晶体的溶解损耗;
(4)在酸性条件下用标准K2Cr2O7溶液滴定含Fe2+的溶液,铬的还原产物为Cr3+,Fe2+会被氧化为Fe3+,离子方程式为6Fe2+++14H+=6Fe3++2Cr3++7H2O;
(5)铁酸铜(CuFe2O4)先要煅烧成氧缺位体(CuFe2O4-a),氧缺位体再与水常温下反应制氢,方程式是CuFe2O4-a+aH2O=CuFe2O4+aH2↑;
(6)CuFe2O4→CuFe2O4-a+aO,充分煅烧,得氧缺位体的质量为原质量的96.6%,则(240-16a)/240=0.966,a=0.51。
一、选择题
1.2020年5月5日我国成功发射了长征五号B运载火箭。科学家通过远程操控在火箭运送的新一代载人飞船中完成了我国首次太空3D打印实验。下列叙述错误的是
A.火箭助推剂中的煤油属于混合物
B.硅单质可以用于制作飞船上的太阳能电池板
C.太空3D打印实验的原材料碳纤维属于有机高分子材料
D.火箭采用的高强度新型钛合金构件,属于金属材料
2.镁铝合金可用于制作窗框、卷帘门、防护拦等。下列性质与这些用途无关的是
A.不易生锈
B.强度高
C.密度小
D.导电性好
3.现代社会的发展与进步离不开材料,下列有关材料的说法错误的是
A.制作N95型口罩的“熔喷布”,其主要组成为聚丙烯,聚丙烯是有机高分子化合物
B.华为5G手机芯片的主要成分是二氧化硅
C.中国天眼FAST用到的高性能碳化硅是一种新型的无机非金属材料
D.“蛟龙号”深潜器的外壳是特种钛合金,该钛合金比金属钛硬度高、耐高压、耐腐蚀
4.新材料的发展充分体现了“中国技术”“中国制造”和“中国力量”。下列说法错误的是
A.蛟龙号潜水器用到了钛合金,22号钛元素属于过渡元素
B.港珠澳大桥用到的合金材料,具有强度大、密度小、耐腐蚀等性能
C.国产大飞机C919使用的“现代工业骨骼”碳纤维是一种新型有机高分子材料
D.“华为麒麟980”手机中芯片的主要成分是硅单质
5.胡粉[主要成分是]具有败毒抗癌、杀虫疗疮的功效,东汉炼丹理论家魏伯阳说著的《周易参同契》中记载:“胡粉投火中,色坏还为铅”,下列说法错误的是
A.胡粉不溶于水
B.胡粉可与盐酸或硝酸反应
C.“火”中含有炭、
D.“还为铅”中的铅是指
6.下列说法中,正确的是
A.碱金属单质的化学性质活泼,易从盐溶液中置换其它金属。
B.碱金属单质在空气中燃烧生成的都是过氧化物。
C.随核电荷数增加,碱金属单质溶、沸点降低。
D.碱金属的原子半径越大,越易失电子,其还原性越弱。
7.2020
年11月10日8时12分,中国“奋斗者”号载人潜水器在马里亚纳海沟成功坐底。“奋斗者”号研制及海试的成功,标志着我国具有了进入世界海洋最深处开展科学探索的能力,体现了我国在海洋高技术领域的综合实力。其中,“奋斗者”号使用了钛合金材料。有关合金的说法中错误的的是
A.钛合金是一种新型金属单质
B.在合金中加入稀土金属,能大大改善合金的性能,使合金具有更优良的性能
C.钛合金熔点比成分金属低,但硬度大
D.钛合金的化学性质具有其各成分金属的化学性质
8.下列有关对金属和金属材料的认识不正确的是
A.铁有良好的导热性,常用来制作炊具
B.铝表面易形成致密的氧化膜,可阻止铝进一步被氧化
C.废旧电池的回收,可减少对环境的污染
D.合金的硬度一般小于成分金属的硬度
9.下列有关金属的说法中,正确的是
A.生铁是合金,钢是纯金属
B.活泼的金属往往采用电解法冶炼
C.纯金属与其合金相比,一般具有更低的熔点
D.铝的化学性质不活泼,因此铝合金在生产、生活中应用非常广泛
10.下列说法不正确的是
A.铝合金密度小、强度高,是制造飞机和宇宙飞船的理想材料
B.过氧化钠可在呼吸面具或潜水艇中作为氧气的来源
C.四氧化三铁俗称铁红,常用作油漆、涂料、油墨和橡胶的颜料
D.在合金中加入适量稀土金属,能大大改善合金的性能
11.下列金属材料中,最适合用于制造飞机部件的是
A.镁铝合金
B.铜合金
C.不锈钢
D.铅锡合金
12.下列生活物品中所涉及的合金材料属于新型合金的是
A.生铁
B.不锈钢
C.储氢合金
D.硬铝
A.A
B.B
C.C
D.D
13.2020年12月17日凌晨,嫦娥五号返回器携带月壤着陆地球,关于嫦娥五号说法不正确的是
A.嫦娥五号主体框架为钛合金和神墙铝合金材料,质量轻,强度高
B.嫦娥五号光学望远镜的某些部件由碳化硅特种陶瓷材料制成,硬度大,耐高温
C.月壤中含有,原子核内含有3个中子,可以作为核聚变的理想核燃料
D.国家天文台已建成国内首个“月球样品实验室”,以避免月壤受到地球大气、水等环境污染
14.下列关于无机非金属材料的说法中,不正确的是
A.高纯硅可用于制造半导体材料
B.氧化铝陶瓷属于新型无机非金属材料,它是生物陶瓷
C.氮化硅陶瓷属于新型无机非金属材料,可用于制造陶瓷发动机的受热面
D.二氧化硅制成的光导纤维,由于导电能力强而被用于制造光缆
15.新材料的发展充分体现了“中国技术”、“中国制造”和“中国力量”。下列说法正确的是
A.华为首款5G手机搭载了智能7nm制程SoC“麒麟980”手机芯片的主要成分是二氧化硅
B.制造“后母戊鼎”的青铜和举世轰动的“超级钢”均属于合金
C.国产飞机C919用到氮化硅陶瓷是传统无机非金属材料
D.碳纳米管属于胶体分散系,该材料具有较强的吸附能力
二、实验题
16.水合草酸亚铁(FeC2O4·xH2O)是生产锂电池的原料,难溶于水,受热易分解。某化学兴趣小组对草酸亚铁的一些性质进行探究。回答下列问题:
(1)实验室用硫酸亚铁溶液和草酸制备水合草酸亚铁,反应的化学方程式是_________。
(2)将水合草酸亚铁溶于适量盐酸。分别取2
mL此溶液于3支试管中,进行实验:
①第一支试管中加入几滴KSCN溶液,溶液不变红;
②第二支试管中加入几滴K3[Fe(CN)6]溶液,生成蓝色沉淀;
③第三支试管中加入几滴酸性KMnO4溶液,溶液紫红色褪去。
上述实验能证明水合草酸亚铁中存在Fe2+的是_________(填编号)。
(3)为测定水合草酸亚铁中结晶水含量,将石英玻璃管(带两端开关K1和K2)(设为装置A)称重,记为m1
g。将样品装入石英玻璃管中,再次将装置A称重,记为m2
g。按下图连接好装置进行实验。
验步骤如下:a.打开K1和K2,缓缓通入N2;b.加热装置A一段时间;c.停止加热,冷却到室温;d.关闭K1和K2,称量A;e.重复上述步骤,直至A恒重,记为m3
g。
①步骤b至步骤c继续通入N2的目的是
________________。
②根据实验数据记录,计算水合草酸亚铁化学式中结晶水数目x=______(列式表示)。
(4)为探究草酸亚铁的分解产物,将(3)中已恒重的装置A接入下图所示部分的装置(可重复选用)进行实验。打开K1和K2,缓缓通入N2,充分加热。实验后石英玻璃管中固体仅残留一种有磁性的黑色化合物。
①写出草酸亚铁受热分解的化学方程式____________。
②实验装置中,依次连接的合理顺序为A、____________。
三、元素或物质推断题
17.已知A是一种淡黄色固体,可做供氧剂,C为具有磁性的黑色晶体,E的焰色反应为黄色,F为红褐色固体(部分产物已略去)。
(1)物质A、F的化学式分别是___________、___________。
(2)A→B+E的反应的化学方程式是___________。
(3)如何检验D中的金属阳离子,说明具体的操作和实验现象___________。
(4)E溶液与地壳中含量最多的金属元素的单质发生反应的离子方程式为___________。
(5)G与D溶液也能发生反应,其反应的类型为___________(填序号)。
a.化合反应
b.置换反应
c.复分解反应
d.氧化还原反应
四、工业流程题
18.铁是人类较早使用的金属之一,铁及其化合物在现代社会各个领域仍有广泛的应用。
I.氧化物—Fe2O3:用工业FeCl3粗品(含Ca、Mn、Cu等杂质离子)制取高纯铁红,实验室常用萃取剂X(甲基异丁基甲酮)萃取法制取高纯铁红的主要实验步骤如下:
已知:HCl(浓)+
FeCl3HFeCl4。试回答下列问题:
(1)用萃取剂X萃取,该步骤中:
①
Ca2+、Mn2+、Cu2+等杂质离子主要在__________(填“水”或“有机”)相。
②
若实验时共用萃取剂X
150mL,萃取率最高的方法是__________(填字母)。
a.一次性萃取,150mL
b.分2次萃取,每次75mL
c.分3次萃取,每次50mL
(2)用高纯水反萃取,萃取后水相中铁的存在形式是________________(写化学式);反萃取能发生的原因是___________________。
(3)所得草酸铁沉淀需用冰水洗涤,其目的一是洗去沉淀表面吸附的杂质离子,二是________________。
(4)测定产品中铁的含量需经酸溶、还原为Fe2+,然后在酸性条件下用标准K2Cr2O7溶液滴定,已知铬的还原产物为Cr3+,写出该滴定反应的离子方程式
___________________。
II.含氧酸盐—铁酸铜(CuFe2O4)是很有前景的热化学分解水制氢的材料,CuFe2O4在制氢过程中可以循环使用。在热化学循环分解水制氢的过程中,铁酸铜(CuFe2O4)先要煅烧成氧缺位体(CuFe2O4-a),氧缺位值(a)越大,活性越高,制氢越容易。
(5)根据以上提示,写出氧缺位体与水常温下反应制氢的化学方程式____________。
(6)课外小组将铁酸铜样品在N2的气氛中充分煅烧,得氧缺位体的质量为原质量的96.6%,则氧缺位值(a)=__________。(结果保留小数点后2位)
参考答案
1.C
【详解】
A.煤油为碳原子数C11~C17的高沸点烃类混合物,主要成分是饱和烃类,还含有不饱和烃和芳香烃,A正确;
B.太阳能电池板主要材料就是硅,B正确;
C.碳纤维不是有机物,C错误;
D.钛合金属于金属材料,D正确;
故选C。
2.D
【详解】
镁铝合金不易生锈、强度高且密度小,所以可用于制作窗框、卷帘门、防护拦等。这与镁铝合金的导电性好没有关系。
答案选D。
3.B
【详解】
A.
“熔喷布”的主要组成为聚丙烯,聚丙烯是有机高分子化合物,A项正确;
B.芯片的主要成分是单质硅,B项错误;
C.SiC属于新型无机非金属材料,C项正确;
D.钛合金材料具有强度大、密度小、耐腐蚀等特性,D项正确;
答案选B。
4.C
【详解】
A.22号钛元素位于第四周期ⅣB族,属于过渡元素,A项正确;
B.港珠澳大桥用到的合金材料,必须具有强度大、密度小、耐腐蚀等特性才能抵御恶劣环境及海水的侵蚀,B项正确;
C.碳纤维主要成分是碳单质,属于无机物,C项错误;
D.硅晶体是良好的半导体材料,常用于制作收集芯片,D项正确;
综上所述答案为C。
5.D
【详解】
A.由胡粉的主要成分是可知,其难溶于水,A项正确;
B.PbCO3和Pb(OH)2均可与盐酸或硝酸反应,故胡粉可与盐酸或硝酸反应,B项正确;
C.古代的“火”是由木材(主要成分为纤维素)燃烧产生的,纤维素不完全燃烧时会产生一氧化碳、炭,C项正确;
D.“还为铅”指胡粉通过一系列反应被还原为Pb,D项错误;
答案选D。
6.C
【详解】
A.K、Na等过于活泼的碱金属先和水反应,生成强碱,而不是与盐溶液发生置换反应,故A错误;
B.金属Li在空气中燃烧生成氧化锂,金属钾在空气中燃烧生成超氧化钾,只有金属钠在空气中燃烧生成过氧化钠,故B错误;
C.随核电荷数增加,其阳离子半径越来越大,与自由电子的作用力越来越弱,所以碱金属单质溶、沸点降低,故C正确;
D.碱金属的原子半径越大,原子核对最外层电子的吸引能力减弱,则越易失电子,其还原性越强,故D错误。
答案选C。
7.A
【详解】
A.合金是指在一种金属中加热熔合其它金属或非金属而形成的具有金属特性的物质,钛合金含有多种物质,属于混合物,不是新型金属单质,A错误;
B.在钛合金中加入稀土金属,能提高钛合金的拉伸性能、蠕变性能、热稳定性、加工性能、工艺性能等多种性能,使钛合金具有更优良的性能,B正确;
C.由于合金中组成元素之间相互作用的情况不同,形成合金后熔点比成分金属低,硬度大,C正确;
D.合金的化学性质与其各成分金属的化学性质是相同的,钛合金除具备钛单质性质外,还具备其他组成成分的性质,D正确;
故选A。
8.D
【详解】
A.铁具有良好的导热性,而且铁元素也是人体必需的元素,常用铁制作炊具,故A正确;
B.铝具有抗腐蚀性,铝表面易形成致密的氧化膜,可阻止里面的金属进一步被氧化,故B正确;
C.废旧电池中汞等重金属元素会污染环境,不能随意丢弃,需要回收,故C正确;
D.合金的硬度一般大于成分金属的硬度,故D错误;
故选D。
9.B
【详解】
A.钢是铁与碳的合金,A错误;
B.活泼的金属一般的还原剂很难将其还原出来,往往采用电解法冶炼,B正确;
C.纯金属的熔点比合金一般要高,C错误;
D.铝的性质活泼,D错误;
故选B。
10.C
【详解】
A.纯铝的硬度和强度较小,不适合制造机器零件;若向铝中加入少量的合金元素,如Cu、Mg及稀土元素等,可制成铝合金,如硬铝是指铝合金中以Cu为主要合金元素的一类合金,密度小、强度高,具有较强的抗腐蚀能力,是制造飞机和宇宙飞船的理想材料,故A正确;
B.过氧化钠与人呼出的二氧化碳或水蒸气反应均生成氧气,过氧化钠可用于呼吸面具或潜水艇中作为氧气的来源,故B正确;
C.四氧化三铁是一种黑色粉末,俗称磁性氧化铁,氧化铁是红色固体,俗称铁红,常用作油漆、涂料、油墨和橡胶的红色颜料,故C错误;
D.在合金中加入适量稀土金属可以制成合金,能大大改善合金的性能,故D正确。
故选C。
11.A
【详解】
A.镁铝合金密度校,符合制造飞机部件密度校、硬度大、耐腐蚀的特点,A正确;
B.铜合金中通属于重金属,且容易生成铜绿,不符合飞机部件的要求,B错误;
C.不锈钢属于铁合金,容易形成电化学腐蚀,不符合飞机部件的要求,C错误;
D.铅锡合金中铅属于重金属,不符合题意制造飞机部件的要求,D正确;
故选A。
12.C
【详解】
新型合金包括储氢合金、形状记忆合金、钛合金、耐热合金等,生铁、硬铝、不锈钢、黄铜等属于普通合金,故答案为C。
13.C
【详解】
A.运载火箭主体结构件框所用高精尖合金材料是铝合金,铝合金材料具有强度大、质量轻、抗腐蚀能力强等优点,故A正确;
B.碳化硅是一种新型无机非金属材料,硬度大,耐高温,故B正确;
C.的质量数是3,质子数是2,中子数=质量数-质子数=3-2=1,有1个中子,故C错误;
D.地球环境和月球环境有明显差异,建立“月球样品实验室”,可避免月壤受到地球大气、水等环境污染,故D正确;
故选:C。
14.D
【详解】
A.高纯硅可用于制造半导体材料,制造芯片,故A正确;
B.氧化铝陶瓷属于新型无机非金属材料,它是生物陶瓷具有特定的生物或生理功能,可直接用于人体,故B正确;
C.氮化硅陶瓷属于新型无机非金属材料,是高温结构材料,可用于制造陶瓷发动机的受热面,故C正确;
D.二氧化硅不具有导电能,故D错误;
故选D。
15.B
【详解】
A.手机芯片主要成分是硅单质,不是二氧化硅,A错误;
B.青铜是铜锡合金,“超级钢”是铁碳等形成的合金,均属于合金,B正确;
C.氮化硅陶瓷是新型无机非金属材料,不是传统无机非金属材料,C错误;
D.碳纳米管不是分散系,不属于胶体分散系,D错误;
答案选B。
16.FeSO4+H2C2O4+xH2O=FeC2O4·xH2O↓+H2SO4
②
将装置A中的水蒸气带走;同时防止FeC2O4冷却时被氧化
3FeC2O4
Fe3O4
+
4CO↑+
2CO2↑
C
E
(C)
F
G
C
H
【详解】
(1)硫酸亚铁溶液和草酸反应的化学方程式是FeSO4+H2C2O4+xH2O=FeC2O4·xH2O↓+H2SO4;
(2)①向试管中加入几滴KSCN溶液,溶液不变红,不能说明肯定存在Fe2+;向试管中加入几滴K3[Fe(CN)6]溶液,生成蓝色沉淀,说明肯定存在Fe2+;草酸根离子、Fe2+均能与紫红色酸性KMnO4溶液反应,不能说明肯定存在Fe2+;故答案选②。
(3)①在无氧环境中进行反应,防止FeC2O4冷却时被氧化,同时将装置A中的水蒸气转移出A装置;②m(H2O)=(m3-m1)g,m(FeC2O4)=
(m2-m3)g,根据FeC2O4·xH2O=
FeC2O4
+
xH2O反应可知:144:18x=(m2-m3)g:(m3-m1)g,x=;
(4)①由于分解后有磁性的黑色化合物生成,该化合物为Fe3O4,铁元素化合价有变化,说明分解过程中发生了氧化还原反应,化学方程式为:3FeC2O4
Fe3O4
+
4CO↑+
2CO2↑;
②生成的气体先通过澄清石灰水来证明二氧化碳的存在,再通过浓的氢氧化钠吸收二氧化碳,再通过澄清石灰水来证明二氧化碳已吸收完全,气体经干燥灼热的氧化铜,将产生后气体澄清石灰水来证明又生成了二氧化碳,最后进行尾气处理;依次连接的合理顺序为A、C
E
(C)
F
G
C
H。
17.Na2O2
Fe(OH)3
2Na2O2+2H2O=4NaOH+O2↑
取D溶液少许于一试管,向其中加入少量的KSCN溶液,溶液立即变为血红色,说明含有Fe3+
2Al+2OH-+2H2O=2+3H2↑
a
d
【分析】
由题干信息可知,A是一种淡黄色固体,可做供氧剂,故A为Na2O2,2Na2O2+2H2O=4NaOH+O2↑,E的焰色反应为黄色,故B为O2,E为NaOH,C为具有磁性的黑色晶体,故C为Fe3O4,Fe在O2中燃烧生成Fe3O4,故G为Fe,F为红褐色固体是Fe(OH)3,故D为FeCl3,Fe3O4+8HCl=2FeCl3+FeCl2+4H2O,2FeCl2+Cl2=2FeCl3,据此分析解题。
【详解】
(1)由分析可知,物质A、F的化学式分别是Na2O2、Fe(OH)3,故答案为:Na2O2;Fe(OH)3;
(2)A→B+E的反应即过氧化钠与水反应,故该化学方程式为2Na2O2+2H2O=4NaOH+O2↑,故答案为:2Na2O2+2H2O=4NaOH+O2↑;
(3)由分析可知,D中含有的金属阳离子为Fe3+,故检验D中的金属阳离子具体的操作和实验现象:取D溶液少许于一试管,向其中加入少量的KSCN溶液,溶液立即变为血红色,说明含有Fe3+,故答案为:取D溶液少许于一试管,向其中加入少量的KSCN溶液,溶液立即变为血红色,说明含有Fe3+;
(4)E溶液与地壳中含量最多的金属元素的单质发生反应即NaOH与Al反应,方程式为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑,故离子方程式为2Al+2OH-+2H2O=2+3H2↑,故答案为:2Al+2OH-+2H2O=2+3H2↑;
(5)G与D溶液也能发生反应,即Fe+2FeCl3=3FeCl2,故其反应的类型为化合反应和氧化还原反应,故答案为:a
d。
18.水
c
FeCl3
加高纯水时,酸度[或c(H+)]降低,HCl(浓)+FeCl3HFeCl4平衡向转化为FeCl3的方向移动
减少草酸铁晶体的溶解损耗
6Fe2++
+14H+=6Fe3++2Cr3++7H2O
CuFe2O4-a
+aH2O=CuFe2O4+aH2↑
0.51
【分析】
FeCl3和浓盐酸反应生成HFeCl4,用萃取剂萃取后有机相中含HFeCl4,用蒸馏水对有机相反萃取,得到FeCl3溶液,向溶液中加入草酸,得到草酸铁,蒸发灼烧后得到高纯氧化铁。
【详解】
(1)
①用萃取剂X萃取,Ca2+、Mn2+、Cu2+等杂质离子溶于水,则主要在水相;
②若实验时共用萃取剂X
150mL,萃取率最高的方法是应是少量多次,答案应选c.分3次萃取,每次50mL;
(2)用高纯水反萃取时,c(H+)降低,HCl(浓)+FeCl3HFeCl4平衡向转化为FeCl3的方向移动,所以萃取后水相中铁的存在形式是FeCl3;
(3)所得草酸铁沉淀需用冰水洗涤,其目的一是洗去沉淀表面吸附的杂质离子,二是因为冰水温度较低,可减少草酸铁晶体的溶解损耗;
(4)在酸性条件下用标准K2Cr2O7溶液滴定含Fe2+的溶液,铬的还原产物为Cr3+,Fe2+会被氧化为Fe3+,离子方程式为6Fe2+++14H+=6Fe3++2Cr3++7H2O;
(5)铁酸铜(CuFe2O4)先要煅烧成氧缺位体(CuFe2O4-a),氧缺位体再与水常温下反应制氢,方程式是CuFe2O4-a+aH2O=CuFe2O4+aH2↑;
(6)CuFe2O4→CuFe2O4-a+aO,充分煅烧,得氧缺位体的质量为原质量的96.6%,则(240-16a)/240=0.966,a=0.51。
