3.3 羧酸 酯1 课件(21张ppt) 2020-2021学年人教版高二化学选修5
文档属性
| 名称 | 3.3 羧酸 酯1 课件(21张ppt) 2020-2021学年人教版高二化学选修5 |

|
|
| 格式 | pptx | ||
| 文件大小 | 1.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-04-19 19:35:35 | ||
图片预览







文档简介
化学 · 选修5
第三章 烃的含氧衍生物
第三节 羧酸 酯
第1课时 羧酸
※明确学习目标※
1、能说出羧酸的概念和结构特点,会对羧酸从不同角度进行简单分类,知道乙酸的物理性质。
2、以乙酸为例,理解羧酸的分子结构与其性质的关系,知道通过同位素示踪法的研究理解酯化反应的断键过程。(学习重点)
【生活中的化学】自然界和日常生活中的有机酸
课本P61
“资料卡片”
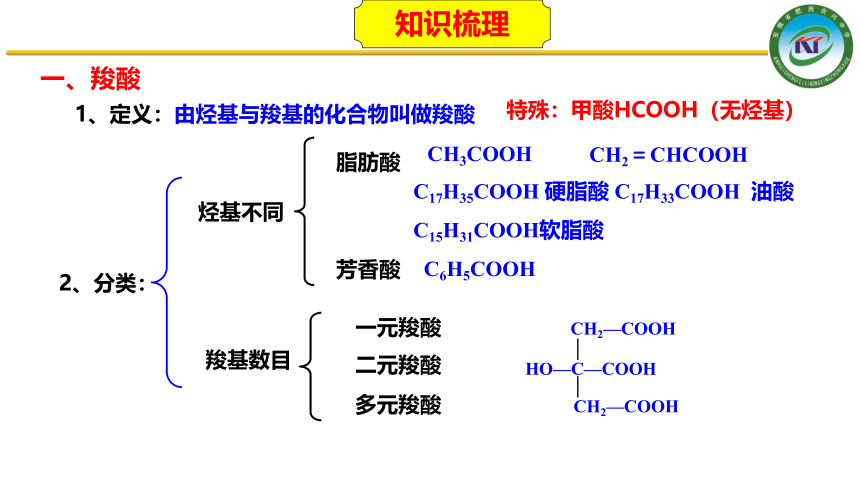
一、羧酸
2、分类:
知识梳理
1、定义:由烃基与羧基的化合物叫做羧酸
特殊:甲酸HCOOH(无烃基)
烃基不同
脂肪酸
芳香酸
CH3COOH
CH2=CHCOOH
C17H35COOH 硬脂酸 C17H33COOH 油酸
C15H31COOH软脂酸
C6H5COOH
羧基数目
一元羧酸
二元羧酸
多元羧酸
HO—C—COOH
CH2—COOH
CH2—COOH
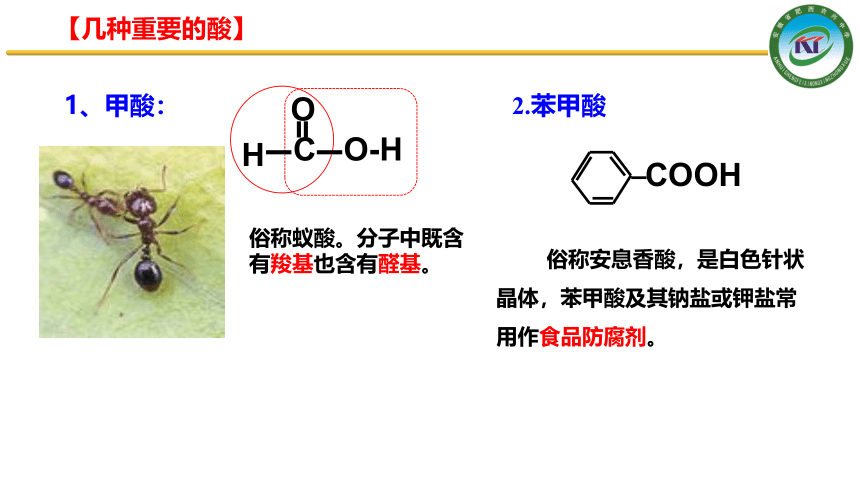
【几种重要的酸】
1、甲酸:
俗称蚁酸。分子中既含有羧基也含有醛基。
C
H
O-H
=
O
2.苯甲酸
COOH
俗称安息香酸,是白色针状晶体,苯甲酸及其钠盐或钾盐常用作食品防腐剂。
3.乙二酸
COOH
COOH
俗称草酸,是无色透明晶体,能溶于水或乙醇。通常以结晶水合物形式存在。草酸钙(CaC2O4)难溶于水,是人体膀胱结石和肾结石的主要成分。
【几种重要的酸】
4.高级脂肪酸
指含碳原子数较多的脂肪酸, 常见有:
C17H35COOH
硬脂酸
C17H33COOH
油 酸
C15H31COOH
软脂酸
C17H31COOH
亚油酸
二、乙酸
知识梳理
1、乙酸的物理性质
颜色、状态:
气味:
沸点:
熔点:
溶解性:
无色液体
有强烈刺激性气味
117.9℃ (易挥发)
16.6℃
(无水乙酸又称为:冰醋酸)
易溶于水、乙醇等溶剂
2、乙酸的分子结构
①分子式:
②结构简式:
③官能团:
C2H4O2
CH3COOH
羧基(-COOH)
二、乙酸
知识梳理
受C=O的影响:
断碳氧单键
氢氧键更易断
受-O-H的影响:
碳氧双键不易断
羧基
当氢氧键断裂时,容易解离出氢离子,使乙酸具有酸性。
【微观探析】羧酸的结构特点
3、乙酸的化学性质
(1)弱酸性:酸性比碳酸强
CH3COOH CH3COO- + H+
1.利用下图所示的仪器和药品,设计一个简单的一次性完成的实验装置,验证乙酸、碳酸和苯酚溶液的酸性强弱。
科学探究
【学习探究一】了解乙酸的酸性
2CH3COONa + CO2↑+ H2O
2CH3COOH+Na2CO3→
①
作用:除去挥发出来的乙酸
酸性:
乙酸>碳酸>苯酚
【微观辨析】:乙酸、乙醇、苯酚中都含有羟基,根据你学到的知识可以判断羟基上的氢的活泼性大小吗?能解释其原因吗?
{5C22544A-7EE6-4342-B048-85BDC9FD1C3A}代表物
结构简式
羟基氢的活泼性
酸性
与钠反应
与NaOH的反应
与Na2CO3的反应
乙醇
CH3CH2OH
增强
中性
能
不能
不能
苯酚
C6H5OH
比碳酸弱
能
能
能,不产
生CO2
乙酸
CH3COOH
比碳酸强
能
能
能
【学习探究一】了解乙酸的酸性
CH3COOH
H2CO3
HCO3-
H2O
C2H5OH
>
>
>
>
记住:羟基氢的活泼性(酸性):
即:电离出的H+能力
C6H5OH
>
能与NaHCO3反应生成气体是-COOH的检验方法。
(2)酯化反应
定义:醇和含氧酸起作用,生成酯和水的反应
注意:可逆号
CH3COOH + HOC2H5 CH3COOC2H5 + H2O
浓硫酸
△
O O
CH3–C–OH+H–O–C2H5 CH3–C–O–C2H5 + H2O
浓H2SO4
O O
CH3–C–O–H+HO–C2H5 CH3–C–O–C2H5 + H2O
浓H2SO4
如何断键?
同位素示踪法
【学习探究二】酯化反应机理
酸脱羟基醇脱氢,酯化加水要记清
(1)反应机理:
浓硫酸、加热
(2) 条件:
酯化反应是分子间脱水,可看作是取代反应.
O O
CH3–C–OH+H–O–C2H5 CH3–C–O–C2H5 + H2O
浓H2SO4
18
18
同位素示踪法
把乙醇分子中的氧原子换成具有放射性的同位素18O,实验后检测到生成物中只有乙酸乙酯中才有18O
思考与交流
乙酸与乙醇的酯化反应是可逆的,在制取乙酸乙酯的实验中,如果要提高乙酸乙酯的产率,你认为应当采取哪些措施?
根据化学平衡原理,提高乙酸乙酯产率的措施有:
(1)由于乙酸乙酯的沸点比乙酸、乙醇都低,因此从反应物中不断蒸出乙酸乙酯可提高其产率。
(2)使用过量的乙醇,可提高乙酸转化率。
(3)使用浓H2SO4作吸水剂,提高反应转化率。
主要化学性质:
既具有羧酸的通性,也具有醛的性质。
酸性;
酯化反应;
银镜反应;
与新制Cu(OH)2反应
C
H
OH
=
O
甲酸的结构式如下,具有不同与其它羧酸的结构特点,你能推断它有哪些化学性质吗?写出具有代表性的化学方程式:
【学习探究三】甲酸化学性质的特殊性
写出下列物质发生酯化反应的化学方程式:
①甲酸与乙醇:
②苯甲酸与甲醇:
【学习评价】
巩固练习
1、化合物 跟足量的下列哪种物质的溶液反应可得到一钠盐C7H5O3Na( )
COOH
OH
A NaOH B Na2CO3
C NaHCO3 D NaCl
C
2、某有机物的结构简式如下图,它在一定条件下可能发生的反应有 ( )
①加成 ②水解 ③酯化 ④氧化 ⑤中和 ⑥消去
A、②③④ B、①③⑤⑥
C、①③④⑤ D、②③④⑤⑥
巩固练习
C
※ 布置作业 ※
1、完成《同步作业》P43-44内容。
第三章 烃的含氧衍生物
第三节 羧酸 酯
第1课时 羧酸
※明确学习目标※
1、能说出羧酸的概念和结构特点,会对羧酸从不同角度进行简单分类,知道乙酸的物理性质。
2、以乙酸为例,理解羧酸的分子结构与其性质的关系,知道通过同位素示踪法的研究理解酯化反应的断键过程。(学习重点)
【生活中的化学】自然界和日常生活中的有机酸
课本P61
“资料卡片”
一、羧酸
2、分类:
知识梳理
1、定义:由烃基与羧基的化合物叫做羧酸
特殊:甲酸HCOOH(无烃基)
烃基不同
脂肪酸
芳香酸
CH3COOH
CH2=CHCOOH
C17H35COOH 硬脂酸 C17H33COOH 油酸
C15H31COOH软脂酸
C6H5COOH
羧基数目
一元羧酸
二元羧酸
多元羧酸
HO—C—COOH
CH2—COOH
CH2—COOH
【几种重要的酸】
1、甲酸:
俗称蚁酸。分子中既含有羧基也含有醛基。
C
H
O-H
=
O
2.苯甲酸
COOH
俗称安息香酸,是白色针状晶体,苯甲酸及其钠盐或钾盐常用作食品防腐剂。
3.乙二酸
COOH
COOH
俗称草酸,是无色透明晶体,能溶于水或乙醇。通常以结晶水合物形式存在。草酸钙(CaC2O4)难溶于水,是人体膀胱结石和肾结石的主要成分。
【几种重要的酸】
4.高级脂肪酸
指含碳原子数较多的脂肪酸, 常见有:
C17H35COOH
硬脂酸
C17H33COOH
油 酸
C15H31COOH
软脂酸
C17H31COOH
亚油酸
二、乙酸
知识梳理
1、乙酸的物理性质
颜色、状态:
气味:
沸点:
熔点:
溶解性:
无色液体
有强烈刺激性气味
117.9℃ (易挥发)
16.6℃
(无水乙酸又称为:冰醋酸)
易溶于水、乙醇等溶剂
2、乙酸的分子结构
①分子式:
②结构简式:
③官能团:
C2H4O2
CH3COOH
羧基(-COOH)
二、乙酸
知识梳理
受C=O的影响:
断碳氧单键
氢氧键更易断
受-O-H的影响:
碳氧双键不易断
羧基
当氢氧键断裂时,容易解离出氢离子,使乙酸具有酸性。
【微观探析】羧酸的结构特点
3、乙酸的化学性质
(1)弱酸性:酸性比碳酸强
CH3COOH CH3COO- + H+
1.利用下图所示的仪器和药品,设计一个简单的一次性完成的实验装置,验证乙酸、碳酸和苯酚溶液的酸性强弱。
科学探究
【学习探究一】了解乙酸的酸性
2CH3COONa + CO2↑+ H2O
2CH3COOH+Na2CO3→
①
作用:除去挥发出来的乙酸
酸性:
乙酸>碳酸>苯酚
【微观辨析】:乙酸、乙醇、苯酚中都含有羟基,根据你学到的知识可以判断羟基上的氢的活泼性大小吗?能解释其原因吗?
{5C22544A-7EE6-4342-B048-85BDC9FD1C3A}代表物
结构简式
羟基氢的活泼性
酸性
与钠反应
与NaOH的反应
与Na2CO3的反应
乙醇
CH3CH2OH
增强
中性
能
不能
不能
苯酚
C6H5OH
比碳酸弱
能
能
能,不产
生CO2
乙酸
CH3COOH
比碳酸强
能
能
能
【学习探究一】了解乙酸的酸性
CH3COOH
H2CO3
HCO3-
H2O
C2H5OH
>
>
>
>
记住:羟基氢的活泼性(酸性):
即:电离出的H+能力
C6H5OH
>
能与NaHCO3反应生成气体是-COOH的检验方法。
(2)酯化反应
定义:醇和含氧酸起作用,生成酯和水的反应
注意:可逆号
CH3COOH + HOC2H5 CH3COOC2H5 + H2O
浓硫酸
△
O O
CH3–C–OH+H–O–C2H5 CH3–C–O–C2H5 + H2O
浓H2SO4
O O
CH3–C–O–H+HO–C2H5 CH3–C–O–C2H5 + H2O
浓H2SO4
如何断键?
同位素示踪法
【学习探究二】酯化反应机理
酸脱羟基醇脱氢,酯化加水要记清
(1)反应机理:
浓硫酸、加热
(2) 条件:
酯化反应是分子间脱水,可看作是取代反应.
O O
CH3–C–OH+H–O–C2H5 CH3–C–O–C2H5 + H2O
浓H2SO4
18
18
同位素示踪法
把乙醇分子中的氧原子换成具有放射性的同位素18O,实验后检测到生成物中只有乙酸乙酯中才有18O
思考与交流
乙酸与乙醇的酯化反应是可逆的,在制取乙酸乙酯的实验中,如果要提高乙酸乙酯的产率,你认为应当采取哪些措施?
根据化学平衡原理,提高乙酸乙酯产率的措施有:
(1)由于乙酸乙酯的沸点比乙酸、乙醇都低,因此从反应物中不断蒸出乙酸乙酯可提高其产率。
(2)使用过量的乙醇,可提高乙酸转化率。
(3)使用浓H2SO4作吸水剂,提高反应转化率。
主要化学性质:
既具有羧酸的通性,也具有醛的性质。
酸性;
酯化反应;
银镜反应;
与新制Cu(OH)2反应
C
H
OH
=
O
甲酸的结构式如下,具有不同与其它羧酸的结构特点,你能推断它有哪些化学性质吗?写出具有代表性的化学方程式:
【学习探究三】甲酸化学性质的特殊性
写出下列物质发生酯化反应的化学方程式:
①甲酸与乙醇:
②苯甲酸与甲醇:
【学习评价】
巩固练习
1、化合物 跟足量的下列哪种物质的溶液反应可得到一钠盐C7H5O3Na( )
COOH
OH
A NaOH B Na2CO3
C NaHCO3 D NaCl
C
2、某有机物的结构简式如下图,它在一定条件下可能发生的反应有 ( )
①加成 ②水解 ③酯化 ④氧化 ⑤中和 ⑥消去
A、②③④ B、①③⑤⑥
C、①③④⑤ D、②③④⑤⑥
巩固练习
C
※ 布置作业 ※
1、完成《同步作业》P43-44内容。
