鲁教版九年级下册化学 8.2海水“晒盐” 课件 (18张PPT)
文档属性
| 名称 | 鲁教版九年级下册化学 8.2海水“晒盐” 课件 (18张PPT) |

|
|
| 格式 | ppt | ||
| 文件大小 | 327.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-04-19 16:20:11 | ||
图片预览





文档简介
第二节 海水晒盐
上节课我们已经知道海水中有丰富的食盐资源,那么具体怎么把盐从海水中“捞”出来呢?
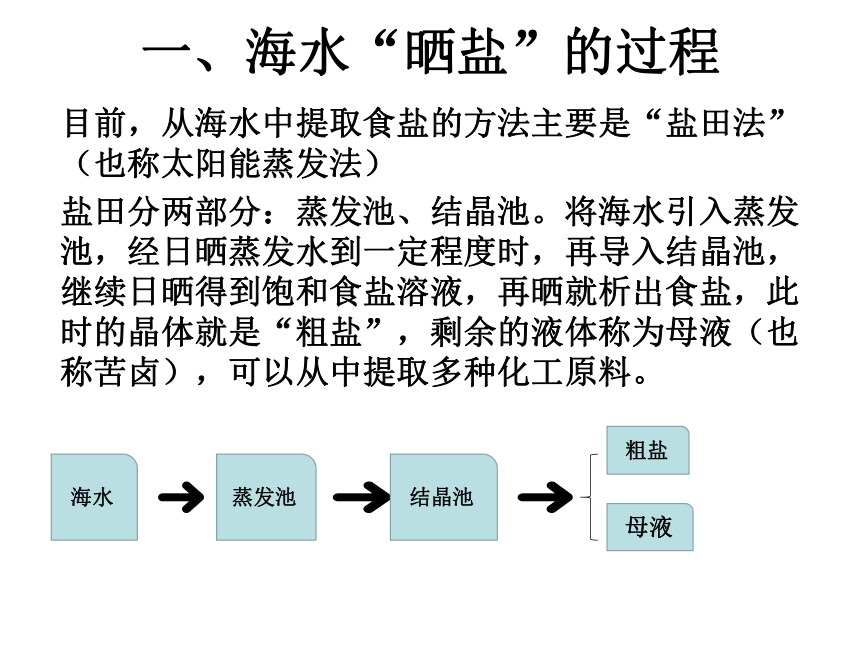
一、海水“晒盐”的过程
目前,从海水中提取食盐的方法主要是“盐田法”(也称太阳能蒸发法)
盐田分两部分:蒸发池、结晶池。将海水引入蒸发池,经日晒蒸发水到一定程度时,再导入结晶池,继续日晒得到饱和食盐溶液,再晒就析出食盐,此时的晶体就是“粗盐”,剩余的液体称为母液(也称苦卤),可以从中提取多种化工原料。
海水
蒸发池
结晶池
粗盐
母液
活动:取少量不饱和氯化钠溶液,滴在洁净的玻璃片上,用电热吹风机向玻璃片上的溶液吹热风,管察现象。(应该能观察到有盐析出)
思考:1、上述过程,氯化钠溶液从不饱和变为饱和的途径是什么?你能够从现象上判断溶液何时饱和吗?
2、你认为哪些自然条件有利于海水“晒盐”?为什么?
固体物质从它的饱和溶液中以晶体的形式析出的过程叫结晶。结晶分为两种:蒸发结晶、降温结晶。
像海水“晒盐”这样,经过日晒、风吹等,使溶剂不断减少,溶质质量分数逐渐增大,直至形成饱和溶液,继而析出晶体,就是蒸发结晶。
结晶
蒸发结晶
降温结晶
蒸发结晶:适用于溶解度受温度影响小的物质,通过升高温度蒸发水分而结晶。例如:氯化钠NaCl。
降温结晶:适用于溶解度受温度大的物质,通过降低温度使溶解度减小而结晶。例如:硝酸钾KNO3。
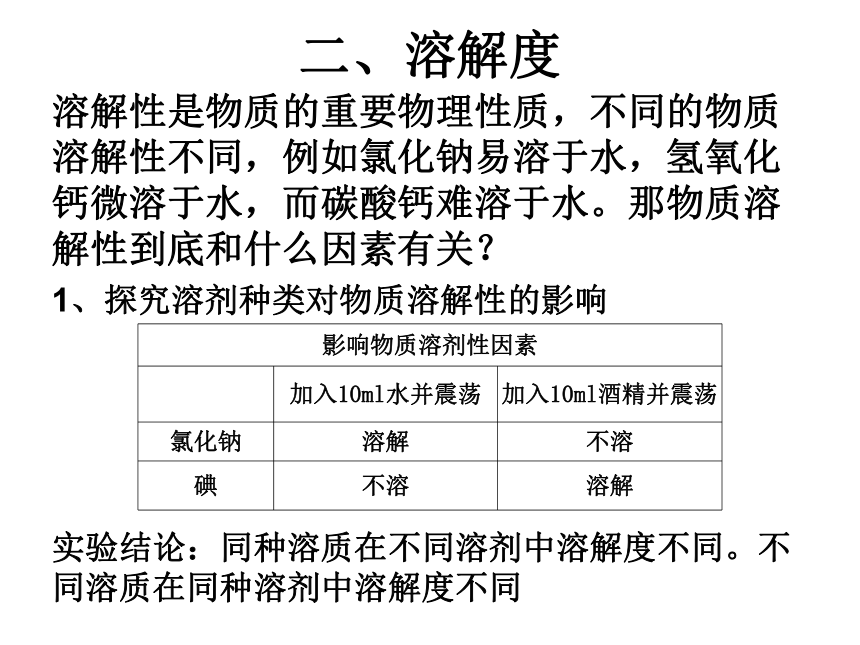
二、溶解度
溶解性是物质的重要物理性质,不同的物质溶解性不同,例如氯化钠易溶于水,氢氧化钙微溶于水,而碳酸钙难溶于水。那物质溶解性到底和什么因素有关?
1、探究溶剂种类对物质溶解性的影响
实验结论:同种溶质在不同溶剂中溶解度不同。不同溶质在同种溶剂中溶解度不同
影响物质溶剂性因素
加入10ml水并震荡
加入10ml酒精并震荡
氯化钠
溶解
不溶
碘
不溶
溶解
2、探究温度对物质溶解性的影响。
设计思路探究温度对硝酸钾溶解性影响。
思路分析:在实验中需要改变的因素是温度,需要保持不变的因素是(溶质与溶剂的种类跟用量不变)硝酸钾与水的用量不变。
实验步骤:向一定量水中加入足量硝酸钾使得溶液达到饱和;
实验现象:加热上述饱和溶液,硝酸钾溶解;冷却热饱和溶液,有硝酸钾晶体析出。
实验结论:溶剂保持不变,当升高温度时,硝酸钾晶体在水中溶解度增加,当降低温度时,溶解度会减少。
化学上用溶解度表示某种物质在某种溶剂中溶解性。
溶解度:指固体物质在一定温度下,100g溶剂中,达到饱和状态时所溶解的质量。
判断正误:1、氯化钠溶解度是36g。
2、20℃时,硝酸钾溶解度是30g。
3、 20℃时,100克水中最多能溶解36克氯钠,因此氯化钠溶解度是36克。
(补充:气体溶解度与温度、气压有关。低温高压溶解度大;高温低压溶解度小。)
物质溶解性三因素:物质本身、溶剂种类、温度。
同一种物质在水中溶解度随温度变化而变化,我们用溶解度曲线来表示这种关系。
P39页
补充:一般将20℃时,溶解度大于10克的称为易溶物质;溶解度为1-10克的称为可溶物质;溶解度为0.01-1克的称为微溶物质;溶解度小于0.01克的称为难溶物质。
从溶解度曲线我们可得到很多信息(一般的)
1、大多数物质溶解度随温度升高而增大。
2、不同物质在同一温度下溶解度不同。
3、同一物质在不同温度下溶解度不同。
4、有的物质溶解度受温度影响很大(即曲线很陡峭),如KNO3,采用降温结晶。
5、有的物质溶解度受温度影响小(即曲线平滑),如NaCl,采用蒸发结晶。
6、特殊物质:Ca(OH)2,溶解度随温度升高而降低。
P40三、粗盐的提纯
海水“晒盐”只能得到粗盐,含有可溶性杂质(如:氯化镁、氯化钙等)和不溶性杂质(如:泥沙等),必须要对粗盐进行分离提纯,才能供给人们日常使用和工业生产。
粗盐提纯过程:粗盐溶于水,过滤除去难溶性杂质,再蒸发结晶得到比较纯净的食盐晶体,但是依然含有很多可溶性杂质,利用化学方法将它们除去。
除去食盐中可溶性杂质方法
除去难溶性杂质后的食盐水中还含有SO42-、Ca2+、Mg2+等杂质离子,除去这些离子的过程如下:
1、先加入过量BaCl2(除去SO42- );
2、然后加入过量NaOH(除去Mg2+ );
3、之后加入过量Na2CO3(除去Ca2+ 和多余的BaCl2 );
4、再后加入适量HCl(除去多余的NaOH 、 Na2CO3 );
5、最后蒸发结晶即可。
上述粗盐中可溶性杂质去除过程,实质:
①Ba2+ + SO42- = BaSO4↓
②2OH- + Mg2+ = Mg(OH)2 ↓
③CO32- + Ca2+ = CaCO3 ↓
④CO32- + Ba2+ = BaCO3 ↓
⑤2H+ + CO32- = H2O + CO2↑
6、H+ +OH— = H2O
第2步与第3步可以对调位置,其余不可以。
上节课我们已经知道海水中有丰富的食盐资源,那么具体怎么把盐从海水中“捞”出来呢?
一、海水“晒盐”的过程
目前,从海水中提取食盐的方法主要是“盐田法”(也称太阳能蒸发法)
盐田分两部分:蒸发池、结晶池。将海水引入蒸发池,经日晒蒸发水到一定程度时,再导入结晶池,继续日晒得到饱和食盐溶液,再晒就析出食盐,此时的晶体就是“粗盐”,剩余的液体称为母液(也称苦卤),可以从中提取多种化工原料。
海水
蒸发池
结晶池
粗盐
母液
活动:取少量不饱和氯化钠溶液,滴在洁净的玻璃片上,用电热吹风机向玻璃片上的溶液吹热风,管察现象。(应该能观察到有盐析出)
思考:1、上述过程,氯化钠溶液从不饱和变为饱和的途径是什么?你能够从现象上判断溶液何时饱和吗?
2、你认为哪些自然条件有利于海水“晒盐”?为什么?
固体物质从它的饱和溶液中以晶体的形式析出的过程叫结晶。结晶分为两种:蒸发结晶、降温结晶。
像海水“晒盐”这样,经过日晒、风吹等,使溶剂不断减少,溶质质量分数逐渐增大,直至形成饱和溶液,继而析出晶体,就是蒸发结晶。
结晶
蒸发结晶
降温结晶
蒸发结晶:适用于溶解度受温度影响小的物质,通过升高温度蒸发水分而结晶。例如:氯化钠NaCl。
降温结晶:适用于溶解度受温度大的物质,通过降低温度使溶解度减小而结晶。例如:硝酸钾KNO3。
二、溶解度
溶解性是物质的重要物理性质,不同的物质溶解性不同,例如氯化钠易溶于水,氢氧化钙微溶于水,而碳酸钙难溶于水。那物质溶解性到底和什么因素有关?
1、探究溶剂种类对物质溶解性的影响
实验结论:同种溶质在不同溶剂中溶解度不同。不同溶质在同种溶剂中溶解度不同
影响物质溶剂性因素
加入10ml水并震荡
加入10ml酒精并震荡
氯化钠
溶解
不溶
碘
不溶
溶解
2、探究温度对物质溶解性的影响。
设计思路探究温度对硝酸钾溶解性影响。
思路分析:在实验中需要改变的因素是温度,需要保持不变的因素是(溶质与溶剂的种类跟用量不变)硝酸钾与水的用量不变。
实验步骤:向一定量水中加入足量硝酸钾使得溶液达到饱和;
实验现象:加热上述饱和溶液,硝酸钾溶解;冷却热饱和溶液,有硝酸钾晶体析出。
实验结论:溶剂保持不变,当升高温度时,硝酸钾晶体在水中溶解度增加,当降低温度时,溶解度会减少。
化学上用溶解度表示某种物质在某种溶剂中溶解性。
溶解度:指固体物质在一定温度下,100g溶剂中,达到饱和状态时所溶解的质量。
判断正误:1、氯化钠溶解度是36g。
2、20℃时,硝酸钾溶解度是30g。
3、 20℃时,100克水中最多能溶解36克氯钠,因此氯化钠溶解度是36克。
(补充:气体溶解度与温度、气压有关。低温高压溶解度大;高温低压溶解度小。)
物质溶解性三因素:物质本身、溶剂种类、温度。
同一种物质在水中溶解度随温度变化而变化,我们用溶解度曲线来表示这种关系。
P39页
补充:一般将20℃时,溶解度大于10克的称为易溶物质;溶解度为1-10克的称为可溶物质;溶解度为0.01-1克的称为微溶物质;溶解度小于0.01克的称为难溶物质。
从溶解度曲线我们可得到很多信息(一般的)
1、大多数物质溶解度随温度升高而增大。
2、不同物质在同一温度下溶解度不同。
3、同一物质在不同温度下溶解度不同。
4、有的物质溶解度受温度影响很大(即曲线很陡峭),如KNO3,采用降温结晶。
5、有的物质溶解度受温度影响小(即曲线平滑),如NaCl,采用蒸发结晶。
6、特殊物质:Ca(OH)2,溶解度随温度升高而降低。
P40三、粗盐的提纯
海水“晒盐”只能得到粗盐,含有可溶性杂质(如:氯化镁、氯化钙等)和不溶性杂质(如:泥沙等),必须要对粗盐进行分离提纯,才能供给人们日常使用和工业生产。
粗盐提纯过程:粗盐溶于水,过滤除去难溶性杂质,再蒸发结晶得到比较纯净的食盐晶体,但是依然含有很多可溶性杂质,利用化学方法将它们除去。
除去食盐中可溶性杂质方法
除去难溶性杂质后的食盐水中还含有SO42-、Ca2+、Mg2+等杂质离子,除去这些离子的过程如下:
1、先加入过量BaCl2(除去SO42- );
2、然后加入过量NaOH(除去Mg2+ );
3、之后加入过量Na2CO3(除去Ca2+ 和多余的BaCl2 );
4、再后加入适量HCl(除去多余的NaOH 、 Na2CO3 );
5、最后蒸发结晶即可。
上述粗盐中可溶性杂质去除过程,实质:
①Ba2+ + SO42- = BaSO4↓
②2OH- + Mg2+ = Mg(OH)2 ↓
③CO32- + Ca2+ = CaCO3 ↓
④CO32- + Ba2+ = BaCO3 ↓
⑤2H+ + CO32- = H2O + CO2↑
6、H+ +OH— = H2O
第2步与第3步可以对调位置,其余不可以。
同课章节目录
- 第七单元 常见的酸和碱
- 第一节 酸及其性质
- 第二节 碱及其性质
- 第三节 溶液的酸碱性
- 第四节 酸碱中和反应
- 到实验室去:探究酸和碱的化学性质
- 第八单元 海水中的化学
- 第一节 海洋化学资源
- 第二节 海水“晒盐“
- 第三节 海水“制碱“
- 到实验室去:粗盐中难溶性杂质的去除
- 第九单元 金属
- 第一节 常见的金属材料
- 第二节 金属的化学性质
- 第三节 钢铁的锈蚀与防护
- 到实验室去 探究金属的性质
- 第十单元 化学与健康
- 第一节 食物中的有机物
- 第二节 化学元素与人体健康
- 第三节 远离有毒物质
- 第十一单元 化学与社会发展
- 第一节 化学与能源开发
- 第二节 化学与材料研制
- 第三节 化学与农业生产
- 第四节 化学与环境保护
