河北省巨鹿中学2020-2021学年高一下学期3月第一次月考化学试卷 Word版含答案
文档属性
| 名称 | 河北省巨鹿中学2020-2021学年高一下学期3月第一次月考化学试卷 Word版含答案 |  | |
| 格式 | doc | ||
| 文件大小 | 295.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-04-19 20:23:28 | ||
图片预览



文档简介
巨鹿中学2020-2021第二学期第一次月考
高一化学试卷
总分100分,考试时间75分钟
注意事项:
1.答卷前,考生务必将自己的班级、姓名和准考证号填写在答题卡上。
2.选择题在选出答案后,用2B铅笔把答题卡上对应题目选项的答案涂黑,如需改动,用橡皮擦干净后,再选涂其他答案;非选择题必须用黑色字迹钢笔或签字笔写在答题卡上,写在试卷上无效。
3.考生必须保持答题卡的整洁。考试结束后,将答题卡交回。
可能用到的相对原子质量:H 1 C 12 N 14 O 16 S 32 Cl 35.5 Cu 64 Zn 65 Ba 137
选择题:本题共10小题,每小题2分,共20分。在每小题给出的四个选项中,只有一项符合题目要求。
1.化学与人类生产、生活、科研密切相关,下列有关说法正确的是
A.“神州十一号”宇宙飞船返回舱表面使用的高温结构陶瓷的主要成分是硅酸盐
B.我国提出网络强国战术,光缆线路总长超过三千万公里,光缆的主要成分是晶体硅
C.手机、电脑中使用的锂电池属于一次电池
D.“煤改气”可以减少SO2等有害物质的排放量,有利于打赢蓝天保卫战
2.下列变化属于吸热反应的是
A.氨气液化 B.生石灰溶于水
C.镁与稀盐酸反应 D.Ba(OH)2·8H2O与NH4Cl的反应
3.下列试剂不需要保存在棕色试剂瓶中的是
A.浓氨水 B.浓硝酸 C.浓硫酸 D.新制氯水
4.下列气体中,可以用排水法收集的是
A.NO B.NO2 C.Cl2 D.NH3
5.石墨在一定条件下转化为金刚石时,要吸收能量。下列说法正确的是
A.1 mol C(金刚石)比1 mol C(石墨)的总能量高
B.等质量的石墨和金刚石完全燃烧释放的热量相同
C.金刚石转化成石墨是吸热反应
D.金刚石比石墨稳定
6.下列反应中,硫元素表现出氧化性的是
A.稀硫酸与锌粒反应 B.SO2使紫色的KMnO4溶液褪色
C.H2S在空气中燃烧 D.浓硫酸与碳反应
7.下列转化不能通过一步反应完成的是
A.N2→NO B. SiO2→Na2SiO3 C.S→SO3 D.SiO2→Si
8.下列关于氮及其化合物的说法不正确的是
A.氮氧化物以及它们在大气中发生反应的生成物溶于雨水会形成酸雨,导致雨水的 pH
小于 5.6
B.1 mol N2 和3 mol H2 充分反应能生成2 mol NH3
C.在稀硫酸中加入铜粉,铜粉不溶解,再加入Cu(NO3)2固体,铜粉逐渐溶解
D.碳酸氢铵俗称碳铵,是常见的铵盐之一,应避免与碱性肥料混合施用
9.几位同学用相同大小的铜片和锌片为电极研究水果电池,得到的实验数据如下表所示,下列说法不正确的是
实验编号 水果种类 电极间距离/cm 电流大小/?A
① 西红柿 1 98.7
② 西红柿 2 72.5
③ 苹?果 2 7.2
A.该实验的目的是探究水果种类和电极间距离对水果电池电流大小的影响
B.能表明水果种类对电流大小有影响的实验编号是②和③
C.上述装置中,锌片作负极,电极反应为:Zn + 2e-=== Zn2+
D.其他条件相同时,改变电极插入水果的深度可能影响水果电池电流大小
10.将铜片、锌片和CuSO4溶液组装成原电池装置,当导线中有0.5 mol电子通过时,下列说法不正确的是
A.溶液中SO42- 移向锌电极
B.铜片作正极,Cu在正极发生还原反应
C.锌片质量减少16.25 g,铜片质量增加16 g
电子由锌片通过导线流向铜片
选择题:本题共5小题,每小题4分,共20分。在每小题给出的四个选项中,有一个或两个选项符合题目要求。若正确答案只包括一个选项,多选时,该小题得0分;若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得4分,但只要选错一个,得0分。
11.欲除去粗盐水中含有的可溶性杂质CaCl2、MgCl2、Na2SO4,下列所选试剂及操作顺序正确的是
A.过量BaCl2溶液→过量NaOH溶液→过量Na2CO3溶液→过滤→适量稀盐酸
B.过量NaOH溶液→过量BaCl2溶液→过量Na2CO3溶液→ 过滤→适量稀盐酸
C.过量Na2CO3溶液→过量NaOH溶液→过量BaCl2溶液→适量稀盐酸→ 过滤
D.过量BaCl2溶液→过量Na2CO3溶液→过量NaOH溶液→ 适量稀盐酸→ 过滤
12.根据下列实验操作和现象得出的结论正确的是
选项 实验操作和现象 结论
A 取少量试液于试管中,加入NaOH稀溶液,湿润的红色石蕊试纸未变蓝 溶液中一定不含有NH4+
B 将气体通入到澄清石灰水中,澄清石灰水变浑浊 气体中一定含有CO2
C 将带火星的木条伸入充满NO2气体的集气瓶中,木条复燃 NO2支持燃烧
D 将蘸有浓氨水的玻璃棒靠近装有浓硝酸的试剂瓶瓶口,瓶口出现白烟 白烟为NH4NO3
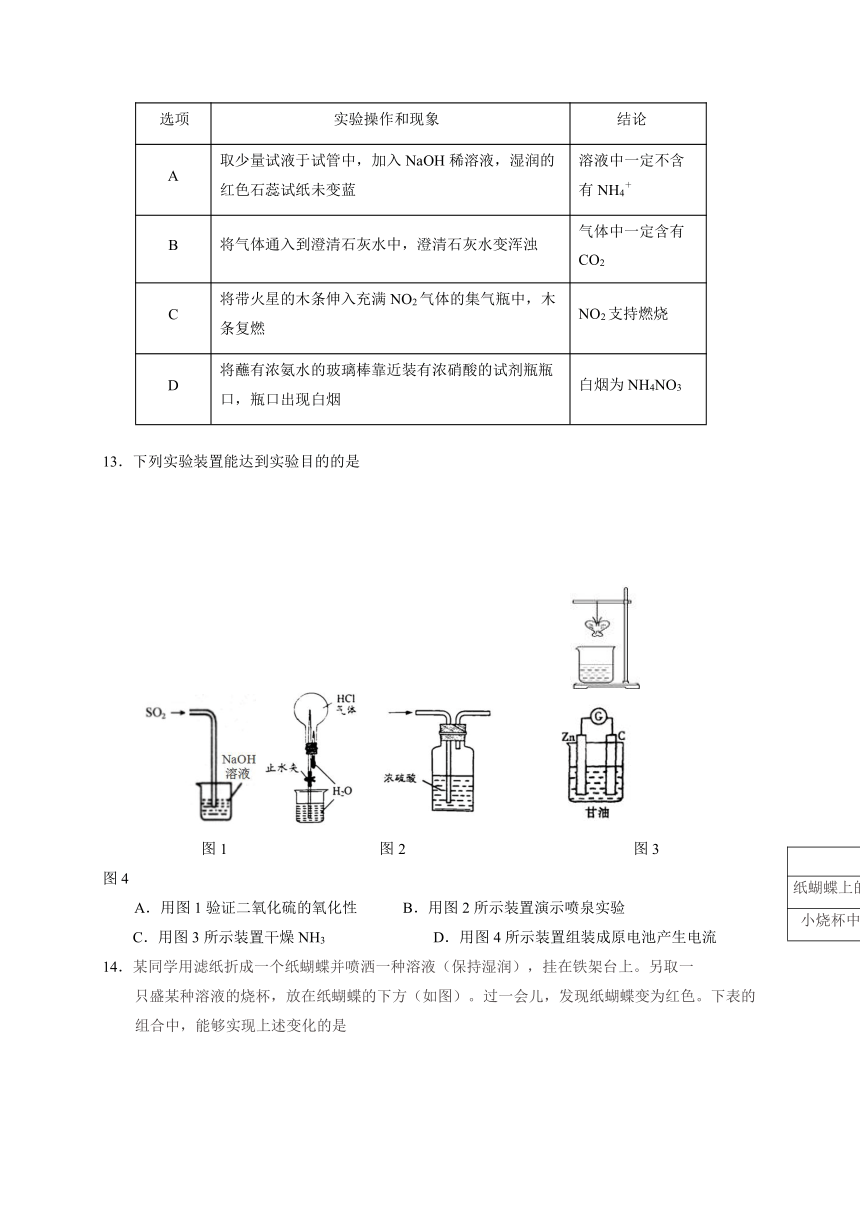
13.下列实验装置能达到实验目的的是
图1 图2 图3 图4
A.用图1验证二氧化硫的氧化性 B.用图2所示装置演示喷泉实验
A B C D
纸蝴蝶上的喷洒液 酚酞 酚酞 石蕊 石蕊
小烧杯中的溶液 浓氨水 NaOH溶液 浓盐酸 浓硫酸
C.用图3所示装置干燥NH3 D.用图4所示装置组装成原电池产生电流
14.某同学用滤纸折成一个纸蝴蝶并喷洒一种溶液(保持湿润),挂在铁架台上。另取一
只盛某种溶液的烧杯,放在纸蝴蝶的下方(如图)。过一会儿,发现纸蝴蝶变为红色。下表的组合中,能够实现上述变化的是
15.向 50 mL 18.4 mol·L-1 H2SO4 溶液中加入足量的铜片并加热,充分反应后,被还原的 H2SO4的物质的量为
A.0.92 mol B.0.46 mol ~ 0.92 mol C.0.46 mol D.小于 0.46 mol
三、非选择题:共60分。
16.(13分)某化学兴趣小组探究Na2SO3固体的热分解产物。
通过查阅资料可知:① 4Na2SO3 Na2S + 3Na2SO4 。
② Na2S能与S反应生成Na2Sx,Na2Sx与酸反应生成S和H2S。
③ BaS易溶于水。回答下面问题:
(1)硫元素在周期表的位置是 ,写出Na2S的电子式 。
(2)Na2SO3溶液易被空气中的O2氧化,其氧化产物的化学式是 。
(3)隔绝空气条件下,加热无水Na2SO3固体得到黄色固体A,过程中未检测到气体生成。黄色固体A加水得到浊液,放置得无色溶液B。
① 检验分解产物Na2S:取少量溶液B,向其中滴加CuSO4溶液,产生黑色沉淀,证实有S2-。该反应的离子方程式为 。
② 黄色固体A中因为生成少量S单质而成黄色,加水得到浊液,放置得无色溶液B。用化学方程式表示浊液变澄清的原因是 。
③ 检验分解产物Na2SO4:
步骤一:另取少量溶液B,加入足量盐酸,生成有臭鸡蛋气味的气体(H2S)和少量浅黄色沉淀,写出该步骤中涉及到的化学反应的离子方程式 _______ 。
步骤二:利用离心机离心沉降(固液分离)后, (填操作和现象),可证实分解产物中含有SO42-。
17.(15分)有关物质的转化关系如图所示(反应条件和部分产物未列出)。A是气态氢化物,C和D的摩尔质量相差16 g·mol-1,G是一种紫红色金属单质。
回答下面问题:
(1)若C是形成酸雨的主要大气污染物之一,能使品红溶液褪色,工业上常用于漂白纸浆、毛、丝等。
① 写出反应④的化学方程式 。
② 在A和C的反应中氧化产物和还原产物的质量之比为 。
③ 已知反应②是可逆反应,写出其逆反应的化学方程式 。
(2)若0.5 mol A中含有5 NA个电子,D是一种红棕色气体。
① D的化学式是 。
② 写出反应①的化学方程式 。
若反应中有1 mol A被氧化,转移电子为 mol。
③ 写出反应④的离子方程式 。
由于E的浓度控制不准确,结果得到物质的量之比为1:1的C和D的混合气体2.24 L(标况下),被还原的硝酸是 mol,溶解的Cu的质量是 g。
(12分)焦亚硫酸钠(Na2S2O5)是常用的抗氧化剂,在空气中、受热时均易分解。实验室制备少量Na2S2O5的方法如下。回答下面问题:
(1)SO2的制备:实验室常用Na2SO3(固体粉末)+ H2SO4(浓)=== Na2SO4 +
SO2 ↑ + H2O来制备SO2。
① 该反应利用了浓硫酸的 性质。
A.强氧化性 B.吸水性 C.脱水性 D.强酸性
② 写出检验产生的气体为SO2的一般方法(写出操作过程和现象):
。
③ 下列装置适合用此反应制备SO2的是 。
(2)制备少量Na2S2O5:在不断搅拌下,控制反应温度在40℃左右,向Na2CO3过饱和溶液中通入SO2,实验装置如下图所示。
当溶液pH约为4时,停止反应,在20℃左右静置结晶。生成Na2S2O5的化学方程式为2NaHSO3 === Na2S2O5 + H2O
① 装置X中发生反应生成CO2气体,写出发生反应的化学方程式
。
② 装置Y的作用是 。
③ 装置Z中发生反应的离子方程式为 。
(3)从S元素的价态分析焦亚硫酸钠(Na2S2O5)常用作抗氧化剂的原因是
。
19.(12分)下面有四种原电池装置:
回答下面问题:
(1)装置①的负极是 (填元素符号,下同) ,原电池反应的离子方程式为 。
(2)装置②的正极是 ,负极发生的电极反应为 。
(3)装置③中有电子流出的电极是 ,原电池反应的离子方程式为
。
(4)装置④发生还原反应的电极是 ,该极的电极反应为 。
20.(8分)称取a g (NH4)2SO4 和NH4Cl固体混合物配成溶液,逐滴加入一定浓度的Ba(OH)2溶液,产生的沉淀质量与加入Ba(OH)2溶液体积的关系如图:
已知:加入Ba(OH)2溶液200 mL时,溶液中NH4+ 恰好反应完毕。
回答下面问题:
(1)开始时发生反应的离子方程式为 。
(2)Ba(OH)2溶液的物质的量浓度为 mol·L-1。
(3)固体混合物中n(NH4+) : n(SO42-) : n(Cl-)= 。
(4)a= g。
2020—2021学年度二学期第一次月考
高一化学参考答案
1.D 2.D 3.C 4.A 5.A 6.D 7.C 8.B 9.C 10.B
11.AB 12.CD 13.B 14.AC 15.D
16.(13分)
(1)第三周期第ⅥA族 (1分) (1分) (2)Na2SO4 (1分)
(3)①Cu2+ + S2-=== CuS↓ (2分) ②Na2S + (x-1)S===Na2SX (2分)
③ S2-+ 2H+===H2S↑ (2分) SX2-+ 2H+===H2S↑ + (x-1)S↓ (2分)
向滤液中滴加BaCl2溶液少许,生成白色沉淀 (2分)
17.(15分)
(1)①Cu + 2H2SO4(浓) CuSO4 + SO2↑ + 2H2O (2分)
②2:1 (1分) ③2SO3 2SO2 + O2 (2分)
(2)①NO2 (1分) ②4NH3 + 5O2 4NO + 6H2O (2分) 5 (1分)
③3Cu + 8H+ + 2NO3-=== 3Cu2+ + 2NO↑+ 4H2O (2分) 0.1 (2分) 6.4 (2分)
18.(12分)
(1)①D (1分) ②将气体通入品红溶液中,品红褪色;加热又恢复为红色,证明为SO2气体 (2分) ③B (1分)
(2)①Na2CO3 + 2SO2 + H2O === 2NaHSO3 + CO2 (2分) ②安全瓶,防倒吸 (1分)
③SO2 + 2OH-=== SO32-+ H2O (2分) CO2 + 2OH-=== CO32-+ H2O (2分)
(3)焦亚硫酸钠(Na2S2O5)中S为+4价,易被氧化为+6价,因此焦亚硫酸钠(Na2S2O5)有较强的还原性,常做抗氧化剂 (1分)
19.(12分)
(1)Mg (1分) Mg + 2H+ ===Mg2+ + H2↑ (2分)
(2)Mg (1分) Al + 4OH--3e-===AlO2-+ 2H2O (2分)
(3)Cu (1分) Cu + 4H+ + 2NO3-===Cu2++ 2NO2↑ + 2H2O (2分)
(4)Cu (1分) O2 + 2H2O + 4e-===4OH- (2分)
20.(8分)
(1)2NH4+ + SO42-+ Ba2+ + 2OH-=== BaSO4↓ + 2NH3·H2O (2分)
(2)0.1 (2分) (3)4:1:2 (2分) (4)2.39 (2分)
高一化学试卷
总分100分,考试时间75分钟
注意事项:
1.答卷前,考生务必将自己的班级、姓名和准考证号填写在答题卡上。
2.选择题在选出答案后,用2B铅笔把答题卡上对应题目选项的答案涂黑,如需改动,用橡皮擦干净后,再选涂其他答案;非选择题必须用黑色字迹钢笔或签字笔写在答题卡上,写在试卷上无效。
3.考生必须保持答题卡的整洁。考试结束后,将答题卡交回。
可能用到的相对原子质量:H 1 C 12 N 14 O 16 S 32 Cl 35.5 Cu 64 Zn 65 Ba 137
选择题:本题共10小题,每小题2分,共20分。在每小题给出的四个选项中,只有一项符合题目要求。
1.化学与人类生产、生活、科研密切相关,下列有关说法正确的是
A.“神州十一号”宇宙飞船返回舱表面使用的高温结构陶瓷的主要成分是硅酸盐
B.我国提出网络强国战术,光缆线路总长超过三千万公里,光缆的主要成分是晶体硅
C.手机、电脑中使用的锂电池属于一次电池
D.“煤改气”可以减少SO2等有害物质的排放量,有利于打赢蓝天保卫战
2.下列变化属于吸热反应的是
A.氨气液化 B.生石灰溶于水
C.镁与稀盐酸反应 D.Ba(OH)2·8H2O与NH4Cl的反应
3.下列试剂不需要保存在棕色试剂瓶中的是
A.浓氨水 B.浓硝酸 C.浓硫酸 D.新制氯水
4.下列气体中,可以用排水法收集的是
A.NO B.NO2 C.Cl2 D.NH3
5.石墨在一定条件下转化为金刚石时,要吸收能量。下列说法正确的是
A.1 mol C(金刚石)比1 mol C(石墨)的总能量高
B.等质量的石墨和金刚石完全燃烧释放的热量相同
C.金刚石转化成石墨是吸热反应
D.金刚石比石墨稳定
6.下列反应中,硫元素表现出氧化性的是
A.稀硫酸与锌粒反应 B.SO2使紫色的KMnO4溶液褪色
C.H2S在空气中燃烧 D.浓硫酸与碳反应
7.下列转化不能通过一步反应完成的是
A.N2→NO B. SiO2→Na2SiO3 C.S→SO3 D.SiO2→Si
8.下列关于氮及其化合物的说法不正确的是
A.氮氧化物以及它们在大气中发生反应的生成物溶于雨水会形成酸雨,导致雨水的 pH
小于 5.6
B.1 mol N2 和3 mol H2 充分反应能生成2 mol NH3
C.在稀硫酸中加入铜粉,铜粉不溶解,再加入Cu(NO3)2固体,铜粉逐渐溶解
D.碳酸氢铵俗称碳铵,是常见的铵盐之一,应避免与碱性肥料混合施用
9.几位同学用相同大小的铜片和锌片为电极研究水果电池,得到的实验数据如下表所示,下列说法不正确的是
实验编号 水果种类 电极间距离/cm 电流大小/?A
① 西红柿 1 98.7
② 西红柿 2 72.5
③ 苹?果 2 7.2
A.该实验的目的是探究水果种类和电极间距离对水果电池电流大小的影响
B.能表明水果种类对电流大小有影响的实验编号是②和③
C.上述装置中,锌片作负极,电极反应为:Zn + 2e-=== Zn2+
D.其他条件相同时,改变电极插入水果的深度可能影响水果电池电流大小
10.将铜片、锌片和CuSO4溶液组装成原电池装置,当导线中有0.5 mol电子通过时,下列说法不正确的是
A.溶液中SO42- 移向锌电极
B.铜片作正极,Cu在正极发生还原反应
C.锌片质量减少16.25 g,铜片质量增加16 g
电子由锌片通过导线流向铜片
选择题:本题共5小题,每小题4分,共20分。在每小题给出的四个选项中,有一个或两个选项符合题目要求。若正确答案只包括一个选项,多选时,该小题得0分;若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得4分,但只要选错一个,得0分。
11.欲除去粗盐水中含有的可溶性杂质CaCl2、MgCl2、Na2SO4,下列所选试剂及操作顺序正确的是
A.过量BaCl2溶液→过量NaOH溶液→过量Na2CO3溶液→过滤→适量稀盐酸
B.过量NaOH溶液→过量BaCl2溶液→过量Na2CO3溶液→ 过滤→适量稀盐酸
C.过量Na2CO3溶液→过量NaOH溶液→过量BaCl2溶液→适量稀盐酸→ 过滤
D.过量BaCl2溶液→过量Na2CO3溶液→过量NaOH溶液→ 适量稀盐酸→ 过滤
12.根据下列实验操作和现象得出的结论正确的是
选项 实验操作和现象 结论
A 取少量试液于试管中,加入NaOH稀溶液,湿润的红色石蕊试纸未变蓝 溶液中一定不含有NH4+
B 将气体通入到澄清石灰水中,澄清石灰水变浑浊 气体中一定含有CO2
C 将带火星的木条伸入充满NO2气体的集气瓶中,木条复燃 NO2支持燃烧
D 将蘸有浓氨水的玻璃棒靠近装有浓硝酸的试剂瓶瓶口,瓶口出现白烟 白烟为NH4NO3
13.下列实验装置能达到实验目的的是
图1 图2 图3 图4
A.用图1验证二氧化硫的氧化性 B.用图2所示装置演示喷泉实验
A B C D
纸蝴蝶上的喷洒液 酚酞 酚酞 石蕊 石蕊
小烧杯中的溶液 浓氨水 NaOH溶液 浓盐酸 浓硫酸
C.用图3所示装置干燥NH3 D.用图4所示装置组装成原电池产生电流
14.某同学用滤纸折成一个纸蝴蝶并喷洒一种溶液(保持湿润),挂在铁架台上。另取一
只盛某种溶液的烧杯,放在纸蝴蝶的下方(如图)。过一会儿,发现纸蝴蝶变为红色。下表的组合中,能够实现上述变化的是
15.向 50 mL 18.4 mol·L-1 H2SO4 溶液中加入足量的铜片并加热,充分反应后,被还原的 H2SO4的物质的量为
A.0.92 mol B.0.46 mol ~ 0.92 mol C.0.46 mol D.小于 0.46 mol
三、非选择题:共60分。
16.(13分)某化学兴趣小组探究Na2SO3固体的热分解产物。
通过查阅资料可知:① 4Na2SO3 Na2S + 3Na2SO4 。
② Na2S能与S反应生成Na2Sx,Na2Sx与酸反应生成S和H2S。
③ BaS易溶于水。回答下面问题:
(1)硫元素在周期表的位置是 ,写出Na2S的电子式 。
(2)Na2SO3溶液易被空气中的O2氧化,其氧化产物的化学式是 。
(3)隔绝空气条件下,加热无水Na2SO3固体得到黄色固体A,过程中未检测到气体生成。黄色固体A加水得到浊液,放置得无色溶液B。
① 检验分解产物Na2S:取少量溶液B,向其中滴加CuSO4溶液,产生黑色沉淀,证实有S2-。该反应的离子方程式为 。
② 黄色固体A中因为生成少量S单质而成黄色,加水得到浊液,放置得无色溶液B。用化学方程式表示浊液变澄清的原因是 。
③ 检验分解产物Na2SO4:
步骤一:另取少量溶液B,加入足量盐酸,生成有臭鸡蛋气味的气体(H2S)和少量浅黄色沉淀,写出该步骤中涉及到的化学反应的离子方程式 _______ 。
步骤二:利用离心机离心沉降(固液分离)后, (填操作和现象),可证实分解产物中含有SO42-。
17.(15分)有关物质的转化关系如图所示(反应条件和部分产物未列出)。A是气态氢化物,C和D的摩尔质量相差16 g·mol-1,G是一种紫红色金属单质。
回答下面问题:
(1)若C是形成酸雨的主要大气污染物之一,能使品红溶液褪色,工业上常用于漂白纸浆、毛、丝等。
① 写出反应④的化学方程式 。
② 在A和C的反应中氧化产物和还原产物的质量之比为 。
③ 已知反应②是可逆反应,写出其逆反应的化学方程式 。
(2)若0.5 mol A中含有5 NA个电子,D是一种红棕色气体。
① D的化学式是 。
② 写出反应①的化学方程式 。
若反应中有1 mol A被氧化,转移电子为 mol。
③ 写出反应④的离子方程式 。
由于E的浓度控制不准确,结果得到物质的量之比为1:1的C和D的混合气体2.24 L(标况下),被还原的硝酸是 mol,溶解的Cu的质量是 g。
(12分)焦亚硫酸钠(Na2S2O5)是常用的抗氧化剂,在空气中、受热时均易分解。实验室制备少量Na2S2O5的方法如下。回答下面问题:
(1)SO2的制备:实验室常用Na2SO3(固体粉末)+ H2SO4(浓)=== Na2SO4 +
SO2 ↑ + H2O来制备SO2。
① 该反应利用了浓硫酸的 性质。
A.强氧化性 B.吸水性 C.脱水性 D.强酸性
② 写出检验产生的气体为SO2的一般方法(写出操作过程和现象):
。
③ 下列装置适合用此反应制备SO2的是 。
(2)制备少量Na2S2O5:在不断搅拌下,控制反应温度在40℃左右,向Na2CO3过饱和溶液中通入SO2,实验装置如下图所示。
当溶液pH约为4时,停止反应,在20℃左右静置结晶。生成Na2S2O5的化学方程式为2NaHSO3 === Na2S2O5 + H2O
① 装置X中发生反应生成CO2气体,写出发生反应的化学方程式
。
② 装置Y的作用是 。
③ 装置Z中发生反应的离子方程式为 。
(3)从S元素的价态分析焦亚硫酸钠(Na2S2O5)常用作抗氧化剂的原因是
。
19.(12分)下面有四种原电池装置:
回答下面问题:
(1)装置①的负极是 (填元素符号,下同) ,原电池反应的离子方程式为 。
(2)装置②的正极是 ,负极发生的电极反应为 。
(3)装置③中有电子流出的电极是 ,原电池反应的离子方程式为
。
(4)装置④发生还原反应的电极是 ,该极的电极反应为 。
20.(8分)称取a g (NH4)2SO4 和NH4Cl固体混合物配成溶液,逐滴加入一定浓度的Ba(OH)2溶液,产生的沉淀质量与加入Ba(OH)2溶液体积的关系如图:
已知:加入Ba(OH)2溶液200 mL时,溶液中NH4+ 恰好反应完毕。
回答下面问题:
(1)开始时发生反应的离子方程式为 。
(2)Ba(OH)2溶液的物质的量浓度为 mol·L-1。
(3)固体混合物中n(NH4+) : n(SO42-) : n(Cl-)= 。
(4)a= g。
2020—2021学年度二学期第一次月考
高一化学参考答案
1.D 2.D 3.C 4.A 5.A 6.D 7.C 8.B 9.C 10.B
11.AB 12.CD 13.B 14.AC 15.D
16.(13分)
(1)第三周期第ⅥA族 (1分) (1分) (2)Na2SO4 (1分)
(3)①Cu2+ + S2-=== CuS↓ (2分) ②Na2S + (x-1)S===Na2SX (2分)
③ S2-+ 2H+===H2S↑ (2分) SX2-+ 2H+===H2S↑ + (x-1)S↓ (2分)
向滤液中滴加BaCl2溶液少许,生成白色沉淀 (2分)
17.(15分)
(1)①Cu + 2H2SO4(浓) CuSO4 + SO2↑ + 2H2O (2分)
②2:1 (1分) ③2SO3 2SO2 + O2 (2分)
(2)①NO2 (1分) ②4NH3 + 5O2 4NO + 6H2O (2分) 5 (1分)
③3Cu + 8H+ + 2NO3-=== 3Cu2+ + 2NO↑+ 4H2O (2分) 0.1 (2分) 6.4 (2分)
18.(12分)
(1)①D (1分) ②将气体通入品红溶液中,品红褪色;加热又恢复为红色,证明为SO2气体 (2分) ③B (1分)
(2)①Na2CO3 + 2SO2 + H2O === 2NaHSO3 + CO2 (2分) ②安全瓶,防倒吸 (1分)
③SO2 + 2OH-=== SO32-+ H2O (2分) CO2 + 2OH-=== CO32-+ H2O (2分)
(3)焦亚硫酸钠(Na2S2O5)中S为+4价,易被氧化为+6价,因此焦亚硫酸钠(Na2S2O5)有较强的还原性,常做抗氧化剂 (1分)
19.(12分)
(1)Mg (1分) Mg + 2H+ ===Mg2+ + H2↑ (2分)
(2)Mg (1分) Al + 4OH--3e-===AlO2-+ 2H2O (2分)
(3)Cu (1分) Cu + 4H+ + 2NO3-===Cu2++ 2NO2↑ + 2H2O (2分)
(4)Cu (1分) O2 + 2H2O + 4e-===4OH- (2分)
20.(8分)
(1)2NH4+ + SO42-+ Ba2+ + 2OH-=== BaSO4↓ + 2NH3·H2O (2分)
(2)0.1 (2分) (3)4:1:2 (2分) (4)2.39 (2分)
同课章节目录
