2020-2021学年 鲁教版化学 九年级下册 9.1常见的金属材料课件(29张PPT)
文档属性
| 名称 | 2020-2021学年 鲁教版化学 九年级下册 9.1常见的金属材料课件(29张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 8.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-04-19 00:00:00 | ||
图片预览







文档简介
第九单元第一节
常见的金属材料
学习目标
1.了解常见金属的物理性质,认识金属材料在生产、生活和社会发展中的重要作用。
2.知道在金属中加入其他元素可以改变金属材料的性能,知道生铁和钢等重要合金。
3.知道一些常见金属(铁、铝等)矿物;知道可用铁矿石炼铁。
大多为银白色
常温下一般为固体
金属光泽
一般较大
一般较大
良好
良好
一般较高
良好
1. 颜色
2. 光泽
3. 状态
4. 密度
5. 硬度
6. 熔、沸点
7. 延展性
8. 导电性
9. 导热性
铜(紫红色)、金(黄色)
汞(液态)
一、金属的物理性质
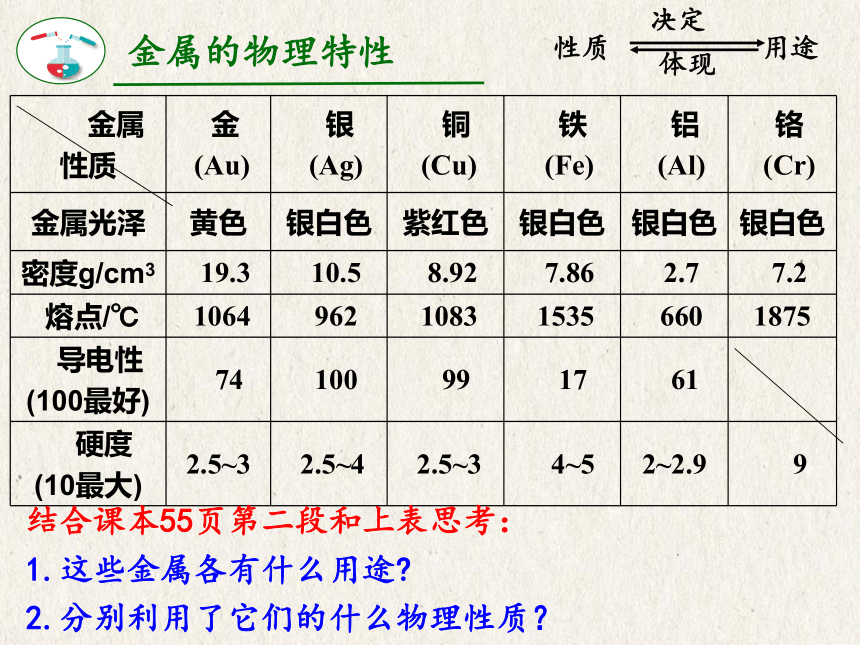
{5940675A-B579-460E-94D1-54222C63F5DA} 金属
性质
金
(Au)
银
(Ag)
铜
(Cu)
铁
(Fe)
铝
(Al)
铬
(Cr)
金属光泽
黄色
银白色
紫红色
银白色
银白色
银白色
密度g/cm3
19.3
10.5
8.92
7.86
2.7
7.2
熔点/℃
1064
962
1083
1535
660
1875
导电性
(100最好)
74
100
99
17
61
硬度
(10最大)
2.5~3
2.5~4
2.5~3
4~5
2~2.9
9
结合课本55页第二段和上表思考:
1.这些金属各有什么用途?
2.分别利用了它们的什么物理性质?
性质 用途
决定
体现
金属的物理特性
1.导电、导热性最好的金属──
2.硬度最高的金属──
3.熔点最高的金属──
4.熔点最低的金属──
5.延性最好的金属──
6.展性最好的金属──
7.人体中含量最高的金属元素──
8.目前世界年产量最高的金属──
9.地壳中含量最高的金属元素──
铝
钙
银
铁
铬
汞
钨
金
铂
(用于电子制造业)
(做灯丝)
(做温度计)
(可抽成铂丝)
(可拓成金箔)
金属之最
1.为什么菜刀、镰刀、锤子等用铁制而不用铝制?
铝的硬度小,而铁的硬度大
2.银的导电性比铜好,为什么电线一般用铜制而不用银制?
银的价格比铜高许多
3.为什么灯泡里的灯丝用钨制而不用锡制?
钨的熔点高,锡的熔点低
4.为什么有的铁制品如水龙头等要镀铬?
铬硬度大, 耐磨、美观,又防锈
思考
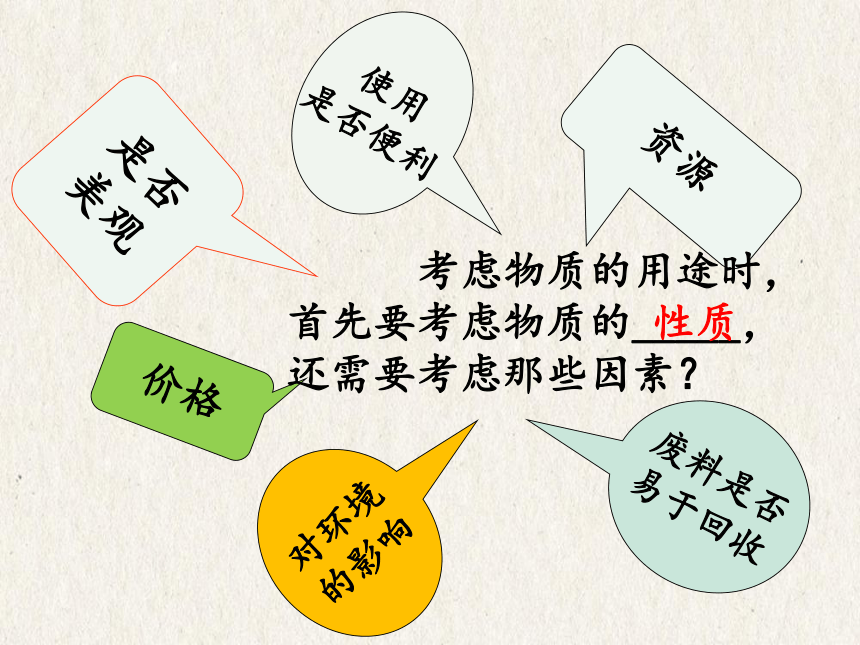
使用
是否便利
资源
废料是否
易于回收
价格
是否
美观
对环境
的影响
考虑物质的用途时,首先要考虑物质的_____,
还需要考虑那些因素?
性质
后母戊鼎是中国目前发现的最重的青铜器
含铜84.77%
含锡11.64%
含铅27.9%
铝镁合金
钛铝钒合金
铁铬镍合金
铁锰碳合金
(1)合金中一定有金属吗?
(2)合金中一定不含非金属吗?
(3)合金是金属材料吗?
2.合金是混合物还是化合物?
3.生活中有哪些常见的合金?
4.合金的性能优于纯金属吗?
合金中一定有金属
合金中可能有非金属
合金是金属材料
合金是混合物
自主学习—课本第56页回答:
1.什么是合金?
在某种金属中加热熔合其他金属或非金属后形成的、具有金属特性的物质。
二、合金
(含碳量不同)
生铁
钢
(含碳:2%-4.3%)
(含碳:0.03%-2%)
常见合金
铁合金
铜合金
黄铜
青铜
(铜、锌)
(铜、锡)
铝合金
钛合金
黄铜制成的硬币
钛合金假牙
铝合金把手
不锈钢锅
生铁锅
飞机的外壳是用铝、镁、铜和其他一些能增加强度的微量金属制成的金属材料----铝合金。
为支持飞机的重量,起落架必须足够牢靠,是由钛、钒、铁和铝组成的金属材料----钛合金制成的。
—合金与组成它的纯金属性质的不同
性质
实验方案
实验现象
实验结论
颜色
硬度
熔点
合金比纯金属的颜色更鲜艳
合金比纯金属的硬度更大
合金比纯金属的熔点低
观察铜片与黄铜片、锡片与焊锡的颜色与光泽
将铜片与黄铜片、锡片与焊锡互相刻划,比较它们的硬度
将锡、铅和焊锡放在铁片上,用酒精灯加热中心部分,观察熔化的难易
金属材料:铜片,黄铜片,锡,铅,焊锡(锡铅合金)
铜是紫红色,黄铜是黄色。锡是银白色,铅是灰白色,焊锡是亮白色
铜片和锡片上的刻痕更深
焊锡先开始熔化
实验探究
【小结】合金与纯金属相比较,
颜色更鲜艳、硬度更大,熔点更低,耐腐蚀性更强。
1.铁勺、不锈钢勺谁不易生锈?这说明了什么?
2.为什么合金与纯金属的性质存在差异?
因为纯金属变为其合金后,不仅组成发生了变化,其内部结构也发生了变化,从而引起性质的变化。
结构 性质
决定
体现
—合金与组成它的纯金属性质的不同
实验探究
1.“垃圾是放错了位置的资源”应分类回收,生活中废弃的铁锅、铝制易拉罐、铜导线等,可以归为一类回收,它们属于( )
A.金属或合金 B.氧化物 C.盐 D.碱
A
2.我国第四套人民币从1999年开始发行,一元为钢芯镀镍,伍角币为钢芯镀铜合金,一角币铝合金或不锈钢,选择铸造硬币的材料不需要考虑的因素是( )
A.金属的硬度 B.金属的耐腐蚀性
C.金属的导电性 D.金属的价格与硬币面值的吻合
C
反馈练习
1.在冶金工业上
黑色金属
有色金属
(铁、铬、锰)
2.按照密度大小
重金属
轻金属
3.按含量多少、分布特点、提取难易等
常见金属
稀有金属
金属的分类和分布
铁矿是钢铁工业的“粮食”
请阅读课本58页1-3段,了解金属以什么形式存在于自然界中,思考下列问题:
三、金属矿物及其冶炼
1. 哪些金属以单质形式存在于自然界中?
2. 哪些金属以化合物的形式存在于自然界中?
3. 铁元素以什么形式存在于自然界中?
少数不活泼的金属如金、银、铂等。
大多以化合物形式存在于各种铁矿石中。
大多数金属如铝、铁等。
赤铁矿
黄铁矿(FeS2)
菱铁矿(FeCO3)
铁元素含量较低,污染环境
(Fe2O3)
磁铁矿
(Fe3O4)
铁元素含量较低
铁矿石炼铁
如何从铁矿石中得到铁呢?
以赤铁矿(主要成分Fe2O3)为例。
Fe2O3 Fe
高温
CO
红色粉末变成黑色,
澄清石灰水变浑浊。
实验现象:
铁矿石炼铁---实验室模拟炼铁
1.如何判断反应中生成了什么物质?
2.右边酒精灯的作用?
3.实验中先通一氧化碳还是先点燃酒精喷灯?为什么?
4.实验结束时,先停止通一氧化碳还是先熄灭酒精喷灯?为什么?
排净装置中的空气,防止加热时装置爆炸。
防止生成的铁在高温时被氧化。
使一氧化碳燃烧,防止逸到空气中污染环境。
澄清石灰水变浑浊,证明生成了CO2
红色粉末变成黑色,并能用磁铁吸引,证明生成了Fe
反思与交流
CO循环利用
反应之前先____,
空气排净再____,
否则 。
反应结束先____,
装置冷却____停,
否则金属又被 。
相关的化学方程式:
CO2 + Ca(OH)2 CaCO3 ↓+ H2O
Fe2O3 + 3CO 2Fe + 3CO2
高温
2CO + O2 2CO2
点燃
通气
点灯
爆炸
撤灯
通气
氧化了
铁矿石炼铁
将下列步骤按正确的顺序排列起来( )
1.将适量的氧化铁装入硬质玻璃管并固定装置
2.通入一氧化碳(已验纯)气体
3.检查装置气密性
4.待玻璃管内固体冷却后停止通入一氧化碳
5.点燃酒精喷灯给氧化铁加热
6.待硬质玻璃管内红色物质完全变为黑色时停止加热
312564
跟踪练习
高温
还原反应
Fe2O3
3CO
2Fe
3CO2
+
+
还原剂
失氧
含氧化合物中的氧被夺去的反应属于还原反应。
作氧化剂
具有氧化性
得氧
氧化反应
作还原剂
具有还原性
氧化还原反应
配平:Fe2O3 + CO Fe + CO2
高温
A. H2+ CuO Cu+H2O
B. Fe2O3+2Al Al2O3+2Fe
2.判断下列反应中的还原剂。
高温
C. 2 C+ SiO2 Si +2CO
高温
4CO+ Fe3O4 3Fe+4CO2
高温
跟踪练习
CO得氧,作还原剂
Fe3O4 失氧,作氧化剂。
3
3
2
1.尝试写出磁铁矿(Fe3O4)炼铁的化学方程式
目前我们学过的工业上冶炼金属的方法有 。
、电解法
还原法
2Al2O3 4Al+3O2↑
通电
MgCl2 Mg+Cl2↑
通电
Fe2O3 + 3CO 2Fe + 3CO2
高温
小结
课堂小结
常见的金属材料
物理性质
合金
金属冶炼
共性
特性
定义
优点
用途
常见的矿石
工业炼铁
原理(氧化还原反应)
现象
注意事项
1.常见的铁矿石有磁铁矿(主要成分是_______ )赤铁矿(主要成分是__________ ).
其中用磁铁矿炼铁时发生反应的化学方程式为___________________________。
Fe3O4
Fe2O3
4CO+ Fe3O4 3Fe+4CO2
高温
课堂检测
2. 某学生改进一氧化碳还原氧化铁的实验装置
(1)若先给氧化铁加热,通入一氧化碳,可
能产生的后果是__________ 。
(2)写出A中发生反应的化学方程式_____
(3)装置B中产生的现象可判断反应是否开始发
生,则B中的试剂是(填名称)__________
(4)装置C的作用是____________________
发生爆炸
澄清石灰水
收集未反应的CO,防止污染空气
Fe2O3+ 3CO 2Fe + 3CO2
高温
课堂检测
3.某炼铁厂利用1000t磁铁矿(含Fe3O4 90%)可炼得含铁96%的生铁多少吨?(相对原子质量:Fe-56,O-16)
设可以炼出纯铁的质量为x
4CO + Fe3O4==== 3Fe + 4CO2
高温
232
168
900t
x
232
168
x
=
900t
x ≈651.7t
生铁的质量为:651.7t ÷ 96%≈ 678.9t
答:可以炼出678.9t生铁。
解:四氧化三铁的质量为1000t ×90%=900t
课堂检测
常见的金属材料
学习目标
1.了解常见金属的物理性质,认识金属材料在生产、生活和社会发展中的重要作用。
2.知道在金属中加入其他元素可以改变金属材料的性能,知道生铁和钢等重要合金。
3.知道一些常见金属(铁、铝等)矿物;知道可用铁矿石炼铁。
大多为银白色
常温下一般为固体
金属光泽
一般较大
一般较大
良好
良好
一般较高
良好
1. 颜色
2. 光泽
3. 状态
4. 密度
5. 硬度
6. 熔、沸点
7. 延展性
8. 导电性
9. 导热性
铜(紫红色)、金(黄色)
汞(液态)
一、金属的物理性质
{5940675A-B579-460E-94D1-54222C63F5DA} 金属
性质
金
(Au)
银
(Ag)
铜
(Cu)
铁
(Fe)
铝
(Al)
铬
(Cr)
金属光泽
黄色
银白色
紫红色
银白色
银白色
银白色
密度g/cm3
19.3
10.5
8.92
7.86
2.7
7.2
熔点/℃
1064
962
1083
1535
660
1875
导电性
(100最好)
74
100
99
17
61
硬度
(10最大)
2.5~3
2.5~4
2.5~3
4~5
2~2.9
9
结合课本55页第二段和上表思考:
1.这些金属各有什么用途?
2.分别利用了它们的什么物理性质?
性质 用途
决定
体现
金属的物理特性
1.导电、导热性最好的金属──
2.硬度最高的金属──
3.熔点最高的金属──
4.熔点最低的金属──
5.延性最好的金属──
6.展性最好的金属──
7.人体中含量最高的金属元素──
8.目前世界年产量最高的金属──
9.地壳中含量最高的金属元素──
铝
钙
银
铁
铬
汞
钨
金
铂
(用于电子制造业)
(做灯丝)
(做温度计)
(可抽成铂丝)
(可拓成金箔)
金属之最
1.为什么菜刀、镰刀、锤子等用铁制而不用铝制?
铝的硬度小,而铁的硬度大
2.银的导电性比铜好,为什么电线一般用铜制而不用银制?
银的价格比铜高许多
3.为什么灯泡里的灯丝用钨制而不用锡制?
钨的熔点高,锡的熔点低
4.为什么有的铁制品如水龙头等要镀铬?
铬硬度大, 耐磨、美观,又防锈
思考
使用
是否便利
资源
废料是否
易于回收
价格
是否
美观
对环境
的影响
考虑物质的用途时,首先要考虑物质的_____,
还需要考虑那些因素?
性质
后母戊鼎是中国目前发现的最重的青铜器
含铜84.77%
含锡11.64%
含铅27.9%
铝镁合金
钛铝钒合金
铁铬镍合金
铁锰碳合金
(1)合金中一定有金属吗?
(2)合金中一定不含非金属吗?
(3)合金是金属材料吗?
2.合金是混合物还是化合物?
3.生活中有哪些常见的合金?
4.合金的性能优于纯金属吗?
合金中一定有金属
合金中可能有非金属
合金是金属材料
合金是混合物
自主学习—课本第56页回答:
1.什么是合金?
在某种金属中加热熔合其他金属或非金属后形成的、具有金属特性的物质。
二、合金
(含碳量不同)
生铁
钢
(含碳:2%-4.3%)
(含碳:0.03%-2%)
常见合金
铁合金
铜合金
黄铜
青铜
(铜、锌)
(铜、锡)
铝合金
钛合金
黄铜制成的硬币
钛合金假牙
铝合金把手
不锈钢锅
生铁锅
飞机的外壳是用铝、镁、铜和其他一些能增加强度的微量金属制成的金属材料----铝合金。
为支持飞机的重量,起落架必须足够牢靠,是由钛、钒、铁和铝组成的金属材料----钛合金制成的。
—合金与组成它的纯金属性质的不同
性质
实验方案
实验现象
实验结论
颜色
硬度
熔点
合金比纯金属的颜色更鲜艳
合金比纯金属的硬度更大
合金比纯金属的熔点低
观察铜片与黄铜片、锡片与焊锡的颜色与光泽
将铜片与黄铜片、锡片与焊锡互相刻划,比较它们的硬度
将锡、铅和焊锡放在铁片上,用酒精灯加热中心部分,观察熔化的难易
金属材料:铜片,黄铜片,锡,铅,焊锡(锡铅合金)
铜是紫红色,黄铜是黄色。锡是银白色,铅是灰白色,焊锡是亮白色
铜片和锡片上的刻痕更深
焊锡先开始熔化
实验探究
【小结】合金与纯金属相比较,
颜色更鲜艳、硬度更大,熔点更低,耐腐蚀性更强。
1.铁勺、不锈钢勺谁不易生锈?这说明了什么?
2.为什么合金与纯金属的性质存在差异?
因为纯金属变为其合金后,不仅组成发生了变化,其内部结构也发生了变化,从而引起性质的变化。
结构 性质
决定
体现
—合金与组成它的纯金属性质的不同
实验探究
1.“垃圾是放错了位置的资源”应分类回收,生活中废弃的铁锅、铝制易拉罐、铜导线等,可以归为一类回收,它们属于( )
A.金属或合金 B.氧化物 C.盐 D.碱
A
2.我国第四套人民币从1999年开始发行,一元为钢芯镀镍,伍角币为钢芯镀铜合金,一角币铝合金或不锈钢,选择铸造硬币的材料不需要考虑的因素是( )
A.金属的硬度 B.金属的耐腐蚀性
C.金属的导电性 D.金属的价格与硬币面值的吻合
C
反馈练习
1.在冶金工业上
黑色金属
有色金属
(铁、铬、锰)
2.按照密度大小
重金属
轻金属
3.按含量多少、分布特点、提取难易等
常见金属
稀有金属
金属的分类和分布
铁矿是钢铁工业的“粮食”
请阅读课本58页1-3段,了解金属以什么形式存在于自然界中,思考下列问题:
三、金属矿物及其冶炼
1. 哪些金属以单质形式存在于自然界中?
2. 哪些金属以化合物的形式存在于自然界中?
3. 铁元素以什么形式存在于自然界中?
少数不活泼的金属如金、银、铂等。
大多以化合物形式存在于各种铁矿石中。
大多数金属如铝、铁等。
赤铁矿
黄铁矿(FeS2)
菱铁矿(FeCO3)
铁元素含量较低,污染环境
(Fe2O3)
磁铁矿
(Fe3O4)
铁元素含量较低
铁矿石炼铁
如何从铁矿石中得到铁呢?
以赤铁矿(主要成分Fe2O3)为例。
Fe2O3 Fe
高温
CO
红色粉末变成黑色,
澄清石灰水变浑浊。
实验现象:
铁矿石炼铁---实验室模拟炼铁
1.如何判断反应中生成了什么物质?
2.右边酒精灯的作用?
3.实验中先通一氧化碳还是先点燃酒精喷灯?为什么?
4.实验结束时,先停止通一氧化碳还是先熄灭酒精喷灯?为什么?
排净装置中的空气,防止加热时装置爆炸。
防止生成的铁在高温时被氧化。
使一氧化碳燃烧,防止逸到空气中污染环境。
澄清石灰水变浑浊,证明生成了CO2
红色粉末变成黑色,并能用磁铁吸引,证明生成了Fe
反思与交流
CO循环利用
反应之前先____,
空气排净再____,
否则 。
反应结束先____,
装置冷却____停,
否则金属又被 。
相关的化学方程式:
CO2 + Ca(OH)2 CaCO3 ↓+ H2O
Fe2O3 + 3CO 2Fe + 3CO2
高温
2CO + O2 2CO2
点燃
通气
点灯
爆炸
撤灯
通气
氧化了
铁矿石炼铁
将下列步骤按正确的顺序排列起来( )
1.将适量的氧化铁装入硬质玻璃管并固定装置
2.通入一氧化碳(已验纯)气体
3.检查装置气密性
4.待玻璃管内固体冷却后停止通入一氧化碳
5.点燃酒精喷灯给氧化铁加热
6.待硬质玻璃管内红色物质完全变为黑色时停止加热
312564
跟踪练习
高温
还原反应
Fe2O3
3CO
2Fe
3CO2
+
+
还原剂
失氧
含氧化合物中的氧被夺去的反应属于还原反应。
作氧化剂
具有氧化性
得氧
氧化反应
作还原剂
具有还原性
氧化还原反应
配平:Fe2O3 + CO Fe + CO2
高温
A. H2+ CuO Cu+H2O
B. Fe2O3+2Al Al2O3+2Fe
2.判断下列反应中的还原剂。
高温
C. 2 C+ SiO2 Si +2CO
高温
4CO+ Fe3O4 3Fe+4CO2
高温
跟踪练习
CO得氧,作还原剂
Fe3O4 失氧,作氧化剂。
3
3
2
1.尝试写出磁铁矿(Fe3O4)炼铁的化学方程式
目前我们学过的工业上冶炼金属的方法有 。
、电解法
还原法
2Al2O3 4Al+3O2↑
通电
MgCl2 Mg+Cl2↑
通电
Fe2O3 + 3CO 2Fe + 3CO2
高温
小结
课堂小结
常见的金属材料
物理性质
合金
金属冶炼
共性
特性
定义
优点
用途
常见的矿石
工业炼铁
原理(氧化还原反应)
现象
注意事项
1.常见的铁矿石有磁铁矿(主要成分是_______ )赤铁矿(主要成分是__________ ).
其中用磁铁矿炼铁时发生反应的化学方程式为___________________________。
Fe3O4
Fe2O3
4CO+ Fe3O4 3Fe+4CO2
高温
课堂检测
2. 某学生改进一氧化碳还原氧化铁的实验装置
(1)若先给氧化铁加热,通入一氧化碳,可
能产生的后果是__________ 。
(2)写出A中发生反应的化学方程式_____
(3)装置B中产生的现象可判断反应是否开始发
生,则B中的试剂是(填名称)__________
(4)装置C的作用是____________________
发生爆炸
澄清石灰水
收集未反应的CO,防止污染空气
Fe2O3+ 3CO 2Fe + 3CO2
高温
课堂检测
3.某炼铁厂利用1000t磁铁矿(含Fe3O4 90%)可炼得含铁96%的生铁多少吨?(相对原子质量:Fe-56,O-16)
设可以炼出纯铁的质量为x
4CO + Fe3O4==== 3Fe + 4CO2
高温
232
168
900t
x
232
168
x
=
900t
x ≈651.7t
生铁的质量为:651.7t ÷ 96%≈ 678.9t
答:可以炼出678.9t生铁。
解:四氧化三铁的质量为1000t ×90%=900t
课堂检测
同课章节目录
- 第七单元 常见的酸和碱
- 第一节 酸及其性质
- 第二节 碱及其性质
- 第三节 溶液的酸碱性
- 第四节 酸碱中和反应
- 到实验室去:探究酸和碱的化学性质
- 第八单元 海水中的化学
- 第一节 海洋化学资源
- 第二节 海水“晒盐“
- 第三节 海水“制碱“
- 到实验室去:粗盐中难溶性杂质的去除
- 第九单元 金属
- 第一节 常见的金属材料
- 第二节 金属的化学性质
- 第三节 钢铁的锈蚀与防护
- 到实验室去 探究金属的性质
- 第十单元 化学与健康
- 第一节 食物中的有机物
- 第二节 化学元素与人体健康
- 第三节 远离有毒物质
- 第十一单元 化学与社会发展
- 第一节 化学与能源开发
- 第二节 化学与材料研制
- 第三节 化学与农业生产
- 第四节 化学与环境保护
