物质的量浓度
图片预览








文档简介
(共31张PPT)
课件名称:《物质的量浓度 》
课件创新点:突出学生自学和探究;
教材(版本、名称、年级):山东科技版,普通高中课程标准实验教科书·化学1(必修),高中一年级;
地址、邮编:山东省莱芜市第五中学,271121
电子邮箱:genghuatian@
知识回顾:
1、用关系式表示出:物质的量与物质微粒的个数、物质的质量、气体的体积之关系
N
m
V
NA
n =
M
=
=
Vm
2、练习:
在标准状况下,2.2gCO2的体积是多少?所含 CO2分子数是多少?
n(co2)=0.05mol V (co2)=1.12L
N(co2)=3.01×1022
物质的量浓度
第 三 课 时
[教学目标]
1、通过活动探究,使学生了解一定物质的量浓度溶液的配制, 并掌握物质的量浓度的概念;
2、通过探究活动培养学生分析、思考和动手能力。
[重点和难点]
物质的量浓度概念的建立
[教学过程]
一、活 动 · 探 究
配制一定体积的溶液并表示其组成
现欲配制0.1 L NaCl溶液,其中溶质的物质的物质的量为0.04mol,请你利用实验室中的固体氯化钠及相关仪器,完成配制过程。
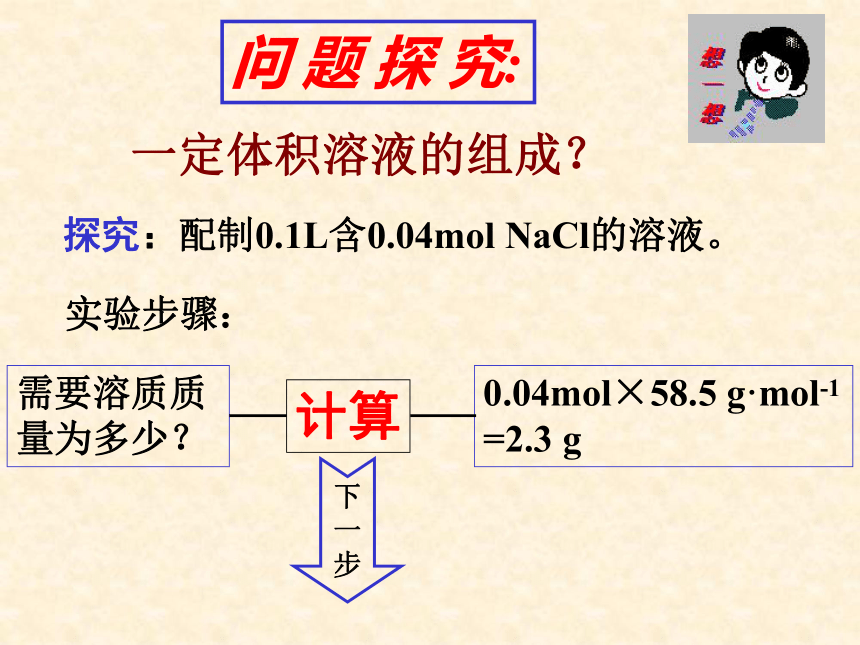
问 题 探 究:
一定体积溶液的组成?
探究:配制0.1L含0.04mol NaCl的溶液。
实验步骤:
计算
需要溶质质量为多少?
0.04mol×58.5 g·mol-1 =2.3 g
下
一
步
准备
仪器
下
一
步
需要哪些仪器?
容量瓶上有哪些标识?
如何洗涤仪器?
选择100ml容量瓶、150ml烧杯、适当长度的玻棒、称量范围为100g的托盘天平
将玻璃仪器分别用
自来水、蒸馏水各
洗3次。
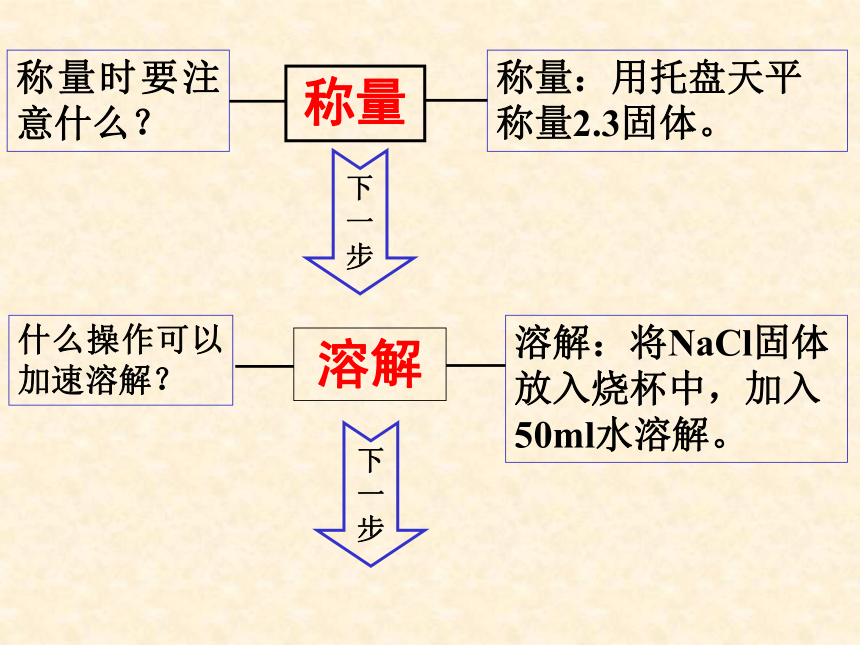
称量
称量时要注意什么?
称量:用托盘天平称量2.3固体。
下
一
步
溶解
什么操作可以加速溶解?
溶解:将NaCl固体放入烧杯中,加入50ml水溶解。
下
一
步
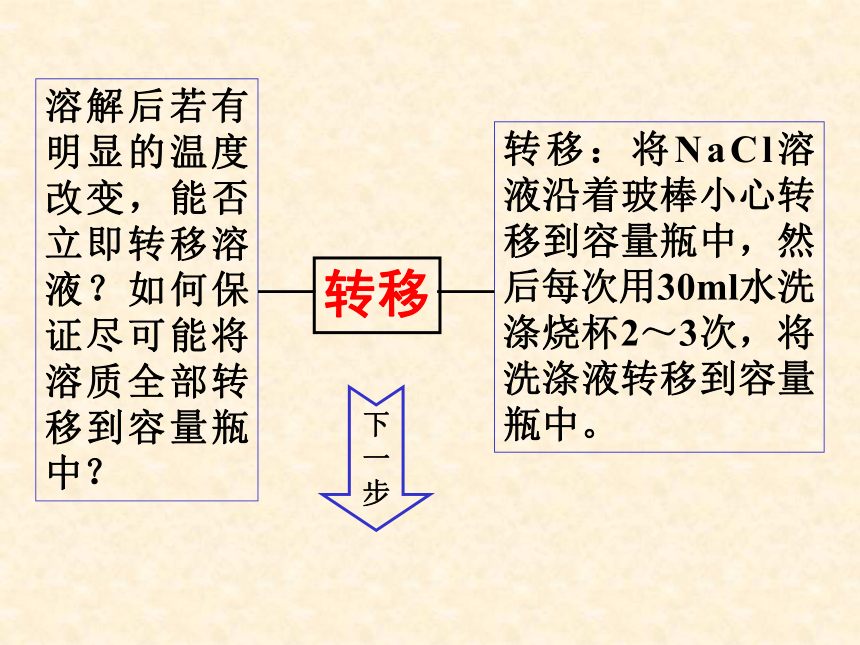
转移
溶解后若有明显的温度改变,能否立即转移溶液?如何保证尽可能将溶质全部转移到容量瓶中?
转移:将NaCl溶液沿着玻棒小心转移到容量瓶中,然后每次用30ml水洗涤烧杯2~3次,将洗涤液转移到容量瓶中。
下
一
步
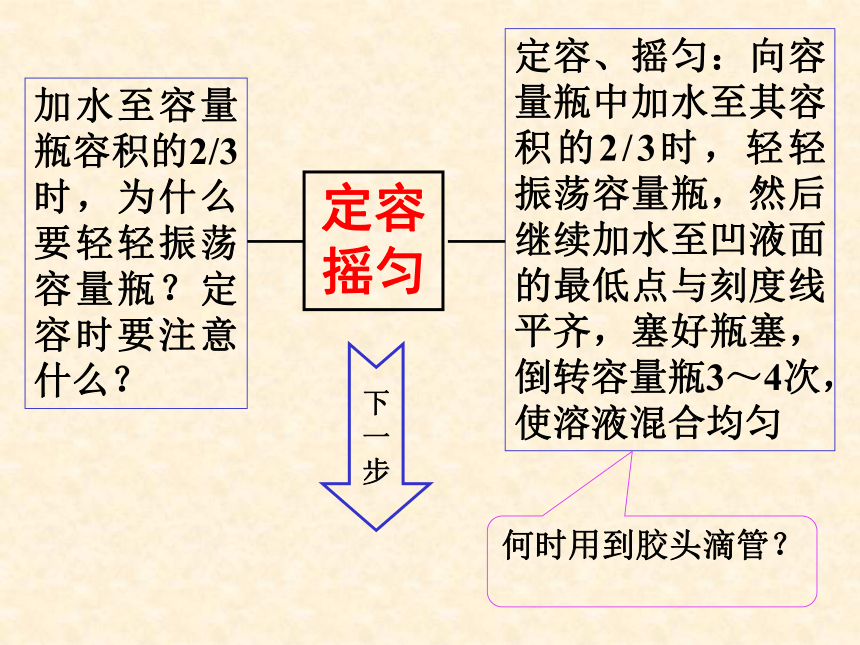
定容
摇匀
加水至容量瓶容积的2/3时,为什么要轻轻振荡容量瓶?定容时要注意什么?
定容、摇匀:向容量瓶中加水至其容积的2/3时,轻轻振荡容量瓶,然后继续加水至凹液面的最低点与刻度线平齐,塞好瓶塞,倒转容量瓶3~4次,使溶液混合均匀
下
一
步
何时用到胶头滴管?
装瓶
贴签
将溶液转移到试剂瓶中,贴上标签。
〖小结〗基本步骤:
算—称—溶—转—定—装
学 生 实 验
3、溶解:
2.3
2、称量:
4、溶质的无损失转移:
5、定容:
6、装瓶
贴标签
1、计算:m(NaCl)=_____g
[思考与讨论]
结合配制过程,如何表示溶液的组成?
以单位体积溶液所含溶质B的物质的量来表示溶液组成的物理量,叫做溶质B的物质的量浓度。
符号:cB ,常用单位 mol ·L-1 或 mol · m-3
物质的量浓度
二、
溶液的体积、物质的量浓度和溶质的物质的量之间的关系:
cB =
nB
V
溶质的
物质的量
溶液的体积
溶质的
物质的量浓度
[研讨练习] :
1、求课堂上刚刚配制成的100mlNaCl溶液中,NaCl的物质的量浓度
解:
c(NaCl) =
V[NaCl(aq)]
n(NaCl)
=
0.04mol
0.1L
=0 . 4mol·L-1
2、从课堂上刚刚配制成的100mlNaCl溶液中取出10ml溶液,你能否求出这10ml溶液中NaCl的物质的量和质量?
解:10mL溶液中NaCl的物质的量浓度仍为0 . 4mol·L-1
n(NaCl)=c (NaCl)×V[NaCl (aq) ]
=0.4mol ×0.01L
=0.004mol
所以
=0.004mol ×58.5g·mol-1
=0.234g
m (NaCl) = n(NaCl) ×M (NaCl)
故有
3、下列溶液中,溶质的物质的量浓度为1mol·L-1的是————
A 将40gNaOH溶于1L水所得的溶液
B 将22.4LHCl溶于水配成1L溶液
C 含K+的物质的量为2mol的K2SO4溶液1L
D 将0.5 mol·L-1的NaCl溶液100ml加热蒸发部分水(无溶质析出)后剩余的50ml溶液
CD
实 际 操 作 对溶液物质的量浓度的影响
称量前未调零点,天平指针偏向左边
容量瓶洗涤后未干燥
溶解NaCl固体的烧杯洗涤后未干燥
定容时眼睛处于仰视的位置
摇匀后发现凹液面的最低点低于刻度线,再加水至刻度线
偏小
无影响
偏小
偏小
偏小
〖拓展讨论〗
1、某同学在配制NaCl溶液的实验中出现了如下
情形,试分析对所配溶液浓度的影响。
2、探讨溶液的质量分数与物质的量浓度
的换算关系:
3、联系氯化钠溶液的配制讨论:如何用质量分数为98%,密度为1.84g/cm3的浓硫酸配制250ml 2mol/L的稀硫酸?
CB=
ρ(g cm-3 )×V( 溶液,ml) ×ω(B)
M(g·mol-1 ) ×V(溶液,L)
(1)计算:V(浓H 2SO4 )=
=26.6cm3=26.6ml
0.25L× 2mol L-1 ×98g·mol -1
1. 84g·cm -3
(3)溶解:用量筒取约150ml水于烧杯中,再将26.6ml浓硫酸沿玻璃棒缓慢加入水中,边加边搅拌。
(2)量取:用50ml量筒准确量取26.6ml浓硫酸
(5)定容:直接加水至离容量瓶刻度线1~ 2 cm时,改用胶头滴管加水至恰好到刻度。
(4)转移:冷却到室温时,将所得溶液转入250ml容量瓶中,再用30ml水洗涤烧杯和玻璃棒2~3次,洗涤液全部转入容量瓶中。
(6)将所配稀硫酸转入试剂瓶中,并贴上标签。
[交流·研讨]
你对化学反应中的定量关系的新认识?
2H2 + O2 === 2H2O
点燃
4g 32g 36g
2分子 1分子 2分子
2mol 1mol 2mol
44.8L 22.4L
从物质的量角度:
从质量角度:
从分子数角度:
从标况下气体
体积角度:
从任意相同条件
气体体积角度:
2体积 1体积
[小结] :
1、一定体积的溶液的配制过程(认识容量瓶;配制时应遵循的原则)
2、物质的量浓度的概念
N微粒数
V气体体积
m质量
C
n
NA ÷
÷ M
× NA
÷Vm
÷V
M ×
Vm ×
V ×
3、
作业:
课本25~26页习题
课件名称:《物质的量浓度 》
课件创新点:突出学生自学和探究;
教材(版本、名称、年级):山东科技版,普通高中课程标准实验教科书·化学1(必修),高中一年级;
地址、邮编:山东省莱芜市第五中学,271121
电子邮箱:genghuatian@
知识回顾:
1、用关系式表示出:物质的量与物质微粒的个数、物质的质量、气体的体积之关系
N
m
V
NA
n =
M
=
=
Vm
2、练习:
在标准状况下,2.2gCO2的体积是多少?所含 CO2分子数是多少?
n(co2)=0.05mol V (co2)=1.12L
N(co2)=3.01×1022
物质的量浓度
第 三 课 时
[教学目标]
1、通过活动探究,使学生了解一定物质的量浓度溶液的配制, 并掌握物质的量浓度的概念;
2、通过探究活动培养学生分析、思考和动手能力。
[重点和难点]
物质的量浓度概念的建立
[教学过程]
一、活 动 · 探 究
配制一定体积的溶液并表示其组成
现欲配制0.1 L NaCl溶液,其中溶质的物质的物质的量为0.04mol,请你利用实验室中的固体氯化钠及相关仪器,完成配制过程。
问 题 探 究:
一定体积溶液的组成?
探究:配制0.1L含0.04mol NaCl的溶液。
实验步骤:
计算
需要溶质质量为多少?
0.04mol×58.5 g·mol-1 =2.3 g
下
一
步
准备
仪器
下
一
步
需要哪些仪器?
容量瓶上有哪些标识?
如何洗涤仪器?
选择100ml容量瓶、150ml烧杯、适当长度的玻棒、称量范围为100g的托盘天平
将玻璃仪器分别用
自来水、蒸馏水各
洗3次。
称量
称量时要注意什么?
称量:用托盘天平称量2.3固体。
下
一
步
溶解
什么操作可以加速溶解?
溶解:将NaCl固体放入烧杯中,加入50ml水溶解。
下
一
步
转移
溶解后若有明显的温度改变,能否立即转移溶液?如何保证尽可能将溶质全部转移到容量瓶中?
转移:将NaCl溶液沿着玻棒小心转移到容量瓶中,然后每次用30ml水洗涤烧杯2~3次,将洗涤液转移到容量瓶中。
下
一
步
定容
摇匀
加水至容量瓶容积的2/3时,为什么要轻轻振荡容量瓶?定容时要注意什么?
定容、摇匀:向容量瓶中加水至其容积的2/3时,轻轻振荡容量瓶,然后继续加水至凹液面的最低点与刻度线平齐,塞好瓶塞,倒转容量瓶3~4次,使溶液混合均匀
下
一
步
何时用到胶头滴管?
装瓶
贴签
将溶液转移到试剂瓶中,贴上标签。
〖小结〗基本步骤:
算—称—溶—转—定—装
学 生 实 验
3、溶解:
2.3
2、称量:
4、溶质的无损失转移:
5、定容:
6、装瓶
贴标签
1、计算:m(NaCl)=_____g
[思考与讨论]
结合配制过程,如何表示溶液的组成?
以单位体积溶液所含溶质B的物质的量来表示溶液组成的物理量,叫做溶质B的物质的量浓度。
符号:cB ,常用单位 mol ·L-1 或 mol · m-3
物质的量浓度
二、
溶液的体积、物质的量浓度和溶质的物质的量之间的关系:
cB =
nB
V
溶质的
物质的量
溶液的体积
溶质的
物质的量浓度
[研讨练习] :
1、求课堂上刚刚配制成的100mlNaCl溶液中,NaCl的物质的量浓度
解:
c(NaCl) =
V[NaCl(aq)]
n(NaCl)
=
0.04mol
0.1L
=0 . 4mol·L-1
2、从课堂上刚刚配制成的100mlNaCl溶液中取出10ml溶液,你能否求出这10ml溶液中NaCl的物质的量和质量?
解:10mL溶液中NaCl的物质的量浓度仍为0 . 4mol·L-1
n(NaCl)=c (NaCl)×V[NaCl (aq) ]
=0.4mol ×0.01L
=0.004mol
所以
=0.004mol ×58.5g·mol-1
=0.234g
m (NaCl) = n(NaCl) ×M (NaCl)
故有
3、下列溶液中,溶质的物质的量浓度为1mol·L-1的是————
A 将40gNaOH溶于1L水所得的溶液
B 将22.4LHCl溶于水配成1L溶液
C 含K+的物质的量为2mol的K2SO4溶液1L
D 将0.5 mol·L-1的NaCl溶液100ml加热蒸发部分水(无溶质析出)后剩余的50ml溶液
CD
实 际 操 作 对溶液物质的量浓度的影响
称量前未调零点,天平指针偏向左边
容量瓶洗涤后未干燥
溶解NaCl固体的烧杯洗涤后未干燥
定容时眼睛处于仰视的位置
摇匀后发现凹液面的最低点低于刻度线,再加水至刻度线
偏小
无影响
偏小
偏小
偏小
〖拓展讨论〗
1、某同学在配制NaCl溶液的实验中出现了如下
情形,试分析对所配溶液浓度的影响。
2、探讨溶液的质量分数与物质的量浓度
的换算关系:
3、联系氯化钠溶液的配制讨论:如何用质量分数为98%,密度为1.84g/cm3的浓硫酸配制250ml 2mol/L的稀硫酸?
CB=
ρ(g cm-3 )×V( 溶液,ml) ×ω(B)
M(g·mol-1 ) ×V(溶液,L)
(1)计算:V(浓H 2SO4 )=
=26.6cm3=26.6ml
0.25L× 2mol L-1 ×98g·mol -1
1. 84g·cm -3
(3)溶解:用量筒取约150ml水于烧杯中,再将26.6ml浓硫酸沿玻璃棒缓慢加入水中,边加边搅拌。
(2)量取:用50ml量筒准确量取26.6ml浓硫酸
(5)定容:直接加水至离容量瓶刻度线1~ 2 cm时,改用胶头滴管加水至恰好到刻度。
(4)转移:冷却到室温时,将所得溶液转入250ml容量瓶中,再用30ml水洗涤烧杯和玻璃棒2~3次,洗涤液全部转入容量瓶中。
(6)将所配稀硫酸转入试剂瓶中,并贴上标签。
[交流·研讨]
你对化学反应中的定量关系的新认识?
2H2 + O2 === 2H2O
点燃
4g 32g 36g
2分子 1分子 2分子
2mol 1mol 2mol
44.8L 22.4L
从物质的量角度:
从质量角度:
从分子数角度:
从标况下气体
体积角度:
从任意相同条件
气体体积角度:
2体积 1体积
[小结] :
1、一定体积的溶液的配制过程(认识容量瓶;配制时应遵循的原则)
2、物质的量浓度的概念
N微粒数
V气体体积
m质量
C
n
NA ÷
÷ M
× NA
÷Vm
÷V
M ×
Vm ×
V ×
3、
作业:
课本25~26页习题
