鲁教版九年级下册化学 8.3海水“制碱” 课件(68张PPT)
文档属性
| 名称 | 鲁教版九年级下册化学 8.3海水“制碱” 课件(68张PPT) |

|
|
| 格式 | ppt | ||
| 文件大小 | 3.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-04-20 14:31:44 | ||
图片预览







文档简介
西藏碱湖
天然碱
第三节 海水“制碱”
纯碱或苏打
预习检查
2.碳酸钠的俗名是什么?
1.碳酸钠化学式是什么?它是属于哪一类物质?
Na2CO3
属于盐类物质
溶液显碱性
信息分析
海水中含量最多的盐就是食盐(NaC1),我国海岸线漫长,可采用盐田法晒盐制得,因此原料来源广,成本低, NaC1和纯碱(Na2CO3)都属钠盐,在组成上都含钠元素。
提出猜想
能否用廉价的NaCl来制取纯碱(Na2CO3)呢?
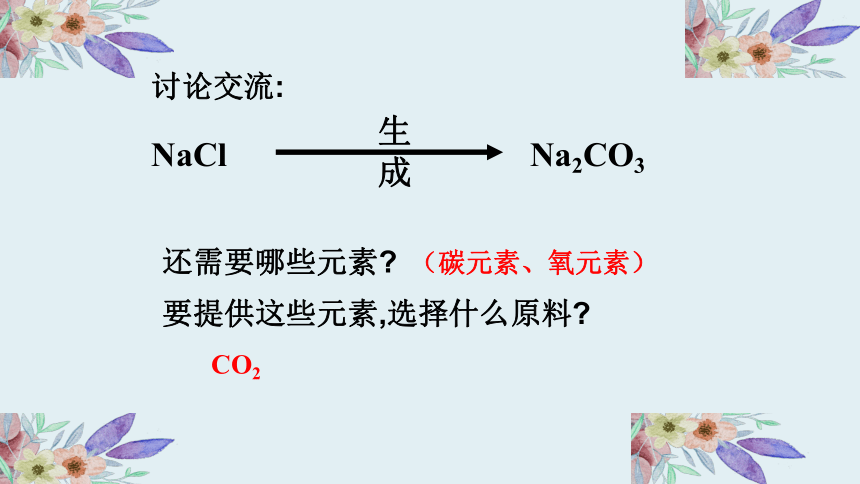
NaCl Na2CO3
生成
讨论交流:
还需要哪些元素?
要提供这些元素,选择什么原料?
(碳元素、氧元素)
CO2
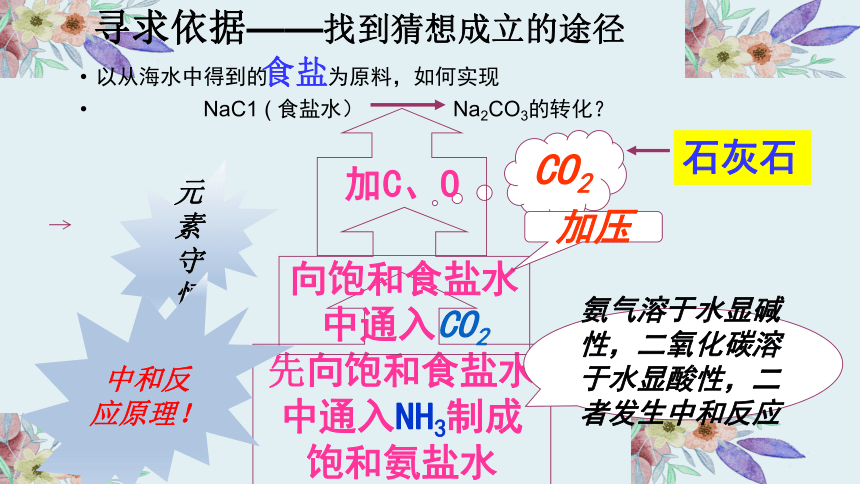
先向饱和食盐水中通入NH3制成饱和氨盐水
以从海水中得到的 为原料,如何实现
NaC1 ( 食盐水) Na2CO3的转化?
CO2
加C、O
元素守恒
向饱和食盐水中通入CO2
氨气溶于水显碱性,二氧化碳溶于水显酸性,二者发生中和反应
中和反应原理!
加压
石灰石
食盐
寻求依据——找到猜想成立的途径
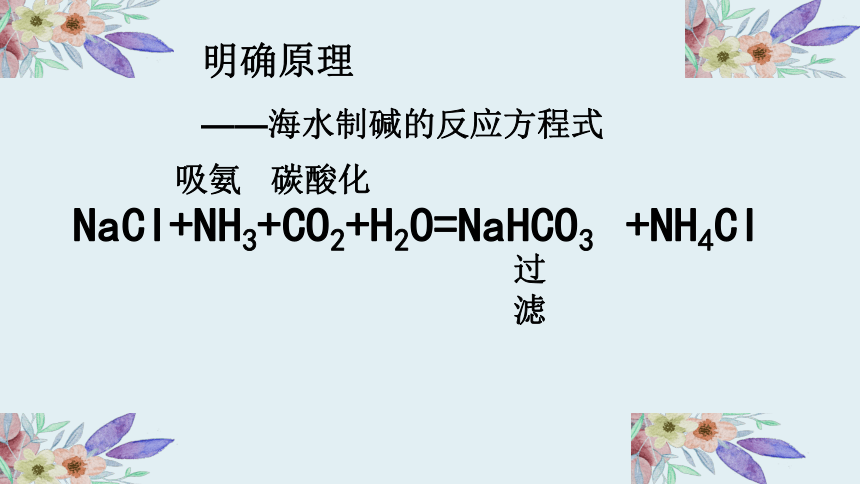
NaCI+NH3+CO2+H2O=NaHCO3 +NH4CI
吸氨
碳酸化
过滤
明确原理
——海水制碱的反应方程式
溶解度\克
0 10 20 30 40 50 60 70 80 90 100
温度/℃
100
90
80
70
60
50
40
30
20
10
0
碳酸氢钠
氯化铵
室温下NaHCO3的溶解度比 NH4C1小易结晶析出。
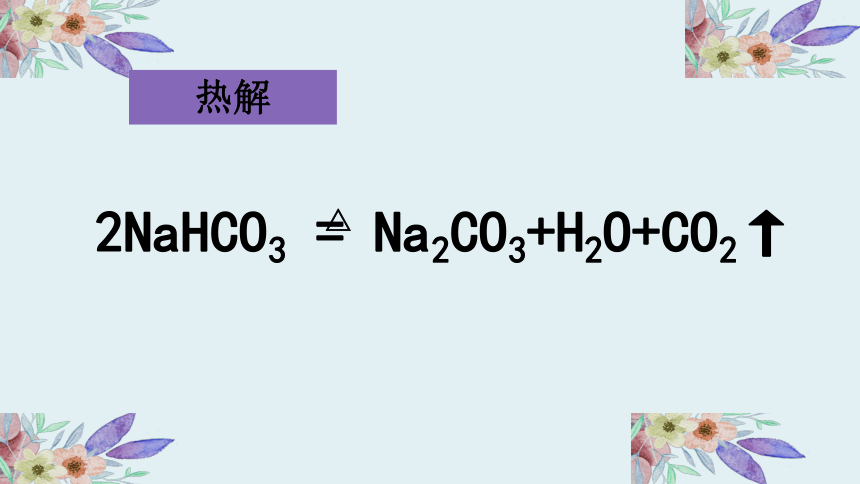
2NaHCO3 = Na2CO3+H2O+CO2↑
△
热解
饱和食盐水
饱和氨盐水
↓
NH3
CO2
过滤
NaHCO3
晶体
含NH4Cl
的溶液
Na2CO3
CO2
H2O
NH4Cl
晶体
加NaCl
结晶
△
NaHCO3+ NH4Cl
NaCl
+H2O
+NH3
+CO2
=
△
2NaHCO3 == Na2CO3+CO2↑+ H2O
交流共享:
1.在用氨碱法生产纯碱的过程中,为什么要先向饱和食盐水中通入氨气,制成饱和氨盐水,再向其中通入二氧化碳?
氨气溶于水显碱性、二氧化碳溶于水生成碳酸,两者之间能发生中和反应。
2.氨盐水吸收二氧化碳后生成的碳酸氢钠和氯化铵,哪种物质首先析出?为什么?(提示:根据课本39页溶解度曲线)
NaHCO3先析出
在同一温度下NaHCO3溶解度小
探究升级
1.析出NaHCO3后的溶液中是否含有NaHCO3?
含有NaHCO3
2.析出NaHCO3后的溶液是NaHCO3的饱和溶液吗?
是饱和溶液
3.析出NaHCO3后的溶液中除了含有NaHCO3外,主
要还含有什么物质?
还含有NH4Cl
讨论分析后回答:
“NaCl+CO2+NH3+H2O→NaHCO3+NH4Cl”是“侯氏制碱法”的重要反应。下面是4位同学对该反应涉及的有关知识发表的部分见解。其中正确的是( )
A.甲同学说:这个反应属于化合反应
B.乙同学说:该温度下NaHCO3的溶解度很大
C.丙同学説:反应后的溶液中存在NH4+
D.丁同学说:结晶出NaHCO3后的溶液中没有Na+
C
实战演练:
阅读课本44页多识一点的内容,回答下列问题:
优点:
原料经济易得
氨气和二氧化碳可循环使用
缺点:
氯化钠利用率低
产生了无用的氯化钙,用处不大,
且污染环境.
纯碱工业始创于18世纪,在很长一段时间内制碱技术把持在英、法、德、美等西方发达国家手中。1921年正在美国留学的侯德榜先生为了发展我国的民族工业,应爱国实业家范旭东先生之邀毅然回国,潜心研究制碱技术,成功地摸索和改进了西方的制碱方法,发明了将制碱与制氨结合起来的联合制碱法(又称侯氏制碱法)。侯德榜为纯碱和氮肥工业技术的发展做出了杰出的贡献。
侯德榜
2.侯氏制碱法是如何克服这个缺的?
向析出NaHCO3的氯化铵溶液中加入研细的NaCI,使NH4CI结晶析出,用作氮肥,氯化钠溶液可循环使用。
碳酸氢钠俗称小苏打,又称酸式碳酸钠,通常是白色晶体,能溶于水。
自学教材第44页的内容,归纳出碳酸钠和碳酸氢钠的部分性质及用途。
1.纯碱通常情况下为 , 溶于
水。
白色粉末
易
2.碳酸氢钠的俗名是 ,是 色
状 体, 溶于水。
小苏打
白
粉末
晶
能
知识拓展
清洗餐具
蒸馒头
碳酸钠在生活中的用途
清洗蔬菜表
面的农药
清洗鱼胆的苦味
灭
火
器
碳酸氢钠的用途
制胃酸过多
反应原理:
NaHCO3+HCl = NaCl + CO2 ↑+ H2O
碳酸饮料
发酵粉
析出固体后的溶液为NaHCO3的不饱和溶液
NaHCO3不是纯碱
从该反应可
以获得氮肥
该条件下NaHCO3
的溶解度较小
5、“NaCl+CO2+NH3+H2O=NaHCO3↓+NH4Cl”是著名的“侯氏制碱法”的重要反应。下面是4位同学对该反应涉及的有关知识发表的部分见解。其中不正确的是
A B C D
C
在发酵面团中加入下列某种物质进行揉和,既能除去面团中的酸,又能使蒸出的馒头疏松多孔。这种物质是( )
A.Na2CO3 B.Ca(OH)2
C.CaO D.NaCl
A
实战演练:
实验探究碳酸钠的化学性质
取少量碳酸钠溶液,加入试管中,滴入2—3滴酚酞试液,观察现象。
思考:显碱性的溶液一定是碱溶液吗?
实验现象:_____________________。
溶液变红
实验结论:
碳酸钠____(难/易)溶于水,溶液显___性。
碱
易
不一定
纯碱不是碱,是盐
向盛碳酸钠固体的试管中滴加稀盐酸,观察现象;迅速将燃着的木条伸进试管口,观察现象。
实验现象:______________________________。
有大量气泡产生,燃着的木条熄灭
思考:
(1)由现象可知生成物中一定有_____
(2)该反应的化学方程式
(3)若用稀硫酸代替稀盐酸进行实验,现象是否相同?
化学方程式
CO2
Na2CO3+2HCl = 2NaCl+CO2↑+H2O
Na2CO3+H2SO4 = Na2SO4+CO2↑+H2O
实验结论:碳酸钠可以与 或者 反应。
H2SO4
HCl
碳酸根离子的检验:
取样品于试管中,加 入稀盐酸,有气泡产生,将 生成的气体通入澄清石灰水,石灰水变浑浊。说明样品中含有碳酸根离子或碳酸氢根离子。
稀盐酸 澄清石灰水
方法
药品
Na2CO3+2HCl = 2NaCl+CO2↑+H2O
*
通过查找资料:你了解到哪些物质中含有碳酸盐?
主要成分是碳酸钙
石头纸
向盛有澄清石灰水的试管中滴加少量碳酸钠溶液,观察现象。
实验现象:_____________________。
该反应的化学方程式
____________________________。
实验结论:碳酸钠可以与 反应。
Ca(OH)2
Na2CO3+ Ca(OH)2 = 2NaOH+CaCO3↓(工业制烧碱)
产生白色沉淀
向盛有少量碳酸钠溶液的试管中滴加氯化
钡溶液,观察现象。
实验现象:_____________________。
该反应的化学方程式
__________________________________。
实验结论:碳酸钠可以与 反应。
BaCl2
Na2CO3+ BaCl2 = 2NaCl+BaCO3↓
产生白色沉淀
1.在滴有紫色石蕊试液的碳酸钠溶液中,加入过量盐酸,则加盐酸前后溶液的颜色依次为(?? ?)?
A.紫色、红色?? B.红色、蓝色?
C.蓝色、红色??? ?D.红色、无色
小试牛刀
C
2.小明学习化学后,在家里想用化学方法来鉴别碱面(主要成分是碳酸钠)和食盐,你认为下列方法可行的是( )
A.观察它们的颜色
B.取少量分别倒入食醋
C.分别倒入水中观察是否溶解
D.分别尝它们的味道
B
1.下列有关物质的化学式、名称、俗名不完全对应的是( )
A. NaCl 氯化钠 食盐
B. CaO 氧化钙 熟石灰
C. Na2CO3 碳酸钠 纯碱
D. NaOH 氢氧化钠 烧碱
达标检测
B
2.鱼胆弄破后会使鱼肉粘上难溶于水的胆汁酸而变苦,要减少这种苦味。用来洗涤的最佳物质是( )
A.水 B.食盐
C.纯碱 D.食醋
C
3.妈妈在洗碗筷时,经常在水中加入一种物质,很快就能将“油乎乎”的菜盘洗得干干净净,加入的物质可能是( )
A.汽油 B.烧碱
C.纯碱 D.食盐水
C
4.检验碳酸盐的正确方法是( )
A.滴加稀盐酸,产生使木条火焰熄灭的气体
B.滴加BaCl2溶液产生白色沉淀
C.加热,产生使澄清石灰水变浑浊的气体
D.滴加稀盐酸产生使澄清石灰水变浑浊的气体
D
1.什么是复分解反应?
2.哪些类物质间的反应是复分解反应?(你能用化学方程式表示吗?)
3.判断复分解反应能否进行,需考虑哪些因素?
4.复分解反应的实质是什么?
?
提出问题:
A
+
C
=
B
A
B
D
C
D
+
1、复分解反应:由两种化合物互相交换成分,生成另外两种化合物的反应。
酸+碱——盐+水
酸+盐——新酸+新盐
碱+盐——新碱+新盐
盐+盐——新盐+新盐
酸碱盐之间发生的反应一般都是复分解反应
2、复分解反应发生的条件
有气体(↑)
有H2O
有沉淀(↓)
(1)再水溶液中
(2)生成物中
如:2NaOH + H2SO4 = Na2SO4+2H2O
如:AgNO3+HCl = AgCl↓+HNO3
如:2HCl+CaCO3 = CaCl2+H2O+CO2↑
注意:反应前后各元素的化合价保持不变
Na+
OH-
H+
NO3-
H2O
NaOH溶液和稀HNO3反应
结论:
有水生成的复分解反应实质是 H+和OH-反应
实质:
旁观者:
NO3-和Na+
Na+
Na+
CO32-
Cl-
H+
Cl-
H+
H2O
碳酸钠和稀盐酸反应
结论:
有co2生成的复分解反应实质是CO32-和H+
反应
CO2
实质:
旁观者:
Cl-和Na+
CO2
Ba2+
SO42-
Cl-
Cl-
Na+
Na+
BaSO4
氯化钡与硫酸钠反应
结论:
有BaSO4沉淀生成的复分解反应实质是
Ba2+和SO42-反应
实质:
旁观者:
Cl-和Na+
酸、碱、盐所电离出的离子相互结合,生成沉淀、气体或者水的过程。
3、复分解反应的实质:
常见的哪些离子之间能产生沉淀、气体、水呢?
1.产生水的:
2.产生气体的:
3产生沉淀的
H+ + OH- →
H2O
(1) 2H+ + CO32- →
(2) H+ + HCO3- →
H2O + CO2↑
H2O + CO2↑
(3) NH4+ + OH- →
NH3↑+ H2O
BaSO4 ↓
Fe(OH)3 ↓
常见生成沉淀的离子
(1) Mg2+ + OH- →
Mg(OH)2↓
(2) Cu2+ + OH- →
Cu (OH)2↓
(3) Fe3+ + OH- →
(4) Ag+ + Cl- →
AgCl ↓
(5) Ba2+ + SO42- →
(6) Ba2+ +CO32- →
(7) Ca2+ + CO32- →
CaCO3 ↓
BaCO3 ↓
钾钠铵盐皆可溶,硝酸盐入水无影踪;
硫酸盐难溶铅和钡,氯化物不溶银亚汞;
碳酸盐只溶钾钠铵,碱溶钾钙钠钡铵;
课本P118溶解性表格记忆口诀
不能共存的离子
1.下列各组物质能够共存的是( )
A、FeCl3溶液、NaOH溶液
B、Ca(OH)2溶液、Na2CO3溶液
C、BaCl2溶液、HCl溶液
D、CaCO3、稀HNO3
C
方法点拨:共存即不反应,一般指
不生成沉淀、气体和水
2.不能在溶液中大量共存的一组离子是 ( )
A、K+、Na+、Mg2+、SO42-
B、Ca2+、H+、NO3-、Cl-
C、Mg2+、K+、NO3-、Cl-
D、H+、SO42-、Ba2+、NO3-
D
3.判断下列物质在水溶液里能否发生复分解反应:
(1)、KNO3+NaCl ( )
(2)、KNO3+Na2CO3 ( )
(3)、BaCl2+Na2SO4 ( )
(4)、FeCl3+NaOH ( )
(5)、CaCO3+HCl ( )
不能
不能
能
能
能
4.下列各组物质的溶液,混合后不能发生反应的一组是 ( )
A、BaCl2、NaCl、 Ca(NO3)2
B、AgNO3、HCl、Cu(NO3)2
C、Ca(OH)2、K2CO3、HCl
D、NaOH、H2SO4、Ba(NO3)2?
A
5.下列各组物质中,不能发生复分解反应
的是( )
A. HCl和Ca(OH)2
B. Na2CO3和H2SO4
C. Ca(OH)2 和Na2CO3
D. KCl和CuSO4
D
6.我国化学家侯德榜发明了联合制碱法,其生产纯碱和副产品氯化铵的工艺流程如下图所示:
中考零距离
(1)NH3溶于水得到氨水,将无色酚酞溶液滴入氨水中,溶液显 色。
(2)写出反应l的化学方程式 ;该反应的基本类型为 。
(3)操作a的过程是加入食盐、 、过滤。
(4)上述工艺流程中可循环利用的物质是 。
(5)最终产物是哪些?写出它们的化学式。
、 。
2NaHCO3 == Na2CO3+CO2↑+ H2O
△
红
分解反应
结晶
CO2
Na2CO3
NH4Cl
(6)有人认为侯氏制碱法的优点有四,你认为正确的是 (用序号回答)
①.生产过程中部分产品可以作为起始原料循环使用
②.副产品是一种可以利用的氮肥
③.有关的反应都不需要加热
④.副产品不会造成环境污染
①②④
常见盐的保健功能
1.高锰酸钾(又称PP粉):具有强氧化性,能杀死病菌,常用以消毒。其中,它的深紫色溶液(约0.3%~0.5%)杀菌力最强,多用于浴缸、便具、痰盂的消毒;紫红色溶液(约0.05%)可用以清洗伤口,浸洗足癣,也可用以对瓜果、蔬菜及餐具的消毒;浅红色溶液(0.01%以下)可用以漱口,有除臭消炎防龋作用。
【知识拓展】
2.硫酸亚铁:亚铁离子是血红蛋白的重要成分,硫酸亚铁可用于治疗缺铁性贫血。许多补血糖浆中均含有硫酸亚铁。
3.氯化钙:人体内的钙,是保证骨骼硬度、促进骨骼生长的主要成分。口服或注射氯化钙,可防治佝偻病、软骨病。与维生素D合用能更好地促进钙的吸收和储存。
4.氯化铁:手指一旦被划破后常会血流不止,若将氯化铁粉末撒入伤口,很快就能使流血凝固,且无痛感。原因在于它是一种重金属盐,能使血红蛋白变性。
5.硫酸锌:锌是人体内重要的微量元素,与生物体内七十多种酶的功能活性密切相关。锌摄取不足时,会产生体、智发育障碍、胃肠功能紊乱、偏头痛、夜盲、异食癖等。服用硫酸锌糖浆或片剂即可快速补充体内的锌元素。
6.碳酸钙:是自然界中大理石、石灰石、白垩的主要成分,实验室常用它做制取二氧化碳的原料:
CaCO3+2HCl = CaCl2+H2O+CO2↑
碳酸钙除了可做补钙剂,还是牙膏内的摩擦剂,通常由纯碱和熟石灰反应制得,反应的化学方程式为
Na2CO3+Ca(OH)2 = CaCO3↓+2NaOH。
汉白玉
7、亚硝酸钠(NaNO2) ——小心亚硝酸钠成为“杀手”
亚硝酸钠亚硝酸钠是工业用盐,它是一种白色不透明晶体,形状很像食盐。是致癌物质,其不仅存在于午餐肉中,在香肠、火腿等一些腌腊制品中都非常常见(主要作为一种增色剂、防腐剂使用,使肉颜色红润);尤其是煮过的剩菜中也存有亚硝酸钠。虽然亚硝酸钠是剧毒物质,但只要严格控制其食用量,对人体不会产生太大危害。
人体不能摄入过量的亚硝酸钠,否则0.3克~0.5克便能中毒,3克便能致死。中毒后症状为心率加速,嗜睡,烦躁不安,呼吸急促,恶心呕吐,腹痛腹泻等,重者甚至昏迷、昏厥,常死于呼吸衰竭。
???专家提醒,为避免亚硝酸钠对人体的危害,
平时要尽量少吃含有亚硝酸钠的食物。
8、硫酸钡
天然BaSO4又称重晶石,由于其中含有CaCO3等杂质。天然BaSO4用于生产涂料或高级纸张,可用作白色颜料 [锌钡白(ZnS.BaSO4) ZnSO4+BaS=ZnS.BaSO4]
并可作为油漆,油墨,塑料,橡胶的原料及填充剂。化工领域用它生产BaCl2及其他含钡化合物。
沉淀BaSO4较为纯净,在医学上,主要用作检查肠胃的内服药剂,进行钡餐透视。
重晶石
用钡餐观察肠内情况
快乐学习
快乐成长
祝大家学有所成!
天然碱
第三节 海水“制碱”
纯碱或苏打
预习检查
2.碳酸钠的俗名是什么?
1.碳酸钠化学式是什么?它是属于哪一类物质?
Na2CO3
属于盐类物质
溶液显碱性
信息分析
海水中含量最多的盐就是食盐(NaC1),我国海岸线漫长,可采用盐田法晒盐制得,因此原料来源广,成本低, NaC1和纯碱(Na2CO3)都属钠盐,在组成上都含钠元素。
提出猜想
能否用廉价的NaCl来制取纯碱(Na2CO3)呢?
NaCl Na2CO3
生成
讨论交流:
还需要哪些元素?
要提供这些元素,选择什么原料?
(碳元素、氧元素)
CO2
先向饱和食盐水中通入NH3制成饱和氨盐水
以从海水中得到的 为原料,如何实现
NaC1 ( 食盐水) Na2CO3的转化?
CO2
加C、O
元素守恒
向饱和食盐水中通入CO2
氨气溶于水显碱性,二氧化碳溶于水显酸性,二者发生中和反应
中和反应原理!
加压
石灰石
食盐
寻求依据——找到猜想成立的途径
NaCI+NH3+CO2+H2O=NaHCO3 +NH4CI
吸氨
碳酸化
过滤
明确原理
——海水制碱的反应方程式
溶解度\克
0 10 20 30 40 50 60 70 80 90 100
温度/℃
100
90
80
70
60
50
40
30
20
10
0
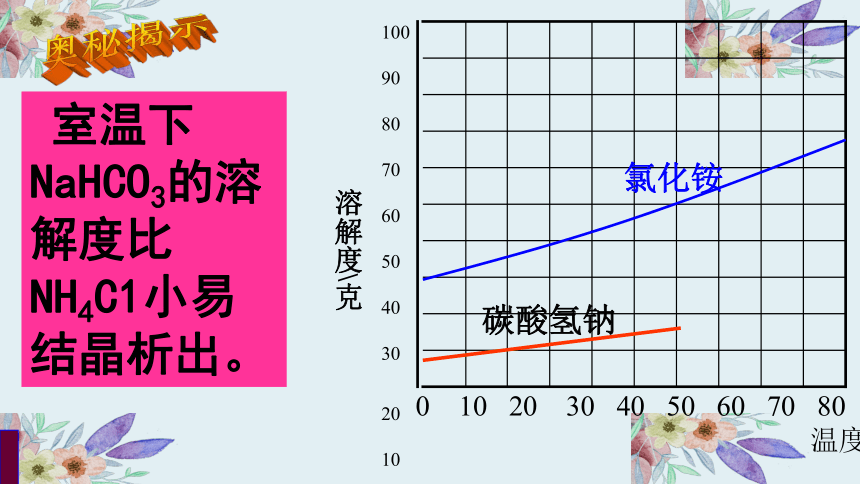
碳酸氢钠
氯化铵
室温下NaHCO3的溶解度比 NH4C1小易结晶析出。
2NaHCO3 = Na2CO3+H2O+CO2↑
△
热解
饱和食盐水
饱和氨盐水
↓
NH3
CO2
过滤
NaHCO3
晶体
含NH4Cl
的溶液
Na2CO3
CO2
H2O
NH4Cl
晶体
加NaCl
结晶
△
NaHCO3+ NH4Cl
NaCl
+H2O
+NH3
+CO2
=
△
2NaHCO3 == Na2CO3+CO2↑+ H2O
交流共享:
1.在用氨碱法生产纯碱的过程中,为什么要先向饱和食盐水中通入氨气,制成饱和氨盐水,再向其中通入二氧化碳?
氨气溶于水显碱性、二氧化碳溶于水生成碳酸,两者之间能发生中和反应。
2.氨盐水吸收二氧化碳后生成的碳酸氢钠和氯化铵,哪种物质首先析出?为什么?(提示:根据课本39页溶解度曲线)
NaHCO3先析出
在同一温度下NaHCO3溶解度小
探究升级
1.析出NaHCO3后的溶液中是否含有NaHCO3?
含有NaHCO3
2.析出NaHCO3后的溶液是NaHCO3的饱和溶液吗?
是饱和溶液
3.析出NaHCO3后的溶液中除了含有NaHCO3外,主
要还含有什么物质?
还含有NH4Cl
讨论分析后回答:
“NaCl+CO2+NH3+H2O→NaHCO3+NH4Cl”是“侯氏制碱法”的重要反应。下面是4位同学对该反应涉及的有关知识发表的部分见解。其中正确的是( )
A.甲同学说:这个反应属于化合反应
B.乙同学说:该温度下NaHCO3的溶解度很大
C.丙同学説:反应后的溶液中存在NH4+
D.丁同学说:结晶出NaHCO3后的溶液中没有Na+
C
实战演练:
阅读课本44页多识一点的内容,回答下列问题:
优点:
原料经济易得
氨气和二氧化碳可循环使用
缺点:
氯化钠利用率低
产生了无用的氯化钙,用处不大,
且污染环境.
纯碱工业始创于18世纪,在很长一段时间内制碱技术把持在英、法、德、美等西方发达国家手中。1921年正在美国留学的侯德榜先生为了发展我国的民族工业,应爱国实业家范旭东先生之邀毅然回国,潜心研究制碱技术,成功地摸索和改进了西方的制碱方法,发明了将制碱与制氨结合起来的联合制碱法(又称侯氏制碱法)。侯德榜为纯碱和氮肥工业技术的发展做出了杰出的贡献。
侯德榜
2.侯氏制碱法是如何克服这个缺的?
向析出NaHCO3的氯化铵溶液中加入研细的NaCI,使NH4CI结晶析出,用作氮肥,氯化钠溶液可循环使用。
碳酸氢钠俗称小苏打,又称酸式碳酸钠,通常是白色晶体,能溶于水。
自学教材第44页的内容,归纳出碳酸钠和碳酸氢钠的部分性质及用途。
1.纯碱通常情况下为 , 溶于
水。
白色粉末
易
2.碳酸氢钠的俗名是 ,是 色
状 体, 溶于水。
小苏打
白
粉末
晶
能
知识拓展
清洗餐具
蒸馒头
碳酸钠在生活中的用途
清洗蔬菜表
面的农药
清洗鱼胆的苦味
灭
火
器
碳酸氢钠的用途
制胃酸过多
反应原理:
NaHCO3+HCl = NaCl + CO2 ↑+ H2O
碳酸饮料
发酵粉
析出固体后的溶液为NaHCO3的不饱和溶液
NaHCO3不是纯碱
从该反应可
以获得氮肥
该条件下NaHCO3
的溶解度较小
5、“NaCl+CO2+NH3+H2O=NaHCO3↓+NH4Cl”是著名的“侯氏制碱法”的重要反应。下面是4位同学对该反应涉及的有关知识发表的部分见解。其中不正确的是
A B C D
C
在发酵面团中加入下列某种物质进行揉和,既能除去面团中的酸,又能使蒸出的馒头疏松多孔。这种物质是( )
A.Na2CO3 B.Ca(OH)2
C.CaO D.NaCl
A
实战演练:
实验探究碳酸钠的化学性质
取少量碳酸钠溶液,加入试管中,滴入2—3滴酚酞试液,观察现象。
思考:显碱性的溶液一定是碱溶液吗?
实验现象:_____________________。
溶液变红
实验结论:
碳酸钠____(难/易)溶于水,溶液显___性。
碱
易
不一定
纯碱不是碱,是盐
向盛碳酸钠固体的试管中滴加稀盐酸,观察现象;迅速将燃着的木条伸进试管口,观察现象。
实验现象:______________________________。
有大量气泡产生,燃着的木条熄灭
思考:
(1)由现象可知生成物中一定有_____
(2)该反应的化学方程式
(3)若用稀硫酸代替稀盐酸进行实验,现象是否相同?
化学方程式
CO2
Na2CO3+2HCl = 2NaCl+CO2↑+H2O
Na2CO3+H2SO4 = Na2SO4+CO2↑+H2O
实验结论:碳酸钠可以与 或者 反应。
H2SO4
HCl
碳酸根离子的检验:
取样品于试管中,加 入稀盐酸,有气泡产生,将 生成的气体通入澄清石灰水,石灰水变浑浊。说明样品中含有碳酸根离子或碳酸氢根离子。
稀盐酸 澄清石灰水
方法
药品
Na2CO3+2HCl = 2NaCl+CO2↑+H2O
*
通过查找资料:你了解到哪些物质中含有碳酸盐?
主要成分是碳酸钙
石头纸
向盛有澄清石灰水的试管中滴加少量碳酸钠溶液,观察现象。
实验现象:_____________________。
该反应的化学方程式
____________________________。
实验结论:碳酸钠可以与 反应。
Ca(OH)2
Na2CO3+ Ca(OH)2 = 2NaOH+CaCO3↓(工业制烧碱)
产生白色沉淀
向盛有少量碳酸钠溶液的试管中滴加氯化
钡溶液,观察现象。
实验现象:_____________________。
该反应的化学方程式
__________________________________。
实验结论:碳酸钠可以与 反应。
BaCl2
Na2CO3+ BaCl2 = 2NaCl+BaCO3↓
产生白色沉淀
1.在滴有紫色石蕊试液的碳酸钠溶液中,加入过量盐酸,则加盐酸前后溶液的颜色依次为(?? ?)?
A.紫色、红色?? B.红色、蓝色?
C.蓝色、红色??? ?D.红色、无色
小试牛刀
C
2.小明学习化学后,在家里想用化学方法来鉴别碱面(主要成分是碳酸钠)和食盐,你认为下列方法可行的是( )
A.观察它们的颜色
B.取少量分别倒入食醋
C.分别倒入水中观察是否溶解
D.分别尝它们的味道
B
1.下列有关物质的化学式、名称、俗名不完全对应的是( )
A. NaCl 氯化钠 食盐
B. CaO 氧化钙 熟石灰
C. Na2CO3 碳酸钠 纯碱
D. NaOH 氢氧化钠 烧碱
达标检测
B
2.鱼胆弄破后会使鱼肉粘上难溶于水的胆汁酸而变苦,要减少这种苦味。用来洗涤的最佳物质是( )
A.水 B.食盐
C.纯碱 D.食醋
C
3.妈妈在洗碗筷时,经常在水中加入一种物质,很快就能将“油乎乎”的菜盘洗得干干净净,加入的物质可能是( )
A.汽油 B.烧碱
C.纯碱 D.食盐水
C
4.检验碳酸盐的正确方法是( )
A.滴加稀盐酸,产生使木条火焰熄灭的气体
B.滴加BaCl2溶液产生白色沉淀
C.加热,产生使澄清石灰水变浑浊的气体
D.滴加稀盐酸产生使澄清石灰水变浑浊的气体
D
1.什么是复分解反应?
2.哪些类物质间的反应是复分解反应?(你能用化学方程式表示吗?)
3.判断复分解反应能否进行,需考虑哪些因素?
4.复分解反应的实质是什么?
?
提出问题:
A
+
C
=
B
A
B
D
C
D
+
1、复分解反应:由两种化合物互相交换成分,生成另外两种化合物的反应。
酸+碱——盐+水
酸+盐——新酸+新盐
碱+盐——新碱+新盐
盐+盐——新盐+新盐
酸碱盐之间发生的反应一般都是复分解反应
2、复分解反应发生的条件
有气体(↑)
有H2O
有沉淀(↓)
(1)再水溶液中
(2)生成物中
如:2NaOH + H2SO4 = Na2SO4+2H2O
如:AgNO3+HCl = AgCl↓+HNO3
如:2HCl+CaCO3 = CaCl2+H2O+CO2↑
注意:反应前后各元素的化合价保持不变
Na+
OH-
H+
NO3-
H2O
NaOH溶液和稀HNO3反应
结论:
有水生成的复分解反应实质是 H+和OH-反应
实质:
旁观者:
NO3-和Na+
Na+
Na+
CO32-
Cl-
H+
Cl-
H+
H2O
碳酸钠和稀盐酸反应
结论:
有co2生成的复分解反应实质是CO32-和H+
反应
CO2
实质:
旁观者:
Cl-和Na+
CO2
Ba2+
SO42-
Cl-
Cl-
Na+
Na+
BaSO4
氯化钡与硫酸钠反应
结论:
有BaSO4沉淀生成的复分解反应实质是
Ba2+和SO42-反应
实质:
旁观者:
Cl-和Na+
酸、碱、盐所电离出的离子相互结合,生成沉淀、气体或者水的过程。
3、复分解反应的实质:
常见的哪些离子之间能产生沉淀、气体、水呢?
1.产生水的:
2.产生气体的:
3产生沉淀的
H+ + OH- →
H2O
(1) 2H+ + CO32- →
(2) H+ + HCO3- →
H2O + CO2↑
H2O + CO2↑
(3) NH4+ + OH- →
NH3↑+ H2O
BaSO4 ↓
Fe(OH)3 ↓
常见生成沉淀的离子
(1) Mg2+ + OH- →
Mg(OH)2↓
(2) Cu2+ + OH- →
Cu (OH)2↓
(3) Fe3+ + OH- →
(4) Ag+ + Cl- →
AgCl ↓
(5) Ba2+ + SO42- →
(6) Ba2+ +CO32- →
(7) Ca2+ + CO32- →
CaCO3 ↓
BaCO3 ↓
钾钠铵盐皆可溶,硝酸盐入水无影踪;
硫酸盐难溶铅和钡,氯化物不溶银亚汞;
碳酸盐只溶钾钠铵,碱溶钾钙钠钡铵;
课本P118溶解性表格记忆口诀
不能共存的离子
1.下列各组物质能够共存的是( )
A、FeCl3溶液、NaOH溶液
B、Ca(OH)2溶液、Na2CO3溶液
C、BaCl2溶液、HCl溶液
D、CaCO3、稀HNO3
C
方法点拨:共存即不反应,一般指
不生成沉淀、气体和水
2.不能在溶液中大量共存的一组离子是 ( )
A、K+、Na+、Mg2+、SO42-
B、Ca2+、H+、NO3-、Cl-
C、Mg2+、K+、NO3-、Cl-
D、H+、SO42-、Ba2+、NO3-
D
3.判断下列物质在水溶液里能否发生复分解反应:
(1)、KNO3+NaCl ( )
(2)、KNO3+Na2CO3 ( )
(3)、BaCl2+Na2SO4 ( )
(4)、FeCl3+NaOH ( )
(5)、CaCO3+HCl ( )
不能
不能
能
能
能
4.下列各组物质的溶液,混合后不能发生反应的一组是 ( )
A、BaCl2、NaCl、 Ca(NO3)2
B、AgNO3、HCl、Cu(NO3)2
C、Ca(OH)2、K2CO3、HCl
D、NaOH、H2SO4、Ba(NO3)2?
A
5.下列各组物质中,不能发生复分解反应
的是( )
A. HCl和Ca(OH)2
B. Na2CO3和H2SO4
C. Ca(OH)2 和Na2CO3
D. KCl和CuSO4
D
6.我国化学家侯德榜发明了联合制碱法,其生产纯碱和副产品氯化铵的工艺流程如下图所示:
中考零距离
(1)NH3溶于水得到氨水,将无色酚酞溶液滴入氨水中,溶液显 色。
(2)写出反应l的化学方程式 ;该反应的基本类型为 。
(3)操作a的过程是加入食盐、 、过滤。
(4)上述工艺流程中可循环利用的物质是 。
(5)最终产物是哪些?写出它们的化学式。
、 。
2NaHCO3 == Na2CO3+CO2↑+ H2O
△
红
分解反应
结晶
CO2
Na2CO3
NH4Cl
(6)有人认为侯氏制碱法的优点有四,你认为正确的是 (用序号回答)
①.生产过程中部分产品可以作为起始原料循环使用
②.副产品是一种可以利用的氮肥
③.有关的反应都不需要加热
④.副产品不会造成环境污染
①②④
常见盐的保健功能
1.高锰酸钾(又称PP粉):具有强氧化性,能杀死病菌,常用以消毒。其中,它的深紫色溶液(约0.3%~0.5%)杀菌力最强,多用于浴缸、便具、痰盂的消毒;紫红色溶液(约0.05%)可用以清洗伤口,浸洗足癣,也可用以对瓜果、蔬菜及餐具的消毒;浅红色溶液(0.01%以下)可用以漱口,有除臭消炎防龋作用。
【知识拓展】
2.硫酸亚铁:亚铁离子是血红蛋白的重要成分,硫酸亚铁可用于治疗缺铁性贫血。许多补血糖浆中均含有硫酸亚铁。
3.氯化钙:人体内的钙,是保证骨骼硬度、促进骨骼生长的主要成分。口服或注射氯化钙,可防治佝偻病、软骨病。与维生素D合用能更好地促进钙的吸收和储存。
4.氯化铁:手指一旦被划破后常会血流不止,若将氯化铁粉末撒入伤口,很快就能使流血凝固,且无痛感。原因在于它是一种重金属盐,能使血红蛋白变性。
5.硫酸锌:锌是人体内重要的微量元素,与生物体内七十多种酶的功能活性密切相关。锌摄取不足时,会产生体、智发育障碍、胃肠功能紊乱、偏头痛、夜盲、异食癖等。服用硫酸锌糖浆或片剂即可快速补充体内的锌元素。
6.碳酸钙:是自然界中大理石、石灰石、白垩的主要成分,实验室常用它做制取二氧化碳的原料:
CaCO3+2HCl = CaCl2+H2O+CO2↑
碳酸钙除了可做补钙剂,还是牙膏内的摩擦剂,通常由纯碱和熟石灰反应制得,反应的化学方程式为
Na2CO3+Ca(OH)2 = CaCO3↓+2NaOH。
汉白玉
7、亚硝酸钠(NaNO2) ——小心亚硝酸钠成为“杀手”
亚硝酸钠亚硝酸钠是工业用盐,它是一种白色不透明晶体,形状很像食盐。是致癌物质,其不仅存在于午餐肉中,在香肠、火腿等一些腌腊制品中都非常常见(主要作为一种增色剂、防腐剂使用,使肉颜色红润);尤其是煮过的剩菜中也存有亚硝酸钠。虽然亚硝酸钠是剧毒物质,但只要严格控制其食用量,对人体不会产生太大危害。
人体不能摄入过量的亚硝酸钠,否则0.3克~0.5克便能中毒,3克便能致死。中毒后症状为心率加速,嗜睡,烦躁不安,呼吸急促,恶心呕吐,腹痛腹泻等,重者甚至昏迷、昏厥,常死于呼吸衰竭。
???专家提醒,为避免亚硝酸钠对人体的危害,
平时要尽量少吃含有亚硝酸钠的食物。
8、硫酸钡
天然BaSO4又称重晶石,由于其中含有CaCO3等杂质。天然BaSO4用于生产涂料或高级纸张,可用作白色颜料 [锌钡白(ZnS.BaSO4) ZnSO4+BaS=ZnS.BaSO4]
并可作为油漆,油墨,塑料,橡胶的原料及填充剂。化工领域用它生产BaCl2及其他含钡化合物。
沉淀BaSO4较为纯净,在医学上,主要用作检查肠胃的内服药剂,进行钡餐透视。
重晶石
用钡餐观察肠内情况
快乐学习
快乐成长
祝大家学有所成!
同课章节目录
- 第七单元 常见的酸和碱
- 第一节 酸及其性质
- 第二节 碱及其性质
- 第三节 溶液的酸碱性
- 第四节 酸碱中和反应
- 到实验室去:探究酸和碱的化学性质
- 第八单元 海水中的化学
- 第一节 海洋化学资源
- 第二节 海水“晒盐“
- 第三节 海水“制碱“
- 到实验室去:粗盐中难溶性杂质的去除
- 第九单元 金属
- 第一节 常见的金属材料
- 第二节 金属的化学性质
- 第三节 钢铁的锈蚀与防护
- 到实验室去 探究金属的性质
- 第十单元 化学与健康
- 第一节 食物中的有机物
- 第二节 化学元素与人体健康
- 第三节 远离有毒物质
- 第十一单元 化学与社会发展
- 第一节 化学与能源开发
- 第二节 化学与材料研制
- 第三节 化学与农业生产
- 第四节 化学与环境保护
