图像题 考点测试 2021年中考化学专题复习学案
文档属性
| 名称 | 图像题 考点测试 2021年中考化学专题复习学案 |  | |
| 格式 | docx | ||
| 文件大小 | 531.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-04-22 11:40:39 | ||
图片预览


文档简介
《图像题》专题
班级
姓名
学号
知识梳理
1.明确题目所描述的化学情景。
看懂图像所表示的化学意义。
答题技巧:
(1)首先要明白横、纵坐标表示的意义,然后分析相关变化过程,对图像涉及的物理量之间的关系进行分析,最后再判断各物理量之间的变化关系与图像是否相符。
(2)重点要关注关键的三点(
、
、
)、曲线的变化
及横、纵坐标的比例关系。
二、考点透视
考点1
化学反应中反应物与生成物的质量变化图像
例1
分类
反应物的质量变化图像
生成物的质量变化图像
图像
举例
①加热高锰酸钾制取氧气
②等质量的镁条和氧气反应
①向CuSO4溶液中加入Fe粉
②向CuSO4和H2SO4的混合溶液中加入NaOH溶液
分析
①随着反应的进行,反应物KMnO4的质量逐渐
,直至质量减小到
,图像如图
所示。
②Mg和O2反应的质量关系为:
2Mg+O22MgO
质量 48
32
80
等质量的Mg和O2反应,随着反应的进行,反应物Mg和O2的质量均逐渐减小,最终
完全反应,
有剩余。Mg的质量变化如图
所示,O2的质量变化如图
所示。
①随着反应的进行,生成物FeSO4、Cu的质量均逐渐增大,反应结束后,生成物的质量不再改变,图像如图
所示。
②先发生反应:
,后发生反应:
,生成物Na2SO4的质量变化如图
所示,生成物Cu(OH)2的质量变化如图
所示。
考点2
物质溶解时溶液中溶质质量、溶液质量、溶质质量分数的变化图像
例2
过程
一定温度下,向一定量溶剂(如水)中加入A
一定温度下,向A的不饱和溶液中加入A
一定温度下,向A的饱和溶液中加入A
一定温度下,向A的饱和溶液中加入B
图像
分析
溶质A质量(质量分数)从0开始不断增大,当溶液达到
状态后,溶质质量(质量分数)不再改变
随着A的溶解,溶质(溶液)质量、溶质质量分数不断
(起点时大于0),当溶液达到
状态后均不再改变
原溶液饱和,A不能继续溶解,溶质(溶液)质量、溶质质量分数均
A的质量始终
,随着B溶解,溶液质量不断增大,当B不能溶解后,溶液质量不再改变,故溶质A的质量分数先
,后不再改变
考点3
溶液pH的变化图像
例3
分类
酸碱稀释过程中溶液pH的变化图像
中和反应过程中溶液pH的变化图像
酸性溶液稀释
碱性溶液稀释
向酸溶液中加入碱溶液
向碱溶液中加入酸溶液
图像
分析
溶液pH由小于7逐渐增大,但溶液始终显
性,溶液pH只能
7,而不能
7
溶液pH由大于7的逐渐减小,但溶液始终显
性,溶液pH只能
7,而不能
7
起点时,pH<7,随着碱溶液的加入,pH逐渐
;当二者恰好完全反应时,pH=
;再继续加入碱溶液,溶液显碱性,pH>7
起点时,pH>7,随着酸溶液的加入,pH逐渐
;当二者恰好完全反应时,pH=
;再继续加入酸溶液,溶液显酸性,pH<7
考点4
与CaO相关的变化图像
例4
分类
向饱和石灰水中加入少量CaO
向一定量的水、不饱和石灰水、饱和石灰水中分别加入CaO
溶质(溶液)质量的变化图像
溶质质量分数的变化图像
向一定量的水中加入CaO
向一定量的不饱和石灰水中加入CaO
图像
分析
①发生反应,放出热量,饱和石灰水中的
析出,导致溶质(溶液)质量减小;
②反应结束,恢复至原来的温度,Ca(OH)2的溶解度
,析出的重新溶解到溶液中,导致溶质(溶液)质量增大,但由于CaO消耗了一部分
,因此溶质(溶液)质量不会回到原来的状态。
溶液始终为
溶液。
①加入CaO,放出热量,温度升高后,Ca(OH)2的溶解度减小,饱和溶液的溶质质量分数
;
②反应结束,恢复至原来的温度,温度相同,同一物质饱和溶液的溶质质量分数相同,因此溶质质量分数
原来的状态。
①发生反应,生成的Ca(OH)2溶解在水中,溶质(溶液)质量
;
②当达到饱和状态时,溶质(溶液)质量达到
;
③继续加入CaO,CaO消耗了溶液中的水,溶液中的
Ca(OH)2析出,溶质(溶液)质量开始减小;
④当CaO把溶液中的水消耗完时,溶质(溶液)质量减小为
。
发生反应,生成的
Ca(OH)2
溶解在水中,形成Ca(OH)2不饱和溶液,继续加入CaO,即向不饱和溶液中加入CaO,溶质(溶液)质量的变化趋势与图
(不含零点)一致。
三、课堂训练
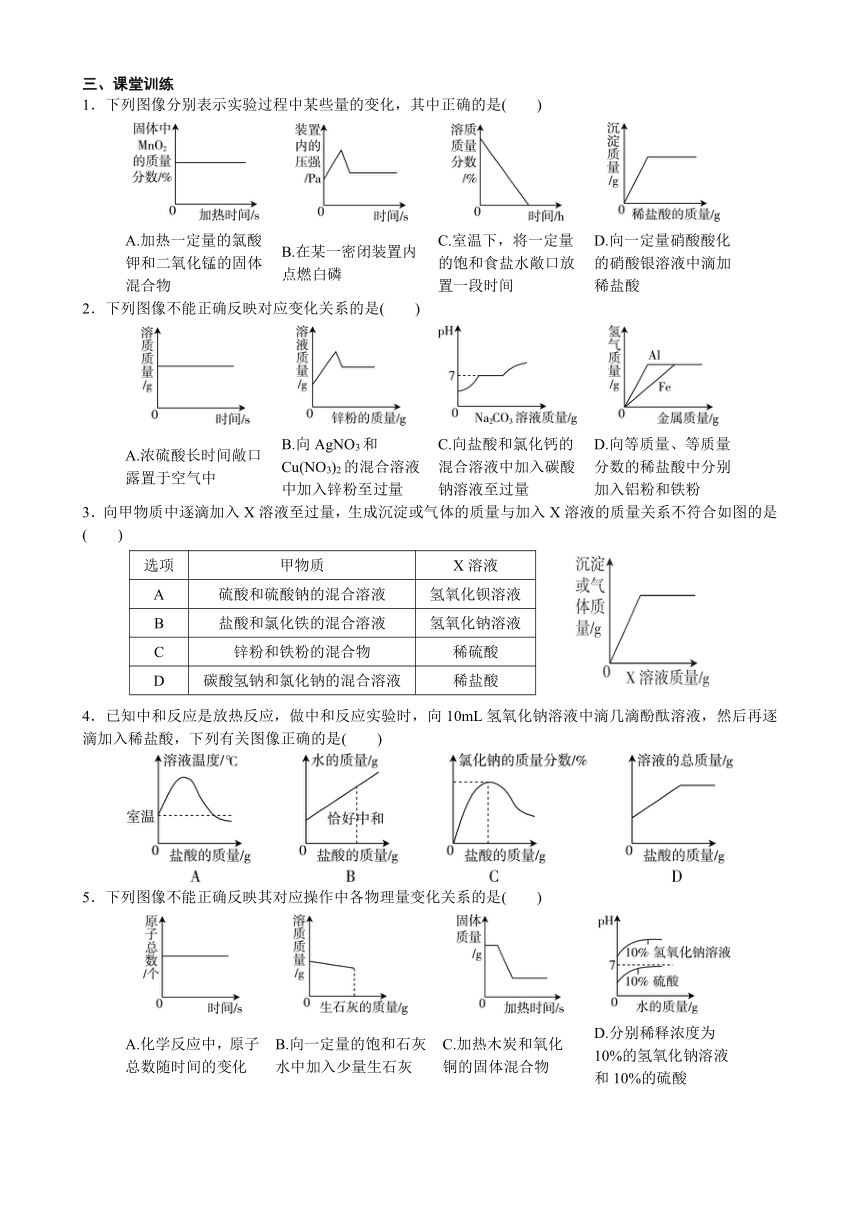
1.下列图像分别表示实验过程中某些量的变化,其中正确的是( )
A.加热一定量的氯酸钾和二氧化锰的固体混合物
B.在某一密闭装置内点燃白磷
C.室温下,将一定量的饱和食盐水敞口放置一段时间
D.向一定量硝酸酸化的硝酸银溶液中滴加稀盐酸
2.下列图像不能正确反映对应变化关系的是( )
A.浓硫酸长时间敞口露置于空气中
B.向AgNO3和Cu(NO3)2的混合溶液中加入锌粉至过量
C.向盐酸和氯化钙的混合溶液中加入碳酸钠溶液至过量
D.向等质量、等质量分数的稀盐酸中分别加入铝粉和铁粉
3.向甲物质中逐滴加入X溶液至过量,生成沉淀或气体的质量与加入X溶液的质量关系不符合如图的是( )
选项
甲物质
X溶液
A
硫酸和硫酸钠的混合溶液
氢氧化钡溶液
B
盐酸和氯化铁的混合溶液
氢氧化钠溶液
C
锌粉和铁粉的混合物
稀硫酸
D
碳酸氢钠和氯化钠的混合溶液
稀盐酸
4.已知中和反应是放热反应,做中和反应实验时,向10mL氢氧化钠溶液中滴几滴酚酞溶液,然后再逐滴加入稀盐酸,下列有关图像正确的是( )
5.下列图像不能正确反映其对应操作中各物理量变化关系的是( )
A.化学反应中,原子总数随时间的变化
B.向一定量的饱和石灰水中加入少量生石灰
C.加热木炭和氧化铜的固体混合物
D.分别稀释浓度为10%的氢氧化钠溶液和10%的硫酸
6.取一定质量的锌粒和铜片于同一敞口容器中,再逐渐加入稀硫酸。加入稀硫酸的质量与有关量的变化关系图正确的是(
)
A
B
C
D
7.下列图像与对应的操作过程相符的是(
)
①
②
③
④
A.①表示向一定的氯化钙溶液中通入二氧化碳至过量
B.②表示向pH=9的氨水中不断加水稀释
C.③表示将等质量的镁片和锌片分别加入足量且溶质的质量分数相同的稀硫酸中
D.④表示用两份溶液质量和溶质的质量分数均相等的过氧化氢溶液制取氧气
8.下列图像不能正确反应其对应变化关系的是(
)
A
B
C
D
A.高温煅烧一定质量的石灰石
B.将等质量的镁条和锌片分别加入相同体积、相同溶质质量分数的足量稀硫酸中
C.向一定质量的稀盐酸中逐滴加入氢氧化钠溶液
D.实验室电解水
9.下列图像不能正确反映对应关系的是(
)
A.在密闭的容器中加热汞得到氧化汞
B.向一定量的稀盐酸中滴加氢氧化钠溶液
C.两份等质量、等溶质的质量分数的过氧化氢溶液分别制取氧气
D.向等质量的Zn和Mg中分别滴加等溶质的质量分数的稀盐酸
参考答案
知识梳理
3.
(2)起点
转折点
终点
趋势
二、考点透视
例1
分类
反应物的质量变化图像
生成物的质量变化图像
图像
举例
①加热高锰酸钾制取氧气
②等质量的镁条和氧气反应
①向CuSO4溶液中加入Fe粉
②向CuSO4和H2SO4的混合溶液中加入NaOH溶液
分析
①随着反应的进行,反应物KMnO4的质量逐渐
减小
,直至质量减小到
0
,图像如图
A
所示。
②Mg和O2反应的质量关系为:
2Mg+O22MgO
质量 48
32
80
等质量的Mg和O2反应,随着反应的进行,反应物Mg和O2的质量均逐渐减小,最终Mg
完全反应,
O2有剩余。Mg的质量变化如图
A
所示,O2的质量变化如图
B
所示。
①随着反应的进行,生成物FeSO4、Cu的质量均逐渐增大,反应结束后,生成物的质量不再改变,图像如图
C
所示。
②先发生反应:2NaOH+H2SO4===Na2SO4+2H2O
,后发生反应:2NaOH+CuSO4===Cu(OH)2↓+Na2SO4,生成物Na2SO4的质量变化如图
C
所示,生成物Cu(OH)2的质量变化如图
D
所示。
例2
过程
一定温度下,向一定量溶剂(如水)中加入A
一定温度下,向A的不饱和溶液中加入A
一定温度下,向A的饱和溶液中加入A
一定温度下,向A的饱和溶液中加入B
图像
分析
溶质A质量(质量分数)从0开始不断增大,当溶液达到
饱和
状态后,溶质质量(质量分数)不再改变
随着A的溶解,溶质(溶液)质量、溶质质量分数不断
增大
(起点时大于0),当溶液达到饱和
状态后均不再改变
原溶液饱和,A不能继续溶解,溶质(溶液)质量、溶质质量分数均
保持不变
A的质量始终不变,随着B溶解,溶液质量不断增大,当B不能溶解后,溶液质量不再改变,故溶质A的质量分数先减小,后不再改变
例3
分类
酸碱稀释过程中溶液pH的变化图像
中和反应过程中溶液pH的变化图像
酸性溶液稀释
碱性溶液稀释
向酸溶液中加入碱溶液
向碱溶液中加入酸溶液
图像
分析
溶液pH由小于7逐渐增大,但溶液始终显酸性,溶液pH只能
接近
7,而不能
等于或大于
7
溶液pH由大于7的逐渐减小,但溶液始终显
碱
性,溶液pH只能
接近7,而不能等于或小于7
起点时,pH<7,随着碱溶液的加入,pH逐渐
增大
;当二者恰好完全反应时,pH=
7
;再继续加入碱溶液,溶液显碱性,pH>7
起点时,pH>7,随着酸溶液的加入,pH逐渐
减小
;当二者恰好完全反应时,pH=
7
;再继续加入酸溶液,溶液显酸性,pH<7
例4
分类
向饱和石灰水中加入少量CaO
向一定量的水、不饱和石灰水、饱和石灰水中分别加入CaO
溶质(溶液)质量的变化图像
溶质质量分数的变化图像
向一定量的水中加入CaO
向一定量的不饱和石灰水中加入CaO
图像
分析
①发生反应,放出热量,饱和石灰水中的
Ca(OH)2
析出,导致溶质(溶液)质量减小;
②反应结束,恢复至原来的温度,Ca(OH)2的溶解度减小,析出的重新溶解到溶液中,导致溶质(溶液)质量增大,但由于CaO消耗了一部分水,因此溶质(溶液)质量不会回到原来的状态。
溶液始终为饱和溶液。
①加入CaO,放出热量,温度升高后,Ca(OH)2的溶解度减小,饱和溶液的溶质质量分数
减小
;
②反应结束,恢复至原来的温度,温度相同,同一物质饱和溶液的溶质质量分数相同,因此溶质质量分数回到
原来的状态。
①发生反应,生成的Ca(OH)2溶解在水中,溶质(溶液)质量
增大
;
②当达到饱和状态时,溶质(溶液)质量达到
最大值
;
③继续加入CaO,CaO消耗了溶液中的水,溶液中的
Ca(OH)2析出,溶质(溶液)质量开始减小;
④当CaO把溶液中的水消耗完时,溶质(溶液)质量减小为
0。
发生反应,生成的
Ca(OH)2
溶解在水中,形成Ca(OH)2不饱和溶液,继续加入CaO,即向不饱和溶液中加入CaO,溶质(溶液)质量的变化趋势与图
3
(不含零点)一致。
三、课堂训练
1.D
2.B
3.B
4.C
5.D
6.C
7.C
8.D
9.C
班级
姓名
学号
知识梳理
1.明确题目所描述的化学情景。
看懂图像所表示的化学意义。
答题技巧:
(1)首先要明白横、纵坐标表示的意义,然后分析相关变化过程,对图像涉及的物理量之间的关系进行分析,最后再判断各物理量之间的变化关系与图像是否相符。
(2)重点要关注关键的三点(
、
、
)、曲线的变化
及横、纵坐标的比例关系。
二、考点透视
考点1
化学反应中反应物与生成物的质量变化图像
例1
分类
反应物的质量变化图像
生成物的质量变化图像
图像
举例
①加热高锰酸钾制取氧气
②等质量的镁条和氧气反应
①向CuSO4溶液中加入Fe粉
②向CuSO4和H2SO4的混合溶液中加入NaOH溶液
分析
①随着反应的进行,反应物KMnO4的质量逐渐
,直至质量减小到
,图像如图
所示。
②Mg和O2反应的质量关系为:
2Mg+O22MgO
质量 48
32
80
等质量的Mg和O2反应,随着反应的进行,反应物Mg和O2的质量均逐渐减小,最终
完全反应,
有剩余。Mg的质量变化如图
所示,O2的质量变化如图
所示。
①随着反应的进行,生成物FeSO4、Cu的质量均逐渐增大,反应结束后,生成物的质量不再改变,图像如图
所示。
②先发生反应:
,后发生反应:
,生成物Na2SO4的质量变化如图
所示,生成物Cu(OH)2的质量变化如图
所示。
考点2
物质溶解时溶液中溶质质量、溶液质量、溶质质量分数的变化图像
例2
过程
一定温度下,向一定量溶剂(如水)中加入A
一定温度下,向A的不饱和溶液中加入A
一定温度下,向A的饱和溶液中加入A
一定温度下,向A的饱和溶液中加入B
图像
分析
溶质A质量(质量分数)从0开始不断增大,当溶液达到
状态后,溶质质量(质量分数)不再改变
随着A的溶解,溶质(溶液)质量、溶质质量分数不断
(起点时大于0),当溶液达到
状态后均不再改变
原溶液饱和,A不能继续溶解,溶质(溶液)质量、溶质质量分数均
A的质量始终
,随着B溶解,溶液质量不断增大,当B不能溶解后,溶液质量不再改变,故溶质A的质量分数先
,后不再改变
考点3
溶液pH的变化图像
例3
分类
酸碱稀释过程中溶液pH的变化图像
中和反应过程中溶液pH的变化图像
酸性溶液稀释
碱性溶液稀释
向酸溶液中加入碱溶液
向碱溶液中加入酸溶液
图像
分析
溶液pH由小于7逐渐增大,但溶液始终显
性,溶液pH只能
7,而不能
7
溶液pH由大于7的逐渐减小,但溶液始终显
性,溶液pH只能
7,而不能
7
起点时,pH<7,随着碱溶液的加入,pH逐渐
;当二者恰好完全反应时,pH=
;再继续加入碱溶液,溶液显碱性,pH>7
起点时,pH>7,随着酸溶液的加入,pH逐渐
;当二者恰好完全反应时,pH=
;再继续加入酸溶液,溶液显酸性,pH<7
考点4
与CaO相关的变化图像
例4
分类
向饱和石灰水中加入少量CaO
向一定量的水、不饱和石灰水、饱和石灰水中分别加入CaO
溶质(溶液)质量的变化图像
溶质质量分数的变化图像
向一定量的水中加入CaO
向一定量的不饱和石灰水中加入CaO
图像
分析
①发生反应,放出热量,饱和石灰水中的
析出,导致溶质(溶液)质量减小;
②反应结束,恢复至原来的温度,Ca(OH)2的溶解度
,析出的重新溶解到溶液中,导致溶质(溶液)质量增大,但由于CaO消耗了一部分
,因此溶质(溶液)质量不会回到原来的状态。
溶液始终为
溶液。
①加入CaO,放出热量,温度升高后,Ca(OH)2的溶解度减小,饱和溶液的溶质质量分数
;
②反应结束,恢复至原来的温度,温度相同,同一物质饱和溶液的溶质质量分数相同,因此溶质质量分数
原来的状态。
①发生反应,生成的Ca(OH)2溶解在水中,溶质(溶液)质量
;
②当达到饱和状态时,溶质(溶液)质量达到
;
③继续加入CaO,CaO消耗了溶液中的水,溶液中的
Ca(OH)2析出,溶质(溶液)质量开始减小;
④当CaO把溶液中的水消耗完时,溶质(溶液)质量减小为
。
发生反应,生成的
Ca(OH)2
溶解在水中,形成Ca(OH)2不饱和溶液,继续加入CaO,即向不饱和溶液中加入CaO,溶质(溶液)质量的变化趋势与图
(不含零点)一致。
三、课堂训练
1.下列图像分别表示实验过程中某些量的变化,其中正确的是( )
A.加热一定量的氯酸钾和二氧化锰的固体混合物
B.在某一密闭装置内点燃白磷
C.室温下,将一定量的饱和食盐水敞口放置一段时间
D.向一定量硝酸酸化的硝酸银溶液中滴加稀盐酸
2.下列图像不能正确反映对应变化关系的是( )
A.浓硫酸长时间敞口露置于空气中
B.向AgNO3和Cu(NO3)2的混合溶液中加入锌粉至过量
C.向盐酸和氯化钙的混合溶液中加入碳酸钠溶液至过量
D.向等质量、等质量分数的稀盐酸中分别加入铝粉和铁粉
3.向甲物质中逐滴加入X溶液至过量,生成沉淀或气体的质量与加入X溶液的质量关系不符合如图的是( )
选项
甲物质
X溶液
A
硫酸和硫酸钠的混合溶液
氢氧化钡溶液
B
盐酸和氯化铁的混合溶液
氢氧化钠溶液
C
锌粉和铁粉的混合物
稀硫酸
D
碳酸氢钠和氯化钠的混合溶液
稀盐酸
4.已知中和反应是放热反应,做中和反应实验时,向10mL氢氧化钠溶液中滴几滴酚酞溶液,然后再逐滴加入稀盐酸,下列有关图像正确的是( )
5.下列图像不能正确反映其对应操作中各物理量变化关系的是( )
A.化学反应中,原子总数随时间的变化
B.向一定量的饱和石灰水中加入少量生石灰
C.加热木炭和氧化铜的固体混合物
D.分别稀释浓度为10%的氢氧化钠溶液和10%的硫酸
6.取一定质量的锌粒和铜片于同一敞口容器中,再逐渐加入稀硫酸。加入稀硫酸的质量与有关量的变化关系图正确的是(
)
A
B
C
D
7.下列图像与对应的操作过程相符的是(
)
①
②
③
④
A.①表示向一定的氯化钙溶液中通入二氧化碳至过量
B.②表示向pH=9的氨水中不断加水稀释
C.③表示将等质量的镁片和锌片分别加入足量且溶质的质量分数相同的稀硫酸中
D.④表示用两份溶液质量和溶质的质量分数均相等的过氧化氢溶液制取氧气
8.下列图像不能正确反应其对应变化关系的是(
)
A
B
C
D
A.高温煅烧一定质量的石灰石
B.将等质量的镁条和锌片分别加入相同体积、相同溶质质量分数的足量稀硫酸中
C.向一定质量的稀盐酸中逐滴加入氢氧化钠溶液
D.实验室电解水
9.下列图像不能正确反映对应关系的是(
)
A.在密闭的容器中加热汞得到氧化汞
B.向一定量的稀盐酸中滴加氢氧化钠溶液
C.两份等质量、等溶质的质量分数的过氧化氢溶液分别制取氧气
D.向等质量的Zn和Mg中分别滴加等溶质的质量分数的稀盐酸
参考答案
知识梳理
3.
(2)起点
转折点
终点
趋势
二、考点透视
例1
分类
反应物的质量变化图像
生成物的质量变化图像
图像
举例
①加热高锰酸钾制取氧气
②等质量的镁条和氧气反应
①向CuSO4溶液中加入Fe粉
②向CuSO4和H2SO4的混合溶液中加入NaOH溶液
分析
①随着反应的进行,反应物KMnO4的质量逐渐
减小
,直至质量减小到
0
,图像如图
A
所示。
②Mg和O2反应的质量关系为:
2Mg+O22MgO
质量 48
32
80
等质量的Mg和O2反应,随着反应的进行,反应物Mg和O2的质量均逐渐减小,最终Mg
完全反应,
O2有剩余。Mg的质量变化如图
A
所示,O2的质量变化如图
B
所示。
①随着反应的进行,生成物FeSO4、Cu的质量均逐渐增大,反应结束后,生成物的质量不再改变,图像如图
C
所示。
②先发生反应:2NaOH+H2SO4===Na2SO4+2H2O
,后发生反应:2NaOH+CuSO4===Cu(OH)2↓+Na2SO4,生成物Na2SO4的质量变化如图
C
所示,生成物Cu(OH)2的质量变化如图
D
所示。
例2
过程
一定温度下,向一定量溶剂(如水)中加入A
一定温度下,向A的不饱和溶液中加入A
一定温度下,向A的饱和溶液中加入A
一定温度下,向A的饱和溶液中加入B
图像
分析
溶质A质量(质量分数)从0开始不断增大,当溶液达到
饱和
状态后,溶质质量(质量分数)不再改变
随着A的溶解,溶质(溶液)质量、溶质质量分数不断
增大
(起点时大于0),当溶液达到饱和
状态后均不再改变
原溶液饱和,A不能继续溶解,溶质(溶液)质量、溶质质量分数均
保持不变
A的质量始终不变,随着B溶解,溶液质量不断增大,当B不能溶解后,溶液质量不再改变,故溶质A的质量分数先减小,后不再改变
例3
分类
酸碱稀释过程中溶液pH的变化图像
中和反应过程中溶液pH的变化图像
酸性溶液稀释
碱性溶液稀释
向酸溶液中加入碱溶液
向碱溶液中加入酸溶液
图像
分析
溶液pH由小于7逐渐增大,但溶液始终显酸性,溶液pH只能
接近
7,而不能
等于或大于
7
溶液pH由大于7的逐渐减小,但溶液始终显
碱
性,溶液pH只能
接近7,而不能等于或小于7
起点时,pH<7,随着碱溶液的加入,pH逐渐
增大
;当二者恰好完全反应时,pH=
7
;再继续加入碱溶液,溶液显碱性,pH>7
起点时,pH>7,随着酸溶液的加入,pH逐渐
减小
;当二者恰好完全反应时,pH=
7
;再继续加入酸溶液,溶液显酸性,pH<7
例4
分类
向饱和石灰水中加入少量CaO
向一定量的水、不饱和石灰水、饱和石灰水中分别加入CaO
溶质(溶液)质量的变化图像
溶质质量分数的变化图像
向一定量的水中加入CaO
向一定量的不饱和石灰水中加入CaO
图像
分析
①发生反应,放出热量,饱和石灰水中的
Ca(OH)2
析出,导致溶质(溶液)质量减小;
②反应结束,恢复至原来的温度,Ca(OH)2的溶解度减小,析出的重新溶解到溶液中,导致溶质(溶液)质量增大,但由于CaO消耗了一部分水,因此溶质(溶液)质量不会回到原来的状态。
溶液始终为饱和溶液。
①加入CaO,放出热量,温度升高后,Ca(OH)2的溶解度减小,饱和溶液的溶质质量分数
减小
;
②反应结束,恢复至原来的温度,温度相同,同一物质饱和溶液的溶质质量分数相同,因此溶质质量分数回到
原来的状态。
①发生反应,生成的Ca(OH)2溶解在水中,溶质(溶液)质量
增大
;
②当达到饱和状态时,溶质(溶液)质量达到
最大值
;
③继续加入CaO,CaO消耗了溶液中的水,溶液中的
Ca(OH)2析出,溶质(溶液)质量开始减小;
④当CaO把溶液中的水消耗完时,溶质(溶液)质量减小为
0。
发生反应,生成的
Ca(OH)2
溶解在水中,形成Ca(OH)2不饱和溶液,继续加入CaO,即向不饱和溶液中加入CaO,溶质(溶液)质量的变化趋势与图
3
(不含零点)一致。
三、课堂训练
1.D
2.B
3.B
4.C
5.D
6.C
7.C
8.D
9.C
同课章节目录
