2021届高考化学三轮复习专项冲刺:综合实验(一)课件(26张ppt)
文档属性
| 名称 | 2021届高考化学三轮复习专项冲刺:综合实验(一)课件(26张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-04-21 16:09:58 | ||
图片预览




文档简介
(共26张PPT)
2021届高考化学二轮复习
综合实验题(一)
命题调研 (2016~2020五年大数据)
2016~2020五年考点分布图
核心素养与考情预测
核心素养:科学探究与创新意识
考情预测:实验综合题主要以物质制备和性质探究考查为主,通常为考生提供一个真实的实验环境,让考生用已有的化学原理和实验技能,结合新信息、新问题去研究和解决问题,预计2021年难度稳中有升,可能涉及到方案设计、定量分析等较高层次的要求。
常用教材实验派生、发展出来的工业产品、实验流程、科技成果转化等背景材料进行命题,呈现真实问题情境,凸显化学学科的实用性。考查学生对化学学科知识、实验基本操作、基本装置的掌握情况,基本原理的理解和应用程度,强调完成实验能力和实验探究能力。
实验大题三大类型分别是物质制备分离型、性质原理探究型、定量分析型。近年来比较喜欢和工艺流程相结合进行考查,如2019年全国卷I等。
题目的结构一般包含三个部分:题干、装置或者流程图、问题,有的还含有较多信息(一般为有机实验)
实验综合题特点
考情预测
1.近年来实验综合题考查比较简单,侧重基本模型和答题规范
3.2021年高考关注和工艺流程相结合的制备类实验及定量分析类实验。难度稳中有升,侧重答题规范。
2.从2020年高考全国卷和新高考地方卷来看制备类实验考查更为广泛,因此制备类实验模型及答案规范依旧是重心
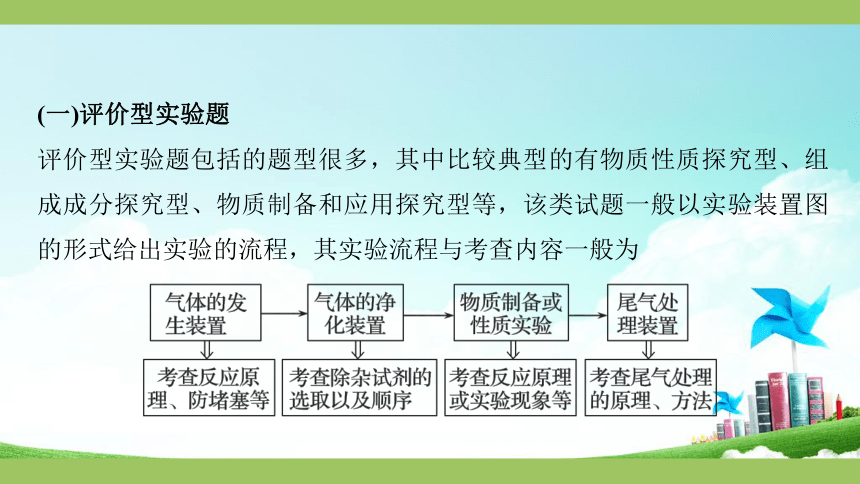
(一)评价型实验题
评价型实验题包括的题型很多,其中比较典型的有物质性质探究型、组成成分探究型、物质制备和应用探究型等,该类试题一般以实验装置图的形式给出实验的流程,其实验流程与考查内容一般为
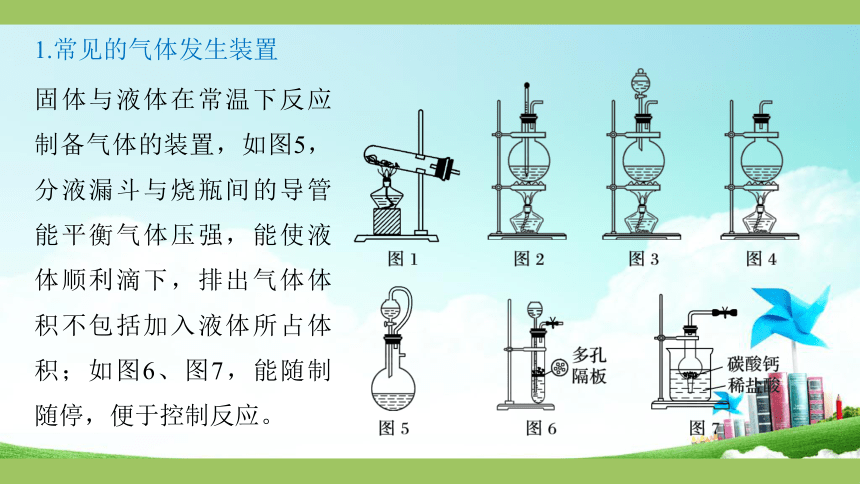
1.常见的气体发生装置
固体与液体在常温下反应制备气体的装置,如图5,分液漏斗与烧瓶间的导管能平衡气体压强,能使液体顺利滴下,排出气体体积不包括加入液体所占体积;如图6、图7,能随制随停,便于控制反应。
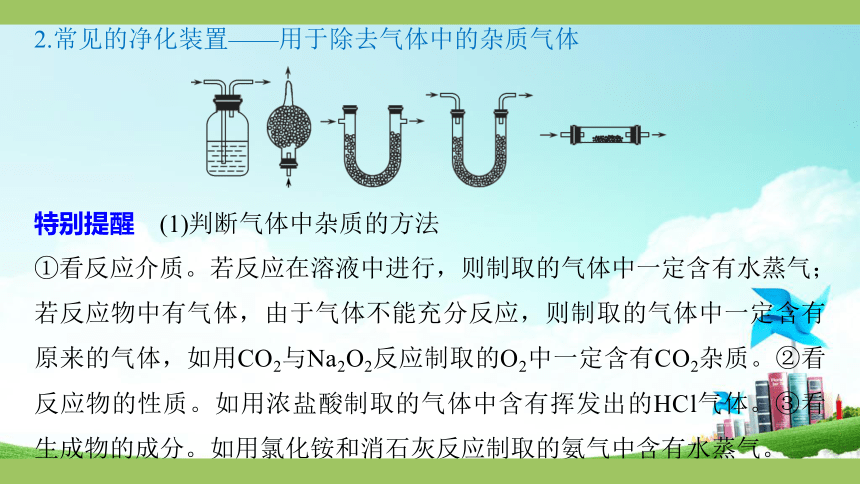
2.常见的净化装置——用于除去气体中的杂质气体
特别提醒 (1)判断气体中杂质的方法
①看反应介质。若反应在溶液中进行,则制取的气体中一定含有水蒸气;若反应物中有气体,由于气体不能充分反应,则制取的气体中一定含有原来的气体,如用CO2与Na2O2反应制取的O2中一定含有CO2杂质。②看反应物的性质。如用浓盐酸制取的气体中含有挥发出的HCl气体。③看生成物的成分。如用氯化铵和消石灰反应制取的氨气中含有水蒸气。
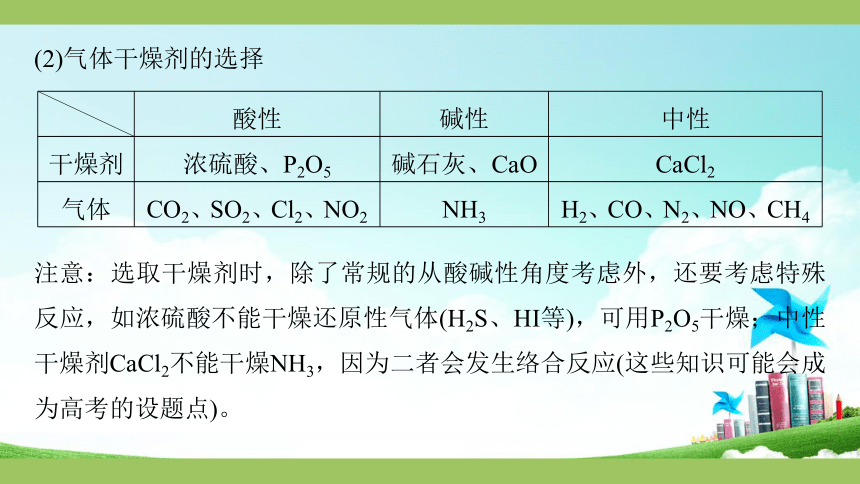
(2)气体干燥剂的选择
?
酸性
碱性
中性
干燥剂
浓硫酸、P2O5
碱石灰、CaO
CaCl2
气体
CO2、SO2、Cl2、NO2
NH3
H2、CO、N2、NO、CH4
注意:选取干燥剂时,除了常规的从酸碱性角度考虑外,还要考虑特殊反应,如浓硫酸不能干燥还原性气体(H2S、HI等),可用P2O5干燥;中性干燥剂CaCl2不能干燥NH3,因为二者会发生络合反应(这些知识可能会成为高考的设题点)。
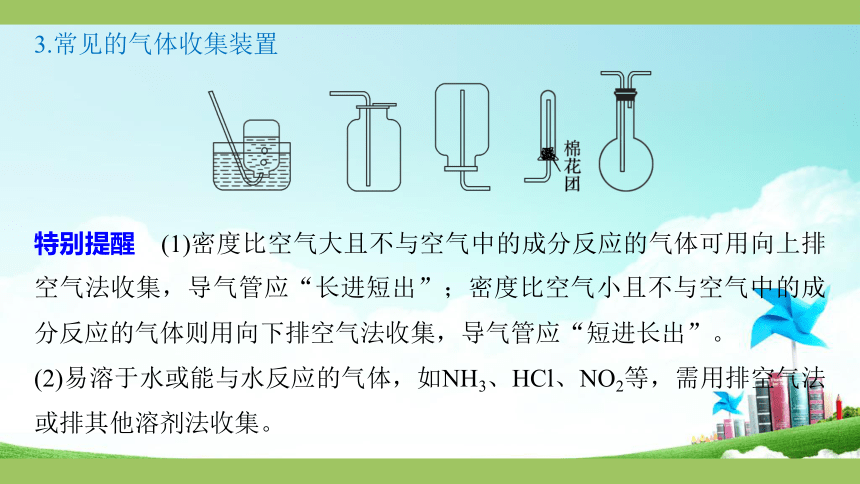
3.常见的气体收集装置
特别提醒 (1)密度比空气大且不与空气中的成分反应的气体可用向上排空气法收集,导气管应“长进短出”;密度比空气小且不与空气中的成分反应的气体则用向下排空气法收集,导气管应“短进长出”。
(2)易溶于水或能与水反应的气体,如NH3、HCl、NO2等,需用排空气法或排其他溶剂法收集。
(3)常温下能与空气中的成分反应的气体(如NO),密度与空气接近的气体(如N2、CO、C2H4等),都不能用排空气法收集。
(4)能溶于水但溶解度不大的气体,可以用排饱和溶液的方法收集,如CO2——排饱和NaHCO3溶液;SO2——排饱和NaHSO3溶液;H2S——排饱和NaHS溶液;Cl2——排饱和NaCl溶液。
4.常见的量气装置
5.有毒气体的处理装置
特别提醒 (1)装置C适用于溶解度较小的有毒气体,如Cl2、NO2、H2S等。
(2)装置D、E适用于溶解度较大的气体,如HCl、NH3等。
(3)装置A适用于某些可燃性气体,如CO等。
(4)装置B采用收集法处理尾气,适用于NO、CO等的尾气处理。
1.(2020·课标全国Ⅰ,27)为验证不同化合价铁的氧化还原能力,利用下列电池装置进行实验。
回答下列问题:
(1)由FeSO4·7H2O固体配制0.10
mol·L-1
FeSO4溶液,需要的仪器有药匙、玻璃棒、________(从下列图中选择,写出名称)。
(2)电池装置中,盐桥连接两电极电解质溶液。盐桥中阴、阳离子不与溶液中的物质发生化学反应,并且电迁移率(u∞)应尽可能地相近。根据下表数据,盐桥中应选择________作为电解质。
(3)电流表显示电子由铁电极流向石墨电极。可知,盐桥中的阳离子进入________电极溶液中。
(4)电池反应一段时间后,测得铁电极溶液中c(Fe2+)增加了0.02
mol·L-1。石墨电极上未见Fe析出。可知,石墨电极溶液中c(Fe2+)=________。
(5)根据(3)、(4)实验结果,可知石墨电极的电极反应式为_______________________,铁电极的电极反应式为____________________________________。因此,验证了Fe2+氧化性小于________、还原性小于________。
(6)实验前需要对铁电极表面活化。在FeSO4溶液中加入几滴Fe2(SO4)3溶液,将铁电极浸泡一段时间,铁电极表面被刻蚀活化。检验活化反应完成的方法是
_________________________________________________。
答案 (1)烧杯、量筒、托盘天平
(2)KCl (3)石墨 (4)0.09
mol·L-1
(5)2Fe3++2e-===2Fe2+ Fe-2e-===Fe2+ Fe3+ Fe
(6)取少量活化后溶液于试管,滴入KSCN溶液,不出现红色
2.(2020·课标全国Ⅱ,27)苯甲酸可用作食品防腐剂。实验室可通过甲苯氧化制苯甲酸,其反应原理简示如下:
名称
相对分子质量
熔点/℃
沸点/℃
密度/(g·mL-1)
溶解性
甲苯
92
-95
110.6
0.867
不溶于水,易溶于乙醇
苯甲酸
122
122.4(100
℃左右开始升华)
248
—
微溶于冷水,易溶于乙醇、热水
实验步骤:
(1)在装有温度计、冷凝管和搅拌器的三颈烧瓶中加入1.5
mL甲苯、100
mL水和4.8
g(约0.03
mol)高锰酸钾,慢慢开启搅拌器,并加热回流至回流液不再出现油珠。
(2)停止加热,继续搅拌,冷却片刻后,从冷凝管上口慢慢加入适量饱和亚硫酸氢钠溶液,并将反应混合物趁热过滤,用少量热水洗涤滤渣。合并滤液和洗涤液,于冰水浴中冷却,然后用浓盐酸酸化至苯甲酸析出完全。将析出的苯甲酸过滤,用少量冷水洗涤,放在沸水浴上干燥。称量,粗产品为1.0
g。
(3)纯度测定:称取0.122
g粗产品,配成乙醇溶液,于100
mL容量瓶中定容。每次移取25.00
mL溶液,用0.010
00
mol·L-1的KOH标准溶液滴定,三次滴定平均消耗21.50
mL的KOH标准溶液。
回答下列问题:
(1)根据上述实验药品的用量,三颈烧瓶的最适宜规格为________(填字母)。
A.100
mL
B.250
mL
C.500
mL
D.1
000
mL
(2)在反应装置中应选用________冷凝管(填“直形”或“球形”),当回流液不再出现油珠即可判断反应已完成,其判断理由是________________________。
(3)加入适量饱和亚硫酸氢钠溶液的目的是___________________________
_________________________________________________;
该步骤亦可用草酸在酸性条件下处理,请用反应的离子方程式表达其原理
_________________________________________________。
(4)“用少量热水洗涤滤渣”一步中滤渣的主要成分是________。
(5)干燥苯甲酸晶体时,若温度过高,可能出现的结果是
_________________________________________________。
(6)本实验制备的苯甲酸的纯度为________;据此估算本实验中苯甲酸的产率最接近于________(填字母)。
A.70%
B.60%
C.50%
D.40%
(7)若要得到纯度更高的苯甲酸,可通过在水中________的方法提纯。
一般7-10空,14-15分阅读量平均400字符,知识点主要有:
(1)常用仪器识别、用途和使用方法;
(2)实验基本操作、实验安全及实验事故处理;
(3)常见气体的实验室制法
;
(4)物质的检验、分离和提纯;
(5)仪器连接或实验步骤设计、评价或改进实验方案;
(6)实验条件的控制;
(7)实验数据的处理;
(8)方程式书写
实验综合题常见考查点
分析模型
圈注信息
(与化学相关的信息)
明确题型
了解原理
物质制备分离型
性质原理探究型
定量分析型
装置功能各步骤分目的
实验目的方法
物质结构性质
反应条件等
快速粗读题干
2021届高考化学二轮复习
综合实验题(一)
命题调研 (2016~2020五年大数据)
2016~2020五年考点分布图
核心素养与考情预测
核心素养:科学探究与创新意识
考情预测:实验综合题主要以物质制备和性质探究考查为主,通常为考生提供一个真实的实验环境,让考生用已有的化学原理和实验技能,结合新信息、新问题去研究和解决问题,预计2021年难度稳中有升,可能涉及到方案设计、定量分析等较高层次的要求。
常用教材实验派生、发展出来的工业产品、实验流程、科技成果转化等背景材料进行命题,呈现真实问题情境,凸显化学学科的实用性。考查学生对化学学科知识、实验基本操作、基本装置的掌握情况,基本原理的理解和应用程度,强调完成实验能力和实验探究能力。
实验大题三大类型分别是物质制备分离型、性质原理探究型、定量分析型。近年来比较喜欢和工艺流程相结合进行考查,如2019年全国卷I等。
题目的结构一般包含三个部分:题干、装置或者流程图、问题,有的还含有较多信息(一般为有机实验)
实验综合题特点
考情预测
1.近年来实验综合题考查比较简单,侧重基本模型和答题规范
3.2021年高考关注和工艺流程相结合的制备类实验及定量分析类实验。难度稳中有升,侧重答题规范。
2.从2020年高考全国卷和新高考地方卷来看制备类实验考查更为广泛,因此制备类实验模型及答案规范依旧是重心
(一)评价型实验题
评价型实验题包括的题型很多,其中比较典型的有物质性质探究型、组成成分探究型、物质制备和应用探究型等,该类试题一般以实验装置图的形式给出实验的流程,其实验流程与考查内容一般为
1.常见的气体发生装置
固体与液体在常温下反应制备气体的装置,如图5,分液漏斗与烧瓶间的导管能平衡气体压强,能使液体顺利滴下,排出气体体积不包括加入液体所占体积;如图6、图7,能随制随停,便于控制反应。
2.常见的净化装置——用于除去气体中的杂质气体
特别提醒 (1)判断气体中杂质的方法
①看反应介质。若反应在溶液中进行,则制取的气体中一定含有水蒸气;若反应物中有气体,由于气体不能充分反应,则制取的气体中一定含有原来的气体,如用CO2与Na2O2反应制取的O2中一定含有CO2杂质。②看反应物的性质。如用浓盐酸制取的气体中含有挥发出的HCl气体。③看生成物的成分。如用氯化铵和消石灰反应制取的氨气中含有水蒸气。
(2)气体干燥剂的选择
?
酸性
碱性
中性
干燥剂
浓硫酸、P2O5
碱石灰、CaO
CaCl2
气体
CO2、SO2、Cl2、NO2
NH3
H2、CO、N2、NO、CH4
注意:选取干燥剂时,除了常规的从酸碱性角度考虑外,还要考虑特殊反应,如浓硫酸不能干燥还原性气体(H2S、HI等),可用P2O5干燥;中性干燥剂CaCl2不能干燥NH3,因为二者会发生络合反应(这些知识可能会成为高考的设题点)。
3.常见的气体收集装置
特别提醒 (1)密度比空气大且不与空气中的成分反应的气体可用向上排空气法收集,导气管应“长进短出”;密度比空气小且不与空气中的成分反应的气体则用向下排空气法收集,导气管应“短进长出”。
(2)易溶于水或能与水反应的气体,如NH3、HCl、NO2等,需用排空气法或排其他溶剂法收集。
(3)常温下能与空气中的成分反应的气体(如NO),密度与空气接近的气体(如N2、CO、C2H4等),都不能用排空气法收集。
(4)能溶于水但溶解度不大的气体,可以用排饱和溶液的方法收集,如CO2——排饱和NaHCO3溶液;SO2——排饱和NaHSO3溶液;H2S——排饱和NaHS溶液;Cl2——排饱和NaCl溶液。
4.常见的量气装置
5.有毒气体的处理装置
特别提醒 (1)装置C适用于溶解度较小的有毒气体,如Cl2、NO2、H2S等。
(2)装置D、E适用于溶解度较大的气体,如HCl、NH3等。
(3)装置A适用于某些可燃性气体,如CO等。
(4)装置B采用收集法处理尾气,适用于NO、CO等的尾气处理。
1.(2020·课标全国Ⅰ,27)为验证不同化合价铁的氧化还原能力,利用下列电池装置进行实验。
回答下列问题:
(1)由FeSO4·7H2O固体配制0.10
mol·L-1
FeSO4溶液,需要的仪器有药匙、玻璃棒、________(从下列图中选择,写出名称)。
(2)电池装置中,盐桥连接两电极电解质溶液。盐桥中阴、阳离子不与溶液中的物质发生化学反应,并且电迁移率(u∞)应尽可能地相近。根据下表数据,盐桥中应选择________作为电解质。
(3)电流表显示电子由铁电极流向石墨电极。可知,盐桥中的阳离子进入________电极溶液中。
(4)电池反应一段时间后,测得铁电极溶液中c(Fe2+)增加了0.02
mol·L-1。石墨电极上未见Fe析出。可知,石墨电极溶液中c(Fe2+)=________。
(5)根据(3)、(4)实验结果,可知石墨电极的电极反应式为_______________________,铁电极的电极反应式为____________________________________。因此,验证了Fe2+氧化性小于________、还原性小于________。
(6)实验前需要对铁电极表面活化。在FeSO4溶液中加入几滴Fe2(SO4)3溶液,将铁电极浸泡一段时间,铁电极表面被刻蚀活化。检验活化反应完成的方法是
_________________________________________________。
答案 (1)烧杯、量筒、托盘天平
(2)KCl (3)石墨 (4)0.09
mol·L-1
(5)2Fe3++2e-===2Fe2+ Fe-2e-===Fe2+ Fe3+ Fe
(6)取少量活化后溶液于试管,滴入KSCN溶液,不出现红色
2.(2020·课标全国Ⅱ,27)苯甲酸可用作食品防腐剂。实验室可通过甲苯氧化制苯甲酸,其反应原理简示如下:
名称
相对分子质量
熔点/℃
沸点/℃
密度/(g·mL-1)
溶解性
甲苯
92
-95
110.6
0.867
不溶于水,易溶于乙醇
苯甲酸
122
122.4(100
℃左右开始升华)
248
—
微溶于冷水,易溶于乙醇、热水
实验步骤:
(1)在装有温度计、冷凝管和搅拌器的三颈烧瓶中加入1.5
mL甲苯、100
mL水和4.8
g(约0.03
mol)高锰酸钾,慢慢开启搅拌器,并加热回流至回流液不再出现油珠。
(2)停止加热,继续搅拌,冷却片刻后,从冷凝管上口慢慢加入适量饱和亚硫酸氢钠溶液,并将反应混合物趁热过滤,用少量热水洗涤滤渣。合并滤液和洗涤液,于冰水浴中冷却,然后用浓盐酸酸化至苯甲酸析出完全。将析出的苯甲酸过滤,用少量冷水洗涤,放在沸水浴上干燥。称量,粗产品为1.0
g。
(3)纯度测定:称取0.122
g粗产品,配成乙醇溶液,于100
mL容量瓶中定容。每次移取25.00
mL溶液,用0.010
00
mol·L-1的KOH标准溶液滴定,三次滴定平均消耗21.50
mL的KOH标准溶液。
回答下列问题:
(1)根据上述实验药品的用量,三颈烧瓶的最适宜规格为________(填字母)。
A.100
mL
B.250
mL
C.500
mL
D.1
000
mL
(2)在反应装置中应选用________冷凝管(填“直形”或“球形”),当回流液不再出现油珠即可判断反应已完成,其判断理由是________________________。
(3)加入适量饱和亚硫酸氢钠溶液的目的是___________________________
_________________________________________________;
该步骤亦可用草酸在酸性条件下处理,请用反应的离子方程式表达其原理
_________________________________________________。
(4)“用少量热水洗涤滤渣”一步中滤渣的主要成分是________。
(5)干燥苯甲酸晶体时,若温度过高,可能出现的结果是
_________________________________________________。
(6)本实验制备的苯甲酸的纯度为________;据此估算本实验中苯甲酸的产率最接近于________(填字母)。
A.70%
B.60%
C.50%
D.40%
(7)若要得到纯度更高的苯甲酸,可通过在水中________的方法提纯。
一般7-10空,14-15分阅读量平均400字符,知识点主要有:
(1)常用仪器识别、用途和使用方法;
(2)实验基本操作、实验安全及实验事故处理;
(3)常见气体的实验室制法
;
(4)物质的检验、分离和提纯;
(5)仪器连接或实验步骤设计、评价或改进实验方案;
(6)实验条件的控制;
(7)实验数据的处理;
(8)方程式书写
实验综合题常见考查点
分析模型
圈注信息
(与化学相关的信息)
明确题型
了解原理
物质制备分离型
性质原理探究型
定量分析型
装置功能各步骤分目的
实验目的方法
物质结构性质
反应条件等
快速粗读题干
同课章节目录
