第二节 元素周期律
图片预览





文档简介
(共18张PPT)
第二节 元素周期律
1
B
Al
Si
Ge
As
Sb
Te
2
3
4
5
6
7
ⅠA
ⅡA
ⅢA
ⅣA
ⅤA
ⅥA
ⅦA
0
Po
At
非金属性逐渐增强
金属性逐渐增强
金属性逐渐增强
非金属性逐渐增强
非金属区
金属区
零
族
元
素
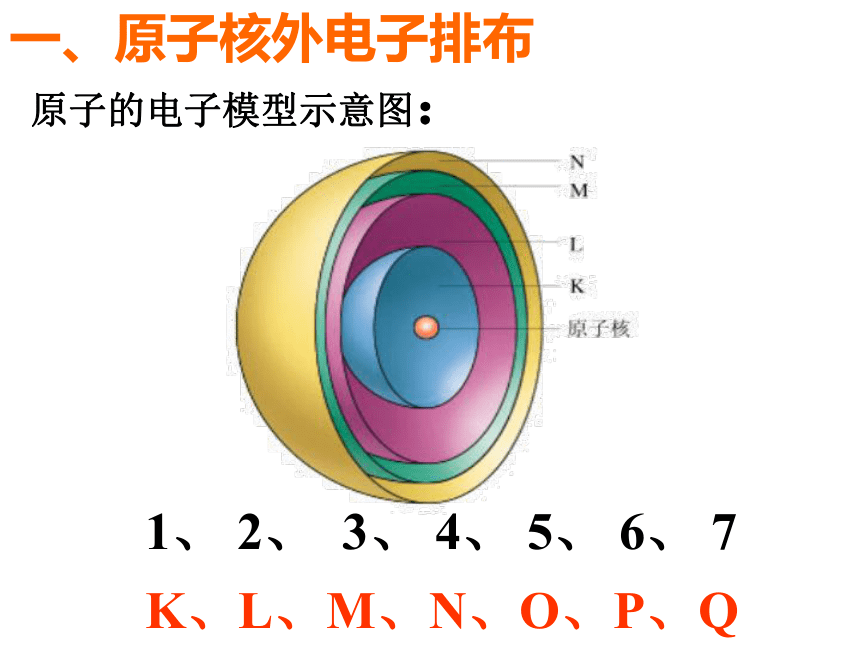
一、原子核外电子排布
原子的电子模型示意图:
1、 2、 3、 4、 5、 6、 7
K、L、M、N、O、P、Q
核外电子排布规律:
2. 各电子层最多容纳的电子数目是2n2个(其中上式中 n 指的是电子层序数)。
3. 最外层电子数目不超过8个(K层为最外层时,不超过2个)。
1. 核外电子总是先排布在能量最低的电子层里,然后由里向外,依次排布在能量逐步升高的电子层上(即排满了K层才排L层,排满L层才排M层)。
次外层电子数目不超过18个,倒数第三层电子数目不超过32个,(K层为次外层时,不超过2个)。
练习1:某元素有3个电子层,最外层电子数是电子总数的1/6,该元素的元素符号是:______。
练习2:写出下列元素原子的原子结构示意图:
83号元素 52号元素
第5周期第ⅦA族元素
3、某元素的原子核外有3个电子层,最外层有4个电子,该原子核内的质子数为( )
A、14 B、15 C、16 D、17
二、元素周期律
结论:
11~18
3~10
1→0
1→2
1
1~2
最高或最低化合价变化
最外层电子数
电子层数
原子序数
-4→-1→0
+1→+5
-4→-1→0
+1→+7
2
1→8
3
1→8
随着原子序数的递增,元素原子的电子层排布和化合价都呈现周期性变化。
科学探究1:电子排布和化合价的变化规律,完成两个表格并思考相关问题。
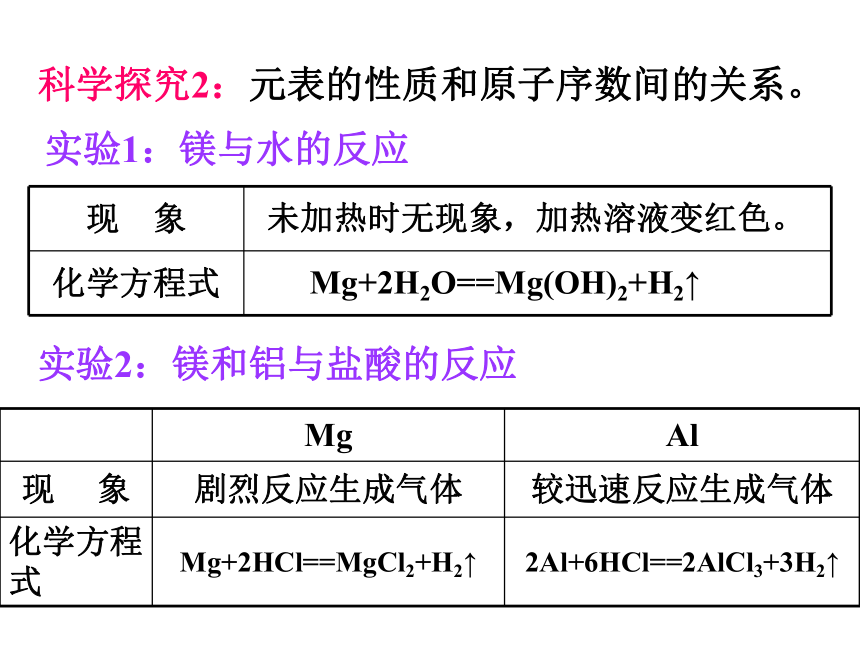
科学探究2:元表的性质和原子序数间的关系。
实验1:镁与水的反应
现 象
化学方程式
未加热时无现象,加热溶液变红色。
Mg+2H2O==Mg(OH)2+H2↑
实验2:镁和铝与盐酸的反应
Mg Al
现 象 剧烈反应生成气体 较迅速反应生成气体
化学方程式 Mg+2HCl==MgCl2+H2↑ 2Al+6HCl==2AlCl3+3H2↑
金属元素性质 Na Mg Al
单质和水(或酸)
的反应情况
最高价氧化物对应水化物碱性
钠镁铝性质比较
跟冷水剧
烈反应
NaOH
强碱
跟沸水反应
放H2;跟酸
剧烈反应放
H2
Mg(OH)2
中强碱
跟酸较为
迅速反应
放H2
Al(OH)3
两性
氢氧化物
结论:金属性 Na>Mg>Al
资料3:非金属性质的变化规律
Si P S Cl
单质与氢气反应的条件 高温 磷蒸气与氢气能反应 加热 光照或点燃时发生爆炸而化合
最高价氧化物对应的水化物(含氧酸)酸性强弱 H4SiO4
弱酸 H3PO4
中强酸 H2SO4
强酸 HClO4
最强酸(比硫酸酸性强)
通过上表分析,能得出第三周期元素的金属性与
非金属性变化情况如何?
14Si 15P 16S 17Cl
对应氧化物
氧化物的水化物
酸性强弱
单质与H2反应条件
气态氢化物及稳定性
氢化物水溶液的酸性
结论
SiO2
P2O5
SO3
Cl2O7
H4SiO4
H3PO4
H2SO4
HClO4
弱酸
中强酸
强酸
最强酸
逐渐增强
高温
加热
加热
点燃或光照
SiH4
PH3
H2S
HCl
逐渐增强
逐渐增强
非金属性逐渐增强
11--18号元素性质的变化中得出如下的结论:
Na Mg Al Si P S Cl
Ar
稀有气体元素
金属性逐渐减弱,非金属性逐渐增强
元素周期律:元素的性质随着元素原子序数的递增而呈周期性的变化。元素周期律是元素原子的核外电子排布的周期性变化的必然结果。
同一周期元素,随核电荷数增大,
金属性逐渐减弱,非金属性逐渐增强。
ⅠA ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA
族
周期
金属性逐渐增强
原子半径逐渐增大
还原性增强
1
2
3
4
5
6
7
B
Al
Si
Ge
As
Sb
Te
Po
At
非金属性逐渐增强
原子半径逐渐减小
氧化性增强
金属性逐渐增强
非金属性逐渐增强
逐渐减小
逐渐增大
三、元素周期表和元素周期律的应用
1.元素的金属性和非金属性与元素在周期表中位置的关系
2.元素化合价与元素在周期表中位置的关系。
(1)价电子:
(2)
(3)
(4)特殊:氧元素; 氟元素; 金属元素.
最外层电子
最高正价 + |最低负价| =8(H 除外)
主族序数=最外层电子数=最高正价
结构
性质
位置
决定
推导
推导
推导
推导
决定
元素“位、构、性”的关系
周期序数 = 电子层数
主族序数=最外层电子数
同周期:递变性
同主族:递变性、相似性
原子半径
电子层结构
金属性/非金属性、化合价
1.下列对铯及其化合物的预测正确的是( )
A.铯的熔点很高
B.在自然界中,铯能以游离态存在
C.氯化铯易溶于水
D.铯只有一种氧化物Cs2O
C
2、下列性质的递变中,正确的是( )
A、O、S、Na的原子半径依次增大
B、LiOH、KOH、CsOH的碱性依次增强
C、HF、NH3、SiH4的稳定性依次增强
D、HCl、HBr、HI的还原性依次减弱
AB
3、应用——在周期表一定区域内寻找元素,发现物质的新用途。
(1)预言未知元素并证实.
(2)分界处找半导体材料.
(3)较低毒磷农药代替砷农药.
(4)过度区寻找催化剂和耐高温、
耐腐蚀的合金材料.
1
B
Al
Si
Ge
As
Sb
Te
2
3
4
5
6
7
ⅠA
ⅡA
ⅢA
ⅣA
ⅤA
ⅥA
ⅦA
0
Po
At
非金属性逐渐增强
金属性逐渐增强
金属性逐渐增强
非金属性逐渐增强
非金属区
金属区
零
族
元
素
第二节 元素周期律
1
B
Al
Si
Ge
As
Sb
Te
2
3
4
5
6
7
ⅠA
ⅡA
ⅢA
ⅣA
ⅤA
ⅥA
ⅦA
0
Po
At
非金属性逐渐增强
金属性逐渐增强
金属性逐渐增强
非金属性逐渐增强
非金属区
金属区
零
族
元
素
一、原子核外电子排布
原子的电子模型示意图:
1、 2、 3、 4、 5、 6、 7
K、L、M、N、O、P、Q
核外电子排布规律:
2. 各电子层最多容纳的电子数目是2n2个(其中上式中 n 指的是电子层序数)。
3. 最外层电子数目不超过8个(K层为最外层时,不超过2个)。
1. 核外电子总是先排布在能量最低的电子层里,然后由里向外,依次排布在能量逐步升高的电子层上(即排满了K层才排L层,排满L层才排M层)。
次外层电子数目不超过18个,倒数第三层电子数目不超过32个,(K层为次外层时,不超过2个)。
练习1:某元素有3个电子层,最外层电子数是电子总数的1/6,该元素的元素符号是:______。
练习2:写出下列元素原子的原子结构示意图:
83号元素 52号元素
第5周期第ⅦA族元素
3、某元素的原子核外有3个电子层,最外层有4个电子,该原子核内的质子数为( )
A、14 B、15 C、16 D、17
二、元素周期律
结论:
11~18
3~10
1→0
1→2
1
1~2
最高或最低化合价变化
最外层电子数
电子层数
原子序数
-4→-1→0
+1→+5
-4→-1→0
+1→+7
2
1→8
3
1→8
随着原子序数的递增,元素原子的电子层排布和化合价都呈现周期性变化。
科学探究1:电子排布和化合价的变化规律,完成两个表格并思考相关问题。
科学探究2:元表的性质和原子序数间的关系。
实验1:镁与水的反应
现 象
化学方程式
未加热时无现象,加热溶液变红色。
Mg+2H2O==Mg(OH)2+H2↑
实验2:镁和铝与盐酸的反应
Mg Al
现 象 剧烈反应生成气体 较迅速反应生成气体
化学方程式 Mg+2HCl==MgCl2+H2↑ 2Al+6HCl==2AlCl3+3H2↑
金属元素性质 Na Mg Al
单质和水(或酸)
的反应情况
最高价氧化物对应水化物碱性
钠镁铝性质比较
跟冷水剧
烈反应
NaOH
强碱
跟沸水反应
放H2;跟酸
剧烈反应放
H2
Mg(OH)2
中强碱
跟酸较为
迅速反应
放H2
Al(OH)3
两性
氢氧化物
结论:金属性 Na>Mg>Al
资料3:非金属性质的变化规律
Si P S Cl
单质与氢气反应的条件 高温 磷蒸气与氢气能反应 加热 光照或点燃时发生爆炸而化合
最高价氧化物对应的水化物(含氧酸)酸性强弱 H4SiO4
弱酸 H3PO4
中强酸 H2SO4
强酸 HClO4
最强酸(比硫酸酸性强)
通过上表分析,能得出第三周期元素的金属性与
非金属性变化情况如何?
14Si 15P 16S 17Cl
对应氧化物
氧化物的水化物
酸性强弱
单质与H2反应条件
气态氢化物及稳定性
氢化物水溶液的酸性
结论
SiO2
P2O5
SO3
Cl2O7
H4SiO4
H3PO4
H2SO4
HClO4
弱酸
中强酸
强酸
最强酸
逐渐增强
高温
加热
加热
点燃或光照
SiH4
PH3
H2S
HCl
逐渐增强
逐渐增强
非金属性逐渐增强
11--18号元素性质的变化中得出如下的结论:
Na Mg Al Si P S Cl
Ar
稀有气体元素
金属性逐渐减弱,非金属性逐渐增强
元素周期律:元素的性质随着元素原子序数的递增而呈周期性的变化。元素周期律是元素原子的核外电子排布的周期性变化的必然结果。
同一周期元素,随核电荷数增大,
金属性逐渐减弱,非金属性逐渐增强。
ⅠA ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA
族
周期
金属性逐渐增强
原子半径逐渐增大
还原性增强
1
2
3
4
5
6
7
B
Al
Si
Ge
As
Sb
Te
Po
At
非金属性逐渐增强
原子半径逐渐减小
氧化性增强
金属性逐渐增强
非金属性逐渐增强
逐渐减小
逐渐增大
三、元素周期表和元素周期律的应用
1.元素的金属性和非金属性与元素在周期表中位置的关系
2.元素化合价与元素在周期表中位置的关系。
(1)价电子:
(2)
(3)
(4)特殊:氧元素; 氟元素; 金属元素.
最外层电子
最高正价 + |最低负价| =8(H 除外)
主族序数=最外层电子数=最高正价
结构
性质
位置
决定
推导
推导
推导
推导
决定
元素“位、构、性”的关系
周期序数 = 电子层数
主族序数=最外层电子数
同周期:递变性
同主族:递变性、相似性
原子半径
电子层结构
金属性/非金属性、化合价
1.下列对铯及其化合物的预测正确的是( )
A.铯的熔点很高
B.在自然界中,铯能以游离态存在
C.氯化铯易溶于水
D.铯只有一种氧化物Cs2O
C
2、下列性质的递变中,正确的是( )
A、O、S、Na的原子半径依次增大
B、LiOH、KOH、CsOH的碱性依次增强
C、HF、NH3、SiH4的稳定性依次增强
D、HCl、HBr、HI的还原性依次减弱
AB
3、应用——在周期表一定区域内寻找元素,发现物质的新用途。
(1)预言未知元素并证实.
(2)分界处找半导体材料.
(3)较低毒磷农药代替砷农药.
(4)过度区寻找催化剂和耐高温、
耐腐蚀的合金材料.
1
B
Al
Si
Ge
As
Sb
Te
2
3
4
5
6
7
ⅠA
ⅡA
ⅢA
ⅣA
ⅤA
ⅥA
ⅦA
0
Po
At
非金属性逐渐增强
金属性逐渐增强
金属性逐渐增强
非金属性逐渐增强
非金属区
金属区
零
族
元
素
