鲁教版九年级下册化学 7.4酸碱中和反应 第二课时课件(18张PPT)
文档属性
| 名称 | 鲁教版九年级下册化学 7.4酸碱中和反应 第二课时课件(18张PPT) |

|
|
| 格式 | ppt | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-04-23 20:56:03 | ||
图片预览




文档简介
第七单元 常见的酸和碱
第四节 酸碱中和反应(2)
①常见的酸:
盐酸、硫酸、硝酸、碳酸、醋酸(乙酸)
读作:某酸
②常见的碱:
氢氧化钠、氢氧化钾、氢氧化钙、氢氧化钡、氨水、浓的肥皂水(显碱性)
读作:氢氧化某
溶液的酸碱性可用酸碱指示剂测定
紫色石蕊试液在酸性溶液中变红色,在碱性溶液中变蓝色。无色酚酞试液在酸性溶液中不变色,在碱性溶液中变红色。
溶液酸碱性的强弱程度叫酸碱度(用pH值表示)
7
酸性增强
0
14
碱性增强
pH值越小,酸性越强; pH值越大,碱性越强。
pH <7 时,溶液显 性; pH = 7 时,溶液显 性; pH >7 时,溶液显 性。
酸
中
碱
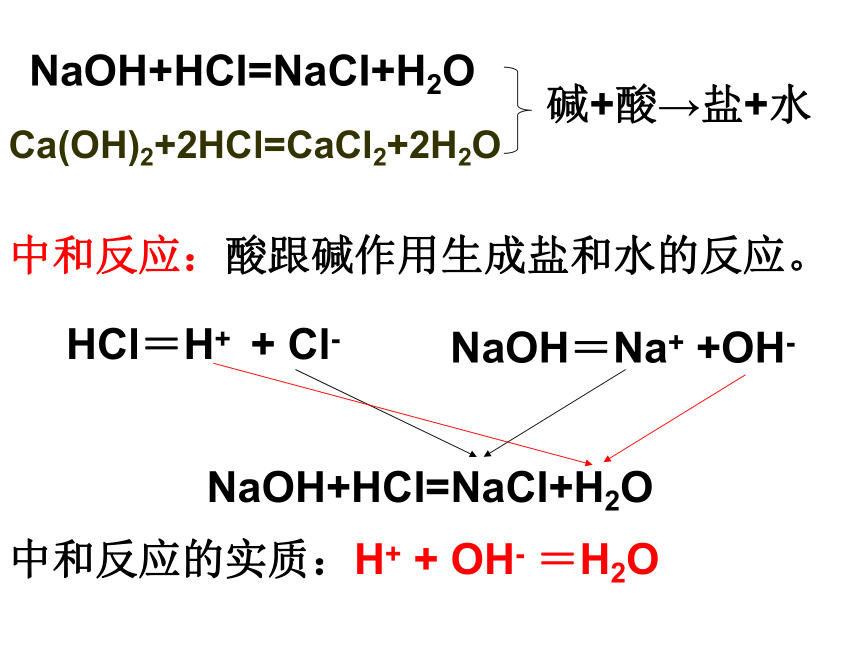
NaOH+HCI=NaCI+H2O
Ca(OH)2+2HCl=CaCl2+2H2O
碱+酸→盐+水
中和反应:酸跟碱作用生成盐和水的反应。
HCl=H+ + Cl-
NaOH=Na+ +OH-
NaOH+HCI=NaCI+H2O
中和反应的实质:H+ + OH- =H2O
活动天地:图像
加入烧碱溶液的体积/mL
0
2
4
6
8
10
12
14
16
18
烧杯中溶液的pH
1.1
1.2
1.4
1.6
2.0
7.0
11.0
12.2
12.4
12.5
向盐酸中滴加氢氧化钠溶液时溶液pH的变化
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
0 2 4 6 8 10 12 14 16 18 20 V/mL
1413121110
9 8 7
6 5 4
3 2 1
pH
.
.
.
.
.
.
.
.
.
.
。
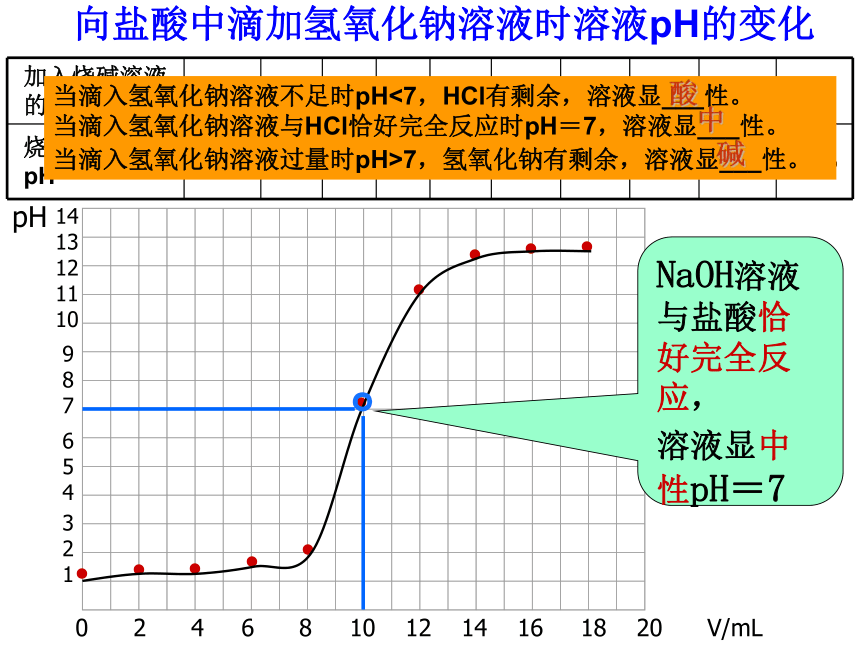
NaOH溶液与盐酸恰好完全反应,
溶液显中性pH=7
当滴入氢氧化钠溶液不足时pH<7,HCl有剩余,溶液显___性。
当滴入氢氧化钠溶液与HCl恰好完全反应时pH=7,溶液显___性。
当滴入氢氧化钠溶液过量时pH>7,氢氧化钠有剩余,溶液显___性。
酸
中
碱
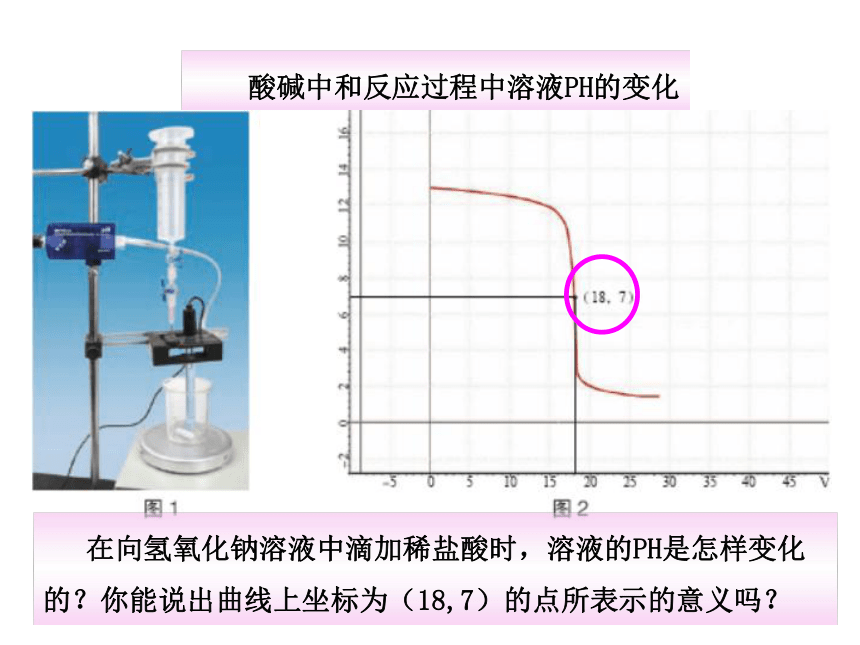
酸碱中和反应过程中溶液PH的变化
在向氢氧化钠溶液中滴加稀盐酸时,溶液的PH是怎样变化的?你能说出曲线上坐标为(18,7)的点所表示的意义吗?
酸碱中和反应过程中溶液PH的变化
二 、中和反应的应用
当滴入盐酸量较少时,溶液中氢氧化钠有剩余,溶液呈_____性,PH____7;
当滴入盐酸恰好与溶液中氢氧化钠完全反应时,溶液呈_____性,PH____7;
当滴入盐酸过量时,溶液中盐酸有剩余,溶液呈_____性,PH____7。
碱
>
中
=
酸
<
1、应用于医药卫生
人体体液必须维持正常的pH才能保证人的正常生理机能。人体体液的pH超出范围,会引发各种疾病,因此需通过酸碱中和反应的原理调节人体体液的pH。
例:人的胃液里含有少量盐酸,呈酸性,当PH为0.9-1.5时,有助于消化食物。胃酸过多会导致胃部不适或疼痛,这时应该服用碱性药物,使药物与胃酸发生中和反应,以降低胃液中胃酸的含量,同时生成无毒的中性物质。
二 、中和反应的应用
碱性药: Al(OH)3 、 Mg(OH)2 、NaHCO3 等
Al(OH)3 + 3HCl = AlCl3 + 3H2O
2、改变土壤的酸碱性
植物的生长适宜在中性或接近中性的土壤中,酸性太强pH<4)或碱性太强(pH>8)作物难以生长,因此需调节土壤的酸碱性。根据土壤的酸碱性和植物生长的需要,可以利用中和反应原理,向土壤中加入酸性或碱性物质,把土壤PH控制在最适宜庄稼生长的范围之内。
如:酸性土壤可用熟石灰,草木灰等碱性物质中和。
Ca(OH)2 + H2SO4 = CaSO4 + 2H2O
3、处理工业废水
工业生产过程中产生的污水,如果酸性或碱性超出环保部门的规定,必须进行处理,达标后才能排放。
如:当污水含酸量超标时可用熟石灰进行中和处理。
Ca(OH)2 + H2SO4 = CaSO4 + 2H2O
在科学实验里,经常需要将溶液的PH控制在一定范围内。如果溶液的酸碱性太强或太弱,就可以用适当的碱或酸来调节溶液的PH。
4、调节溶液的酸碱性
H+ + OH- = H2O
1、(2012年四川泸州,11题,2分)某实验室废水含有较多的盐酸,排放前应加入某种试剂将废水调至中性,下列试剂中最合适的是_______
A.AgNO3溶液 B.NaOH溶液
C.稀醋酸 D.KNO3溶液
2、(2012年山东烟台,15题,2分)实验小组探究盐酸和氢氧化钠反应过程中溶液pH的变化规律,得到如图所示曲线。下列有关该实验事实的说法正确的是______(多选)
A.该实验是将氢氧化钠溶液滴入盐酸中
B.B点表示盐酸和氢氧化钠恰好完全反应
C.A点时的溶液能使酚酞试液变红
D.C点时,溶液中的溶质只有氯化钠
在线测试
B
BC
3、下列反应,属于中和反应的是( )
A. Ca(OH)2+ CO2=CaCO3↓+H2O
B. CuO + 2HCl = CuCl2 + H2O
C. Cu(OH)2 + H2SO4 = CuSO4 + 2H2O
D. AgNO3 + HCl =AgCl↓+ HNO3
C
4、(2012年山东临沂,18题,2分)向稀盐酸中逐滴加入试剂X后,溶液的pH变化情况如右图所示,试剂X是下列物质中的_______
A.Mg B.H2O
C.NaOH D.CaCO3
C
5.一种消化药片的有效成分是氢氧化镁,能减缓因胃酸过多引起的胃痛。在氢氧化镁与胃酸作用的过程中,胃液的pH变化的情况符合下图中的( )
C
6. 向NaOH溶液中不断滴加稀盐酸,溶液pH随加入盐酸体积变化与下图相符的是( )
pH
14
7
盐酸的体积
O
pH
14
7
盐酸的体积
O
盐酸的体积
14
7
O
pH
盐酸的体积
14
7
O
pH
A
B
C
D
C
7、(2012年四川眉山,18题,5分) (1)向盛有氢氧化钠溶液的锥形瓶里滴入几滴酚酞溶液,溶液变成__ __色,pH_ __7(填“>”、“<”或“=”),逐滴向锥形瓶中滴人盐酸并振荡,观察到的现象是 ,
溶液的pH (填“增大”或“减小”)。(2)有一瓶溶液pH是4.5,如果要使溶液的pH升高,可以用________________ 的方法。
红
>
红色逐渐退去
减小
加水或碱性溶液
物质
混合物
纯净物
单质
化合物
氧化物
酸
碱
盐
金属
非金属
第四节 酸碱中和反应(2)
①常见的酸:
盐酸、硫酸、硝酸、碳酸、醋酸(乙酸)
读作:某酸
②常见的碱:
氢氧化钠、氢氧化钾、氢氧化钙、氢氧化钡、氨水、浓的肥皂水(显碱性)
读作:氢氧化某
溶液的酸碱性可用酸碱指示剂测定
紫色石蕊试液在酸性溶液中变红色,在碱性溶液中变蓝色。无色酚酞试液在酸性溶液中不变色,在碱性溶液中变红色。
溶液酸碱性的强弱程度叫酸碱度(用pH值表示)
7
酸性增强
0
14
碱性增强
pH值越小,酸性越强; pH值越大,碱性越强。
pH <7 时,溶液显 性; pH = 7 时,溶液显 性; pH >7 时,溶液显 性。
酸
中
碱
NaOH+HCI=NaCI+H2O
Ca(OH)2+2HCl=CaCl2+2H2O
碱+酸→盐+水
中和反应:酸跟碱作用生成盐和水的反应。
HCl=H+ + Cl-
NaOH=Na+ +OH-
NaOH+HCI=NaCI+H2O
中和反应的实质:H+ + OH- =H2O
活动天地:图像
加入烧碱溶液的体积/mL
0
2
4
6
8
10
12
14
16
18
烧杯中溶液的pH
1.1
1.2
1.4
1.6
2.0
7.0
11.0
12.2
12.4
12.5
向盐酸中滴加氢氧化钠溶液时溶液pH的变化
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
0 2 4 6 8 10 12 14 16 18 20 V/mL
1413121110
9 8 7
6 5 4
3 2 1
pH
.
.
.
.
.
.
.
.
.
.
。
NaOH溶液与盐酸恰好完全反应,
溶液显中性pH=7
当滴入氢氧化钠溶液不足时pH<7,HCl有剩余,溶液显___性。
当滴入氢氧化钠溶液与HCl恰好完全反应时pH=7,溶液显___性。
当滴入氢氧化钠溶液过量时pH>7,氢氧化钠有剩余,溶液显___性。
酸
中
碱
酸碱中和反应过程中溶液PH的变化
在向氢氧化钠溶液中滴加稀盐酸时,溶液的PH是怎样变化的?你能说出曲线上坐标为(18,7)的点所表示的意义吗?
酸碱中和反应过程中溶液PH的变化
二 、中和反应的应用
当滴入盐酸量较少时,溶液中氢氧化钠有剩余,溶液呈_____性,PH____7;
当滴入盐酸恰好与溶液中氢氧化钠完全反应时,溶液呈_____性,PH____7;
当滴入盐酸过量时,溶液中盐酸有剩余,溶液呈_____性,PH____7。
碱
>
中
=
酸
<
1、应用于医药卫生
人体体液必须维持正常的pH才能保证人的正常生理机能。人体体液的pH超出范围,会引发各种疾病,因此需通过酸碱中和反应的原理调节人体体液的pH。
例:人的胃液里含有少量盐酸,呈酸性,当PH为0.9-1.5时,有助于消化食物。胃酸过多会导致胃部不适或疼痛,这时应该服用碱性药物,使药物与胃酸发生中和反应,以降低胃液中胃酸的含量,同时生成无毒的中性物质。
二 、中和反应的应用
碱性药: Al(OH)3 、 Mg(OH)2 、NaHCO3 等
Al(OH)3 + 3HCl = AlCl3 + 3H2O
2、改变土壤的酸碱性
植物的生长适宜在中性或接近中性的土壤中,酸性太强pH<4)或碱性太强(pH>8)作物难以生长,因此需调节土壤的酸碱性。根据土壤的酸碱性和植物生长的需要,可以利用中和反应原理,向土壤中加入酸性或碱性物质,把土壤PH控制在最适宜庄稼生长的范围之内。
如:酸性土壤可用熟石灰,草木灰等碱性物质中和。
Ca(OH)2 + H2SO4 = CaSO4 + 2H2O
3、处理工业废水
工业生产过程中产生的污水,如果酸性或碱性超出环保部门的规定,必须进行处理,达标后才能排放。
如:当污水含酸量超标时可用熟石灰进行中和处理。
Ca(OH)2 + H2SO4 = CaSO4 + 2H2O
在科学实验里,经常需要将溶液的PH控制在一定范围内。如果溶液的酸碱性太强或太弱,就可以用适当的碱或酸来调节溶液的PH。
4、调节溶液的酸碱性
H+ + OH- = H2O
1、(2012年四川泸州,11题,2分)某实验室废水含有较多的盐酸,排放前应加入某种试剂将废水调至中性,下列试剂中最合适的是_______
A.AgNO3溶液 B.NaOH溶液
C.稀醋酸 D.KNO3溶液
2、(2012年山东烟台,15题,2分)实验小组探究盐酸和氢氧化钠反应过程中溶液pH的变化规律,得到如图所示曲线。下列有关该实验事实的说法正确的是______(多选)
A.该实验是将氢氧化钠溶液滴入盐酸中
B.B点表示盐酸和氢氧化钠恰好完全反应
C.A点时的溶液能使酚酞试液变红
D.C点时,溶液中的溶质只有氯化钠
在线测试
B
BC
3、下列反应,属于中和反应的是( )
A. Ca(OH)2+ CO2=CaCO3↓+H2O
B. CuO + 2HCl = CuCl2 + H2O
C. Cu(OH)2 + H2SO4 = CuSO4 + 2H2O
D. AgNO3 + HCl =AgCl↓+ HNO3
C
4、(2012年山东临沂,18题,2分)向稀盐酸中逐滴加入试剂X后,溶液的pH变化情况如右图所示,试剂X是下列物质中的_______
A.Mg B.H2O
C.NaOH D.CaCO3
C
5.一种消化药片的有效成分是氢氧化镁,能减缓因胃酸过多引起的胃痛。在氢氧化镁与胃酸作用的过程中,胃液的pH变化的情况符合下图中的( )
C
6. 向NaOH溶液中不断滴加稀盐酸,溶液pH随加入盐酸体积变化与下图相符的是( )
pH
14
7
盐酸的体积
O
pH
14
7
盐酸的体积
O
盐酸的体积
14
7
O
pH
盐酸的体积
14
7
O
pH
A
B
C
D
C
7、(2012年四川眉山,18题,5分) (1)向盛有氢氧化钠溶液的锥形瓶里滴入几滴酚酞溶液,溶液变成__ __色,pH_ __7(填“>”、“<”或“=”),逐滴向锥形瓶中滴人盐酸并振荡,观察到的现象是 ,
溶液的pH (填“增大”或“减小”)。(2)有一瓶溶液pH是4.5,如果要使溶液的pH升高,可以用________________ 的方法。
红
>
红色逐渐退去
减小
加水或碱性溶液
物质
混合物
纯净物
单质
化合物
氧化物
酸
碱
盐
金属
非金属
同课章节目录
- 第七单元 常见的酸和碱
- 第一节 酸及其性质
- 第二节 碱及其性质
- 第三节 溶液的酸碱性
- 第四节 酸碱中和反应
- 到实验室去:探究酸和碱的化学性质
- 第八单元 海水中的化学
- 第一节 海洋化学资源
- 第二节 海水“晒盐“
- 第三节 海水“制碱“
- 到实验室去:粗盐中难溶性杂质的去除
- 第九单元 金属
- 第一节 常见的金属材料
- 第二节 金属的化学性质
- 第三节 钢铁的锈蚀与防护
- 到实验室去 探究金属的性质
- 第十单元 化学与健康
- 第一节 食物中的有机物
- 第二节 化学元素与人体健康
- 第三节 远离有毒物质
- 第十一单元 化学与社会发展
- 第一节 化学与能源开发
- 第二节 化学与材料研制
- 第三节 化学与农业生产
- 第四节 化学与环境保护
