2020-2021学年鲁教版化学 九年级下册 8.2海水“晒盐 -粗盐提纯课件(共22张PPT)
文档属性
| 名称 | 2020-2021学年鲁教版化学 九年级下册 8.2海水“晒盐 -粗盐提纯课件(共22张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 2.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-04-23 22:11:17 | ||
图片预览





文档简介
(共22张PPT)
海水“晒盐
-粗盐提纯
第八单元
第二节
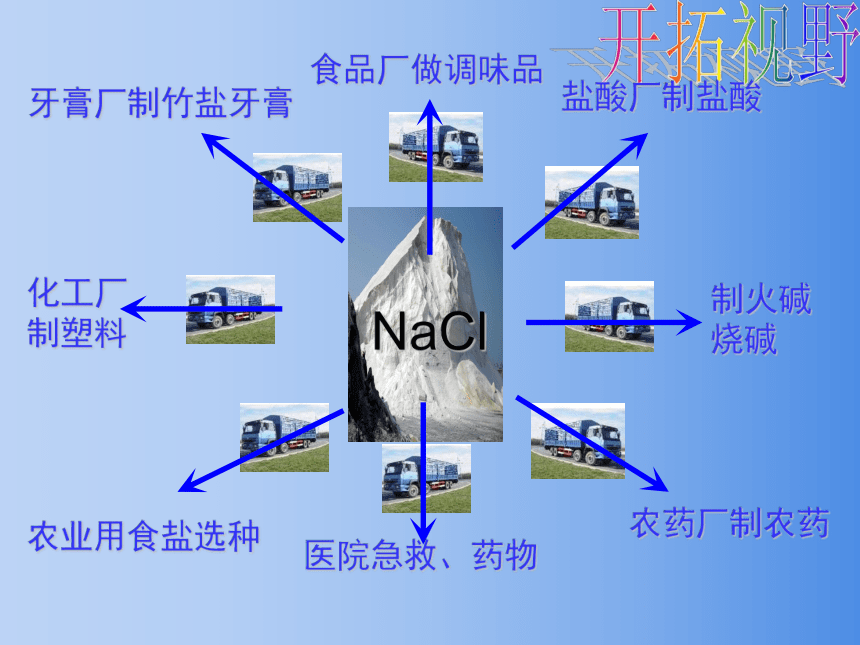
开拓视野
NaCl
食品厂做调味品
盐酸厂制盐酸
制火碱
烧碱
化工厂
制塑料
牙膏厂制竹盐牙膏
农业用食盐选种
农药厂制农药
医院急救、药物
粗盐提纯
泥沙、碎石
CaCl2
MgCl2
Na2SO4
杂质
难溶性杂质
可溶性杂质
分析粗盐成分
主要:
NaCl
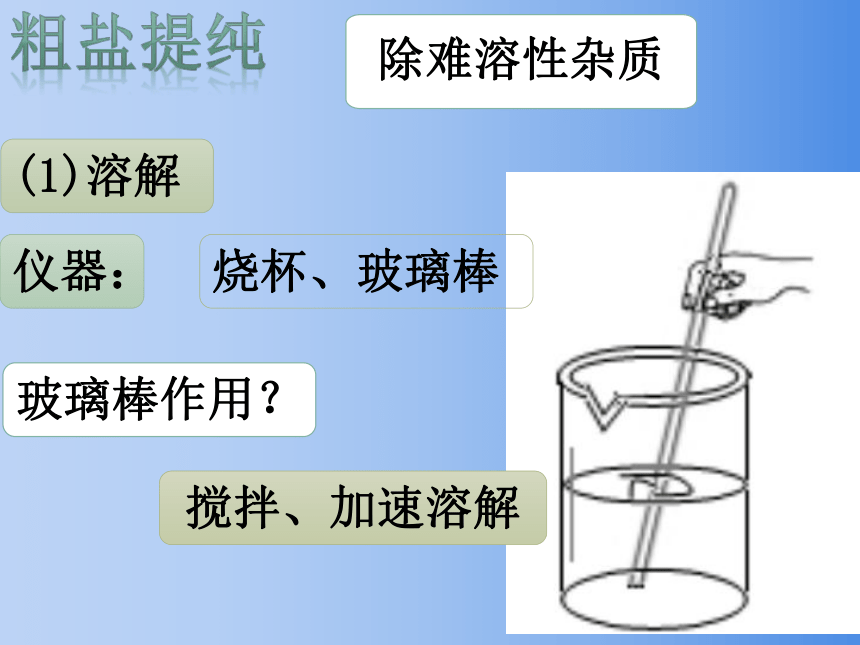
(1)溶解
烧杯、玻璃棒
仪器:
粗盐提纯
搅拌、加速溶解
玻璃棒作用?
除难溶性杂质
(2)过滤
烧杯、玻璃棒、
漏斗、铁架台
仪器:
粗盐提纯
粗盐提纯
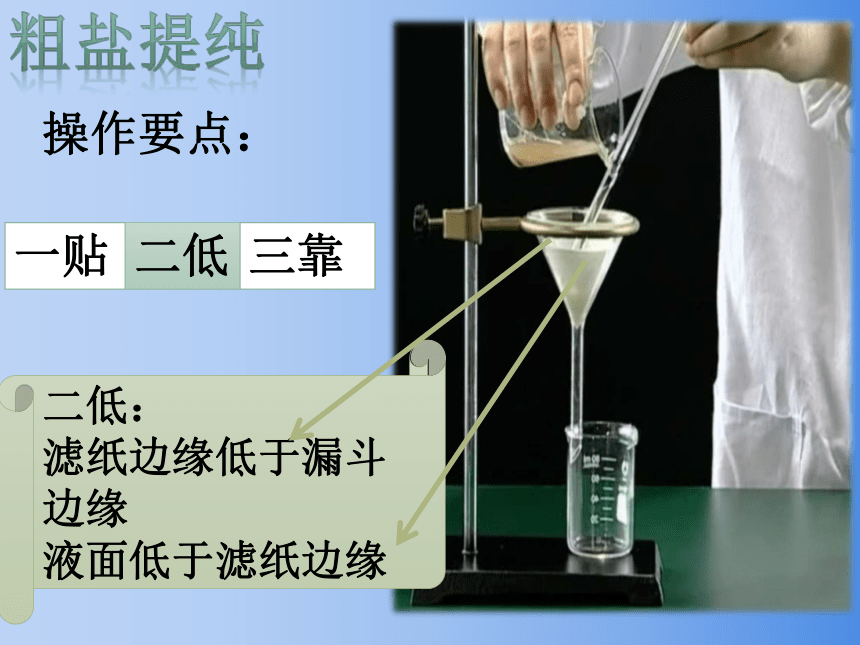
操作要点:
三靠
一贴:
滤纸紧贴漏斗内壁
一贴
二低
粗盐提纯
操作要点:
二低:
滤纸边缘低于漏斗边缘
液面低于滤纸边缘
三靠
一贴
二低
粗盐提纯
操作要点:
三靠:
烧杯口紧靠玻璃棒上
玻璃棒末端轻靠三层滤纸
漏斗下端管口紧靠烧杯内壁
三靠
一贴
二低
引流
玻璃棒作用?
粗盐提纯
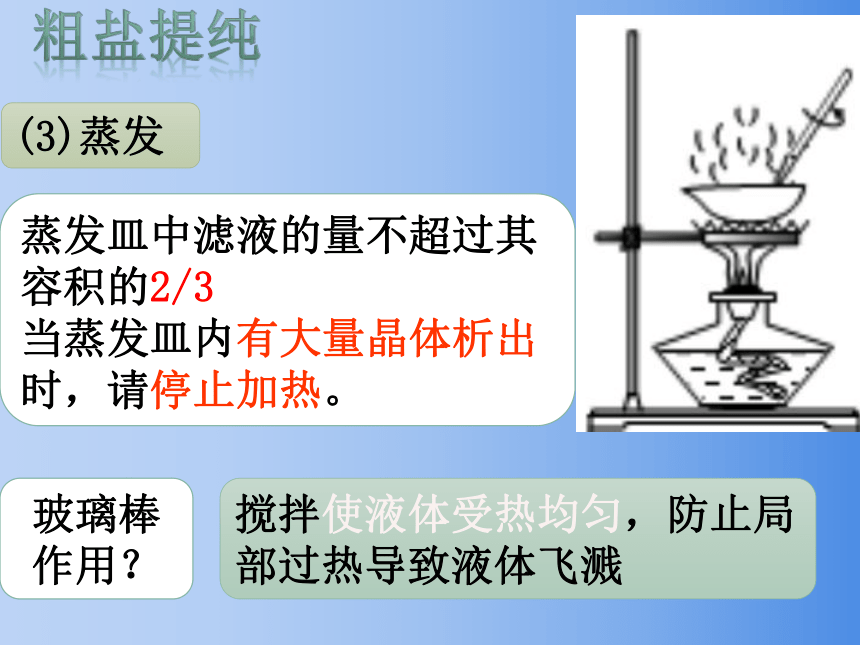
(3)蒸发
蒸发皿中滤液的量不超过其容积的2/3
当蒸发皿内有大量晶体析出时,请停止加热。
玻璃棒作用?
搅拌使液体受热均匀,防止局部过热导致液体飞溅
玻璃棒的作用呢?
小结1:除难溶性杂质
④转移固体
【小练1】
1.将饱和溶液放在蒸发皿里利用酒精灯加热,使溶质从溶液中结晶析出,何时可停止加热(
)
A.滤液开始沸腾
B.水分完全蒸干
C.出现大量固体
D.出现少量固体
2.重结晶法提纯粗盐的实验中,下列操作错误的是(
???)
A.粗盐溶液过滤后,如果滤液仍然浑浊,应该再过滤一次
B.把蒸发皿放在铁圈上,直接用酒精灯加热
C.加热过程中,要用玻璃棒不断搅拌液体
D.当蒸发皿中的水全部蒸发干时,再停止加热
C
D
Na2SO4
CaCl2
MgCl2
除可溶性杂质
粗盐提纯
除去杂质的同时不引入新的杂质
加入化学试剂,让杂质离子转化成气体、沉淀或水除去
a.加入合适的试剂
b.试剂的用量c.过量试剂的处理等问题d.加入试剂的先后顺序
原则:
方法:
需考虑:
我们要的是:
杂质离子:
除杂离子:
NaCl
SO42-、Ca2+、Mg2+
Ba2+、CO32-、OH-
Na+
Cl-
Mg2+
SO42-
Ca2+
Cl-
Mg2+
Na+
Ca2+
SO42-
Ba2+
OH-
CO32-
BaCl2、Na2CO3、NaOH
Ca2+
Mg2+
SO42-
粗盐提纯
Na2SO4
CaCl2
MgCl2
除可溶性杂质
杂质离子:
CaCO3
Mg(OH)2
BaSO4
Na2CO3
NaOH
BaCl2
过量
过量
过量
CO32-
OH-
Ba2+
引入新杂质离子:
CO32-
OH-
Ba2+
新杂质离子
HCl
HCl
Na2CO3
H2O+CO2↑
H2O
BaCO3
过量
适量
适量
Na2CO3溶液在BaCl2溶液之后加
CaCl2
+
Na2CO3
=
CaCO3↓+2NaCl
Na2CO3+2HCl=2NaCl+H2O+CO2↑
NaOH+HCl=NaCl+H2O
BaCl2
+
Na2CO3
=
BaCO3↓
+2NaCl
MgCl2
+
2NaOH
=
Mg(OH)2↓+2NaCl
思考:这些沉淀遇盐酸,会发生怎样的变化?
因此,过滤之后再加盐酸
Na2SO4+
BaCl2
=
BaSO4↓
+2NaCl
1.BaCl2?、NaOH、Na2CO3、过滤
、
盐酸
3.
NaOH
、BaCl2?、Na2CO3、
过滤
、
盐酸
除去粗盐中的Ca2+、Mg2+和SO42-离子,加入下列沉淀剂的顺序是
2.
BaCl2?、Na2CO3、NaOH、过滤
、
盐酸
注:必须
先加BaCl2溶液,后加Na2CO3溶液
过滤之后再加盐酸
小结2:除可溶性杂质
知识梳理
1.为除去粗盐中含有的氯化镁、硫酸钠、氯化钙等杂质,应加入过量的氢氧化钠、氯化钡、碳酸钠等物质,将杂质转化为沉淀。过滤去除沉淀后,再向滤液中加入适量的盐酸得到精盐水。实验操作过程如下图所示:
下列说法错误的是(
)
A.实验操作步骤也可以是①③④②⑤⑥
B.操作⑥中,加入盐酸的目的是除去过量的氢氧化钠和碳酸钠,将滤液的pH调为7
C.在实验操作过程中,氯化钡和碳酸钠溶液的添加顺序可以颠倒
D.操作⑤得到的沉淀中共有四种物质
C
【小练2】
【过关检测】
1.我国的海岸线较为漫长,有充足的海水资源。人们常把海水引入盐田,经过风吹日晒使海水中的水分蒸发获得粗盐。在此过程中(
)
A.溶剂的质量不变
B.氯化钠的质量不变
C.氯化钠的质量分数始终不变
D.氯化钠的溶液质量保持不变
2.用“不变”“增加”或“减少”填空。在一定温度下,向饱和的NaCl溶液中进行如下操作:
(1)加入少量NaCl后,溶液的质量________。
(2)若向其中加入少量水,则溶质的质量________,溶液的质量________。
(3)若温度不变,蒸发掉少量水,则溶质的质量________,溶液的质量________。
3.在“粗盐的提纯”实验中,下列仪器用到的次数最多的是
(
)
A.漏斗
B.烧杯
C.玻璃棒
D.酒精灯
4.下列有关玻璃棒在“粗盐提纯”实验中,操作错误的是(
)
A.捣碎研细
B.搅拌溶解
C.引流浊液
D.搅拌防溅
B
不变
不变
增大
减少
减少
C
A
5.用海水“晒盐”的方法得到的粗盐中,除氯化钠外,还含有氯化镁、氯化钙、硫酸钠等杂质。将此粗盐提纯的实验方案如下:
粗
盐
水
过量
氯化钡溶液
沉淀
滤液
过量
氢氧化钠溶液
过量
碳酸钠溶液
稀盐酸
精盐水
过滤
①加入碳酸钠溶液的目的是___________________
怎样判断加入的氢氧化钠溶液已经过量?
②过滤后得到的沉淀成分有:(用化学式表示,共有
4种沉淀)_______________________________
③请设计实验,能通过清晰可见的现象,准确控制在
少量滤液样品中加入稀盐酸,至恰好完全反应?
除尽氯化钙和过量氯化钡
向滤液中先滴加酚酞试液,再加入稀盐酸,滴加至红色刚好消失为止。
静置,取反应后的上层清液于试管中,滴加少量的氯化镁溶液,有白色沉淀生成,说明氢氧化钠溶液已经过量。
BaSO4
CaCO3
Mg(OH)2
BaCO3
海水“晒盐
-粗盐提纯
第八单元
第二节
开拓视野
NaCl
食品厂做调味品
盐酸厂制盐酸
制火碱
烧碱
化工厂
制塑料
牙膏厂制竹盐牙膏
农业用食盐选种
农药厂制农药
医院急救、药物
粗盐提纯
泥沙、碎石
CaCl2
MgCl2
Na2SO4
杂质
难溶性杂质
可溶性杂质
分析粗盐成分
主要:
NaCl
(1)溶解
烧杯、玻璃棒
仪器:
粗盐提纯
搅拌、加速溶解
玻璃棒作用?
除难溶性杂质
(2)过滤
烧杯、玻璃棒、
漏斗、铁架台
仪器:
粗盐提纯
粗盐提纯
操作要点:
三靠
一贴:
滤纸紧贴漏斗内壁
一贴
二低
粗盐提纯
操作要点:
二低:
滤纸边缘低于漏斗边缘
液面低于滤纸边缘
三靠
一贴
二低
粗盐提纯
操作要点:
三靠:
烧杯口紧靠玻璃棒上
玻璃棒末端轻靠三层滤纸
漏斗下端管口紧靠烧杯内壁
三靠
一贴
二低
引流
玻璃棒作用?
粗盐提纯
(3)蒸发
蒸发皿中滤液的量不超过其容积的2/3
当蒸发皿内有大量晶体析出时,请停止加热。
玻璃棒作用?
搅拌使液体受热均匀,防止局部过热导致液体飞溅
玻璃棒的作用呢?
小结1:除难溶性杂质
④转移固体
【小练1】
1.将饱和溶液放在蒸发皿里利用酒精灯加热,使溶质从溶液中结晶析出,何时可停止加热(
)
A.滤液开始沸腾
B.水分完全蒸干
C.出现大量固体
D.出现少量固体
2.重结晶法提纯粗盐的实验中,下列操作错误的是(
???)
A.粗盐溶液过滤后,如果滤液仍然浑浊,应该再过滤一次
B.把蒸发皿放在铁圈上,直接用酒精灯加热
C.加热过程中,要用玻璃棒不断搅拌液体
D.当蒸发皿中的水全部蒸发干时,再停止加热
C
D
Na2SO4
CaCl2
MgCl2
除可溶性杂质
粗盐提纯
除去杂质的同时不引入新的杂质
加入化学试剂,让杂质离子转化成气体、沉淀或水除去
a.加入合适的试剂
b.试剂的用量c.过量试剂的处理等问题d.加入试剂的先后顺序
原则:
方法:
需考虑:
我们要的是:
杂质离子:
除杂离子:
NaCl
SO42-、Ca2+、Mg2+
Ba2+、CO32-、OH-
Na+
Cl-
Mg2+
SO42-
Ca2+
Cl-
Mg2+
Na+
Ca2+
SO42-
Ba2+
OH-
CO32-
BaCl2、Na2CO3、NaOH
Ca2+
Mg2+
SO42-
粗盐提纯
Na2SO4
CaCl2
MgCl2
除可溶性杂质
杂质离子:
CaCO3
Mg(OH)2
BaSO4
Na2CO3
NaOH
BaCl2
过量
过量
过量
CO32-
OH-
Ba2+
引入新杂质离子:
CO32-
OH-
Ba2+
新杂质离子
HCl
HCl
Na2CO3
H2O+CO2↑
H2O
BaCO3
过量
适量
适量
Na2CO3溶液在BaCl2溶液之后加
CaCl2
+
Na2CO3
=
CaCO3↓+2NaCl
Na2CO3+2HCl=2NaCl+H2O+CO2↑
NaOH+HCl=NaCl+H2O
BaCl2
+
Na2CO3
=
BaCO3↓
+2NaCl
MgCl2
+
2NaOH
=
Mg(OH)2↓+2NaCl
思考:这些沉淀遇盐酸,会发生怎样的变化?
因此,过滤之后再加盐酸
Na2SO4+
BaCl2
=
BaSO4↓
+2NaCl
1.BaCl2?、NaOH、Na2CO3、过滤
、
盐酸
3.
NaOH
、BaCl2?、Na2CO3、
过滤
、
盐酸
除去粗盐中的Ca2+、Mg2+和SO42-离子,加入下列沉淀剂的顺序是
2.
BaCl2?、Na2CO3、NaOH、过滤
、
盐酸
注:必须
先加BaCl2溶液,后加Na2CO3溶液
过滤之后再加盐酸
小结2:除可溶性杂质
知识梳理
1.为除去粗盐中含有的氯化镁、硫酸钠、氯化钙等杂质,应加入过量的氢氧化钠、氯化钡、碳酸钠等物质,将杂质转化为沉淀。过滤去除沉淀后,再向滤液中加入适量的盐酸得到精盐水。实验操作过程如下图所示:
下列说法错误的是(
)
A.实验操作步骤也可以是①③④②⑤⑥
B.操作⑥中,加入盐酸的目的是除去过量的氢氧化钠和碳酸钠,将滤液的pH调为7
C.在实验操作过程中,氯化钡和碳酸钠溶液的添加顺序可以颠倒
D.操作⑤得到的沉淀中共有四种物质
C
【小练2】
【过关检测】
1.我国的海岸线较为漫长,有充足的海水资源。人们常把海水引入盐田,经过风吹日晒使海水中的水分蒸发获得粗盐。在此过程中(
)
A.溶剂的质量不变
B.氯化钠的质量不变
C.氯化钠的质量分数始终不变
D.氯化钠的溶液质量保持不变
2.用“不变”“增加”或“减少”填空。在一定温度下,向饱和的NaCl溶液中进行如下操作:
(1)加入少量NaCl后,溶液的质量________。
(2)若向其中加入少量水,则溶质的质量________,溶液的质量________。
(3)若温度不变,蒸发掉少量水,则溶质的质量________,溶液的质量________。
3.在“粗盐的提纯”实验中,下列仪器用到的次数最多的是
(
)
A.漏斗
B.烧杯
C.玻璃棒
D.酒精灯
4.下列有关玻璃棒在“粗盐提纯”实验中,操作错误的是(
)
A.捣碎研细
B.搅拌溶解
C.引流浊液
D.搅拌防溅
B
不变
不变
增大
减少
减少
C
A
5.用海水“晒盐”的方法得到的粗盐中,除氯化钠外,还含有氯化镁、氯化钙、硫酸钠等杂质。将此粗盐提纯的实验方案如下:
粗
盐
水
过量
氯化钡溶液
沉淀
滤液
过量
氢氧化钠溶液
过量
碳酸钠溶液
稀盐酸
精盐水
过滤
①加入碳酸钠溶液的目的是___________________
怎样判断加入的氢氧化钠溶液已经过量?
②过滤后得到的沉淀成分有:(用化学式表示,共有
4种沉淀)_______________________________
③请设计实验,能通过清晰可见的现象,准确控制在
少量滤液样品中加入稀盐酸,至恰好完全反应?
除尽氯化钙和过量氯化钡
向滤液中先滴加酚酞试液,再加入稀盐酸,滴加至红色刚好消失为止。
静置,取反应后的上层清液于试管中,滴加少量的氯化镁溶液,有白色沉淀生成,说明氢氧化钠溶液已经过量。
BaSO4
CaCO3
Mg(OH)2
BaCO3
同课章节目录
- 第七单元 常见的酸和碱
- 第一节 酸及其性质
- 第二节 碱及其性质
- 第三节 溶液的酸碱性
- 第四节 酸碱中和反应
- 到实验室去:探究酸和碱的化学性质
- 第八单元 海水中的化学
- 第一节 海洋化学资源
- 第二节 海水“晒盐“
- 第三节 海水“制碱“
- 到实验室去:粗盐中难溶性杂质的去除
- 第九单元 金属
- 第一节 常见的金属材料
- 第二节 金属的化学性质
- 第三节 钢铁的锈蚀与防护
- 到实验室去 探究金属的性质
- 第十单元 化学与健康
- 第一节 食物中的有机物
- 第二节 化学元素与人体健康
- 第三节 远离有毒物质
- 第十一单元 化学与社会发展
- 第一节 化学与能源开发
- 第二节 化学与材料研制
- 第三节 化学与农业生产
- 第四节 化学与环境保护
