《水的电离和溶液的酸碱性》公开课课件
文档属性
| 名称 | 《水的电离和溶液的酸碱性》公开课课件 |

|
|
| 格式 | zip | ||
| 文件大小 | 2.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-04-23 11:34:43 | ||
图片预览






文档简介
(共18张PPT)
水的电离和溶液的酸碱性
考 纲 定 位
考 情 分 析
1.了解水的电离,离子积常数。
2.了解溶液pH定义及测定溶液pH的方法,能进行pH的简单计算。
本节重点考查:
影响水电离及离子积常数的因素、溶液酸碱性判断、中和滴定原理及其应用。多以选择题形式出现,试题难度中等。
1.电离方程式
水是一种极弱的电解质,其电离方程式为:
,可简写为:
。
室温下,c(H+)=c(OH-)=
。
10-7
mol/L
一、水的电离
?
?
2.水的离子积
水的离子积常数表达式为Kw=
,25
℃时Kw=
。
Kw是温度的函数,温度不变,Kw
,温度升高,Kw
。
c(H+)·c(OH-)
1.0×10-14
不变
增大
【巩固练习】
1.(判一判)判断正误(正确的打“√”,错误的打“×”)。
(1)水是弱电解质( )
(2)温度一定时,水的电离常数与水的离子积常数相等( )
(3)水的离子积常数的数值大小与温度和稀水溶液的浓度有关( )
(4)将纯水加热到90
℃时,c(H+)变大,酸性增强( )
(5)水的电离平衡移动符合勒夏特列原理( )
【答案】 (1)√ (2)× (3)× (4)× (5)√
2.(填一填)25
℃,向水中加入①NaCl粉末、②NaOH固体、③Na2CO3粉末,水的电离平衡被促进__________,被抑制________,无影响________(用序号填写,下同);水的离子积不变的是________。若对上述三种电解质的溶液加热,水的电离平衡被促进的有________,水的离子积增大的有________。
【答案】 ③ ② ① ①②③ ①②③ ①②③
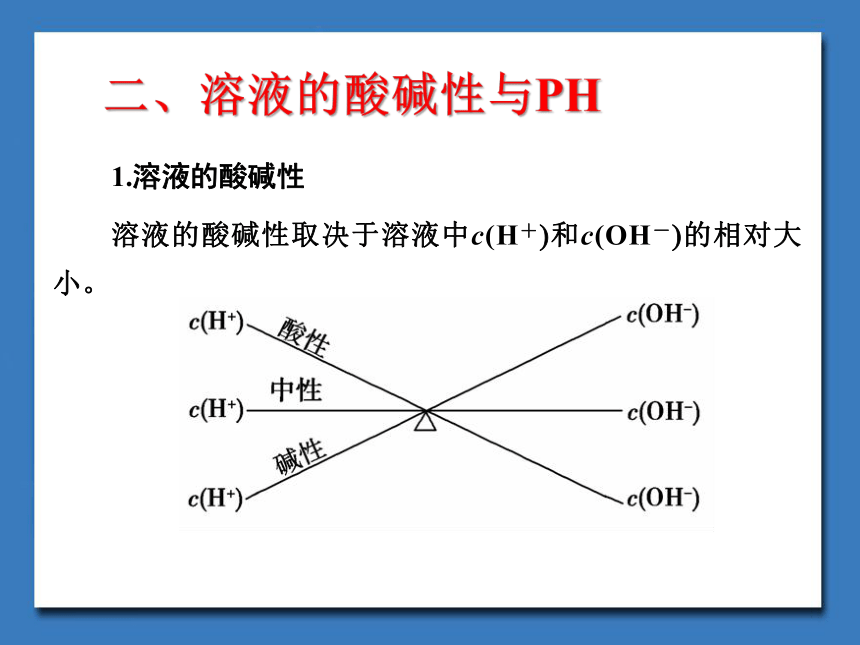
1.溶液的酸碱性
溶液的酸碱性取决于溶液中c(H+)和c(OH-)的相对大小。
二、溶液的酸碱性与PH
2.pH
(1)定义式:pH=
。
(2)pH与溶液c(H+)的关系
①由图示关系知,pH越小,溶液的酸性
。
②pH一般表示c(H+)<
的稀溶液。
1
mol/L
-lg
c(H+)
越强
(3)pH测定
①用pH试纸测定
把小片试纸放在
上,用
蘸取待测液点在
的pH试纸上,试纸变色后,与标准比色卡对比即可确定溶液的pH。
②pH计测定:可精确测定溶液的pH。
表面皿
玻璃棒
干燥
【巩固练习】
3.(判一判)判断正误(正确的打“√”,错误的打“×”)。
(1)升高温度,水电离平衡右移,H+浓度增大,呈酸性( )
(2)溶液中c(H+)>10-7mol·L-1,该溶液呈酸性( )
(3)任何温度下,利用H+和OH-浓度的相对大小均可判断溶液的酸碱性( )
(4)用pH试纸测得某溶液的pH为3.4( )
(5)用湿润的pH试纸测溶液的pH,一定影响测量结果( )
(6)能使pH试纸显红色的溶液呈酸性( )
【答案】 (1)× (2)× (3)√ (4)× (5)× (6)√
4.(填一填)(1)25
℃时,0.1
mol·L-1的盐酸溶液中c(H+)=_______mol·L-1,c(OH-)=_______mol·L-1,c(H+)H2O=________mol·L-1。
(2)25
℃
pH=3的NH4Cl溶液中,c(H+)=______mol·L-1,c(OH-)=________mol·L-1,c(H+)H2O=______mol·L-1。
【答案】 (1)0.1 1.0×10-13 1.0×10-13
(2)1.0×10-3 1.0×10-11 1.0×10-3
1.实验用品
(1)仪器:
滴定管(如图A)、
滴定管(如图B)、滴定管夹、铁架台、
。
(2)试剂:标准液、待测液、指示剂、蒸馏水。
碱式
酸式
锥形瓶
三、酸碱中和滴定
2.实验操作(以标准盐酸滴定待测NaOH溶液为例)
(1)滴定前的准备
①滴定管:
→洗涤→
→装液→调液面→记录。
②锥形瓶:注碱液→记读数→加指示剂。
(2)滴定
查漏
润洗
(3)终点判断:等到滴入最后一滴标准液,指示剂变色,且在
内不恢复原来的颜色,视为滴定终点并记录标准液的体积。
半分钟
3.数据处理
按上述操作重复二至三次,求出用去标准盐酸体积的平均值,根据c(NaOH)=
计算。
【巩固练习】
5.(填一填)一支标有20
℃、25
mL字样的滴定管,内装液体到刻度1.00
mL时,管内液体的体积是________24.00
mL(填“大于”、“小于”或“等于”)。
【答案】 大于
谢谢大家!
水的电离和溶液的酸碱性
考 纲 定 位
考 情 分 析
1.了解水的电离,离子积常数。
2.了解溶液pH定义及测定溶液pH的方法,能进行pH的简单计算。
本节重点考查:
影响水电离及离子积常数的因素、溶液酸碱性判断、中和滴定原理及其应用。多以选择题形式出现,试题难度中等。
1.电离方程式
水是一种极弱的电解质,其电离方程式为:
,可简写为:
。
室温下,c(H+)=c(OH-)=
。
10-7
mol/L
一、水的电离
?
?
2.水的离子积
水的离子积常数表达式为Kw=
,25
℃时Kw=
。
Kw是温度的函数,温度不变,Kw
,温度升高,Kw
。
c(H+)·c(OH-)
1.0×10-14
不变
增大
【巩固练习】
1.(判一判)判断正误(正确的打“√”,错误的打“×”)。
(1)水是弱电解质( )
(2)温度一定时,水的电离常数与水的离子积常数相等( )
(3)水的离子积常数的数值大小与温度和稀水溶液的浓度有关( )
(4)将纯水加热到90
℃时,c(H+)变大,酸性增强( )
(5)水的电离平衡移动符合勒夏特列原理( )
【答案】 (1)√ (2)× (3)× (4)× (5)√
2.(填一填)25
℃,向水中加入①NaCl粉末、②NaOH固体、③Na2CO3粉末,水的电离平衡被促进__________,被抑制________,无影响________(用序号填写,下同);水的离子积不变的是________。若对上述三种电解质的溶液加热,水的电离平衡被促进的有________,水的离子积增大的有________。
【答案】 ③ ② ① ①②③ ①②③ ①②③
1.溶液的酸碱性
溶液的酸碱性取决于溶液中c(H+)和c(OH-)的相对大小。
二、溶液的酸碱性与PH
2.pH
(1)定义式:pH=
。
(2)pH与溶液c(H+)的关系
①由图示关系知,pH越小,溶液的酸性
。
②pH一般表示c(H+)<
的稀溶液。
1
mol/L
-lg
c(H+)
越强
(3)pH测定
①用pH试纸测定
把小片试纸放在
上,用
蘸取待测液点在
的pH试纸上,试纸变色后,与标准比色卡对比即可确定溶液的pH。
②pH计测定:可精确测定溶液的pH。
表面皿
玻璃棒
干燥
【巩固练习】
3.(判一判)判断正误(正确的打“√”,错误的打“×”)。
(1)升高温度,水电离平衡右移,H+浓度增大,呈酸性( )
(2)溶液中c(H+)>10-7mol·L-1,该溶液呈酸性( )
(3)任何温度下,利用H+和OH-浓度的相对大小均可判断溶液的酸碱性( )
(4)用pH试纸测得某溶液的pH为3.4( )
(5)用湿润的pH试纸测溶液的pH,一定影响测量结果( )
(6)能使pH试纸显红色的溶液呈酸性( )
【答案】 (1)× (2)× (3)√ (4)× (5)× (6)√
4.(填一填)(1)25
℃时,0.1
mol·L-1的盐酸溶液中c(H+)=_______mol·L-1,c(OH-)=_______mol·L-1,c(H+)H2O=________mol·L-1。
(2)25
℃
pH=3的NH4Cl溶液中,c(H+)=______mol·L-1,c(OH-)=________mol·L-1,c(H+)H2O=______mol·L-1。
【答案】 (1)0.1 1.0×10-13 1.0×10-13
(2)1.0×10-3 1.0×10-11 1.0×10-3
1.实验用品
(1)仪器:
滴定管(如图A)、
滴定管(如图B)、滴定管夹、铁架台、
。
(2)试剂:标准液、待测液、指示剂、蒸馏水。
碱式
酸式
锥形瓶
三、酸碱中和滴定
2.实验操作(以标准盐酸滴定待测NaOH溶液为例)
(1)滴定前的准备
①滴定管:
→洗涤→
→装液→调液面→记录。
②锥形瓶:注碱液→记读数→加指示剂。
(2)滴定
查漏
润洗
(3)终点判断:等到滴入最后一滴标准液,指示剂变色,且在
内不恢复原来的颜色,视为滴定终点并记录标准液的体积。
半分钟
3.数据处理
按上述操作重复二至三次,求出用去标准盐酸体积的平均值,根据c(NaOH)=
计算。
【巩固练习】
5.(填一填)一支标有20
℃、25
mL字样的滴定管,内装液体到刻度1.00
mL时,管内液体的体积是________24.00
mL(填“大于”、“小于”或“等于”)。
【答案】 大于
谢谢大家!
