辽宁省盘锦市第二高级中学2020-2021学年高一下学期4月第一次阶段考试化学试卷 Word版含答案
文档属性
| 名称 | 辽宁省盘锦市第二高级中学2020-2021学年高一下学期4月第一次阶段考试化学试卷 Word版含答案 |

|
|
| 格式 | doc | ||
| 文件大小 | 342.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-04-24 00:00:00 | ||
图片预览


文档简介
盘锦市第二高级中学
2020-2021学年度第二学期第一阶段考试
高一化学试题
考试时间: 75分钟 满分: 100分
一、选择题(共15小题,每小题3分,共45分,每小题只有一个选项符合题意)
1.下列关于N2的叙述错误的是( )
A.N2既可作氧化剂又可作还原剂
B.雷雨天,空气中的N2和O2可反应生成NO
C.氮的固定是将N2转化成含氮化合物的过程
D.氮气的化学性质活泼,通常情况下可以与很多物质发生反应
2.下列气体①N2;②O2;③NO2;④NO;⑤CO2;⑥SO2中,属于大气污染物的是( )
A.③④⑥ B.①②③④
C.③④⑤⑥ D.全部
3.下列有关硅及硅酸盐材料的说法正确的是( )
A.硅酸钠溶液可以保存在磨口玻璃塞试剂瓶中
B.高纯度的硅单质广泛用于制造光导纤维
C.普通玻璃、石英、水泥等均属于硅酸盐材料
D.SiO2是水晶、玛瑙的主要成分,也是制造光导纤维的原料
4.下列说法正确的是( )
A.硫质脆,微溶于酒精和二硫化碳
B.硫与氢气反应,体现了硫的还原性
C.硫与铁粉和铜粉分别反应,都可生成二价金属硫化物
D.从硫的化合价角度分析,硫单质既可作氧化剂又可作还原剂
5.检验铵盐的方法是将待检物取出少量放入试管中,然后( )
A.加热,将红色石蕊试纸放在试管口检验
B.加水溶解,用红色石蕊试纸检验溶液的酸碱性
C.加入碱溶液,加热,再滴入酚酞溶液
D.加入氢氧化钠溶液,加热,将湿润的红色石蕊试纸放在试管口检验
6.下列关于硅的说法不正确的是( )
A.硅在地壳中的含量仅次于氧
B.硅在自然界中既有化合态,又有游离态
C.硅是人类将太阳能转换为电能的常用材料
D.硅单质的导电能力介于导体和绝缘体之间
7.有些科学家提出硅是“21世纪的能源”,下列关于硅及其化合物的说法正确的是
A.SiO2是一种酸性氧化物,所以不和任何酸反应
B.高温下,工业制硅的反应方程式为C+SiO2Si+CO2
C.光导纤维的主要成分是SiO2
D.太阳能发电板的主要材料是SiO2
8.下列对事实的解释不正确的是( )
选项 事实 解释
A 用铝罐槽车储运浓硫酸 常温下,浓硫酸与铝不反应
B 浓硫酸滴加到蔗糖中,蔗糖变黑 浓硫酸具有脱水性
C 浓硝酸在光照下颜色变黄 浓HNO3不稳定,生成的有色产物NO2能溶于浓硝酸
D SO2能使氯水褪色 SO2具有还原性
A.A B.B C.C D.D
9.普通玻璃的主要成分是( )
①Na2SiO3 ②CaCO3 ③CaSiO3 ④SiO2 ⑤Na2CO3 ⑥CaO
A.①③④ B.②③④ C.①③⑥ D.③④⑤
10.将盛有12mLNO2和O2混合气体的量筒倒立于水槽中,充分反应后,还剩余2mL无色气体,则原混合气体中O2的体积是( )
A.2mL B.2.4mL C.4mL D.4.8mL
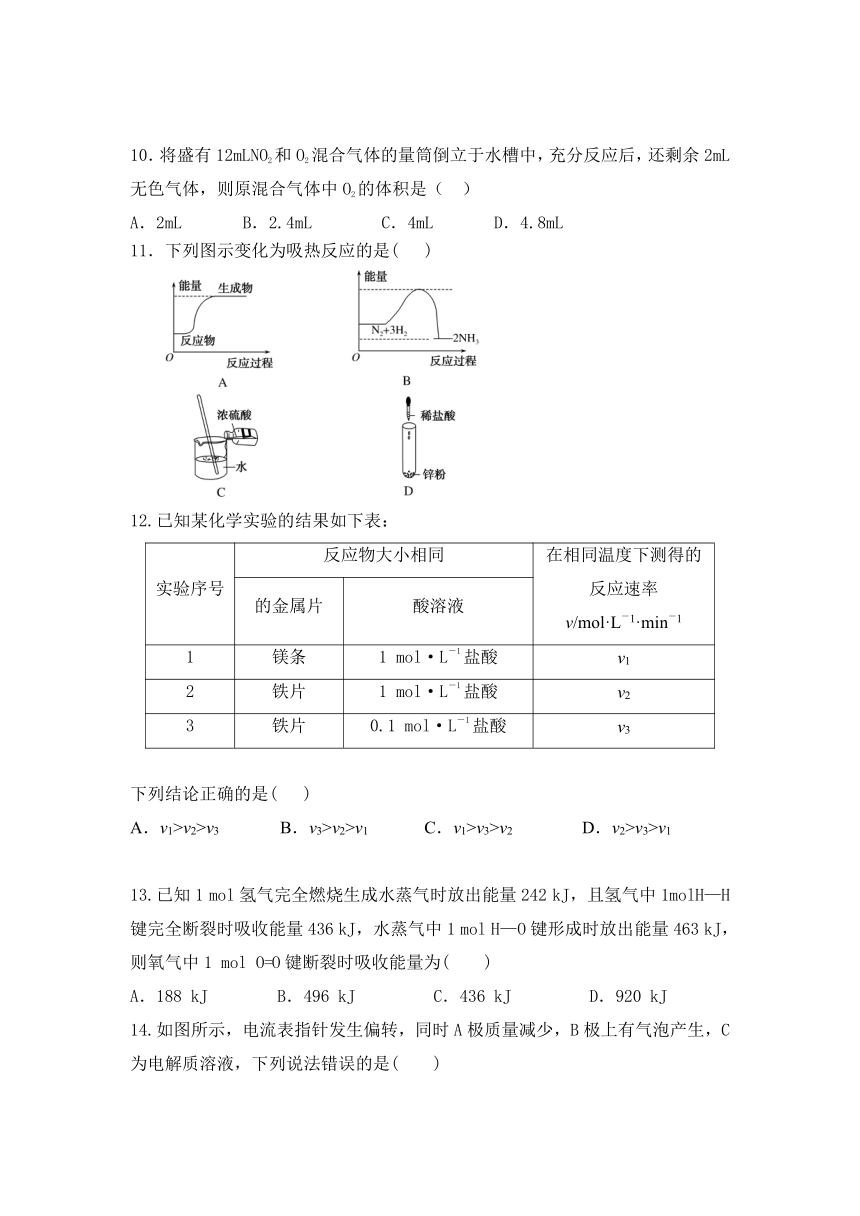
11.下列图示变化为吸热反应的是( )
12.已知某化学实验的结果如下表:
实验序号 反应物大小相同 在相同温度下测得的反应速率
v/mol·L-1·min-1
的金属片 酸溶液
1 镁条 1 mol·L-1盐酸 v1
2 铁片 1 mol·L-1盐酸 v2
3 铁片 0.1 mol·L-1盐酸 v3
下列结论正确的是( )
A.v1>v2>v3 B.v3>v2>v1 C.v1>v3>v2 D.v2>v3>v1
13.已知1 mol氢气完全燃烧生成水蒸气时放出能量242 kJ,且氢气中1molH—H键完全断裂时吸收能量436 kJ,水蒸气中1 mol H—O键形成时放出能量463 kJ,则氧气中1 mol O=O键断裂时吸收能量为( )
A.188 kJ B.496 kJ C.436 kJ D.920 kJ
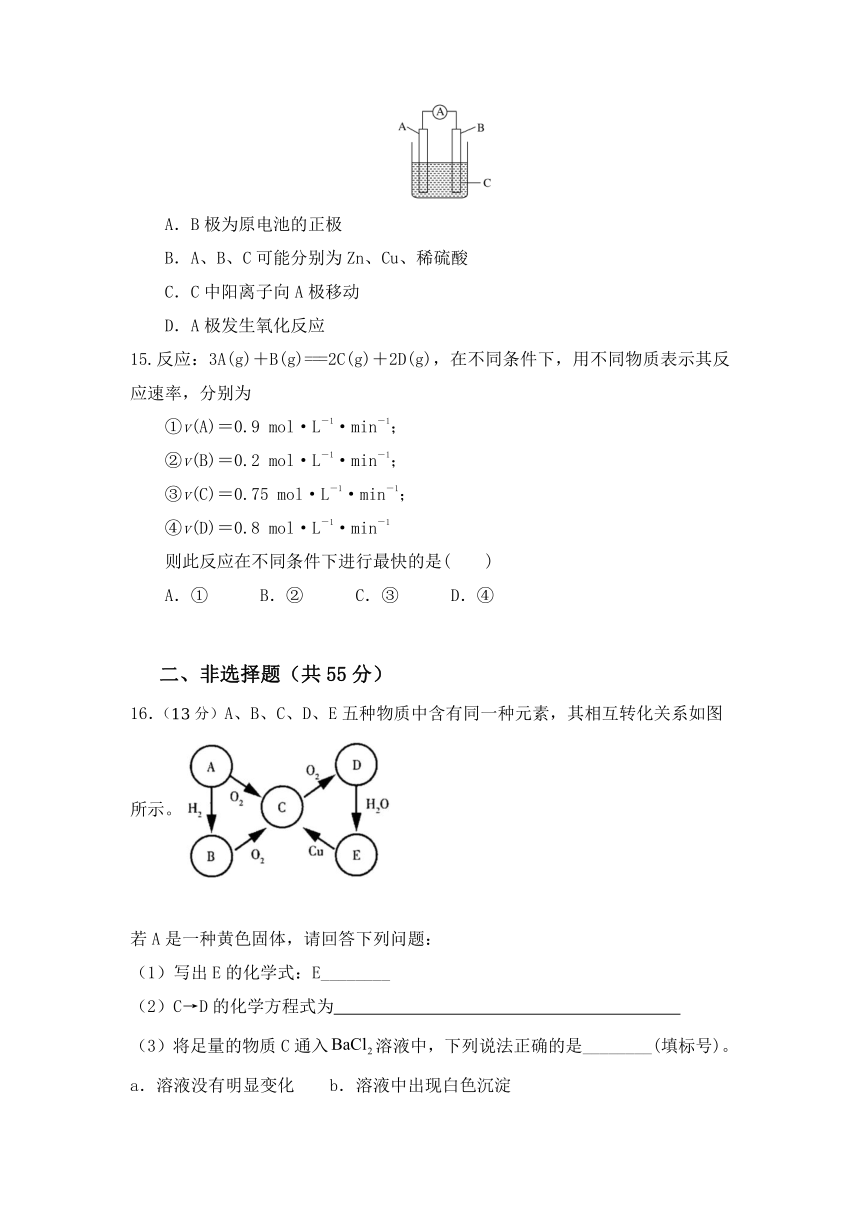
14.如图所示,电流表指针发生偏转,同时A极质量减少,B极上有气泡产生,C为电解质溶液,下列说法错误的是( )
A.B极为原电池的正极
B.A、B、C可能分别为Zn、Cu、稀硫酸
C.C中阳离子向A极移动
D.A极发生氧化反应
15.反应:3A(g)+B(g)===2C(g)+2D(g),在不同条件下,用不同物质表示其反应速率,分别为
①v(A)=0.9 mol·L-1·min-1;
②v(B)=0.2 mol·L-1·min-1;
③v(C)=0.75 mol·L-1·min-1;
④v(D)=0.8 mol·L-1·min-1
则此反应在不同条件下进行最快的是( )
A.① B.② C.③ D.④
二、非选择题(共55分)
16.(13分)A、B、C、D、E五种物质中含有同一种元素,其相互转化关系如图所示。
若A是一种黄色固体,请回答下列问题:
(1)写出E的化学式:E________
(2)C→D的化学方程式为
(3)将足量的物质C通入溶液中,下列说法正确的是________(填标号)。
a.溶液没有明显变化 b.溶液中出现白色沉淀
c.若继续通入,则溶液中出现白色沉淀
若A通常状态下为气态单质,且D为红棕色气体,请回答下列问题:
(4)写出B、E的化学式:B________、E________
(5)C→D的化学方程式为 ;
B→C的化学方程式为 ;
(6)38.4 g铜跟适量的E的浓溶液反应,铜全部反应后,共收集到气体22.4 L(标准状况),反应消耗的E的物质的量可能是( )
A.2.4 mol B.2.2mol C.1.6 mol D.1 mol
(10分)某研究性学习小组利用下列装置检验炭与浓硫酸反应的产物。请回答:
(1)写出装置①中反应的化学方程式
(2)装置④的作用是 ,装置④中发生反应的离子方程式
是 。
(3)证明产物中有SO2的实验现象是 。
(4)装置⑤中溶液不褪色,⑥中溶液变浑浊,据此现象能否说明装置①的反应产物中有______生成。
18.(12分)某实验小组利用以下装置制取并探究氨气的性质:
(1)装置A中发生反应的化学方程式为 。
(2)下列能用于干燥氨气的是________(填标号)。
A.浓硫酸 B. 氯化钙 C.五氧化二磷 D.碱石灰
(3)实验进行一段时间后,挤压装置D中的胶头滴管,滴入滴浓盐酸,可观察到的现象是___________。
(4)为防止过量氨气外逸,需要在上述装置的末端增加一个尾气吸收装置,应选用的装置是___________(填“E”或“F”)。
(5)生石灰与水反应生成Ca(OH)2并放出热量。实验室利用此原理,向生石灰中滴加浓氨水,可以快速制取氨气。用此方法制取氨气应选用的气体发生装置是______(填标号),反应方程式是 。
(8分)一定条件下,在2L密闭容器中发生反应:3A(g)+B(g)?2C(g)。开始时加入2 mol A、4 mol B、2 mol C,2min末测得C的物质的量是3mol。
(1)用C的浓度变化表示2 min内反应的平均反应速率是 。
(2)2 min内A的转化率是_______。
(3)2min末,生成物 B的浓度为______。
(4)下列条件能使化学反应速率增大的是 (填标号)。
①增大压强 ②降低温度
③增大A的浓度 ④恒容下充入He气
(12分)人们应用原电池原理制作了多种电池,以满足不同的需要。请根据题中提供的信息,填写空格。
(1) FeCl3溶液常用于腐蚀印刷电路铜板,发生2FeCl3+Cu =2FeCl2+CuCl2,若将此反应设计成原电池,则负极所用电极材料为: 。当线路中转移0.4mol电子时,则被腐蚀铜的质量为:____g。(已知:铜的相对原子量是64)
(2)将铝片和铜片用导线相连,一组插入溶液氢氧化钠中,一组插入浓硝酸中,分别形成了原电池,在这两个原电池中,负极分别为____。
A.铝片、铜片 B.铜片、铝片 C.铝片、铝片
(3)燃料电池是一种高效、环境友好的供电装置,如图是电解质为稀硫酸溶液的氢氧燃料电池原理示意图,回答下列问题:
该酸式氢氧燃料电池的负极电极反应式是 ,正极电极
反应式是 ,电池工作一段时间后电解质溶液PH (填“增大”“减小”或“不变”)。
化学答案
一、选择题(每题3分)
1~5 DADDD 6~10 BCAAC 11~15 AABCD
二、非选择题
16.(13分)(1)H2SO4(1分)
(2)2SO2+O22SO3
(3)a c
(4)NH3 HNO3 (每空1分)
(5)2NO+O2=2NO2 4NH3+5O24NO+6H2O
B
(10分,每空2分)
(1)C+2H2SO4(浓)CO2↑+2SO2↑+2H2O
(2)吸收SO2 略
(3)③中品红溶液褪色
(4)CO2
18.(12分,每空2分)
(1)
(2)D (3)瓶内有白烟产生 (4) E (5) c 略
(8分,每空2分)
(1)0.25mol/(L?min) (2)75% (3)1.75mol/L (4) ①③
(12分,每空2分)
(1) Cu 12.8 (2)A (3) H2-2e-═2H+ O2+4e-+4H+=2H2O 增大
2020-2021学年度第二学期第一阶段考试
高一化学试题
考试时间: 75分钟 满分: 100分
一、选择题(共15小题,每小题3分,共45分,每小题只有一个选项符合题意)
1.下列关于N2的叙述错误的是( )
A.N2既可作氧化剂又可作还原剂
B.雷雨天,空气中的N2和O2可反应生成NO
C.氮的固定是将N2转化成含氮化合物的过程
D.氮气的化学性质活泼,通常情况下可以与很多物质发生反应
2.下列气体①N2;②O2;③NO2;④NO;⑤CO2;⑥SO2中,属于大气污染物的是( )
A.③④⑥ B.①②③④
C.③④⑤⑥ D.全部
3.下列有关硅及硅酸盐材料的说法正确的是( )
A.硅酸钠溶液可以保存在磨口玻璃塞试剂瓶中
B.高纯度的硅单质广泛用于制造光导纤维
C.普通玻璃、石英、水泥等均属于硅酸盐材料
D.SiO2是水晶、玛瑙的主要成分,也是制造光导纤维的原料
4.下列说法正确的是( )
A.硫质脆,微溶于酒精和二硫化碳
B.硫与氢气反应,体现了硫的还原性
C.硫与铁粉和铜粉分别反应,都可生成二价金属硫化物
D.从硫的化合价角度分析,硫单质既可作氧化剂又可作还原剂
5.检验铵盐的方法是将待检物取出少量放入试管中,然后( )
A.加热,将红色石蕊试纸放在试管口检验
B.加水溶解,用红色石蕊试纸检验溶液的酸碱性
C.加入碱溶液,加热,再滴入酚酞溶液
D.加入氢氧化钠溶液,加热,将湿润的红色石蕊试纸放在试管口检验
6.下列关于硅的说法不正确的是( )
A.硅在地壳中的含量仅次于氧
B.硅在自然界中既有化合态,又有游离态
C.硅是人类将太阳能转换为电能的常用材料
D.硅单质的导电能力介于导体和绝缘体之间
7.有些科学家提出硅是“21世纪的能源”,下列关于硅及其化合物的说法正确的是
A.SiO2是一种酸性氧化物,所以不和任何酸反应
B.高温下,工业制硅的反应方程式为C+SiO2Si+CO2
C.光导纤维的主要成分是SiO2
D.太阳能发电板的主要材料是SiO2
8.下列对事实的解释不正确的是( )
选项 事实 解释
A 用铝罐槽车储运浓硫酸 常温下,浓硫酸与铝不反应
B 浓硫酸滴加到蔗糖中,蔗糖变黑 浓硫酸具有脱水性
C 浓硝酸在光照下颜色变黄 浓HNO3不稳定,生成的有色产物NO2能溶于浓硝酸
D SO2能使氯水褪色 SO2具有还原性
A.A B.B C.C D.D
9.普通玻璃的主要成分是( )
①Na2SiO3 ②CaCO3 ③CaSiO3 ④SiO2 ⑤Na2CO3 ⑥CaO
A.①③④ B.②③④ C.①③⑥ D.③④⑤
10.将盛有12mLNO2和O2混合气体的量筒倒立于水槽中,充分反应后,还剩余2mL无色气体,则原混合气体中O2的体积是( )
A.2mL B.2.4mL C.4mL D.4.8mL
11.下列图示变化为吸热反应的是( )
12.已知某化学实验的结果如下表:
实验序号 反应物大小相同 在相同温度下测得的反应速率
v/mol·L-1·min-1
的金属片 酸溶液
1 镁条 1 mol·L-1盐酸 v1
2 铁片 1 mol·L-1盐酸 v2
3 铁片 0.1 mol·L-1盐酸 v3
下列结论正确的是( )
A.v1>v2>v3 B.v3>v2>v1 C.v1>v3>v2 D.v2>v3>v1
13.已知1 mol氢气完全燃烧生成水蒸气时放出能量242 kJ,且氢气中1molH—H键完全断裂时吸收能量436 kJ,水蒸气中1 mol H—O键形成时放出能量463 kJ,则氧气中1 mol O=O键断裂时吸收能量为( )
A.188 kJ B.496 kJ C.436 kJ D.920 kJ
14.如图所示,电流表指针发生偏转,同时A极质量减少,B极上有气泡产生,C为电解质溶液,下列说法错误的是( )
A.B极为原电池的正极
B.A、B、C可能分别为Zn、Cu、稀硫酸
C.C中阳离子向A极移动
D.A极发生氧化反应
15.反应:3A(g)+B(g)===2C(g)+2D(g),在不同条件下,用不同物质表示其反应速率,分别为
①v(A)=0.9 mol·L-1·min-1;
②v(B)=0.2 mol·L-1·min-1;
③v(C)=0.75 mol·L-1·min-1;
④v(D)=0.8 mol·L-1·min-1
则此反应在不同条件下进行最快的是( )
A.① B.② C.③ D.④
二、非选择题(共55分)
16.(13分)A、B、C、D、E五种物质中含有同一种元素,其相互转化关系如图所示。
若A是一种黄色固体,请回答下列问题:
(1)写出E的化学式:E________
(2)C→D的化学方程式为
(3)将足量的物质C通入溶液中,下列说法正确的是________(填标号)。
a.溶液没有明显变化 b.溶液中出现白色沉淀
c.若继续通入,则溶液中出现白色沉淀
若A通常状态下为气态单质,且D为红棕色气体,请回答下列问题:
(4)写出B、E的化学式:B________、E________
(5)C→D的化学方程式为 ;
B→C的化学方程式为 ;
(6)38.4 g铜跟适量的E的浓溶液反应,铜全部反应后,共收集到气体22.4 L(标准状况),反应消耗的E的物质的量可能是( )
A.2.4 mol B.2.2mol C.1.6 mol D.1 mol
(10分)某研究性学习小组利用下列装置检验炭与浓硫酸反应的产物。请回答:
(1)写出装置①中反应的化学方程式
(2)装置④的作用是 ,装置④中发生反应的离子方程式
是 。
(3)证明产物中有SO2的实验现象是 。
(4)装置⑤中溶液不褪色,⑥中溶液变浑浊,据此现象能否说明装置①的反应产物中有______生成。
18.(12分)某实验小组利用以下装置制取并探究氨气的性质:
(1)装置A中发生反应的化学方程式为 。
(2)下列能用于干燥氨气的是________(填标号)。
A.浓硫酸 B. 氯化钙 C.五氧化二磷 D.碱石灰
(3)实验进行一段时间后,挤压装置D中的胶头滴管,滴入滴浓盐酸,可观察到的现象是___________。
(4)为防止过量氨气外逸,需要在上述装置的末端增加一个尾气吸收装置,应选用的装置是___________(填“E”或“F”)。
(5)生石灰与水反应生成Ca(OH)2并放出热量。实验室利用此原理,向生石灰中滴加浓氨水,可以快速制取氨气。用此方法制取氨气应选用的气体发生装置是______(填标号),反应方程式是 。
(8分)一定条件下,在2L密闭容器中发生反应:3A(g)+B(g)?2C(g)。开始时加入2 mol A、4 mol B、2 mol C,2min末测得C的物质的量是3mol。
(1)用C的浓度变化表示2 min内反应的平均反应速率是 。
(2)2 min内A的转化率是_______。
(3)2min末,生成物 B的浓度为______。
(4)下列条件能使化学反应速率增大的是 (填标号)。
①增大压强 ②降低温度
③增大A的浓度 ④恒容下充入He气
(12分)人们应用原电池原理制作了多种电池,以满足不同的需要。请根据题中提供的信息,填写空格。
(1) FeCl3溶液常用于腐蚀印刷电路铜板,发生2FeCl3+Cu =2FeCl2+CuCl2,若将此反应设计成原电池,则负极所用电极材料为: 。当线路中转移0.4mol电子时,则被腐蚀铜的质量为:____g。(已知:铜的相对原子量是64)
(2)将铝片和铜片用导线相连,一组插入溶液氢氧化钠中,一组插入浓硝酸中,分别形成了原电池,在这两个原电池中,负极分别为____。
A.铝片、铜片 B.铜片、铝片 C.铝片、铝片
(3)燃料电池是一种高效、环境友好的供电装置,如图是电解质为稀硫酸溶液的氢氧燃料电池原理示意图,回答下列问题:
该酸式氢氧燃料电池的负极电极反应式是 ,正极电极
反应式是 ,电池工作一段时间后电解质溶液PH (填“增大”“减小”或“不变”)。
化学答案
一、选择题(每题3分)
1~5 DADDD 6~10 BCAAC 11~15 AABCD
二、非选择题
16.(13分)(1)H2SO4(1分)
(2)2SO2+O22SO3
(3)a c
(4)NH3 HNO3 (每空1分)
(5)2NO+O2=2NO2 4NH3+5O24NO+6H2O
B
(10分,每空2分)
(1)C+2H2SO4(浓)CO2↑+2SO2↑+2H2O
(2)吸收SO2 略
(3)③中品红溶液褪色
(4)CO2
18.(12分,每空2分)
(1)
(2)D (3)瓶内有白烟产生 (4) E (5) c 略
(8分,每空2分)
(1)0.25mol/(L?min) (2)75% (3)1.75mol/L (4) ①③
(12分,每空2分)
(1) Cu 12.8 (2)A (3) H2-2e-═2H+ O2+4e-+4H+=2H2O 增大
同课章节目录
